Применение левилимаба у пациентов с новой коронавирусной инфекцией (COVID-19) в реальной клинической практике
Ретроспективный анализ эффективности и безопасности терапии COVID-19 левилимабом в реальной клинической практике.
Проведен ретроспективный анализ историй болезни пациентов, госпитализированных со среднетяжелым и тяжелым течением COVID-19 и получивших патогенетическую терапию левилимабом в дозе 324 мг подкожно. Эффективность терапии оценивали на основании изменения статуса пациентов и клинико-лабораторных параметров. Для анализа безопасности терапии определяли частоту и профиль нежелательных явлений с оценкой причинно-следственной связи с применением препарата.
В исследование были включены 273 пациента (медиана возраста 62,0 года, 62,3% мужчин). У 56,4% из них наблюдалось среднетяжелое течение COVID-19, у 43,2% –тяжелое. У 76,6% пациентов распространенность поражения легочной ткани соответствовала КТ-2-3. У 89,0% больных имелись сопутствующие заболевания. В результате терапии 253 (92,7%) из 273 пациентов были выписаны из стационара, в том числе 9 (3,3%) – после перевода в отделение реанимации и интенсивной терапии (ОРИТ). Умерли 17 (6,2%) больных, в том числе 9 (3,3%) – после перевода в ОРИТ. 3 (1,1%) пациента были потеряны из-под наблюдения в связи с переводом в другое лечебное учреждение по организационным причинам. У выписанных пациентов продемонстрированы снижение потребности в оксигенотерапии и положительная динамика клинико-лабораторных параметров с купированием лихорадки, снижением уровня СРБ, а также повышением сатурации кислорода и абсолютного количества лимфоцитов. Эффективность левилимаба была выше у пациентов с КТ-1-3 при назначении препарата в первые двое суток от момента госпитализации. Раннее применение левилимаба сопровождалось существенным сокращением сроков госпитализации вне зависимости от объема поражения по КТ.
Исследование свидетельствует о хорошей эффективности и благоприятном профиле безопасности левилимаба в лечении пациентов с осложненным COVID-19. Своевременное подкожное введение препарата у пациентов со среднетяжелым и тяжелым течением заболевания обеспечивает наилучшие клинические исходы и может способствовать оптимальному использованию ресурсов здравоохранения в условиях пандемии.
Оказание медицинской помощи пациентам с новой коронавирусной инфекцией (COVID-19) является приоритетной задачей национального здравоохранения уже более года. У большинства пациентов (примерно у 80%) инфекция протекает бессимптомно или с легкими проявлениями, в то время как у 20% инфицированных развивается системная воспалительная реакция с осложнениями в виде тяжелог о поражения легких, вплоть до острого респираторного дистресс-синдрома (ОРДС), нарушений коагуляции и полиорганной недостаточности. Наиболее важными факторами риска осложненного течения COVID-19 являются пожилой возраст (старше 60 лет), мужской пол и сопутствующие заболевания, в том числе ожирение, сахарный диабет, заболевания сердечно-сосудистой системы, печени, почек и др. [1].
Ключевые факторы патогенеза жизнеугрожающих осложнений, вызванных SARSCoV2, – развитие вирус-индуцированного дисбаланса в иммунном ответе макроорганизма и гиперактивация врожденного и приобретенного иммунитета, а не прямое цитопатическое действие вируса [2]. При развитии воспалительной реакции в ответ на распознавание вируса происходит мощная индукция синтеза провоспалительных цитокинов – именно эта особенность иммунопатогенеза отличает новую коронавирусную инфекцию от других сходных нозологий [3]. Гиперактивация врожденного иммунитета, проявляющаяся высоким уровнем провоспалительных цитокинов, определяет тяжесть клинических симптомов и летальность при COVID-19. В связи с тропностью SARS-CoV-2 к пневмоцитам органом-мишенью при данной инфекции являются легкие, а гипервоспалительный иммунный ответ может сопровождаться как ограниченным поражением ткани легких, так и развитием фатальной дыхательной недостаточности [2].
Ведущую роль в патогенезе COVID-19 играет интерлейкин-6 (ИЛ-6), высокий уровень которого связан с более тяжелым течением новой коронавирусной инфекции [4], выраженными структурными изменениями легких, обусловливающими потребность в респираторной поддержке, а также риском летального исхода при COVID-19 [5,6]. В связи с этим ингибирование рецепторов ИЛ-6 рассматривается как один из основных аспектов патогенетической терапии новой коронавирусной инфекции [7,8].
Левилимаб – рекомбинантное оригинальное моноклональное антитело к a-субъединице рецептора ИЛ-6. Препарат блокирует как растворимые, так и мембранные рецепторы ИЛ-6, что позволяет купировать развитие провоспалительного каскада, препятствуя активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, избыточной продукции других провоспалительных цитокинов и острофазовых белков [9,10]. Левилимаб зарегистрирован в качестве препарата патогенетической терапии синдрома высвобождения цитокинов при COVID-19 и внесен во Временные методические рекомендации Минздрава РФ, начиная с 8 версии от 03.09.2020 [11].
Целью исследования было провести ретроспективный анализ эффективности и безопасности терапии левилимабом у пациентов с COVID-19 в реальной клинической практике.
Материал и методы
Проведен ретроспективный анализ случаев применения левилимаба у пациентов со среднетяжелым и тяжелым COVID-19, госпитализированных с ноября 2020 г. по февраль 2021 г. в следующие лечебно-профилактические учреждения (ЛПУ): ГБУЗ Городская клиническая больница им. Ф.И. Иноземцева (г. Москва), ГБУЗ “Городская клиническая больница №4 Департамента здравоохранения Москвы", Санкт-Петербургское ГБУЗ “Городская больница Святого Великомученика Георгия", ГБУЗ РК “Коми республиканская клиническая больница", ГБУЗ Рес пуб лики Коми “Республиканская инфекционная больница", Санкт-Петербургское ГБУЗ “Городская больница №40".
Диагноз COVID-19 подтверждали с помощью выявления рибонуклеиновой кислоты (РНК) SARS-CoV-2 с применением методик амплификации нуклеиновых кислот или определения иммуноглобулинов классов M, G, А (IgM, IgG, IgА) и/или на основании эпидемиологического анамнеза и типичных клинических проявлений с характерными изменениями в легких на компьютерной томограмме (КТ), результаты которой оценивали по “эмпирической" визуальной шкале [11].
Согласно текущей версии Временных методических рекомендаций [11] помимо левилимаба пациенты получали противовирусную терапию, антибактериальные препараты, глюкокортикостероиды и антикоагулянты.
Левилимаб вводили в дозе 324 мг в виде двух подкожных инъекций в соответствии с Временными методическими рекомендациями МЗ РФ [11] и инструкцией по медицинскому применению препарата [12].
Для оценки эффективности терапии определяли статус пациентов по семикатегориальной шкале, предложенной Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) [13], начиная с дня, предшествующего введению левилимаба, и до дня достижения клинического исхода (выписка из стационара или летальный исход). Рассчитывали частоту клинических исходов и долю пациентов, нуждавшихся в различных вариантах респираторной поддержки, а также в переводе в отделение реанимации и интенсивной терапии (ОРИТ). Дополнительно оценивали динамику клинико-лабораторных показателей, в том числе температуры тела, уровня сатурации кислорода, С-реактивного белка (СРБ) и абсолютного числа лимфоцитов.
Оценка безопасности терапии левилимабом проводилась путем определения числа и доли пациентов с нежелательными явлениями (НЯ), профиля выявленных НЯ, а также причинно-следственной связи с применением препарата.
В анализ не включали пациентов, у которых выписка из стационара или летальный исход наступили в день введения левилимаба. При подкожном применении терапевтические концентрации и эффект препарата достигаются в течение двух-трех суток, что не позволяет оценить эффективность его применения у этих пациентов.
С учетом ретроспективного анализа и проведения терапии в рамках действующих рекомендаций этическая экспертиза не проводилась. Все пациенты при поступлении в стационар подписывали информированное согласие на проведение лечебно-диагностических мероприятий.
Статистический анализ. Анализ данных проводился с помощью языка программирования для статистических расчетов R v.4.0.5. Количественные показатели представлены в виде медианы (Me), первого (Q1) и третьего (Q3) квартилей на основе результатов оценки соответствия полученных распределений нормальному закону с помощью критерия Шапиро-Уилка. Для сравнения подгрупп по этим показателям использовали критерий Манна-Уитни (Wilcoxon rank-sum test). Частотные показатели представлены в виде количества и доли пациентов с наличием или отсутствием анализируемого признака. Сравнительный анализ частот проводился с помощью отношения рисков (ОР) и его 95% доверительного интервала (ДИ) или точного критерия Фишера. Для оценки наличия зависимости между переменными проводили регрессионный анализ на основе обобщенной линейной модели (general linear model). В зависимости от типа анализируемого исхода применяли логистическую или линейную регрессию.
Результаты
Исходная характеристика пациентов. В ретроспективное исследование были включены 273 больных, демографические и клинические показатели которых на момент введения левилимаба представлены в табл. 1. В исследуемой популяции преобладали мужчины (62,3%). Медиана возраста составила 62 года, при этом большинство пациентов (93,0%) были старше 40 лет, а наиболее многочисленной (49,1%) была возрастная группа 60-79 лет.
| Показатели | Значения |
|---|---|
| Примечание: *указаны наиболее отклоняющиеся от нормы значения за сутки на момент введения левилимаба. НИВЛ – неинвазивная вентиляция легких, ИВЛ – инвазивная вентиляция легких, ЭКМО – экстракорпоральная мембранная оксигенация | |
| Мужчины, n (%) | 170 (62,3) |
| Медиана возраста, лет | 62,0 (51,0-69,0) |
| Возраст, лет, n (%) | |
| до 40 | 19 (7,0) |
| 40-59 | 99 (36,2) |
| 60-79 | 134 (49,1) |
| 80 и старше | 21 (7,7) |
| Объем поражения легких по КТ, n (%) | |
| КТ-1 (0-25%) | 39 (14,3) |
| КТ-2 (25-50%) | 140 (51,3) |
| КТ-3 (50-75%) | 69 (25,3) |
| КТ-4 (>75%) | 22 (8,1) |
| Нет данных | 3 (1,1) |
| Потребность в оксигенотерапии, n (%) | |
| Не требуется | 23 (8,4) |
| Низкопоточная оксигенация | 176 (64,5) |
| Высокопоточная оксигенация или НИВЛ | 73 (26,7) |
| ИВЛ или ЭКМО | 1 (0,4) |
| Жизненно-важные показатели | |
| Температура тела, °С* | 38,0 (37,0-38,7) |
| Сатурация, %* | 93 (90-94) |
| Лабораторные показатели | |
| С-реактивный белок, мг/мл* | 87,0 (48,0-132,7) |
| Лимфоциты, x109/л* | 0,9 (0,6-1,2) |
У 254 (93,0%) пациентов этиология заболевания подтверждена лабораторным исследованием на наличие РНК SARS-CoV-2 и/или положительным результатом на IgM, IgG, IgА к SARS-CoV-2, у 19 (7,0%) был диагностирован вероятный COVID-19 в соответствии с клиническими проявлениями, эпидемиологическим анамнезом и данными КТ.
Наиболее частыми клиническими проявлениями COVID-19 на момент госпитализации были лихорадка, кашель и одышка (рис. 1). Доля пациентов с одышкой возрастала по мере увеличения объема поражения легких: от 66,7% при КТ-1 до 95,2% при КТ-4. В соответствии с классификационными критериями [11] около половины (56,4%) пациентов были госпитализированы в состоянии средней тяжести, у 43,2% констатировано тяжелое течение COVID-19, один пациент поступил в стационар в критическом состоянии с потребностью в инвазивной вентиляции легких (ИВЛ).
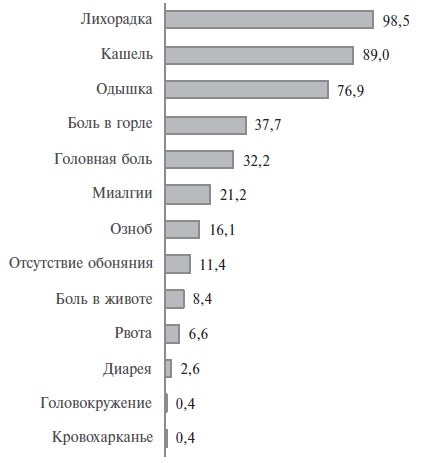
У большинства (76,6%) пациентов отмечен средний или значительный (КТ-2 или КТ-3) объем изменений легких, у 14,3% применение левилимаба осуществлялось на фоне минимального объема поражения (КТ-1), у 8,1% – субтотального (КТ-4).
Медиана срока госпитализации пациентов в стационар от момента появления симптомов заболевания составила 7 (5–9) суток. Взаимосвязи между объемом поражения легких и сроком госпитализации не выявлено.
У большинства (89,0%) пациентов имелись сопутствующие хронические заболевания, в том числе у 56,6% – два и более. Чаще всего отмечались сердечнососудистые заболевания (79,5%), ожирение (25,6%) и сахарный диабет (22,4%), реже – хронические заболевания почек (14,6%) и легких (11,0%).
Наряду с левилимабом 92% пациентов получали антикоагулянты, 85% – глюкокортикостероиды, 82% – антибактериальные препараты, 64% – фавипиравир, 30% – гидроксихлорохин.
Терапия левилимабом. Левилимаб применяли в составе комплексной терапии согласно актуальным клиническим рекомендациям и подходам, принятым в ЛПУ. Препарат вводили в интервале от 1 до 13 суток после госпитализации (медиана 3 суток [2–5]). У пациентов с КТ-4 решение о назначении препарата врачи принимали в более короткий срок – 2 (1–6) суток. В течение первых двух суток пребывания в стационаре левилимаб получили 104 (38,1%) пациента.
Медиана срока введения левилимаба от момента появления первых симптомов COVID-19 составила 11 (8–13) суток, при этом у 18,7% пациентов патогенетическая терапия левилимабом проведена через 14 и более дней после начала заболевания.
Оценка эффективности. Частота клинических исходов приведена в табл. 2. 253 (92,7%) из 273 пациентов были выписаны из стационара, в том числе 9 (3,3%) – после перевода в ОРИТ. Умерли 17 (6,2%) пациентов, в том числе 9 (3,3%) – после перевода в ОРИТ. Клинический исход у 3 (1,1%) пациентов оценить не удалось в связи с их переводом в другое ЛПУ по организационным причинам. К моменту перевода пациенты достигли клинического улучшения. Этих пациентов не учитывали при анализе эффективности терапии в связи с отсутствием информации о клиническом исходе.
| Исходы | КТ-1Б (N=39) |
КТ-2 (N=140) |
КТ-3 (N=69) |
КТ-4 (N=22) |
Все пациенты (N=273) |
|---|---|---|---|---|---|
| Выписка | 39 (100) | 131 (93,6) | 65 (94,2) | 15 (68,2) | 253 (92,7) |
| Без перевода в ОРИТ | 38 (97,4) | 131 (93,6) | 60 (87,0) | 13 (59,1) | 244 (89,4) |
| После перевода в ОРИТ | 1 (2,6) | 0 | 5 (7,2) | 2 (9,1) | 9 (3,3) |
| Летальный исход | 0 | 6 (4,3) | 4 (5,8) | 7 (31,8) | 17 (6,2) |
| Без перевода в ОРИТ | 0 | 3 (2,1) | 1 (1,4) | 4 (18,2) | 8 (2,9) |
| После перевода в ОРИТ | 0 | 3 (2,1) | 3 (4,3) | 3 (13,6) | 9 (3,3) |
| Перевод в другое ЛПУ | 0 | 3 (2,1) | 0 | 0 | 3 (1,1) |
Возраст и пол пациентов, наличие сопутствующих заболеваний, а также срок госпитализации в стационар не оказывали статистически значимого влияния на клинический исход. В то же время частота выписки пациентов без перевода в ОРИТ была статистически значимо ниже у пациентов с высоким исходным уровнем СРБ и низкой сатурацией кислорода (р<0,01).
Эффективность терапии левилимабом была сопоставимой у пациентов с КТ-1, КТ-2 и КТ-3 и значительно ниже у больных с КТ-4 (p<0,01). На лечение ответили 93,5% (229/245) пациентов с КТ-1-3 и 59,1% (13/22) пациентов с КТ-4. Таким образом, риск комбинированного неблагоприятного исхода (перевод в ОРИТ и/или смерть) при подкожном введении левилимаба у пациентов с КТ 1-3 был на 84,0% ниже, чем у пациентов с КТ4 (ОР 0,16; 95% ДИ 0,08–0,32).
Соблюдение подходов по выбору антицитокиновой терапии, прописанных в клинических рекомендациях [11], и минимальных сроков с момента поступления в стационар до введения препарата обеспечивало снижение риска неблагоприятного исхода. Так, среди пациентов с КТ-1-3, которым левилимаб был введен в первые двое суток госпитализации, перевод в ОРИТ и/или летальный исход наблюдались у 2,3% (2/87), а при отсроченном введении препарата (спустя 3 и более суток) и/или у пациентов с КТ-4 (вне зависимости от времени введения) – у 13,1% (24/183). Таким образом, при раннем введении препарата у пациентов с КТ-1-3 риск комбинированного неблагоприятного исхода снизился на 82,0% (ОР 0,18; 95% ДИ 0,04–0,73).
Медиана длительности госпитализации у выписанных пациентов составила 11 (9–14) суток. Она была максимальной у пациентов с КТ-4 – 18 (14–23) суток. Пациенты, которым не потребовался перевод в ОРИТ, были выписаны через 7 (6–9) суток, а пациенты, переведенные в ОРИТ, – через 16 (14–19) суток от момента подкожной инъекции левилимаба. У пациентов с недостаточной эффективностью препарата перевод в ОРИТ происходил через 1 (1–4) сутки, летальный исход – через 9 (6–14) суток от момента введения.
Применение левилимаба в первые двое суток от момента поступления в стационар сопровождалось статистически значимым сокращением длительности госпитализации по сравнению с его отсроченным введением (спустя 3 и более суток) вне зависимости от степени поражения легких (p<0,01). Наиболее существенное сокращение медианы длительности госпитализации отмечено у пациентов с КТ-4: с 22,0 (15,0-25,7) до 12,0 (9,7-18,3) суток. У пациентов с КТ 1-3 при раннем введении препарата длительность госпитализации сокращалась с 12,0 (10,0-15,0) до 9,0 (7,0-11,0) суток. Время от момента появления симптомов до госпитализации в стационар также негативно влияло на последующую длительность пребывания в стационаре (р<0,01).
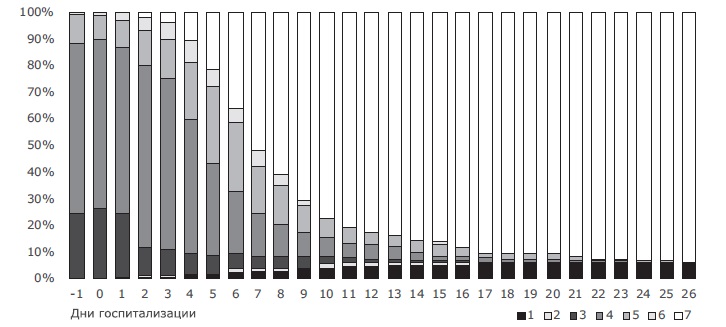
Динамика статуса пациентов по семикатегориальной шкале FDA представлена на рис. 2. Число пациентов, нуждающихся в различных вариантах оксигенотерапии, прогрессивно снижалось, начиная с третьих суток после введения препарата. Доля пациентов, выписанных из стационара, значимо увеличивалась уже с конца первой недели и через 14 дней после подкожного введения левилимаба составила 86,0%.
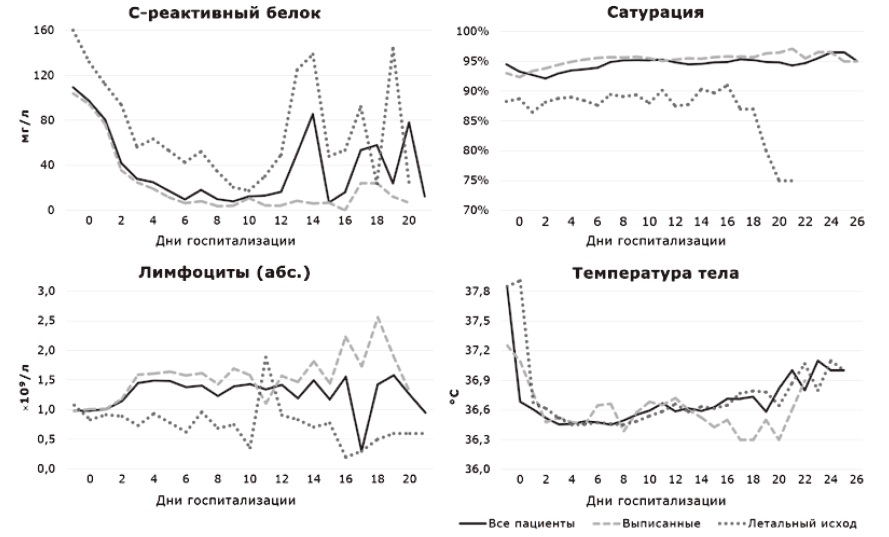
Динамика клинико-лабораторных показателей у всех включенных пациентов и в подгруппах в зависимости от клинического исхода представлена на рис. 3. На фоне терапии левилимабом наблюдалось купирование лихорадки, снижение уровня СРБ, а также повышение сатурации кислорода и абсолютного количества лимфоцитов. В подгруппе умерших пациентов значимая динамика сатурации и абсолютного числа лимфоцитов отсутствовала. Снижение температуры тела и концентрации СРБ наблюдалось у всех пациентов, однако в подгруппе с летальным исходом, начиная с конца второй недели, отмечена отрицательная динамика этих параметров, что в большинстве случаев можно объяснить развитием вторичной бактериальной инфекции в условиях ОРИТ.
Оценка безопасности. Доля пациентов с клинически значимыми нежелательными явлениями (НЯ) составила 4,8% (13/273). Чаще всего – у 6 (2,2%) пациентов – отмечалось повышение активности аминотрансфераз (АЛТ и АСТ). Стоит отметить, что пациенты с клинически значимым повышением АСТ/АЛТ помимо левилимаба получали противовирусные и антибактериальные препараты (прежде всего фавипиравир и фторхинолоны), которые часто вызывают повышение активности печеночных ферментов.
Развитие вторичной бактериальной инфекции наблюдалось у 7 (2,6%) пациентов, 5 (1,8%) из которых умерли. До момента возникновения этого осложнения пациенты были переведены в ОРИТ, где им проводилась неинвазивная или инвазивная вентиляция легких.
У 1 (0,3%) пациента развилась сегментарная односторонняя тромбоэмболия легочной артерии с благоприятным исходом. В качестве ключевой причины была рассмотрена гиперкоагуляция, вызванная SARS-CoV-2. Связь данного НЯ с левилимабом расценена исследователем как маловероятная.
Обсуждение
Применение ингибиторов рецепторов ИЛ-6 рассматривается как один из основных компонентов терапии пациентов со среднетяжелым или тяжелым течением COVID-19 [8,11,14,15]. Несмотря на противоречивые данные рандомизированных и наблюдательных исследований, последние метаанализы свидетельствуют о том, что применение этих препаратов у пациентов с COVID-19 приводит к снижению летальности, риска перевода в ОРИТ и потребности в инвазивной вентиляции легких [14,15]. Развитие патологической реакции иммунной системы в виде гипервоспаления имеет стадийный характер, поэтому своевременное подавление ИЛ-6-зависимого провоспалительного каскада, способствует предупреждению жизнеугрожающих состояний и осложнений [16,17]. Данный подход был определен как “упреждающая терапия" и отражен во Временных методических рекомендациях Минздрава РФ еще в 2020 году [11].
Проведенный нами анализ показал, что при применении левилимаба доля выписанных из стационара пациентов со среднетяжелым и тяжелым течением COVID-19 составила 92,7%. При этом уже с третьих суток после введения препарата констатированы снижение потребности в кислородотерапии и активная выписка пациентов из стационара, что может способствовать эффективному использованию коечного фонда и других ресурсов лечебного учреждения. Наилучшие исходы определялись у пациентов с КТ-1-3, которым левилимаб вводили в первые 2 суток после поступления в стационар, что подтверждает целесообразность и эффективность упреждающего подхода в противовоспалительной патогенетической терапии.
Важно, что эффективность терапии левилимабом не зависела от пола, возраста и профиля сопутствующей патологии, которые не являются ограничивающими факторами при выборе данного препарата в качестве терапии COVID-19.
Среди пациентов, у которых лечение оказалось неэффективным, имелись лица, для которых выбор подкожного введения левилимаба не был оптимальным ввиду субтотального поражения легких и быстро развивающихся гиперцитокиновых реакций. Эта ситуация имела место по причине сложностей лекарственного обеспечения в пиковые периоды пандемии и в ряде случаев рассматривалась как терапия отчаяния. В настоящий момент тактика использования левилимаба пересмотрена экспертами: помимо подкожного применения предлагается альтернативный внутривенный путь введения стандартных доз, а также эскалационная схема с двойной дозой 648 мг внутривенно капельно для купирования “цитокинового шторма" при недоступности других антицитокиновых препаратов с внутривенным путем введения [11]. Учитывая, что в инструкции по медицинскому применению левилимаба зарегистрирован исключительно подкожный путь введения, для принятия решения о внутривенном применении препарата целесообразно проведение врачебной комиссии с указанием необходимости данной тактики.
Профиль безопасности левилимаба при терапии COVID-19 в целом расценен как благоприятный и сопоставимый с таковым при его использовании для продолжительной терапии ревматоидного артрита [10], а также с профилем безопасности других ингибиторов рецепторов ИЛ-6. С учетом одновременного назначения противовирусных и антибактериальных препаратов у части пациентов можно ожидать повышения активности печеночных аминотрансфераз, однако по нашему опыту оно не сопровождалось повышением содержания билирубина и нарушением функции печени. Хотя инфекционные осложнения являются одним из частых побочных эффектов всех ингибиторов рецепторов ИЛ6, в проанализированной нами популяции пациентов развитие вторичной бактериальной инфекции наблюдалось в единичных случаях у больных, которые получали терапию в условиях ОРИТ, где предполагается большой объем инвазивных процедур и в целом выше риск инфекций. По отношению к времени введения левилимаба данное осложнение развивалось отсрочено, на фоне ухудшения функции легких и проведения НИВЛ и ИВЛ. Этот факт подчеркивает важность своевременной блокады гипервоспаления с предупреждением потребности в реанимационной поддержке.
Установленный нами факт более поздней госпитализации у пациентов, имевших неблагоприятный исход терапии, актуализирует задачу активного информирования населения о необходимости своевременного обращения за медицинской помощью и готовности лечебных учреждений госпитализировать лиц с осложненным течением COVID-19, особенно имеющих факторы риска неблагоприятного исхода.
Фармакокинетические особенности левилимаба в дозе 324 мг определяют развитие терапевтического эффекта препарата в течение 2-3 суток после его подкожного введения [12], в связи с чем оперативное принятие решения о его назначении в ближайшие двое суток с момента госпитализации у пациентов с КТ-1-3 позволяет получить лучшие клинические результаты.
Ограничением проведенного анализа являются ретроспективный подход и отсутствие группы сравнения, однако полученные данные позволяют судить о месте левилимаба в терапии осложненного течения новой коронавирусной инфекции и преимуществах его подкожного введения у пациентов со среднетяжелым течением COVID-19.
Эффективность и безопасность внутривенного введения левилимаба у пациентов с COVID-19, которое находит применение в обычной клинической практике в соответствии с Временными методическими рекомендациями [11], требуют дополнительного анализа.
Своевременное применение левилимаба в соответствии с текущими рекомендациями позволяет снизить риск неблагоприятных исходов в виде потребности в реанимационной поддержке и летального исхода более чем на 80% и, таким образом, обеспечить эффективное оказание медицинской помощи пациентам с COVID-19 в условиях пандемии.
Заключение
Левилимаб в качестве патогенетической терапии осложненного течения COVID-19 демонстрирует хороший клинический эффект с высокой долей выписанных пациентов на фоне благоприятного профиля безопасности. Своевременное подкожное введение препарата у пациентов со среднетяжелым и тяжелым течением новой коронавирусной инфекции обеспечивает наилучшие клинические исходы и может способствовать оптимальному использованию ресурсов здравоохранения в условиях пандемии.
Используемые источники
- Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med 2020;8(4):420–2.
- Abdulamir A, Hafidh R. The possible immunological pathways for the variable immunopathogenesis of COVID-19 infections among healthy adults, elderly and children. Electron J Gen Med 2020;17:em202.
- GarcТa LF. Immune Response, inflammation, and the clinical spectrum of COVID-19. Front Immunol 2020;11:1441.
- Chen X, Zhao B, Qu Y, et al. Detectable serum severe acute respiratory syndrome coronavirus 2 viral load (RNAemia) is closely correlated with drastically elevated interleukin 6 level in critically ill patients with Coronavirus Disease 2019. Clin Infect Dis 2020;71(8):1937-42.
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395(10223):497–506.
- Coomes EA, Haghbayan H. Interleukin-6 in COVID-19: a systemic review and meta-analysis. medRxiv. doi: 10.1101/2020.03.30.200448058
- Zhou G, Chen S, Chen Z. Advances in COVID-19: the virus, the pathogenesis, and evidence-based control and therapeutic strategies Front Med 2020;14(2):117–25.
- Насонов Е.Л. Иммунопатология и иммунофармакотерапия коронавирусной болезни 2019 (COVID-19): фокус на интерлейкин 6. Научно-практическая ревматология 2020;58(3):245-61 [Nasonov E.L. Immunopathology and immunopharmacotherapy of coronavirus disease 2019 (COVID-19): focus on interleukin 6. Rheumatology Science and Practice 2020;58(3):245-61. (In Russ.)].
- Насонов Е.Л., Мазуров В.И., Усачева Ю.В. и др. Разработки отечественных оригинальных генно-инженерных биологических препаратов для лечения иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология 2017;55(2):201-10 [Nasonov EL, Mazurov VI, Usacheva YuV, et al. Developments of Russian original biological agents for the treatment of immunoinflammatory rheumatic diseases. Rheumatology Science and Practice 2017;55(2):201-10 (In Russ.)].
- Мазуров В.И., Зоткин Е.Г., Гайдукова И.З. и др. Эффективность и безопасность применения левилимаба в комбинации с метотрексатом у пациентов с ревматоидным артритом: результаты II фазы исследования AURORA. Научно-практическая ревматология 2021;59(2):141-51 [Mazurov VI, Zotkin EG, Gaydukova IZ, et al. Efficacy and safety of levilimab in combination with methotrexate in subjects with rheumatoid arthritis: Results of phase II AURORA study. Rheumatology Science and Practice 2021;59(2):141-51 (In Russ.)].
- https://minzdrav.gov.ru/ministry/med_covid19 (дата доступа 20.07.2021)
- Инструкция по медицинскому применению препарата Илсира http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=3003f770-1557-4b3b98bf-47f3a95eafeb&t= (дата доступа 20.07.2021)
- COVID-19: Developing Drugs and Biological Products for Treatment or Prevention Guidance. Guidance for Industry, May 11 2020. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/covid-19-developingdrugs-and-biological-products-treatment-or-prevention (дата доступа 18.07.2021)
- Avni T, Leibovici L, Cohen I, et al. Tocilizumab in the treatment of COVID-19 – a meta-analysis. QJM 2021 May 19:hcab142.
- Pinzon RT, Wijaya VO, Buana RB. Interleukin-6 (IL-6) inhibitors as therapeutic agents for coronavirus disease 2019 (COVID-19): A systematic review and metaanalysis [published online ahead of print, 2021 Jun 15]. J Infect Public Health 2021;14(8):1001-9.
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020;395(10223):497-506..
- Zhou G, Chen S, Chen Z. Advances in COVID-19: the virus, the pathogenesis, and evidence-based control and therapeutic strategies. Front Med 2020;14(2):117-25.
