Прогностическое значение эхокардиографических параметров у пациентов с тромбоэмболией легочной артерии
Оценка прогностического значения эхокардиографических параметров у пациентов с тромбоэмболией легочной артерии (ТЭЛА) в отношении госпитальной смертности.
В ретроспективное исследование был включен 91 пациент с ТЭЛА. У всех больных при трансторакальной эхокардиографии в течение 48 ч после поступления в стационар измеряли систолическое давление в легочной артерии (СДЛА), экскурсию кольца трикуспидального клапана (tricuspid annular plane systolic excursion – TAPSE), отношение TAPSE/СДЛА и определяли наличие гипокинезии стенки правого желудочка и тромбоза полостей правых предсердия и желудочка. Первичной конечной точкой была госпитальная смерть.
Во время госпитализации умерли 11 (12,1%) из 91 пациента. Следующие признаки у умерших больных встречались чаще, чем у выживших: D-образный левый желудочек (72,7% и 50,0%, соответственно, р=0,03), тромбы в полостях сердца (18,2% и 2,5%, р=0,02) и TAPSE<16 мм (90,9% и 33,8%, р<0,01). СДЛА было значительно повышено в обеих группах и не различалось между ними (62,0±12,8 и 62,0±12,8 мм рт. ст., р=0,48). У умерших пациентов TAPSE была достоверно ниже, чем у выживших (14,2±2,7 и 18,6±5,0 мм, р=0,002), как и отношение TAPSE/СДЛА (0,23±0,06 и 0,33±0,30, р=0,02). При снижении TAPSE <16 мм отношение рисков (ОР) госпитальной смерти составило 14,8 (95% ДИ 1,8-120,7; p<0,001). Ассоциация между СДЛА (ОР 1,0, 95% ДИ 0,96–1,0, р=0,73) и отношением TAPSE/СДЛА <0,4 (ОР 4,5, 95% ДИ 0,55– 36,5, р=0,09) и госпитальной смертностью отсутствовала. По данным ROC-анализа, площадь под кривой была максимальной для TAPSE<16 мм (AUC=0,77).
У пациентов с ТЭЛА значение TAPSE <16 мм является независимым предиктором госпитальной смертности.
Эхокардиография является методом выбора оценки морфологии и функции правого желудочка у пациентов с тромбоэмболией легочной артерии (ТЭЛА), а также дает представление о наличии легочной гипертензии и увеличении после нагрузки правого желудочка. Ультразвуковое исследование – это широкодоступный метод, который позволяет оценить состояние сердца без больших финансовых затрат в кратчайшие сроки после поступления пациента в стационар [1,11].
Дисфункция правого желудочка часто встречается при ТЭЛА и четко коррелирует с внутрибольничной и 30-дневной смертностью, поэтому трансторакальная эхокардиография играет важную роль в стратификации риска у таких пациентов [11]. Cуществует целый ряд параметров, которые используются для выявления перегрузки и дисфункции правого желудочка, в том числе дилатация правого желудочка, отношение конечных диастолических объемов правого и левого желудочков, наличие симптома Макконела (гипокинезия свободной стенки при нормальной сократимости верхушки правого желудочка), систолическая экскурсия кольца трикуспидального клапана (tricuspid annular plane systolic excursion – TAPSE), систолическое артериальное давление в легочной артерии (СДЛА), признак "60/60" (сочетание времени ускорения кровотока в выносящем тракте правого желудочка менее 60 мс с максимальным систолическим градиентом на трикуспидальном клапане менее 60 мм рт. ст.), наличие тромбоза полостей сердца, D-образный левый желудочек (уплощение межжелудочковой перегородки). Однако специфичность и чувствительность эхокардиографических показателей при оценке прогноза у пациентов с ТЭЛА заметно отличаются. По данным мета-анализа, у пациентов со стабильной гемодинамикой самым надежным предиктором госпитальной смертности (чувствительность 66%, специфичность 77%) было отношение конечных диастолических объемов правого и левого желудочков >0,7, а самым специфичным (96%), но низкочувствительным (16%) – признак МакКоннелла [4].
Эхокардиографические параметры включены во многие прогностические шкалы, предназначенные для оценки риска неблагоприятных исходов у пациентов с ТЭЛА, в том числе шкалу BOVA (наличие любого признака дисфункции правого желудочка по данным эхокардиографии или компьютерной томографии) [11], шкалу PESI-Echo (балл, рассчитанный по формуле PESI + СДЛА – TAPSE) [3], российскую шкалу СИРЕНА (снижение фракции выброса левого желудочка) [6]. В соответствии с рекомендациями Европейского общества кардиологов 2019 г. эхокардиография может быть полезной у гемодинамически нестабильных пациентов при дифференциальной диагностике причины шока и позволяет выявить тампонаду сердца, острую клапанную дисфункцию, глобальную или региональную дисфункцию левого желудочка, расслоение аорты или гиповолемию [8]. Хотя компьютерная томография легочной артерии с контрастным усилением считается золотым стандартом диагностики ТЭЛА, данный метод имеет ряд ограничений, связанных в первую очередь с использованием внутривенного контрастного вещества.
Целью ретроспективного исследования была оценка прогностического значения эхокардиографических параметров у пациентов с ТЭЛА в отношении госпитальной смертности.
Материал и методы
В одноцентровое ретроспективное исследование включали пациентов с ТЭЛА, госпитализированных в реанимационное отделение городской клинической больницы г. Москвы в 2019-2021 гг. Диагноз ТЭЛА был подтвержден с помощью компьютерной томографии легочной артерии с контрастным усилением. Критерием включения было наличие результатов эхокардиографии, выполненной в течение 48 ч после поступления в стационар. Первичной конечной точкой исследования была госпитальная смертность.
При трансторакальной эхокардиографии оценивали параметры, отражающие перегрузку правых отделов сердца: D-образный левый желудочек, гипокинезия свободной стенки правого желудочка, TAPSE, СДЛА, отношение TAPSE/СДЛА и наличие тромбоза полостей сердца. Отрезными считали значения TAPSE<16 мм и TAPSE/ СДЛА<0,4, так как в предыдущих исследованиях была показана их высокая прогностическая значимость [2]. Во время процедуры использовали стандартные проекции, позволяющие обеспечить регистрацию необходимых параметров при оптимальном уровне визуализации. Иссле до вание выполняли по стандартной методике на аппарате VIVID-Е90 (General Electric, США).
Статистическая обработка полученных данных проведена с использованием пакетов прикладного программного обеспечения Stata/MP 14.0 для Windows 64-bit и Excel 2016 (Microsoft, США). Для проверки гипотезы о законе распределения использовали критерий Колмогорова-Смирнова. Для количественных переменных с нормальным распределением рассчитывали среднее арифметическое значение (М) и стандартное отклонение (SD), а для количественных переменных с асимметричным распределением (Skewness>1) – медиану (Me) и интерквартильный размах (IQR). При сравнении количественных признаков в подгруппах с бинарными характеристиками использовали непараметрический критерий Манна-Уитни. О различиях качественных признаков судили по критерию χ2 и точному критерию Фишера. Для оценки статистической значимости различий между корреляционными связями использовали Z-преобразование Фишера для независимых коэффициентов корреляции. Различия считали статистически значимыми при p<0,05. Для оценки связи признака с одним или несколькими количественными или качественными данными применялся логистический регрессионный анализ и ROC-анализ.
Результаты
В ретроспективное исследование был включен 91 пациент с ТЭЛА (42,9% мужчин, средний возраст 65,8±12,8 лет). Во время госпитализации умерли 11 (12,1%) больных. Умершие и выжившие пациенты были в целом сопоставимы по наличию сопутствующих заболеваний и факторов риска (табл. 1). Доля мужчин в двух группах составила 36,5% и 43,8%, соответственно, а средний возраст пациентов – 65,2±7,5 и 65,9±13,4 лет. В группе умерших пациентов чаще встречались ожирение и хронические заболевания легких и было больше больных с нестабильной гемодинамикой, повышенным уровнем тропонина, а также цианозом, хрипами в легких и набуханием шейных вен (табл. 2).
| Факторы риска | Выжившие,n=80 | Умершие,n=11 | p |
|---|---|---|---|
| Примечание: ХСН – хроническая сердечная недостаточность, ТГВ – тромбоз глубоких вен нижних конечностей, ХБП – хроническая болезнь почек, ХОБЛ – хроническая обструктивная болезнь легких | |||
| Гипертоническая болезнь | 67 (83,8) | 7 (63,6) | 0,109 |
| Ожирение | 28 (35,0) | 6 (54,6) | 0,024 |
| ХСН | 20 (25,0) | 5 (45,5) | 0,154 |
| Варикозная болезнь | 20 (25,0) | 3 (27,3) | 0,871 |
| Сахарный диабет | 15 (18,8) | 3 (27,3) | 0,506 |
| ТГВ в анамнезе | 16 (20,0) | 1 (9,1) | 0,376 |
| Опухоль | 12 (15,0) | 4 (36,4) | 0,081 |
| Инфаркт миокарда | 13 (16,3) | 1 (9,1) | 0,537 |
| Хронические заболевания легких | 8 (10,0) | 4 (36,4) | 0,015 |
| Иммобилизация | 8 (10,0) | 3 (27,3) | 0,099 |
| ТЭЛА в анамнезе | 9 (11,3) | 1 (9,1) | 0,830 |
| Курение | 7 (8,8) | 3 (27,3) | 0,066 |
| ХБП | 6 (7,5) | 2 (18,2) | 0,241 |
| Любые переломы в течение года | 3 (3,8) | 1 (9,1) | 0,418 |
| ХОБЛ | 1 (1,3) | 2 (18,2) | 0,003 |
| Операция в течение 4 недель | 4 (5,0) | 2 (18,2) | 0,099 |
Среднее СДЛА было значительно повышено в обеих группах и не различалось между ними (62,0±12,8 и 62,0±12,8 мм рт. ст., соответственно, р=0,48) (табл. 3). У умерших пациентов TAPSE была достоверно ниже, чем у выживших (14,2±2,7 и 18,6±5,0 мм, р=0,002), как и отношение TAPSE/СДЛА (0,23±0,06 и 0,33±0,30, р=0,02). Фракция выброса левого желудочка была сходной у выживших и умерших пациентов (50,2±9,8 и 52,0±7,0%, соответственно, р=0,25). Следующие признаки у умерших больных встречались чаще, чем у выживших: D-образный левый желудочек (72,7% и 50,0%, соответственно, р=0,03), тромбы в полостях сердца (18,2% и 2,5%, р=0,02) и TAPSE<16 мм (90,9% и 33,8%, р<0,01).
| Симптомы | Выжившие,n=80 | Умершие,n=11 | p |
|---|---|---|---|
| Примечание: ЧСС – частота сердечных сокращений, ЧДД – часто-та дыхательных движений, САД – систолическое артериальное давление, SpO2 – сатурация крови кислородом | |||
| Одышка | 75 (93,8) | 10 (90,9) | 0,722 |
| Слабость | 43 (53,8) | 5 (45,5) | 0,605 |
| Отек ног | 40 (50,0) | 5 (45,5) | 0,777 |
| Боль в ноге | 27 (33,8) | 0 | 0,022 |
| ЧСС>110 в минуту | 23 (28,8) | 4 (36,4) | 0,623 |
| САД<120 мм рт. ст. | 20 (25,0) | 6 (54,6) | 0,045 |
| САД<100 мм рт. ст. | 9 (11,3) | 6 (54,6) | 0,0001 |
| Акроцианоз | 19 (23,8) | 5 (45,5) | 0,126 |
| SpО2<90% | 20 (25,0) | 6 (54,6) | 0,124 |
| Боль в груди | 18 (22,5) | 1 (9,1) | 0,305 |
| Обморок | 13 (16,3) | 1 (9,1) | 0,537 |
| Нарушение сознания | 7 (8,8) | 3 (27,3) | 0,066 |
| Массивный цианоз | 6 (7,5) | 4 (36,4) | 0,004 |
| Головокружение | 9 (11,3) | 0 | 0,241 |
| Хрипы в легких | 6 (7,5) | 3 (27,3) | 0,039 |
| ЧДД >30 в минуту | 2 (2,5) | 1 (9,1) | 0,261 |
| Кровохарканье | 2 (2,5) | 1 (9,1) | 0,251 |
| Набухание шейных вен | 1 (1,3) | 2 (18,2) | 0,003 |
| Повышение уровня тропонина | 46 (57,5) | 11 (100) | 0,040 |
При проведении ROC-анализа значение TAPSE <16 мм имело максимальную площадь под кривой (AUC; 0,77, 95% доверительный интервал [ДИ] 0,65–0,89) для прогнозирования госпитальной смертности и характеризовалось высокими чувствительностью (91%) и специфичностью (66%). Значения AUC для СДЛА и отношения TAPSE/СДЛА были значительно ниже – 0,52 (95% ДИ 0,29–0,67) и 0,59 (95% ДИ 0,48–0,72), соответственно. Увеличение СДЛА >30 мм рт. ст. обладало высокой чувствительностью (100%) при очень низкой специфичности (4%). TAPSE/СДЛА<0,4 также характеризовалось высокой чувствительностью (91%), но специфичность этого показателя (31%) была ниже таковой TAPSE<16 мм. Значение AUC для D-образного левого желудочка составило 0,70 (95% ДИ 0,57–0,82), а для тромбоза полостей сердца – 0,54 (95% ДИ 0,43– 0,65).
| Показатели | Выжившие,n=80 | Умершие,n=11 | p |
|---|---|---|---|
| Примечание: ПЖ – правый желудочек, ЛЖ – левый желудочек, СДЛА– систолическое давление в легочной артерии, TAPSE – экскурсия кольца трикуспидального клапана | |||
| D-образный ЛЖ, n (%) | 40 (50,0) | 8 (72,7) | 0,030 |
| СДЛА>30 мм рт. ст., n (%) | 73 (91,3) | 9 (81,8) | 0,544 |
| Гипокинезия стенки ПЖ, n (%) | 12 (15,0) | 3 (27,3) | 0,694 |
| TAPSE<16 мм, n (%) | 27 (33,8) | 10 (90,9) | <0,01 |
| TAPSE/СДЛА<0,4, n (%) | 55 (68,8) | 10 (90,9) | 0,127 |
| Тромбы в полостях сердца, n (%) | 2 (2,5) | 2 (18,2) | 0,018 |
| Фракция выброса ЛЖ, % | 52,0±7,0 | 50,2±9,8 | 0,247 |
| СДЛА, мм рт. ст. | 62,3±16,0 | 62,0±12,8 | 0,480 |
| TAPSE, мм | 18,6±5,0 | 14,2±2,7 | 0,002 |
| TAPSE/СДЛА | 0,33±0,33 | 0,23±0,07 | 0,018 |
При однофакторном анализе только TAPSE позволяло предсказать госпитальную смертность, в частности при снижении этого показателя <16 мм отношение рисков (ОР) смерти составило 14,8 (95% ДИ 1,8-120,7; p<0,001). Корреляции между СДЛА и отношением TAPSE/СДЛА и летальностью выявлено не было (табл. 4, 5).
| Показатели | AUC | Чувствительность, % | Специфичность, % |
|---|---|---|---|
| СДЛА>30 мм рт.ст. | 0,52 | 100 | 4,0 |
| TAPSE<16 мм | 0,77 | 90,9 | 66,3 |
| TAPSE/СДЛА<0,4 | 0,59 | 90,9 | 31,3 |
| D-образный ЛЖ | 0,70 | 88,9 | 49,4 |
| Тромбы в сердце | 0,54 | 18,2 | 97,5 |
| Гипокинезия ПЖ | 0,53 | 28,5 | 74,7 |
| Показатели | ОР | 95% ДИ | p |
|---|---|---|---|
| TAPSE, мм | 0,85 | 0,70-0,98 | 0,020 |
| СДЛА, мм рт. ст. | 1,00 | 0,96-1,00 | 0,730 |
| TAPSE/СДЛА | 0,03 | 0,52-1,80 | 0,045 |
| TAPSE<16 мм | 14,80 | 1,80-120,70 | 0,001 |
| TAPSE/СДЛА<0,4 | 4,50 | 0,55-36,50 | 0,090 |
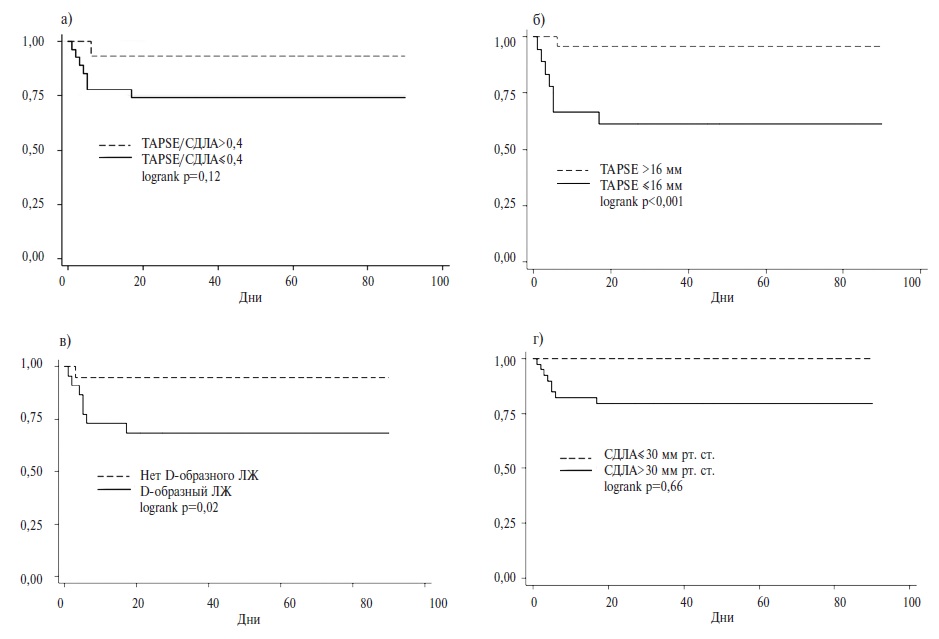
Также была проанализирована кривая выживаемости для госпитальной смертности. Были выявлены статистически значимые различия между группами пациентов со значением TAPSE менее и более 16 мм (logrank р<0,001), а также с D-образным желудочком и без него (logrank р=0,02) (рис. 1).
Обсуждение
Эхокардиография является наиболее информативным и доступным методом для выявления дисфункции правых отделов сердца [10]. Уплощение межжелудочковой перегородки (D-образный левый желудочек) коррелирует со значительной перегрузкой правого желудочка. В нашем исследовании частота этого признака у умерших пациентов с ТЭЛА была достоверно выше, чем у выживших (72,7% и 50,0%, соответственно; р=0,03).
Существуют определенные сложности в оценке объема и фракции выброса правого желудочка, связанные с его сложной геометрией и анатомическим строением, делающими невозможным точный расчет этих параметров [2]. В связи с этим были разработаны другие параметры, позволяющие оценить функцию правого желудочка, такие как СДЛА и TAPSE. Во многих исследованиях было показано, что повышение СДЛА у пациентов с острой ТЭЛА ассоциируется с развитием стойкой легочной гипертензии, а также внутрибольничной и 30-дневной смертностью [7]. Однако в нашем исследовании среднее СДЛА было повышено как у умерших, так и выживших пациентов и достоверно не отличалось между двумя группами.
В многочисленных исследованиях изучали диагностическое значение TAPSE у пациентов с подозрением на ТЭЛА. J. Daley и соавт. при обследовании 150 пациентов, у 32 из которых был установлен диагноз ТЭЛА, рассчитали оптимальное пороговое значение TAPSE, которое составило 20 мм. Чувствительность этого показателя в диагностике ТЭЛА равнялась 72% (95% ДИ 5386), специфичность – 66% (95% ДИ 57-75), AUC – 0,73 (95% ДИ 0,65-0,83) [5]. В другом недавно проведенном исследовании средние значения TAPSE достоверно отличались между группами пациентов с подтвержденной ТЭЛА (15,2 мм) и без нее (22,7 мм; р<0,0001). Пороговое значение этого показателя, равное 15,2 мм, обладало чувствительностью 53,3% (95% ДИ 26,7–80,0) и специфичностью 100% (95% ДИ 100–100) в диагностике клинически значимой ТЭЛА [8]. P. Pruszczyk показали, что TAPSE≤15 мм позволяет выделить пациентов с повышенным риском 30-дневной смертности, связанной с ТЭЛА, тогда как TAPSE>20 мм может использоваться для идентификации пациентов группы очень низкого риска [12]. Кроме того, снижение TAPSE у пациентов с ТЭЛА позволяло предсказать увеличение смертности и срока пребывания в отделении интенсивной терапии [5]. В нашем исследовании значение TAPSE<16 мм было независимым предиктором риска госпитальной смертности, а среднее значение этого показателя в группе умерших пациентов было достоверно ниже, чем среди выживших (14,2 и 18,6 мм, соответственно; р=0,002).
В проспективном исследовании, проводимом на базе американского реестра PERT, был выделен новый эхокардиографический параметр, достоверно ассоциированный с ранними неблагоприятными исходами, и представляющий собой отношение TAPSE и СДЛА [9]. Использование предложенного параметра основано на интеграции оценки сократительной функции правого желудочка и посленагрузки на него. Нормальные значения TAPSE/СДЛА находятся в диапазоне 0,8–1,8 и могут зависеть от возраста, но не от пола. Высокое отношение TAPSE/СДЛА означает, что функция правого желудочка сохранна при существующей посленагрузке. Отношение уменьшается по мере увеличения СДЛА и/или снижения функции правого желудочка, оцененной с помощью TAPSE. Предполагается, что в большинстве случаев изменения TAPSE/СДЛА обусловлены увеличением СДЛА, так как посленагрузка у пациентов с недавним эпизодом острой ТЭЛА является более динамичным фактором по сравнению с сократимостью правого желудочка. Мы не подтвердили высокое предсказательное значение TAPSE/СДЛА в отношении госпитальной смертности, хотя у умерших пациентов оно было достоверно ниже, чем у выживших (0,23 и 0,33, соответственно, р=0,02). При этом доля пациентов с TAPSE/СДЛА<0,4 достоверно не отличалась между двумя группами (91% и 69%, р=0,13) за счет вариабельных значений СДЛА.
Заключение
В ходе нашего исследования была обнаружена взаимосвязь нескольких эхокардиографических параметров, в том числе отношения TAPSE/СДЛА<0,4, TAPSE<16 мм и наличия D-образного ЛЖ, с госпитальной смертностью пациентов с ТЭЛА, а также выявлен сильный предиктор госпитальной смертности – TAPSE<16 мм.
Используемые источники
- Буховец И.Л., Васильцева О.Я., Ворожцова И.Н., Лавров А.Г., Усов В.Ю. Возможности эхокардиографии в дифференциальной диагностике немассивной ТЭЛА. Журнал сердечная недостаточность 2016;17(4):266-72.
- Aloia E, Cameli M, D'Ascenzi F, Sciaccaluga C, Mondillo S. TAPSE: An old but useful tool in different diseases. Int J Cardiol 2016;225:177-83.
- Burgos LM, Scatularo CE, Cigalini IM, et al. The addition of echocardiographic parameters to PESI risk score improves mortality prediction in patients with acute pulmonary embolism: PESI-Echo score. Eur Heart J Acute Cardiovasc Care 2021;10(3):250-257.
- Cho JH, Kutti Sridharan G, Kim SH, et al. Right ventricular dysfunction as an echocardiographic prognostic factor in hemodynamically stable patients with acute pulmonary embolism: a meta-analysis. BMC Cardiovasc Disord 2014;14:64.
- Daley J, Grotberg J, Pare J, et al. Emergency physician performed tricuspid annular plane systolic excursion in the evaluation of suspected pulmonary embolism. Am J Emerg Med 2017;35(1):106-111.
- Эрлих А.Д., Барбараш О.Л., Бернс С.А. и др. Шкала SIRENA для оценки риска госпитальной смерти у пациентов с острой лёгочной эмболией. Российский кардиологический журнал 2020;25(4S):4231 [Erlikh AD, Barbarash OL, Berns SA, et al. SIRENA score for in-hospital mortality risk assessment in patients with acute pulmonary embolism. Russian Journal of Cardiology 2020;25(4S):4231 (In Russ.)].
- Korkmaz A, Ozlu T, Ozsu S, et al. Long-term outcomes in acute pulmonary thromboembolism: the incidence of chronic thromboembolic pulmonary hypertension and associated risk factors. Clin Appl Thromb Hemost 2012;18(3):281-8.
- Lahham S, Fox JC, Thompson M, et al. Tricuspid annular plane of systolic excursion to prognosticate acute pulmonary symptomatic embolism (TAPSEPAPSE study). J Ultrasound Med 2019;38(3):695-702.
- Lyhne MD, Kabrhel C, Giordano N, et al. The echocardiographic ratio tricuspid annular plane systolic excursion/pulmonary arterial systolic pressure predicts short-term adverse outcomes in acute pulmonary embolism. Eur Heart J Cardiovasc Imaging 2021;22(3):285-294
- Matthews JC, McLaughlin V. Acute right ventricular failure in the setting of acute pulmonary embolism or chronic pulmonary hypertension: a detailed review of the pathophysiology, diagnosis, and management. Curr Cardiol Rev 2008;4(1):49-59.
- Konstantinides SV, Meyer G, Becattini C, et al; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020;41(4):543-603.
- Pruszczyk P, Goliszek S, Lichodziejewska B, et al. Prognostic value of echocardiography in normotensive patients with acute pulmonary embolism. JACC Cardiovasc Imaging 2014;7(6):553-60.
