Прямые оральные антикоагулянты в профилактике повторного инсульта у пациентов с фибрилляцией предсердий
Инсульт или транзиторная ишемическая атака (ТИА) в анамнезе у пациентов с неклапанной фибрилляцией предсердий (ФП) более чем в два раза увеличивают риск повторного острого нарушения мозгового кровообращения. Если таким больным не проводится антикоагулянтная терапия, то частота повторного инсульта составляет 6-9% в год и в несколько раз превышает таковую у пациентов с другими факторами риска тромбоэмболических осложнений. Результаты мета-анализа рандомизированных контролируемых исследований показали, что прямые оральные антикоагулянты (ПОАК) у пациентов с ФП, перенесших инсульт/ТИА, по эффективности и безопасности статистически значимо превосходят варфарин и, соответственно, рассматриваются как препараты выбора. Оптимальные сроки назначения антикоагулянтной терапии после перенесенного ишемического инсульта изучаются в рандомизированных контролируемых исследованиях, однако эксперты различных профессиональных обществ считают, что лечение антикоагулянтами в большинстве случаев может быть возобновлено в течение 4-14 дней после нарушения мозгового кровообращения (в зависимости от тяжести инсульта и размера очага). До возобновления антикоагуляции в острую фазу инсульта у пациентов с ФП может быть использована ацетилсалициловая кислота, однако назначать ее на длительный срок в сочетании с антикоагулянтами не следует.
Инсульт остается ведущей медико-социальной проблемой за счет высокой доли в структуре причин заболеваемости, инвалидизации и смертности населения [1]. По данным исследования Global Burden of Disease, в 2016 г. в мире было зарегистрировано около 14 млн новых случаев инсульта, а более 5 млн человек умерли от этого заболевания [2]. В течение жизни инсульт развивается у каждого четвертого жителя Земли в возрасте старше 25 лет. В России доля инсульта в структуре общей смертности превышает 20%, причем в острый период умирают более трети больных, а в течение года – около половины [1]. Кроме того, инсульт занимает первое место среди причин первичной инвалидности. В нашей стране проживает более 1 млн человек, перенесших инсульт. Около трети из них составляют люди трудоспособного возраста, однако к труду возвращается только каждый четвертый больной.
Одной из причин развития ишемического инсульта, доля которого в структуре острых нарушений мозгового кровообращения составляет около 70%, является фибрилляция предсердий (ФП). Распространенность этой аритмии постоянно увеличивается в результате постарения населения, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение и др. В 2017 г. в мире было зарегистрировано более 37 млн пациентов с ФП и около 3 млн новых случаев этой аритмии [3]. ФП встречается по крайней мере у каждого десятого человека старческого возраста [4]. По данным российского исследования, частота ФП среди 1732 москвичей в возрасте в среднем 68,5 лет составила 5,8% у мужчин и 7,4% у женщин, а в возрасте ≥75 лет – 10,0% и 12,8%, соответственно [5]. Следует отметить, что в России в настоящее время проживает более 22 млн людей в возрасте 65 лет и старше, что составляет около 15% от всего населения. При этом за последние 10 лет количество людей в возрасте ≥80 лет увеличилось на 40% и достигло 5,7 млн (3,9% от общей популяции) [6].
Основой профилактики ишемического инсульта у пациентов с ФП являются антикоагулянты. Сегодня с этой целью чаще назначают прямые оральные антикоагулянты (ПОАК), которые по эффективности, безопасности и удобству применения имеют преимущества перед варфарином и другими антагонистами витамина К [7]. В данной статье рассматриваются практические аспекты антикоагулянтной терапии с целью вторичной профилактики инсульта у пациентов с ФП, перенесших острое нарушение мозгового кровообращения.
Риск повторного инсульта у пациентов с ФП
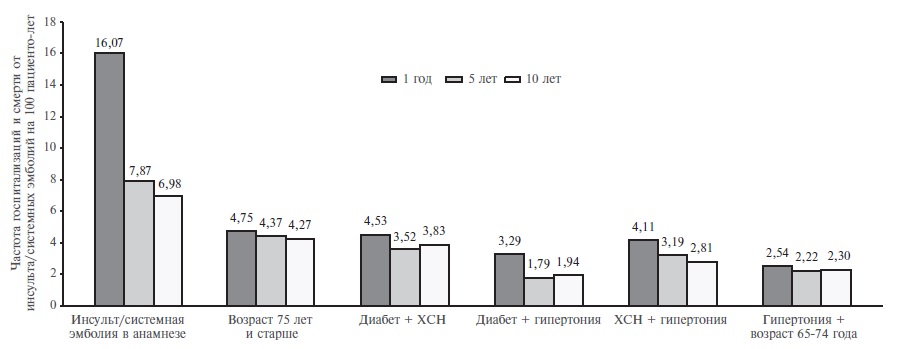
По данным мета-анализа 7 исследований, инсульт или транзиторная ишемическая атака (ТИА) в анамнезе у пациентов с неклапанной ФП, в 2,5 раза увеличивают риск повторного инсульта, причем в большей степени, чем другие факторы риска [8]. Ежегодная частота инсульта у пациентов, не получавших антикоагулянтную терапию, при наличии инсульта/ТИА в анамнезе составила 6-9% и по крайней мере в 3 раза превышала таковую у пациентов в возрасте старше 75 лет (1,53,0%) и больных артериальной гипертонией (1,5-3,0%) или сахарным диабетом (2,0-3,5%). Сходные данные приводят и другие авторы. В датском когортном исследовании был сопоставлен вклад различных факторов риска, которые учитываются по шкале CHA2DS2-VASc, в развитие ишемического инсульта/системных эмболий более чем у 73000 пациентов с неклапанной ФП, не получавших антикоагулянты [9]. По указанной шкале инсульту/ТИА в анамнезе и возрасту ≥75 лет соответствуют по 2 балла, а остальным факторам риска, таким как артериальная гипертония, сахарный диабет, сердечная недостаточность и др., – по 1 баллу. В выборке пациентов со значением индекса CHA2DS2-VASc, равным 2, частота госпитализаций и смерти от ишемического инсульта или системных эмболий у больных, перенесших инсульт/ТИА, в несколько раз превышала таковую у людей старческого возраста и пациентов с сочетанием двух других факторов риска эмболических осложнений (рис. 1). Наиболее значительная разница между группами была отмечена в течение первого года наблюдения, однако она сохранялась и через 5 и 10 лет. Таким образом, в этом исследовании наличие ишемического инсульта или системных эмболий в анамнезе позволяло предсказать значительно более высокий риск повторных неблагоприятных исходов, чем возраст ≥75 лет или сочетание двух других факторов риска, в том числе артериальной гипертонии, сахарного диабета, сердечной недостаточности, возраста 65-74 года.
В наблюдательном исследовании в течение 5 лет после инсульта умерли 60,8% больных с ФП, а перенесли повторный инсульт – 21,5% [10]. Более того, к концу 5-летнего наблюдения после индексного инсульта только 14% больных с ФП были живы и не требовали постороннего ухода. По данным другого популяционного исследования, смертность в течение 1 года после перенесенного инсульта у пациентов с ФП достигла 50% [11]. Еще во Фрамингемском исследовании было установлено, что инсульт у пациентов с ФП протекает тяжелее, чаще рецидивирует и сопровождается более высокой смертностью, чем у больных без ФП [12]. Так, 30-дневная смертность после перенесенного инсульта у пациентов с ФП была более чем в 1,5 раза выше, чем у больных с инсультом другой этиологии (25% и 14%, соответственно). В Copenhagen Stroke Study ФП была выявлена у 18% из 1197 пациентов с острым инсультом [13]. Наличие этой аритмии у пациентов с острым нарушением мозгового кровообращения ассоциировалось с более высокой смертностью и большей длительностью госпитализации. Кроме того, пациентов, перенесших инсульт на фоне ФП, значительно реже удавалось выписать домой.
Неадекватная антикоагулянтная терапия вносит важный вклад в развитие ишемического инсульта, в том числе повторного, у пациентов с неклапанной ФП. D. Gladstone и соавт. проанализировали актуальность этой проблемы на основании канадского проспективного регистра больных острым ишемическим инсультом [14]. Среди почти 600 пациентов с первым ишемическим инсультом, развившимся на фоне ФП, только 10% получали варфарин в терапевтической дозе (международное нормализованное отношение [МНО] ≥2,0). При этом 30% пациентов принимали только антитромбоцитарные препараты, которые мало эффективны в профилактике инсульта при ФП, а 29% – вообще не получали какие-либо антитромботические средства. Похожие данные были получены и у 323 больных с ФП и ишемическим инсультом/ТИА в анамнезе. В этой выборке только 18% больных перед госпитализацией по поводу повторного инсульта получали варфарин в терапевтической дозе, в то время как у 39% пациентов доза антикоагулянта не обеспечивала терапевтическое МНО, а 15% больных не получали антитромботические препараты.
В последние годы частота применения оральных антикоагулянтов, в том числе ПОАК, у больных с ФП увеличилась. Тем не менее, результаты зарубежных и российских проспективных когортных исследований (регистров) свидетельствуют о том, что в обычной клинической практике врачи далеко не всегда проводят адекватную антикоагулянтную терапию пациентам с ФП, в частности не назначают антикоагулянты больным с высоким риском инсульта, но применяют их у пациентов с низким риском эмболических осложнений, а также используют эти препараты в пониженных дозах или заменяют их антиагрегантами [15].
Профиль эффективности и безопасности ПОАК во вторичной профилактике инсульта у пациентов с ФП
При ведении пожилого пациента с ФП, особенно перенесшего инсульт, врач сталкивается с многочисленными проблемами, включая высокий риск не только повторного острого нарушения мозгового кровообращения, но и коронарных осложнений и кровотечений, наличие хронической болезни почек и возможность ее прогрессирования, когнитивные расстройства, снижающие приверженность к терапии. Все перечисленные факторы следует учитывать при выборе стратегии лечения, чтобы обеспечить ее максимальные эффективность и безопасность.
В соответствии с действующими рекомендациями антикоагулянтная терапия, предпочтительно ПОАК, показана пациентам с ФП, у которых значение индекса по шкале CHA2DS2-VASc составляет по крайней мере 1 у мужчин и 2 у женщин [7]. Соответственно, антикоагулянты следует назначать всем пациентам с ишемическим инсультом/ТИА в анамнезе, даже при отсутствии других факторов риска инсульта. Подходить к терапии следует комплексно с учетом риска не только инсульта, но и кровотечений, а также сопутствующих заболеваний (коронарных осложнений, ХБП) и возможности низкой приверженности, принимая во внимание предпочтения пациента. Эффективность и безопасность ПОАК по сравнению с варфарином у пациентов с ФП были установлены в рандомизированных контролируемых исследованиях RE-LY (дабигатран), ROCKET AF (ривароксабан) и ARISTOTLE (апиксабан). Протоколы исследований 3 фазы предусматривали субанализ эффективности ПОАК в выборке больных, перенесших инсульт/ТИА. Самой высокой доля таких пациентов была в исследовании ROCKET AF – 52% против 19% в исследовании ARISTOTLE и 20% в исследовании RELY.
В исследовании ROCKET AF лечение ривароксабаном привело к снижению риска развития инсульта и системных эмболий на 21% и сопровождалось статистически значимо меньшим риском внутричерепного, смертельного и кровотечения из жизненно-важных органов по сравнению с варфарином [16]. Эти результаты были получены в популяции пациентов с более высоким риском инсульта и кровотечений по сравнению с таковым в исследованиях других ПОАК (средний балл по шкале CHADS2 составил 3,5 в ROCKET AF и всего 2,1 в RE-LY и ARISTOTLE, а средний балл по шкале HAS-BLED – 3,0 в ROCKET AF и 2,0 в ARISTOTLE; последний не указан в исследовании RE-LY). При этом доля пациентов с высоким риском кровотечений (сумма баллов по шкале HAS-BLED 3 и более) составила 62% в исследовании ROCKET AF, 23% в ARISTOTLE и 10% в RE-LY.
G. Hankey и соавт. на основании данных исследования ROCKET AF сопоставили результаты применения ривароксабана и варфарина у 7468 пациентов, перенесших инсульт или ТИА, и 6796 больных без инсульта/ТИА в анамнезе [17]. Как и ожидалось, в первой выборке частота неблагоприятных исходов была примерно в два раза выше, чем во второй. При этом в обеих выборках показан благоприятный профиль эффективности ривароксабана в профилактике инсульта/системных эмболий (рис. 2). Частота больших и клинически значимых небольших кровотечений у пациентов с ишемическим инсультом/ТИА в анамнезе также была сходной при лечении ривароксабаном и варфарином. При этом она оказалась несколько ниже, чем у пациентов без инсульта/ТИА в анамнезе. Среди больных с ишемическим инсультом/ТИА в анамнезе частота внутричерепных и смертельных кровотечений при лечении ривароксабаном также была ниже, чем при применении варфарина, хотя разница между группами не достигла статистической значимости.
![Частота (%) первичного и повторного инсульта/ТИА при лечении ривароксабаном или варфарином в ROCKET AF [17].](/wp-content/uploads/2021/10/pryamye-oralnye-antikoagulyanty-v-profilaktike-povtornogo-insulta_fig2.jpg)
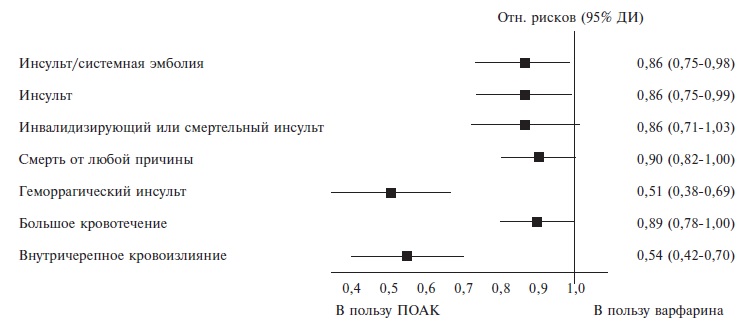
G. Ntaios и соавт. провели мета-анализ 4 рандомизированных контролируемых исследований, в которых сравнивали эффективность и безопасность ПОАК и варфарина у пациентов с ФП [18]. В эти исследования были включены 20500 пациентов, перенесших ишемической инсульт или ТИА в анамнезе. В данной выборке лечение ПОАК в течение от 1,8 до 2,8 лет по сравнению с варфарином сопровождалось статистически значимым снижением риска инсульта/системной эмболии (на 13,7%), геморрагического инсульта (на 50,0%), любого инсульта (на 13,1%) и внутричерепного кровоизлияния (на 46,1%) (рис. 3). Кроме того, при применении ПОАК была отмечена тенденция к снижению частоты больших кровотечений (на 10,6%). На основании результатов этого мета-анализа эксперты Европейского общества кардиологов рекомендовали отдавать предпочтение ПОАК при проведении вторичной профилактики инсульта у пациентов с ФП [7].
Профиль эффективности и безопасности ПОАК во вторичной профилактике инсульта дополняется и результатами ретроспективных исследований и исследований, проводившихся в обычной клинической практике. В проспективное наблюдательное исследование NEURO-XAR, проводившееся в российских центрах, были включены 214 пациентов в возрасте от 46 до 87 лет с ФП, которым в связи с перенесенным ишемическим инсультом или ТИА был назначен ривароксабан [19]. Через 6 мес наблюдения 94% пациентов продолжали терапию ПОАК. В течение указанного срока были зарегистрированы всего два случая кровотечения (один – на фоне одновременного приема ацетилсалициловой кислоты), а частота повторных церебральных ишемических осложнений составила 0,9%.
C. Coleman и соавт. на основании медицинской базы данных сопоставили риск развития ишемического инсульта или внутричерепного кровоизлияния у пациентов с ФП, перенесших ишемический инсульт или ТИА, при лечении апиксабаном или варфарином (n=2514), дабигатраном или варфарином (n=1962) и ривароксабаном или варфарином (n=5208) [20]. Па циенты групп сравнения в трех когортах были сопоставимы по демографическим и клиническим показателям. По данным регрессионного анализа Кокса, апиксабан и дабигатрин не уступали варфарину по эффективности в профилактике повторного ишемического инсульта или внутричерепного кровоизлиния (отношения рисков 0,70; 95% ДИ 0,33-1,48, и 0,53; 95% ДИ 0,26-1,07, соответственно), в то время как при лечении ривароксабаном риск первичной конечной точки статистически значимо снизился (отношение рисков 0,45; 95% ДИ 0,29-0,72). Частота больших кровотечений статистически значимо не отличалась при лечении ПОАК и варфарином. В другом когортном исследовании лечение ривароксабаном у пациентов с впервые выявленной ФП привело к снижению риска развития любого инсульта на 19% по сравнению с варфарином [21]. При этом риск развития тяжелого инсульта снизился на 48%, а риск смерти непосредственно после инсульта и в течение 30 дней – на 24% и 59%, соответственно.
Ведущими причинами смерти пациентов с ФП, получавших антикоагулянтную терапию, являются не инсульт, а другие сердечно-сосудистые осложнения, в том числе инфаркт миокарда [22]. Более того, ФП является независимым фактором риска развития инфаркта миокарда [23], профилактика которого и других сердечно-сосудистых исходов является одним из ключевых компонентов современной стратегии ведения пациентов с ФП [7]. Результаты наблюдательных исследований свидетельствуют о том, что ПОАК могут иметь преимущество перед антагонистами витамина К по эффективности в профилактике сердечно-сосудистых осложнений. Например, в проспективном исследовании ATHERO-AF у 2366 пациентов с неклапанной ФП лечение ПОАК по сравнению с непрямыми антикоагулянтами в течение в среднем 3 лет привело к снижению риска сердечно-сосудистых исходов, в том числе инфаркта миокарда, вмешательств на коронарных артериях и смерти от сердечно-сосудистых причин, на 36% и инфаркта миокарда на 50% [24]. В крупном ретроспективном исследовании при лечении ривароксабаном выявлено снижение суммарного риска сердечно-сосудистых исходов, включая ишемический инсульт, инфаркт миокарда и необходимость в реваскуляризации периферической артерии/ампутации конечности, по сравнению с варфарином при сопоставимой частоте больших кровотечений [25]. По данным мета-анализов рандомизированных исследований, ривароксабан, в отличие от дабигатрана и апиксабана, статистически значимо снижал риск развития инфаркта миокарда [2628].
ФП часто встречается у пациентов с хронической болезнью почек (ХБП) [29] и почти в 2 раза увеличивает риск ухудшения почечной функции [30]. В свою очередь, ХБП у пациентов с ФП сопровождается увеличением риска инсульта, в том числе повторного [31]. Лечение антикоагулянтами может спровоцировать ухудшение функции почек за счет острого их повреждения, связанного с чрезмерной антикоагуляцией и кровоизлияниями в клубочки почек. При применении ПОАК это осложнение встречается реже, чем при применении варфарина, что объясняют их более предсказуемым антикоагулянтным действием, а также отсутствием эффекта кальцификации в силу механизма действия [32]. Результаты ряда исследований свидетельствуют о том, что терапия ПОАК может улучшить почечные исходы у пациентов с ФП. В ретроспективном исследовании у 72000 пациентов с ФП, начавших лечение ривароксабаном или варфарином в течение предыдущих 12 мес, прием ривароксабана сопровождался снижением риска развития острого почечного повреждения (ОПП) на 19% и ХБП 5 стадии на 18% по сравнению с варфарином [33]. В другом ретроспективном исследовании более чем у 21000 пациентов с сахарным диабетом и неклапанной ФП риск развития ОПП при лечении ривароксабаном снизился на 17% по сравнению с таковым в группе варфарина, а риск развития ХБП 5 стадии – на 18% [34]. Улучшение почечных исходов (снижения скорости клубочковой фильтрации [СКФ] по крайней мере на 30% или удвоения сывороточного креатинина) было отмечено также при применении ривароксабана, но не апиксабана, в ретроспективном исследовании у 9769 пациентов с неклапанной ФП, получавших различные ПОАК или варфарин в течение 2 лет [35]. В российском многоцентром проспективном рандомизированном исследовании, представленном на Европейском конгрессе кардиологов в 2020 г., у 109 пациентов с неклапанной ФП и ХБП 4 стадии или устойчивым снижением СКФ лечение ривароксабаном по сравнению с варфарином привело к значимому улучшению динамики уровня креатинина и СКФ (по CKD-EPI и Кокрофту–Голту) по сравнению с варфарином [36]. Возможность снижения риска почечных исходов при применении ривароксабана и дабигатрана по сравнению с варфарином отмечена в американских рекомендациях по ведению пациентов с ФП, опубликованных в 2019 г. [37].
Основным нежелательным эффектом любых антитромботических препаратов являются кровотечения. У пациентов, перенесших ишемический инсульт/ТИА, риск геморрагических осложнений увеличивается, в частности инсульту в анамнезе соответствует 1 балл по шкале HAS-BLED, которую используют для оценки вероятности кровотечений при лечении антикоагулянтами у больных с ФП. Тем не менее, высокое значение индекса по этой шкале при отсутствии абсолютных противопоказаний не может служить основанием для отказа от антикоагулянтной терапии у пациентов с ФП, у которых имеется высокий риск развития ишемического инсульта, в том числе перенесших инсульт/ТИА в анамнезе [7]. Более того, пациенты с высоким риском кровотечений получают большую чистую клиническую пользу от применения антикоагулянта, чем с низким [38]. Важное значение для профилактики кровотечений имеет контроль модифицируемых фак торов риска, таких как артериальная гипертония, злоупотребление алкоголем, прием нестероидных противовоспалительных препаратов. Следует также избегать необоснованного присоединение ацетилсалициловой кислоты к антикоагулянтам, так как комбинированная терапия антитромботическими препаратами у пациентов с ФП сопровождалась увеличением риска кровотечений, но не влияла на частоту тромботических осложнений [39].
Как указано выше, ПОАК в рандомизированных контролируемых исследованиях имели преимущества по безопасности перед варфарином у пациентов с инсультом/ТИА в анамнезе за счет двухкратного снижения риска развития геморрагического инсульта и внутричерепного кровоизлияния [18]. Снижение частоты наиболее опасных кровотечений при лечении ПОАК было отмечено и при наличии других факторов риска геморрагических осложнений. Например, в исследовании ROCKET AF при лечении ривароксабаном частота смертельных кровотечений у пациентов с ФП и умеренным нарушением функции почек была статистически значимо ниже, чем в группе варфарина (p=0,047) [40]. В том же исследовании статистически значимо меньший риск внутричерепных кровоизлияний при лечении ривароксабаном был отмечен и у пациентов в возрасте ≥75 лет [41].
В проспективном наблюдательном исследовании SAFIR-AC, проводившемся в обычной клинической практике, профиль безопасности ривароксабана и непрямых антикоагулянтов был сопоставлен у 1903 пациентов в возрасте ≥80 лет c ФП [42]. Средний возраст пациентов составлял 86 лет, а 23% больных были в возрасте 90 лет и старше. Доля пациентов такого возраста в рандомизированных клинических исследованиях была небольшой, что определяло необходимость в дополнительном изучении показателей безопасности антикоагулянтной терапии в этой “уязвимой" популяции. Следует отметить, что профиль безопасности других ПОАК не изучался в аналогичных крупных проспективных исследованиях в популяции пациентов старческого возраста с ФП. Средний индекс CHA2DS2VASc у пациентов, включенных в исследование SAFIRAC, составлял около 4,5, а индекс HAS-BLED – около 2. В когортах пациентов, сопоставимых по исходным показателям, лечение ривароксабаном привело к статистически значимо меньшему риску больших кровотечений (на 47%), прежде всего за счет внутримозговых кровоизлияний (на 62%) и смертельных кровотечений (на 58%). Частота желудочно-кишечных кровотечений была также ниже при лечении ривароксабаном, однако разница риска их развития не была подтверждена при статистическом анализе. По эффективности в профилактике ишемического инсульта ривароксабан и непрямые антикоагулянты достоверно не отличались. В целом приведенные данные свидетельствуют о благоприятном профиле безопасности ривароксабана у пациентов старческого возраста с ФП, у которых резко увеличивается риск не только ишемического инсульта, но и геморрагических осложнений.
Ведение пациентов с ФП и ишемическим инсультом, развившимся на фоне антикоагуляции
У пациентов с ФП и ишемическим инсультом, развившимся несмотря на антикоагулянтную терапию, ключевое значение имеет оптимизации антикоагуляции [7]. Если пациент получает антагонист витамина К, то необходимо убедиться в том, что лечение поддерживает МНО в терапевтическом диапазоне (2,0-3,0) более 70% времени, и, если нет, то скорректировать дозу и/или схему применения препарата. Следует учитывать, что обеспечить адекватную антикоагуляцию с помощью варфарина бывает сложно, так как пациентам, особенно старческого возраста, часто трудно регулярно мониторировать МНО из-за ограниченной мобильности или титровать дозу непрямого антикоагулянта из-за когнитивных расстройств. В таких случаях целесообразно перевести пациента с антагониста витамина К на ПОАК, при лечении которым не требуется подбор дозы или измерение МНО и значительно ниже риск взаимодействия с другими препаратами. Еще более вескими доводами в пользу применения ПОАК вместо варфарина являются их более высокие эффективность и безопасность во вторичной профилактике инсульта у пациентов с ФП [7]. Если ишемический инсульт развился на фоне терапии ПОАК, то следует убедиться в том, что пациент принимает препарат в адекватной дозе, и контролировать приверженность к лечению. Дозы ПОАК рекомендуется снижать в определенных ситуациях согласно одобренным инструкциям по применению, например, дозу ривароксабана целесообразно снизить с 20 до 15 мг один раз в сутки у пациентов с клиренсом креатинина ниже 50 мл/мин. Однако врачи иногда снижают дозы ПОАК без должных оснований, в частности из-за опасений по поводу возможных геморрагических осложнений. B. Steinberg и соавт. изучили последствия подобной практики на основании регистра ORBIT-AF II почти у 8000 пациентов с ФП, получавших ПОАК [43]. 1289 (16%) из них принимали ПОАК в сниженных дозах, причем более чем в половине случаев снижение дозы было необоснованным, т.е. не соответствовало инструкции по применению. У пациентов, получавших ПОАК в неадекватно низких дозах, было отмечено статистически незначимое увеличение риска тромбоэмболических осложнений (отношение рисков 1,56, 95% ДИ 0,92-2,67), больших кровотечений (1,49, 95% ДИ 1,022,18) и смерти (2,61, 95% ДИ 1,86-3,67). Таким образом, результаты этого исследования свидетельствуют о том, что необоснованное снижение дозы ПОАК может ухудшить эффективность профилактики инсульта и при этом может не сопровождаться снижением риска геморрагических осложнений.
Актуальность проблемы неадекватного дозирования ПОАК в обычной клинической практике иллюстрируют результаты мета-анализа 23 исследований более чем у 160000 пациентов с ФП [44]. В целом почти каждый четвертый пациент (24%) принимал ПОАК в дозах, не соответствовавших инструкции по применению. Чаще всего (20%) врачи необоснованно снижали дозы ПОАК и реже (5%) применяли их в дозах, превышавших рекомендуемые. Частота неадекватного дозирования ПОАК была выше в странах Азии (32%) и ниже в Северной Америке (14%) и Европе (22%). Приведенные данные указывают на необходимость внедрения образовательных программ для врачей, чтобы обеспечить адекватность дозирования ПОАК в клинической практике и, соответственно, повысить эффективность и безопасность профилактики инсульта у пациентов с ФП.
Еще одним важным условием эффективной профилактики неблагоприятных исходов является высокая приверженность к антикоагулянтной терапии. ФП часто встречается у людей старческого возраста, которые нередко забывают принимать таблетки из-за когнитивных расстройств. Более того, ФП сама по себе ассоциируется с развитием когнитивных нарушений. По данным мета-анализа 14 исследований, риск развития деменции у пациентов с ФП был повышен в 2 раза (p<0,0001), а в одном исследовании было также выявлено 4-кратное увеличение риска прогрессирования легких когнитивных расстройств с переходом в деменцию [45]. Когнитивные расстройства обычно усугубляются после перенесенного инсульта. По данным другого мета-анализа исследований более чем у 14360 больных с инсультом в анамнезе (у 1363 из них имелась ФП), наличие ФП у таких пациентов ассоциировалось с более высоким риском развития когнитивных расстройств (отношение шансов 1,60; 95% ДИ 1,20-2,14) и деменции (3,11; 95% ДИ 2,05-4,73) [46]. В целом частота когнитивных нарушений различной выраженности у больных, перенесших инсульт, достигает 70-80% [47].
Как и неадекватное дозирование, недостаточная приверженность к антикоагулянтной терапии отражается на ее эффективности и может привести к тяжелым, иногда необратимым, последствиям. A. Ozaki и соавт. на основании мета-анализа 48 наблюдательных исследований почти у 600000 пациентов с ФП (средний возраст 71 год) проанализировали зависимость клинических исходов от приверженности к терапии ПОАК. В целом приверженность к приему этих препаратов была высокой в 66% случаев. Неадекватная приверженность к антикоагулянтной терапии ассоциировалась с достоверным увеличением риска инсульта в 1,39 раза (95% ДИ 1,06-1,81) [48]. В этом исследовании вероятность регулярного приема антикоагулянтов при назначении ПОАК была в 1,44 раза выше (95% ДИ 1,12-1,86), чем при применении антагонистов витамина К.
Более удобная схема дозирования ПОАК может способствовать дополнительному повышению приверженности к терапии. По данным российского исследования более чем у 400 пациентов старше 75 лет с ФП/трепетанием предсердий, при двукратном приеме ПОАК нарушения режима, дозы и схемы приема препаратов наблюдались чаще, чем при однократном режиме дозирования [49]. Применение ривароксабана, который назначают один раз в день, позволило уменьшить вероятность низкой приверженности к лечению на 28,8% по сравнению с дабигатраном (р<0,01) и на 23,9% по сравнению с апиксабаном (р<0,01).
Еще одной проблемой у пациентов с ФП, перенесших инсульт, является дисфагия, которая встречается более чем у половины больных и нередко сохраняется даже спустя 6 месяцев после острого нарушения мозгового кровообращения [50]. Таблетка ривароксабана имеет маленький размер (6 мм; для сравнения размер капсулы дабигатрана составляет 22 мм), может быть измельчена и смешана с водой или жидким питанием, что имеет практическое значение для пациентов, испытывающих затруднение при глотании пищи.
В клинической практике оральные антикоагулянты нередко назначают в комбинации с антиагрегантами, в том числе при отсутствии каких-либо показаний к применению последних. В регистре GARFIELD-AF, в который были включены около 51000 пациентов с ФП в 35 странах, доля больных, получавших комбинированную антитромботическую терапию, составила 14% [51]. В руководстве Европейского общества кардиологов по диагностике и лечению ФП указано, что в настоящее время нет данных, подтверждающих более высокую эффективность комбинированной терапии у пациентов с ФП, перенесших инсульт или ТИА [7]. Более того, присоединение антитромбоцитарных препаратов к антикоагулянтам приводило к увеличению риска больших и внутричерепных кровотечений и не оказывало влияние на смертность [52]. Комбинированная терапия антикоагулянтами и антитромбоцитарными препаратами не требуется и пациентам с ФП и хронической ИБС, хотя она обоснована в течение 6-12 мес после стентирования коронарных артерий [7].
Сроки возобновления антикоагулянтной терапии после инсульта
Хотя необходимость антикоагулянтной терапии для вторичной профилактики инсульта у пациентов с ФП не вызывает сомнения, оптимальные сроки возобновления/инициации антикоагуляции после перенесенного ишемического инсульта не определены [53]. В настоящее время этот вопрос изучается в нескольких крупных клинических исследованиях (ELAN, OPTIMAS, TIMING и START), результаты которых пока не опубликованы. Соответственно, все существующие рекомендации основываются на данных наблюдательных исследований и мнении экспертов.
С одной стороны, возобновлять антикоагулянтную терапию у пациентов с ФП целесообразно в ранние сроки после ишемического инсульта, учитывая высокий риск повторного инсульта, который в первые 2 недели составляет от 0,5 до 1,3% в день [54]. С другой стороны, лечение антикоагулянтами может осложниться геморрагической трансформацией инсульта, которая сопровождается увеличением риска смерти. Для оценки риска ишемического инсульта и геморрагических осложнений при проведении антикоагулянтной терапии у пациентов с ФП используют шкалы CHA2DS2VASc и HAS-BLED, соответственно, однако они не предназначены для использования в острую фазу инсульта. В связи с этим определить баланс между возможной пользой и риском антикоагуляции в ранние сроки после ишемического инсульта у конкретного больного достаточно сложно.
Подробные рекомендации по вторичной профилактике инсульта у пациентов с ФП, перенесших инсульт/ ТИА, были опубликованы в 2019 г. Евро пейской организацией по изучению инсульта [55]. По мнению экспертов, сроки возобновления антикоагулянтной терапии следует выбирать с учетом распространенности и тяжести инсульта. У пациентов, перенесших ТИА, риск внутричерепного кровоизлияния низкий, поэтому в таких случаях антикоагуляция может быть продолжена без перерыва. При сохранении неврологического дефицита следует повторить компьютерную или магнитно-резонансную томографию через 24-72 ч, чтобы исключить кровоизлияние и определить размер инфаркта мозга. У пациентов с легким инсультом (балл по шкале NIHSS <8) размером <1,5 см лечение оральными антикоагулянтами может быть возобновлено через 3-4 дня, со средне-тяжелым инсультом (NIHSS 816) – через 5-7 дней и с тяжелым инсультом (NIHSS>16) – через 12-14 дней после индексного события. Результаты рандомизированных контролируемых исследований свидетельствуют о том, что применение стандартного или низкомолекулярного гепарина в первые дни после развития острого кардиоэмболического инсульта сопровождается увеличением частоты внутричерепных кровоизлияний и недостоверным снижением частоты повторного ишемического инсульта и при этом не оказывает существенного влияния на летальность или инвалидизацию [56]. В связи с этим проводить гепаринотерапию до назначения оральных антикоагулянтов нецелесообразно. В то же времени раннее применение ацетилсалициловой кислоты у пациентов с острым инсультом вызывало снижение риска смерти или повторного нефатального инсульта, в том числе у пациентов с ФП [57]. Соответственно, в первые 48 ч после развития ишемического инсульта или ТИА целесообразно на короткий срок назначать ацетилсалициловую кислоту в дозе 100-300 мг/сут, которую отменяют после возобновления антикоагулянтной терапии. В рекомендациях Европейского общества кардиологов также предлагается возобновлять антикоагулянтную терапию через 4-14 дней после развития острого ишемического инсульта [7].
Эффективность и безопасность антикоагулянтной терапии после внутричерепного кровоизлияния (эпидурального, субдурального, субарахноидального или внутримозгового) в рандомизированных клинических исследованиях не изучались. Однако результаты метаанализа 7 наблюдательных исследований (n=2452) показали, что у пациентов с ФП, перенесших внутричерепное кровоизлияние и не получавших какие-либо антитромботические средства, частота ишемического инсульта в течение от 6 недель до 1 года была выше частоты повторного кровотечения. Лечение антагонистами витамина К вызывало снижение риска ишемического инсульта (на 53% по сравнению с отсутствием антитромботической терапии) и не сопровождалось увеличением риска повторного внутричерепного кровоизлияния [58]. Результаты антикоагуляции зависят от причины внутричерепного кровоизлияния. У пациентов с травматическим кровоизлиянием возобновление антикоагулянтной терапии вызывало снижение риска ишемического инсульта и смерти и не приводило к увеличению риска повторного кровотечения [59], в то время как при внутричерепном кровоизлиянии, не связанном с травмой, антикоагуляция может привести к увеличению частоты повторных кровотечений, особенно при наличии внутримозговых микрокровоизлияний [60]. По мнению экспертов Европейского общества кардиологов, возобновление антикоагулянтной терапии после внутричерепного кровоизлияния (не ранее, чем через 4 недели) возможно у части пациентов с ФП после тщательной оценки потенциальных пользы и риска при участии различных специалистов, включая кардиолога, невролога и нейрохирурга. Для антикоагуляции предпочтительно применять ПОАК, так как они вызывают внутричерепные кровоизлияния в два раза реже, чем варфарин [7]. При решении вопроса о возобновлении антикоагулянтной терапии следует учитывать модифицируемые (артериальная гипертония, низкие уровни холестерина липопротеинов низкой плотности, употребление алкоголя, курение) и немодифицируемые (пожилой возраст, мужской пол, монголоидная раса, хроническая болезнь почек, церебральная амилоидная ангиопатия, поражение мелких сосудов головного мозга) факторы риска внутричерепного кровоизлияния. В определенных случаях альтернативой антикоагуляции может служить окклюзия ушка левого предсердия [7].
Заключение
Для максимального улучшения прогноза у пациентов с ФП и инсультом в анамнезе необходимо обеспечить профилактику не только повторного острого нарушения мозгового кровообращения, но и других осложнений, представляющих угрозу жизни и здоровью. Результаты рандомизированных контролируемых исследований свидетельствуют о том, что применение ПОАК вместо антагонистов витамина К может рассматриваться как ключевой элемент стратегии повышения эффективности и безопасности антикоагулянтной терапии у пациентов с ФП, перенесших ишемический инсульт/ ТИА. ПОАК могут быть эффективны и в профилактике других неблагоприятных исходов у пациентов с ФП, в частности лечение ривароксабаном сопровождалось снижением риска развития коронарных осложнений и ухудшения функции почек. Достижение максимально возможной клинической пользы применения ривароксабана возможно за счет высокой приверженности к терапии, связанной с удобным режимом приема (один раз в день), а также маленьким размером таблетки, удобным для глотания, что имеет практическую ценность для пациентов с перенесенным инсультом.
Используемые источники
- Пирадов М.А., Максимова М.Ю., Танашян М.М. Инсульт: пошаговая инструкция. Руководство для врачей 2-е изд., переработанное и дополненное. М.: ГЭОТАР-Медиа Москва, 2020. 288 с.
- GBD 2016 Stroke Collaborators. Global, regional, and national burden of stroke, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol 2019;18(5):439-58.
- Dai H, Zhang Q, Much AA, et al. Global, regional, and national prevalence, incidence, mortality, and risk factors for atrial fibrillation, 1990-2017: results from the Global Burden of Disease Study 2017. Eur Heart J Qual Care Clin Outcomes 2020 Jul 31:qcaa061.
- Zoni-Berisso M, Lercari F, Carazza T, Domenicucci S. Epidemiology of atrial fibrillation: European perspective. Clin Epidemiol 2014;6:213-20.
- Shkolnikova MA, Jdanov DA, Ildarova RA, et al. Atrial fibrillation among Russian men and women aged 55 years and older: prevalence, mortality, and associations with biomarkers in a population-based study. J Geriatr Cardiol 2020;17(2):74-84.
- Федеральная служба государственной статистики. Численность населения Российской Федерации по полу и возрасту на 1 января 2020 года. https://rosstat.gov.ru/compendium/document/13284.
- Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;ehaa612.
- Stroke Risk in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007; 69(6):546–54.
- Olesen JB, Lip GY, Hansen ML, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ 2011;342:d124.
- Hayden DT, Hannon N, Callaly E, et al. Rates and determinants of 5-year outcomes after atrial fibrillation-related stroke: A population dtudy. Stroke 2015; 46(12):3488-93.
- Marini C, De Santis F, Sacco S, et al. Contribution of atrial fibrillation to incidence and outcome of ischemic stroke: results from a population-based study. Stroke. 2005;36(6):1115-9.
- Lin HJ, Wolf PA, Kelly-Hayes M, et al. Stroke severity in atrial fibrillation. The Framingham Study. Stroke 1996;27(10):1760-4.
- Jorgensen HS, Nakayama H, Reith J, et al. Acute stroke with atrial fibrillation. The Copenhagen Stroke Study. Stroke 1996;27(10):1765-9.
- Gladstone DJ, Bui E, Fang J, et al. Potentially preventable strokes in high-risk patients with atrial fibrillation who are not adequately anticoagulated. Stroke 2009;40(1):235-40.
- Решетько О.В., Соколов А.В., Фурман Н.В. Анализ антитромботической терапии фибрилляции предсердий в международных и российских регистрах. Качественная клиническая практика 2019;1:83-96 [Reshetko OV, Sokolov AV, Furman NV. Analysis of antithrombotic therapy of atrial fibrillation in international and Russian registries. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice 2019;1:83-96 (In Russ.)].
- Patel MR, Mahaff EY KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883–91.
- Hankey GJ, Patel MR, Stevens SR, et al; ROCKET AF Steering Committee Investigators. Rivaroxaban compared with warfarin in patients with atrial fibrillation and previous stroke or transient ischaemic attack: a subgroup analysis of ROCKET AF. Lancet Neurol 2012;11(4):315-22.
- Ntaios G, Papavasileiou V, Diener HC, et al. Nonvitamin-K-antagonist oral anticoagulants versus warfarin in patients with atrial fibrillation and previous stroke or transient ischemic attack: an updated systematic review and meta-analysis of randomized controlled trials. Int J Stroke 2017;12:589-96.
- Фонякин А.В. от имени рабочей группы исследователей. Применение ривароксабана для вторичной профилактики инсульта в реальной клинической практике. Результаты российского проспективного многоцентрового наблюдательного исследования NEURO-XAR. Кардиология 2016;4:49–53 [Fonyakin AV on behalf of the working group of researchers. Application of rivaroxaban for secondary stroke prevention in clinical practice. Results of the Russian prospective, multicenter, observational study NEURO-XAR. Kardiologiya 2016;4:49-53 (In Russ.)].
- Coleman CI, Peacock WF, Bunz TJ, Alberts MJ. Effectiveness and safety of apixaban, dabigatran, and rivaroxaban versus warfarin in patients with nonvalvular atrial fibrillation and previous stroke or transient ischemic attack. Stroke 2017; 48(8):2142-9.
- Alberts M, Chen YW, Lin JH, et al. Risks of stroke and mortality in atrial fibrillation patients treated with rivaroxaban and warfarin. Stroke 2020;51(2):549-55.
- Gomez-Outes A, Lagunar-Ruiz J, Terleira-Fernandez A, et al. Causes of death in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2016;68:2508-21.
- Soliman E, Lopez F, O'Neal W, et al. Atrial fibrillation and risk of ST-segmentelevation versus non-ST-segment-elevation myocardial infarction: The Athero -sclerosis Risk in Communities (ARIC) Study. Circulation 2015;131:1843-50.
- Pastori D, Menichelli D, Del Sole F, et al; ATHERO-AF study group. Long-term risk of major adverse cardiac events in atrial fibrillation patients on direct oral anticoagulants. Mayo Clin Proc 2020;S0025-6196(20)30854-5.
- Coleman CI, Baker WL, Meinecke AK, et al. Effectiveness and safety of rivaroxaban vs. warfarin in patients with non-valvular atrial fibrillation and coronary or peripheral artery disease. Eur Heart J Cardiovasc Pharmacother 2020;6(3):159-66.
- Chatterjee S, Sharma A, Uchino K, et al. Rivaroxaban and risk of myocardial infarction: insights from a meta-analysis and trial sequential analysis of randomized clinical trials. Coron Artery Dis 2013;24(8):628-35.
- Loke YK, Pradhan S, Yeong JK, Kwok CS. Comparative coronary risks of apixaban, rivaroxaban and dabigatran: a meta-analysis and adjusted indirect comparison. Br J Clin Pharmacol 2014;78:707-17.
- Uchino K, Hernandez AV. Dabigatran association with higher risk of acute coronary events: meta-analysis of noninferiority randomized controlled trials. Arch Intern Med 2012;172(5):397-402.
- Чашкина М.И., Козловская Н.Л., Андреев Д.А. и др. Распространенность хронической болезни почек поздних стадий у пациентов с неклапанной фибрилляцией предсердий, госпитализированных в кардиологические отделения. Кардиология 2020;60(2):41-6 [Chashkina MI, Kozlovskaya NL, Andreev DA, et al. Prevalence of advanced chronic kidney disease in patients with nonvalvular atrial fibrillation hospitalized in cardiology departments. Kardiologiia 2020;60(2):41-6 (In Russ.)].
- Watanabe H, Watanabe T, Sasaki S, et al. Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study. Am Heart J 2009;158(4):629-36.
- Kotalczyk A, Ding WY, Wong CF, et al. Atrial fibrillation in patients with chronic kidney disease. Cardiol Clin 2021;39(3):435-46.
- Моисеев С.В. Применение прямых оральных антикоагулянтов у пациентов с фибрилляцией предсердий и ухудшающейся функцией почек. Клин фармакол тер 2020;29(2):12-20 [Moiseev S. Novel oral anticoagulants for atrial fibrillation in patients with worsening renal function. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):12-20 (In Russ.)].
- Coleman CI, Kreutz R, Sood N, et al. Rivaroxaban's impact on renal decline in patients with nonv alvular atrial fibrillation: A US MarketScan claims database analysis. Clin Appl Thromb Hemost 2019;25:1076029619868535.
- Hernandez AV, Bradley G, Khan M, et al. Rivaroxaban vs. warfarin and renal outcomes in non-valvular atrial fibrillation patients with diabetes. Eur Heart J Qual Care Clin Outcomes 2020;6(4):301-7.
- Yao X, Tangri N, Gersh BJ, et al. Renal outcomes in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol 2017;70:2621-32.
- Чашкина М.И., Андреев Д.А., Козловская Н.Л. и др. Показатели безопасности ривароксабана по сравнению с варфарином у пациентов с фибрилляцией предсердий и хронической болезнью почек поздних стадий. Кардиология 2020;60(11):94–100 [Chashkina MI, Andreev DA, Kozlovskaya NL, et al. Safety performance of rivaroxaban versus warfarin in patients with atrial fibrillation and advanced chronic kidney disease. Kardiologiia 2020;60(11):94–100 (In Russ.)].
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2019;74(1):104-32.
- Friberg L, Rosenqvist M, Lip GY. Net clinical benefit of warfarin in patients with atrial fibrillation: a report from the Swedish atrial fibrillation cohort study. Circulation 2012;125(19):2298-307.
- Schaefer JK, Errickson J, Li Y, et al. Adverse events associated with the addition of aspirin to direct oral anticoagulant therapy without a clear indication. JAMA Intern Med 2021;181(6):817-24.
- Fox KA, Piccini JP, Wojdyla D, et al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin in patients with non-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011;32(19):2387-94.
- Halperin JL, Hankey GJ, Wojdyla DM, et al. Efficacy and safety of rivaroxaban compared with warfarin among elderly patients with nonvalvular atrial fibrillation in the Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared With Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF). Circulation 2014;130(2):138-46.
- Hanon O, Vidal JS, Pisica-Donose G, et al. Bleeding risk with rivaroxaban compared with vitamin K antagonists in patients aged 80 years or older with atrial fibrillation. Heart 2020;heartjnl-2020-317923.
- Steinberg BA, Shrader P, Pieper K, et al; Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF) II Investigators. Frequency and outcomes of reduced dose non-vitamin K antagonist anticoagulants: Results from ORBIT-AF II (The Outcomes Registry for Better Informed Treatment of Atrial Fibrillation II). J Am Heart Assoc 2018;7(4):e007633.
- Shen NN, Zhang C, Hang Y, et al. Real-world prevalence of direct oral anticoagulant off-label doses in atrial fibrillation: An epidemiological meta-analysis. Front Pharmacol 2021 May 26;12:581293.
- Kwok CS, Loke YK, Hale R, et al. Atrial fibrillation and incidence of dementia: a systematic review and meta-analysis. Neurology 2011;76(10):914-22.
- Kokkinidis DG, Zareifopoulos N, Theochari CA, et al. Association between atrial fibrillation and cognitive impairment in individuals with prior stroke: A metaanalysis and meta-regression analysis. Stroke 2020;51(6):1662-6.
- Боголепова А.Н. Постинсультные когнитивные нарушения и возможности их коррекции. Мед совет 2015;5:24-27 [Bogolepova AN. Cognitive disorders after stroke and their treatment. Meditsinskiy sovet 2015;5:24-27 (In Russ.)].
- Ozaki AF, Choi AS, Le QT, et al. Real-world adherence and persistence to direct oral anticoagulants in patients with atrial fibrillation: A systematic review and meta-analysis. Circ Cardiovasc Qual Outcomes 2020;13(3):e005969.
- Туров А.Н., Панфилов С.В., Чиглинцева О.В. Эффективность, безопасность и приверженность при использовании новых антикоагулянтов у пациентов с фибрилляцией предсердий старше 75 лет. Рациональная фармакотерапия в кардиологии 2020;16(1):10-8 [Turov AN, Panfilov SV, Tschiglinzeva OV. The efficacy, safety and adherence to treatment when new anticoagulants taking in over 75 years old patients with atrial fibrillation. Rational Pharmacotherapy in Cardiology 2020;16(1):10-8 (In Russ.)].
- Gonzalez-Fernandez M, Ottenstein L, Atanelov L, Christian AB. Dysphagia after stroke: an overview. Curr Phys Med Rehabil Rep 2013;1(3):187-96.
- Verheugt FWA, Gao H, Al Mahmeed W, et al; GARFIELD-AF Investigators. Characteristics of patients with atrial fibrillation prescribed antiplatelet monotherapy compared with those on anticoagulants: insights from the GARFIELD-AF registry. Eur Heart J 2018;39:464-73.
- Benz AP, Johansson I, Dewilde WJM, et al. Antiplatelet therapy in patients with atrial fibrillation: A systematic review and metaanalysis of randomized trials. Eur Heart J Cardiovasc Pharmacother 2021 Jun 17:pvab044.
- Seiffge DJ, Werring DJ, Paciaroni M, et al. Timing of anticoagulation after recent ischaemic stroke in patients with atrial fibrillation. Lancet Neurol 2019;18:117-26.
- Hart RG, Coull BM, Hart D. Early recurrent embolism associated with nonvalvular atrial fibrillation: a retrospective study. Stroke 1983;14:688–93.
- Klijn CJ, Paciaroni M, Berge E, et al. Antithrombotic treatment for secondary prevention of stroke and other thromboembolic events in patients with stroke or transient ischemic attack and non-valvular atrial fibrillation: A European Stroke Organisation guideline. Eur Stroke J 2019;4(3):198-223.
- Paciaroni M, Agnelli G, Micheli S, et al. Efficacy and safety of anticoagulant treatment in acute cardioembolic stroke: a meta-analysis of randomized controlled trials. Stroke 2007;38:423–30.
- Chen ZM, Sandercock P, Pan HC, et al. Indications for early aspirin use in acute ischemic stroke: a combined analysis of 40 000 randomized patients from the Chinese acute stroke trial and the international stroke trial. On behalf of the CAST and IST collaborative groups. Stroke 2000;31:1240–9.
- Korompoki E, Filippidis FT, Nielsen PB, et al. Long-term antithrombotic treatment in intracranial hemorrhage survivors with atrial fibrillation. Neurology 2017;89:687-96.
- Nielsen PB, Larsen TB, Skjoth F, Lip GY. Outcomes associated with resuming. warfarin treatment after hemorrhagic stroke or traumatic intracranial hemorrhage in patients with atrial fibrillation. JAMA Intern Med 2017;177:563-570.
- Wilson D, Ambler G, Shakeshaft C, et al on behalf of the CROMIS-2 Collaborators. Cerebral microbleeds and intracranial haemorrhage risk in patients anticoagulated for atrial fibrillation after acute ischaemic stroke or transient ischaemic attack (CROMIS-2): a multi-centre observational cohort study. Lancet Neurol 2018;17:539-47.
