Сравнительный анализ эффективности препаратов экулизумаба в лечении акушерского атипичного гемолитико-уремического синдрома
Акушерский атипичный гемолитико-уремический синдром (аГУС) – ургентная патология с крайне неблагоприятным при естественном течении прогнозом. Введение в клиническую практику комплемент-блокирующего препарата экулизумаб радикально изменило прогноз пациенток с акушерским аГУС с фатального на относительно благоприятный. Длительное время в клинической практике использовался экулизумаб, разработанный компанией “Alexion” (Солирис), но в 2019 г. в России компанией АО “ГЕНЕРИУМ” был создан первый биоаналог экулизумаба (Элизария).
Ретроспективный сравнительный анализ эффективности комплемент-блокирующей терапии акушерского аГУС оригинальным экулизумабом и его биоаналогом.
В исследование было включено 50 пациенток с акушерским аГУС, которым проводилась комплемент-блокирующая терапия экулизумабом. 41 женщина получала оригинальный экулизумаб, 9 – биоаналог экулизумаба. 18 из 41 пациентки, которым исходно проводилась терапия оригинальным экулизумабом, в 2019 г. были переведены на лечение биоаналогом.
Пациентки в двух группах исходно не различались по возрасту, акушерскому анамнезу, количеству предшествующих комплемент-активирующих состояний и основным клинико-лабораторным параметрам в острый период заболевания. В результате лечения функция почек полностью восстановилась у 80,5% и 88,9% больных, получавших оригинальный экулизумаб и его биоаналог, соответственно, остались диализзависимыми 12,2% и 11,1% женщин. В обеих группах почечные исходы были лучше при раннем (в течение 2 недель от дебюта заболевания) начале терапии (отношение шансов 11,67; 95% доверительный интервал 1,73-78,43). Гематологические показатели нормализовались у всех выживших женщин. Ни у одной из 18 пациенток, которые были переведены с оригинального экулизумаба на биоаналог, не было отмечено рецидива тромботической микроангиопатии.
Полученные результаты подтвердили равную эффективность оригинального экулизумаба (Солирис) и биоаналога экулизумаба (Элизария) в лечении акушерского аГУС, как в отношении купирования острого эпизода тромботической микроангиопатии, так и в отношении профилактики рецидивов аГУС.
Атипичный гемолитико-уремический синдром (аГУС) – тяжелое, угрожающее жизни заболевание, в основе которого лежит нарушение регуляции комплемента с развитием комплемент-опосредованной тромботической микроангиопатии (ТМА) [1,2]. В качестве триггеров аГУС, как правило, выступают различные комплементактивирующие состояния, среди которых одно из ведущих мест занимают беременность и ее осложнения. аГУС нередко дебютирует во время беременности или непосредственно после родов, представляя серьезную проблему в акушерской практике. Отличительной особенностью акушерского аГУС являются крайне тяжелое (даже посравнению с аГУС в целом), нередко фульминантное течение и неблагоприятный прогноз [3,4].
Клинически аГУС проявляется классической триадой ТМА (микроангиопатическая гемолитическая анемия – МАГА, тромбоцитопения и ишемическое поражение органов), но при этом отличается особенно тяжелым прогрессирующим поражением почек с развитием у большинства больных терминальной почечной недостаточности (ТПН). Так, до начала эры патогенетической терапии в течение года от начала заболевания смерть или развитие ТПН отмечались у 67% пациентов с аГУС [5]. В случаях же акушерского аГУС, по собственным данным, за период с 2011 по 2014 г., когда диагноз аГУС устанавливался только в единичных случаях, а патогенетическая терапия не назначалась, неблагоприятный почечный исход с развитием ТПН, требующей лечения гемодиализом, или продвинутых стадий хронической болезни почек (ХБП; 4-5 стадии) наблюдался у 70% выживших пациенток [6].
В начале 2000-х годов был разработан экулизумаб, который первоначально был одобрен для лечения пароксизмальной ночной гемоглобинурии, а затем и аГУС. Экулизумаб является рекомбинантным гуманизированным моноклональным антителом (IgG2/4k), блокирующим расщепление С5 компонента комплемента, быстро и стабильно ингибирующим образование анафилотоксина С5а и мембраноатакующих комплексов. Введение в клиническую практику экулизумаба радикально изменило прогноз пациентов с аГУС (и в первую очередь, пациенток с акушерским аГУС) с фатального на относительно благоприятный. В литературе имеются многочисленные доказательства, подтверждающие эффективность экулизумаба при лечении аГУС. Так, в результате терапии этим препаратов исчезновение потребности в диализе было отмечено у 80-95% пациентов, а улучшение/восстановление функции почек – у 48-95% [2,7-15]. По данным литературы, среди па циенток с акушерским аГУС, получавших лечение экулизумабом, ремиссия заболевания с восстановлением/улучшением функции почек наблюдалась в 88% случаев [16]. В нашем исследовании полное восстановление или улучшение функции почек было достигнуто у 17 (74%) из 23 женщин с акушерским аГУС, получавших экулизумаб, развитие ТПН – у 2 (9%), смерть – у 4 (17%) [5].
На протяжении около 10 лет в клинической практике применялся только оригинальный экулизумаб (Соли рис), разработанный компанией “Alexion". Но в 2019 г. в нашей стране компанией АО “ГЕНЕРИУМ" был создан первый биоаналог экулизумаба (Элизария), предназначенный для лечения аГУС и пароксизмальной ночной гемоглобинурии и прошедший необходимые доклинические и клинические исследования для подтверждения биоаналогичности оригинальному препарату [17-19]. Эффективность и безопасность биоаналога экулизамаба продемонстрированы в лечении отдельных категорий пациентов с аГУС [20,21].
Целью нашего ретроспективного исследования было оценить сравнительную эффективность комплемент-блокирующей терапии акушерского аГУС препаратами Солирис и Элизария.
Материал и методы
В исследование включали пациенток с аГУС, ассоциированным с беременностью, которые получали лечение в перинатальных центрах Российской Федерации в период с 2013 по 2021 г. Диагноз аГУС устанавливали на основании развившейся после родоразрешения острой ТМА при исключении тромботической тромбоцитопенической пурпуры (ТТП), катастрофического антифосфолипидного синдрома (КАФС) и системной красной волчанки (СКВ). Критерием исключения ТТП считали активность ADAMTS 13 >10%. КАФС и СКВ исключали на основании отрицательных результатов определения волчаночного антикоагулянта, антител к кардиолипину и b2-гликопротеину 1, антинуклеарного фактора, антител к ДНК, а HELLP-синдром – на основании отрицательной динамики после родоразрешения. Всем пациенткам после подтверждения диагноза аГУС назначали комплемент-блокирующую терапию экулизумабом. До 2019 г. пациентки получали оригинальный экулизумаб (Солирис), с апреля 2019 г. – его биоаналог (Элизария). Дозы, метод и кратность введения Солириса и Элизарии были одинаковыми в соответствии с инструкциями по применению: 900 мг один раз в неделю в течение 4 недель, 1200 мг на 5-й неделе, а затем 1200 мг каждые 2 недели.
Эффективность лечения оценивали на основании купирования микроангиопатического гемолиза, тромбоцитопении, полиорганной недостаточности, улучшения/восстановления функции почек. Под неблагоприятным почечным прогнозом подразумевали развитие ТПН с потребностью в лечении программным гемодиализом.
Данные анализировали с помощью методов описательной статистики. Рассчитывали относительные частоты с 95% доверительным интервалом (95% ДИ), средние значения, их ошибки и 95% ДИ, стандартные отклонения измеряемых показателей, а также медианы и квартили для показателей, выборочное распределение вероятности которых существенно отклонялось от нормального. Стати стическую значимость различия средних значений между группами проверяли с помощью критерия Стьюдента или непараметрического критерия Манна-Уитни, если выборочное распределение статистически значимо отклонялось от нормального. В качестве меры эффекта фактора риска на вероятность события рассчитывали отношение шансов (ОШ) и 95% ДИ. Уровень значимости при проверке статистических гипотез, а также значимости эффекта был принят равным 0,05.
Результаты
Клиническая характеристика больных. В ретроспективное исследование были включены 50 пациенток с акушерским аГУС. Сроки установления диагноза варьировались в широких пределах – от 2 суток до 4 мес. В основном отсроченная диагностика аГУС наблюдалась в 2013-2016 гг., когда данная патология была еще недостаточно известна врачам. У 41 женщины проводилась терапия оригинальным экулизумабом (Солирис), а у 9 – его биоаналогом (Элизария). 18 больных, первоначально получавших Солирис, в 2019 г. были переведены на Элизарию, в то время как у 23 пациенток комплемент-блокирующая терапия была прекращена.
По клиническим и лабораторным показателям группы больных, получавших оригинальный экулизумаб и биоаналог, были сопоставимыми (табл. 1). На момент развития аГУС средний возраст пациенток двух групп составил 28,24±6,51 и 30,77±6,83 лет, соответственно (разница недостоверная). Только около трети пациенток в обеих группах были первородящими, в то время как у двух третей женщин беременность была повторной. При этом ни у одной женщины эпизодов ТМА в анамнезе не было.
| Показатели | Все пациентки(n=50) | Получавшие Солирис (n=41) | Получавшие Элизарию (n=9) | p |
|---|---|---|---|---|
| Возраст, лет | 28,70±6,57 | 28,24±6,51 | 30,77±6,83 | 0,188 |
| Первая беременность, n (%) | 16 (32,0) | 13 (31,7) | 3 (33,3) | 0,937 |
| Повторная беременность, n (%) | 34 (68,0) | 28 (68,3) | 6 (66,7) | 0,934 |
| Среднее число КАС | 3,56±1,34 | 3,56±1,34 | 3,55±1,42 | 0,918 |
| Поражение органов, n (%) | ||||
| Почки (ОПП) | 50 (100) | 41 (100) | 9 (100) | 0,677 |
| Лечение гемодиализом | 46 (92,0) | 37 (90,2) | 9 (100) | 0,285 |
| Печень | 38 (76,0) | 30 (73,1) | 8 (88,9) | 0,330 |
| Легкие | 38 (76,0) | 31 (75,6) | 7 (77,8) | 0,944 |
| Искусственная вентиляция легких | 24 (48,0) | 21 (51,2) | 3(33,3) | 0,343 |
| ЦНС | 28 (56,0) | 24 (58,5) | 4 (44,4) | 0,453 |
| Сердце | 14 (28,0) | 10 (24,3) | 4 (44,4) | 0,236 |
| Среднее число пораженных органов | 3,58±1,26 | 3,48±1,31 | 4,00±1,00 | 0,229 |
| Гемоглобин, г/л | 62,0 [53,5;71,5] | 60,5 [52,5;68,5] | 80,5 [67,0;87,0] | 0,008 |
| Тромбоциты, х109/л | 44,5 [23,0;57,0] | 42,5 [23,5;56,5] | 48,5 [28,0;74,0] | 0,570 |
| Гаптоглобин, г/л | 0,13 [0,04;0,40] (n=15) | 0,20 [0,06;0,40] (n=13) | 0,05 [0,03;0,07] (n=2) | 0,232 |
| Шизоциты, % | 1,0 [1,0;2,0] (n=32) | 1,0 [1,0;2,0] (n=25) | 2,0 [1,0;4,0] (n=7) | 0,371 |
| Креатинин, мкмоль/л | 521,0 [350,0;645,0] | 528,0 [342,0;640,5] | 458,0 [350,0;682,5] | 0,782 |
| ЛДГ, ед/л | 2703,5 [1409,0;4499,5] | 2251,0 [1340,5;4499,5] | 3405,0 [3007,0;4660,0] | 0,091 |
| АСТ, ед/л | 185,0 [57,0;344,0] | 185,0 [54,0;356,0] | 178,0 [127,0;289,0] | 0,640 |
| АЛТ, ед/л | 132,0 [30,0;226,0] | 136,0 [28,0;232,0] | 75,0 [40,0;155,0] | 0,691 |
| Билирубин, ммоль/л | 19,9 [10,0;44,0] | 19,4 [12,0;57,0] | 20,0 [7,8;23,0] | 0,310 |
| Глюкоза, ммоль/л | 6,0 [5,6;7,5] | 6,0 [5,6;8,0] | 6,4 [5,5;7,2] | 0,909 |
| ADMTS13, % | 54,0 [42,0;74,0] (n=30) | 53,0 [42,0;74,0] (n=26) | 69,4 [50,0;79,4] (n=4) | 0,258 |
Во всех случаях развитию аГУС предшествовали в различных комбинациях дополнительные комплементактивирующие состояния (КАС): диарея, пищевая токсикоинфекция, преэклампсия, ручное отделение плаценты, кровотечение (при операции кесарева сечения и ручном отделении плаценты), кесарево сечение, ампутация матки или сепсис. В среднем количество КАС, предшествующих развитию аГУС, было одинаковым в обеих группах (3,56±1,34 и 3,55±1,42, соответственно, в группах женщин, получавших оригинальный экулизумаб и биоаналог).
У всех пациенток в обеих группах отмечался полный симптомокомплекс ТМА: МАГА (снижение содержания гемоглобина при отсутствии продолжающегося кровотечения, значительное повышение активности ЛДГ, шизоцитоз >1% в мазке периферической крови у всех 32 пациенток, у которых определяли данный показатель), низкое содержание гаптоглобина (у 15 пациенток, у которых его исследовали), тромбоцитопения и поражение внутренних органов с развитием полиорганной недостаточности. Поражение почек наблюдалось у всех женщин и было представлено острым повреждением почек (ОПП): олигурией или анурией с быстро нарастающим повышением сывороточного уровня креатинина, потребовавшим начала лечения диализом у 46 из 50 пациенток. У 35 (85,4%) пациенток, получавших Солирис, и у всех женщин, которым проводилась терапия Элизарией, помимо почек, наблюдалось поражение других жизненно-важных органов и систем с развитием тяжелой полиорганной недостаточности. Среди внепочечных проявлений у пациенток двух групп чаще всего отмечалось поражение печени (повышение активности аминотрансфераз, прежде всего АСТ, свидетельствующее об ишемическом характере повреждения) и легких (отек легких, массивная двусторонняя инфильтрация легочной ткани, прогрессирующая дыхательная недостаточность с потребностью в вентиляционной поддержке), реже – поражение ЦНС (тяжелая энцефалопатия, угнетение сознания вплоть до комы, генерализованный судорожный синдром) и сердца (острая сердечная недостаточность с дилатацией камер сердца и снижением фракции выброса левого желудочка; минимальное значение – 22%). Среднее число пораженных органов у пациенток, получавших Солирис и Элизарию, составило 3,48 и 3,48, соответственно.
Лечение. 49 (98,0%) из 50 больных (за исключением одной пациентки, получавшей Солирис) в начале заболевания получали лечение свежезамороженной плазмой в режиме трансфузий (20/49; 40,8%) и/или плазмообмена (29/49; 59,2%), которое не оказывало существенного влияния на выраженность МАГА, тромбоцитопении и органного поражения. После постановки диагноза аГУС всем пациенткам была начата терапия экулизумабом. Продолжительность терапии варьировалась от нескольких инфузий до 5 лет.
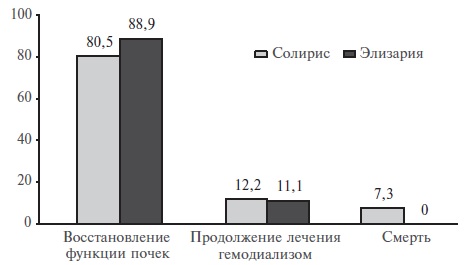
Исходы. В целом полное восстановление функции почек было отмечено у 41 (82,0%) из 50 пациенток с акушерским аГУС, в том числе у 33 (80,5%) больных, получавших оригинальный экулизумаб, и у 9 (88,9%) женщин, которым проводилась терапия биоаналогом экулизумабом (рис. 1). Остались диализзависимыми 6 (12%) из 50 женщин, в том числе 5 (12,2%) больных, получавших Солирис, и 1 (11,1%) пациентка, леченная Элизарией. Умерли 3 (7,3%) пациентки (все они получали Солирис). Гематологические показатели нормализовались у всех выживших женщин. Достоверных различий почечных исходов между двумя группами не выявили.
| Сроки начала терапии от дебюта аГУС | Препарат | n (%) | Функция почек полностью восстановилась, n (%) | ХБП 4-5 стадии, | Программный, n(%) | Смерть матери, n (%) |
|---|---|---|---|---|---|---|
| <1 недели | Солирис | 20 (48,8) | 18 (90,0) | 2 (10,0) | 0 | 0 |
| Элизария | 4 (44,5) | 3 (75,0) | 1 (25,0) | 0 | 0 | |
| 1-2 недели | Солирис | 11 (26,8) | 6 (54,5) | 2 (18,2) | 2 (18,2) | 1 (9,1) |
| Элизария | 3 (33,3) | 3 (100) | 0 | 0 | 0 | |
| ≥3 недель | Солирис | 10 (24,4) | 3 (30,0) | 2 (20,0) | 3 (30,0) | 2 (20,0) |
| Элизария | 2 (22,2) | 0 | 1 (50,0) | 1 (50,0) | 0 |
Почечные исходы в обеих группах зависели от сроков назначения патогенетической терапии (табл. 2). Позднее начало лечения экулизумабом (через 3 недели и более) сопровождалось достоверным увеличением ОШ неблагоприятного почечного исхода, т.е. развития ТПН с потребностью в лечении программным гемодиализом (11,67, 95% ДИ 1,73-78,43; р=0,01), и недостоверным увеличением ОШ смерти (7,40, 95% ДИ 0,60-90,15; р=0,11) (табл. 3).
| Начало терапии | Почечный исход | ОШ (95% ДИ) | Материнский исход | ОШ (95% ДИ) | ||
|---|---|---|---|---|---|---|
| Благоприятный | Неблагоприятный | Умерла | Жива | |||
| ≤2 недели | 35 | 2 | 11,667 (1,73; 78,43) | 1 | 37 | 7,40 (0,60; 90,15) |
| ≥3 недель | 6 | 4 | р=0,01 | 2 | 10 | p=0,11 |
У 23 из 41 пациенток, получавших исходно Солирис, препарат был отменен в связи с достигнутой клиниколабораторной ремиссией. Оставшимся 18 пациенткам терапия была продолжена, поскольку у 4 из них были выявлены патогенные мутации в генах системы комплемента, а у 14, несмотря на гематологическую ремиссию и исчезновение потребности в диализе, сохранялись признаки ХБП 3-4 стадии. В 2019 г. эти 18 пациенток были переведены на лечение биоаналогом экулизумаба. После смены препарата ни у одной из них не было рецидива ТМА.
Обсуждение
Настоящая работа представляет собой первое в России исследование, в котором сравнивали эффективность применения оригинального экулизумаба (Солирис) и его первого российского биоаналога (Элизария) у наиболее тяжелой когорты пациентов с аГУС – беременных и родильниц. Ограничением нашего исследования было небольшое количество пациенток, получавших биоаналог экулизумаба для купирования острого эпизода аГУС, что было обусловлено большей длительностью использования в нашей стране Солириса по сравнению с Элизарией (6 и 2 года, соответственно).
Группы пациенток с акушерским аГУС, получавших оригинальный экулизумаб и биоаналог экулизумаба, были сопоставимы по возрасту, акушерскому анамнезу, числу и срокам беременностей, количеству предшествующих КАС. Клинико-лабораторные проявления ТМА также не различались между двумя группами в острый период заболевания, хотя у пациенток, получавших биоаналог экулизумаба, исходно отмечались несколько более выраженный гемолиз (активность ЛДГ, количество шизоцитов и содержание гаптоглобина) и большее число пораженных органов. В обеих группах более 80% пациенток достигли полного восстановления функции почек, при этом частота благоприятного почечного исхода у пациенток, получавших Элизарию, оказалась даже недостоверно выше, чем в группе женщин, которым проводилась терапия оригинальным экулизумабом (88,9% и 80,5%, соответственно), в то время как доля женщин, оставшихся на диализе, была сопоставимой в двух группах (11,1% и 12,2%). Случаи смерти при применении Элизарии зарегистрированы не были. Полученные результаты свидетельствуют о сопоставимой эффективности Элизарии и Солириса в лечение акушерского аГУС. Практически у всех больных, независимо от общего и почечного исхода, оба препарата одинаково эффективно купировали МАГА и тромбоцитопению.
Эффективность лечения как оригинальным экулизумабом, так и его биоаналогом зависела от сроков начала терапии. Результаты комплемент-блокирующей терапии были значительно лучше, если ее начинали в первые 2 недели после дебюта заболевания. В этом случае вероятность полного восстановления функции почек была почти в 12 раз выше, чем при более позднем назначении патогенетической терапии.
Особый интерес представляют 18 пациенток, которым в 2019 г. была произведена замена оригинального экулизумаба на биоаналог. У всех 18 пациенток к этому моменту отмечались состояние гематологической ремиссии и положительная динамика показателей функции почек, которая сохранялась и после смены препарата. Ни в одном случае не было отмечено рецидива ТМА, что подтверждает взаимозаменяемость оригинального экулизумаба и его биоаналога.
Немаловажное значение имеет более низкая стоимость Элизарии (примерно на 20%) по сравнению с Солирисом, который сегодня остается одним из самых дорогих препаратов в мире [22].
Заключение
Настоящее исследование подтвердило одинаковую эффективность препаратов экулизумаба – Солириса и Элизарии в лечении акушерского аГУС, как в отношении купирования острого эпизода ТМА, так и в отношении профилактики рецидивов аГУС. Кроме того, исследование, выполненное на акушерском контингенте, дает основание экстраполировать успешные результаты лечения Элизарией на популяцию взрослых пациентов с аГУС в целом.
Используемые источники
- Fakhouri F, Zuber J, FrОmeaux-Bacchi V, Loirat C. Haemolytic uraemic syndrome. Lancet 2017;390(10095):681-96.
- Noris M, Caprioli J, Bresin E, et al. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. Clin J Am Soc Nephrol 2010;5(10):1844–59.
- Fakhouri F, Roumenina L, Provot F, et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol 2010;21:859–67.
- Козловская Н.Л., Коротчаева Ю.В., Шифман Е.М., Кудлай Д.А. Акушерский атипичный гемолитико-уремический синдром: виновата беременность или ее осложнения? Вопросы гинекологии, акушерства и перинатологии 2020;19(4):81–91. [Kozlovskaya NL, Korotchaeva YuV, Shifman EM, Kudlay DA. Pregnancy-associated atypical hemolytic-uremic syndrome: is pregnancy to blame or its complications? Voprosy ginekologii akusherstva perinatologii 2020;19(4):81–91 (In Russ.)].
- Fremeaux-Bacchi V, Fakhouri F, Garnier A, et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. Clin J Am Soc Nephrol 2013;8(4):554-62.
- Козловская Н.Л., Коротчаева Ю.В., Шифман Е.М., Боброва Л.А. Атипичный гемолитико-уремический синдром как одна из причин острого повреждения почек у беременных. Тер архив 2018;90(6):28-32 [Kozlovskaya NL, Korotchaeva YV, Shifman EM, Bobrova LA. Atypical hemolytic-uremic syndrome as one of the causes of acute kidney injury in pregnant women. Terapevticheskii arkhiv 2018;90(6):28-34 (In Russ.)].
- Kato H, Miyakawa Y, Hidaka Y, et al. Safety and effectiveness of Eculizumab for adult patients with atypical hemolytic-uremic syndrome in Japan: interim analysis of post-marketing surveillance. Clin Exp Nephrol 2018;23(1):65–75.
- Licht C, Greenbaum LA, Muus P, et al. Efficacy and safety of Eculizumab in atypical hemolytic uremic syndrome from 2-year extensions of phase 2 studies. Kidney Int 2015;87:1061–73.
- Cofiell R, Kukreja A, Bedard K, et al. Eculizumab reduces complement activation, inflammation, endothelial damage, thrombosis, and renal injury markers in aHUS. Blood 2015;125:3253–62.
- Cavero T, Rabasco C, Lopez A, et al. Eculizumab in secondary atypical hemolytic uraemic syndrome. Nephrol Dial Transplant 2017;32:466–74.
- Greenbaum LA, Fila M, Ardissino G, et al. Eculizumab is a safe and effective treatment in pediatric patients with atypical hemolytic uremic syndrome. Kidney Int 2016;89:701–11.
- Kumar G, Al-Masri O, Alismaili Z, et al. Eculizumab in pediatric atypical hemolytic uremic syndrome: lessons learned from a single center experience in the United Arab Emirates. J Paediatr Child Health 2019. doi:10.1111/jpc.14390
- Fakhouri F, Hourmant M, Campistol JM, et al. Terminal complement inhibitor eculizumab in adult patients with atypical hemolytic uremic syndrome: a singlearm, open-label trial. Am J Kidney Dis 2016;68(1):84–93.
- Merrill SA, Brittingham ZD, Yuan X, et al. Eculizumab cessation in atypical hemolytic uremic syndrome. Blood 2017;130:368–72.
- Huerta A, Arjona E, Portoles J, et al. A retrospective study of pregnancy-associated atypical hemolytic uremic syndrome. Kidney Int 2018;93:450–9.
- Gupta M, Govindappagari S, Burwick RM. Pregnancy-associated atypical hemolytic uremic syndrome: A systematic review. Obstet Gynecol 2020;135(1):46-58.
- Иванов Р., Секарёва Г., Кравцова О. и др. Правила проведения исследований биоаналоговых лекарственных средств (биоаналогов). Фармако кинетика и фармакодинамика 2014;1:21-36. [Ivanov R, Sekarnva G, Kravtsova O, et al. Guidelines of research biosimilar drugs. Pharmacokinetics and Pharmacodynamics 2014;(1):21-36. (In Russ.)].
- Kulagin A, Ptushkin V, Lukina E, et al. Phase III clinical trial of Elizaria® and Soliris® in adult patients with paroxysmal nocturnal hemoglobinuria: results of comparative analysis of efficacy, safety, and pharmacological data. Blood 2019;134 (Suppl 1):3748.
- Птушкин В.В., Кулагин А.Д., Лукина Е.А. и др. Результаты открытого многоцентрового клинического исследования Ib фазы по оценке безопасности, фармакокинетики и фармакодинамики первого биоаналога экулизумаба у нелеченных пациентов с пароксизмальной ночной гемоглобинурией в фазе индукции терапии. Терапевтический архив. 2020;92(7):77-84 [Ptushkin VV, Kulagin AD, Lukina EA, et al. Results of phase Ib open multicenter clinical trial of the safety, pharmacokinetics and pharmacodynamics of first biosimilar of eculizumab in untreated patients with paroxysmal nocturnal hemoglobinuria during induction of therapy. Terapevticheskii arkhiv 2020;92(7):77-84 (In Russ.)].
- Эмирова Х.М., Орлова О.М., Музуров А.Л. и др. Опыт применения Элизарии® при атипичном гемолитико-уремическом синдроме. Педиатрия 2019;98(5):225-9 [Emirova KhМ, Orlova OM, Мuzurov АL, et al. The experience of using Elizaria® for atypical hemolytic uremic syndrome. Pediatria 2019;98(5):225-9 (In Russ.)].
- Lavrishcheva IV, Jakovenko AA, Kudlay DA. A case report of atypical hemolyticuremic syndrome treatment with the first Russian eculizumab in adult patient. Urol Nephrol 2020;8(2):37-40.
- Zelek WM, Morgan BP. Monoclonal antibodies capable of inhibiting complement downstream of C5 in multiple species. Front Immunol 2020;11:612402.
