Эффективность и безопасность левилимаба, блокирующего рецепторы интерлейкина-6, в лечении ревматоидного артрита
Интерлейкин (ИЛ)-6 – это ключевой провоспалительный медиатор, который играет важную роль в патогенезе суставных и внесуставных проявлений ревматоидного артрита (РА). Ингибиторы ИЛ-6 применяют для лечения активного РА в комбинации с метотрексатом или другими базисными противовоспалительными препаратами (БПВП) у пациентов, не ответивших на монотерапию БПВП или комбинированную терапию БПВП и ингибиторами фактора некроза опухоли альфа или другими генно-инженерными биологическими препаратами. Левилимаб представляет собой моноклональное антитело, которое подавляет развитие воспалительного каскада за счет блокады как растворимых, так и мембранных рецепторов ИЛ-6. Эффективность и благоприятный профиль безопасности левилимаба в комбинации с метотрексатом были установлены в двух рандомизированных, двойных слепых, плацебоконтролируемых исследованиях (AURORA и SOLAR), в которые включали пациентов с РА умеренной или высокой степени активности несмотря на монотерапию метотрексатом. В обоих исследованиях преимущества левилимаба перед плацебо были подтверждены при анализе как первичных, так и ряда вторичных показателей эффективности, включавших частоту ответа по критериям Американской коллегии ревматологов, достижения низкой активности и ремиссии РА, динамику индексов активности РА и т.д. Нежелательные эффекты левилимаба были типичными для ингибиторов ИЛ-6. Результаты наблюдательных исследований свидетельствуют о том, что лечение ингибиторами ИЛ-6, в отличие от некоторых других противоревматических препаратов, прежде всего ритуксимаба и глюкокортикостероидов в средних и высоких дозах, не ухудшает течение COVID-19 и не влияет на иммуногенность вакцинации против COVID-19. Соответственно, у больных, получающих левилимаб, предполагается отсутствие необходимости откладывать вакцинацию, подбирать сроки введения вакцины или менять схему лечения препаратом.
За последние два десятилетия возмож ности лечения ревматоидного артрита(РА) значительно расширились благо даря разработке и внедрению в клиническуюпрактику генно-инженерных биологическихпрепаратов (ГИБП) и таргетных синтетиче ских базисных противовоспалительных пре паратов (БПВП), которые применяют принеэффективности стандартных БПВП. Доляпациентов с РА, получающих ГИБП, отли чается в разных странах, однако онанеуклонно увеличивается во всем мире.Первоначально препаратами выбора средиГИБП считали ингибиторы фактора некрозаопухоли альфа, что отражало больший опытизучения эффективности и безопасностидлительной терапии этими лекарственнымисредствами не только в клинических иссле дованиях, но и в обычной клиническойпрактике. Однако в последних рекоменда циях Европейской антиревматической лиги(EULAR) данное ограничение отсутствует,что позволяет врачу выбирать любой ГИБПили таргетный БПВП при необходимости вмодификации базисной противовоспали тельной терапии [1]. Хотя препаратами первой линии влечении РА остаются метотрексат, лефлуномид и/илисульфасалазин, тем не менее, более раннее назначениеГИБП обосновано при отсутствии ответа на лечение покрайней мере двумя стандартными БПВП и наличиинеблагоприятных прогностических факторов, таких каксохранение умеренной или высокой активности РА,высокие титры ревматоидного фактора и/или антител кцитруллинированным пептидам, наличие ранних эро зий [1]. Необходимость в назначении ГИБП может дик товаться и плохой переносимостью стандартных БПВПили наличием противопоказаний к их применению. Вчастности, отмечается тенденция к увеличению долипациентов, которые по тем или иным причинам полу чают монотерапию ГИБП, хотя такой подход к лечениюРА не рекомендуется в современных руководствах [1].
Одним из ключевых медиаторов воспаления является интерлейкин (ИЛ)-6, который играет важную роль в патогенезе не только поражения суставов, но и внесуставных проявлений РА [2,3]. В настоящее время для лечения РА зарегистрированы несколько ингибиторов ИЛ-6, в том числе тоцилизумаб, сарилумаб и олокизумаб. Первые два представляют собой моноклональные антитела к рецептору ИЛ-6, в то время как последний взаимодействует непосредственно с самим цитокином. Левилимаб (Илсира) – это новый оригинальный ингибитор рецепторов ИЛ-6, разработанный российской компанией ЗАО “БИОКАД". Препарат является моноклональным антителом, которое подавляет развитие воспалительного каскада за счет блокады как растворимых, так и мембранных рецепторов ИЛ-6 и препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, избыточной продукции других провоспалительных цитокинов и острофазовых белков [4]. В Российской Федерации левилимаб одобрен не только для лечения РА, но и патогенетической терапии COVID-19 [5].
Роль ИЛ-6 в патогенезе ревматоидного артрита
РА – это хроническое воспалительное заболевание, характеризующееся опуханием, болезненностью и деструкцией синовиальных суставов. У 20-40% пациентов с РА наблюдаются различные внесуставные проявления, в том числе ревматоидные узелки, васкулит, невропатия, плеврит, синдром Шегрена, поражение органа зрения, почек и легких [6]. Кроме того, РА ассоциируется с ускоренным развитием атеросклероза, тромбоэмболическими осложнениями, анемией, депрессией и другими психоневрологическими расстройствами, которые в зарубежной литературе обычно относят к системным проявлениям РА, хотя они не являются специфичными для этого заболевания и связаны с хроническим персистирующим воспалением [7]. К этой группе внесуставных проявлений можно отнести и АА-амилоидоз, развитие которого также связано со стойким воспалением, так как АА-амилоид образуется из сывороточного предшественника SAA (serum amyloid A) – острофазового белка, продуцируемого в значительных количествах при воспалительных процессах. У больных РА развитие АА-амилоидоза ассоциировалось с большей длительностью заболевания (>15 лет) и недостаточным контролем воспаления, характеризовавшимся стойким повышением уровня С-реактивного белка (СРБ) >15 мг/л [8]. От системных проявлений РА необходимо отличать побочные эффекты медикаментозной терапии, например, интерстициальное поражение легких, вызванное метотрексатом, или нефропатию, которая развивается при применении нефротоксичных препаратов, таких как D-пеницилламин, циклоспорин или препараты золота. Следует отметить, что исключение последних из современных схем базисной терапии РА привело к значительному снижению доли лекарственной нефропатии в структуре поражения почек при РА, хотя многолетний прием нестероидных противовоспалительных препаратов может быть причиной развития интерстициального нефрита.
ИЛ-6 – это плеотропный провоспалительный цитокин, который взаимодействует со специфическими рецепторами, экспрессирующимися на мембранах различных клеток, и циркулирующими растворимыми рецепторами и вызывает воспалительный каскад за счет активации различных сигнальных систем, в частности янус-киназ [9]. ИЛ-6 не только способствует развитию воспаления и деструкции суставов, но и играет важную роль в патогенезе различных внесуставных проявлений РА [10]. Например, повышенные уровни ИЛ-6 ассоциируются с развитием депрессии и утомляемости, часто наблюдающихся у пациентов с РА. ИЛ-6 вызывает увеличение продукции в печени острофазовых белков, которые ускоряют атерогенез и повышают риск развития сердечно-сосудистых исходов [11]. В крупном исследовании выявлена четкая связь между содержанием С-реактивного белка и риском сердечно-сосудистых осложнений, которая подтверждает центральную роль воспаления в развитии и прогрессирования атеротромбоза [12]. Кроме того, как указано выше, один из белков острой фазы – SAA – является сывороточным предшественником АА-амилоида, поэтому длительное сохранение высокой воспалительной активности РА сопровождается увеличением риска развития АА-амилоидоза. ИЛ-6 может также вносить вклад в патогенез анемии при РА за счет нарушения образования гепцидина, который ингибирует всасывание железа в тонкой кишке и его высвобождение из макрофагов. ИЛ-6 усиливает транскрипцию гена, кодирующего гепцидин, в клетках печени [13]. Повышение экспрессии ИЛ-6 сопровождается образованием RANKL и активацией остеокластов, что приводит к усилению разрушения костной ткани и развитию остеопороза. Снижение минеральной плотности костной ткани при РА и других аутоиммунных заболеваниях преимущественно связано с длительной терапией глюкокортикостероидами, хотя у пациентов с РА риск переломов увеличивается независимо от применения препаратов этой группы [14]. Стойкое повышение содержания ИЛ-6 вызывает нарушение гомеостаза глюкозы и инсулинорезистентность в печени и жировой ткани [15]. Эти изменения могут привести к развитию сахарного диабета 2 типа, частота которого у больных РА значительно выше, чем в общей популяции [16].
Приведенные данные свидетельствуют о том, что применение ингибиторов ИЛ-6 у пациентов с РА может не только подавить активность воспаления и предупредить прогрессирование структурных изменений суставов, но и оказать благоприятное влияние на внесуставные проявления заболевания.
Клинические исследования левилимаба у пациентов с РА
Эффективность и безопасность левилимаба у пациентов с РА изучались в клиническом исследовании 2 фазы AURORA и исследовании 3 фазы SOLAR.
AURORA. Целью рандомизированного, двойного слепого, плацебо-контролируемого исследования AURORA было изучение эффективности и безопасности двух режимов дозирования левилимаба (162 мг подкожно один раз в одну или две недели) по сравнению с плацебо [17]. В исследование включали пациентов с активным РА, получавших метотрексат в стабильной дозе. При этом протокол исследования допускал применение других стандартных БПВП, глюкокортикостероидов, ГИБП (за исключением ингибиторов ИЛ-6/рецепторов ИЛ-6, а также ингибиторов янускиназ) в анамнезе. Первичным показателем эффективности была доля пациентов, ответивших на лечение через 12 недель по критериям Американской коллегии ревматологов (АКР20). Кроме того, анализировали различные вторичные показатели эффективности, в том числе частоту ответа по критериям АКР50 и АКР70, частоту достижения низкой активности или ремиссии РА, изменения индексов активности и индекса HAQDI, динамику рентгенологических признаков прогрессирования деструкции суставов, а также безопасность, фармакокинетику, фармакодинамику и иммуногенность левилимаба. После оценки первичного показателя эффективности через 12 недель пациенты групп левилимаба продолжали прием препарата в ранее назначенных дозах, в то время как пациентов группы плацебо переводили на введение лемилимаба в дозе 162 мг каждые 2 недели. Длительность исследования составляла 52 недели.
В многоцентровое исследование, проводившееся в Российской Федерации и Республике Беларусь, были включены 144 пациента, 105 из которых (82,9% женщин, медиана возраста около 50 лет) были рандомизированы на три равные группы и начали лечение левилимабом в двух дозах или плацебо. Группы сравнения были сопоставимы по клиническим и демографическим показателям. У большинства пациентов (82,9-97,4%) были выявлены антитела к цитруллинированным пептидам. Несмотря на лечение метотрексатом (медиана дозы 15 мг/нед) медиана DAS28-СРБ во всех трех группах превышала 6,0. Каждый пятый пациент в прошлом получал ингибиторы фактора некроза опухоли-альфа, преимущественно инфликсимаб.
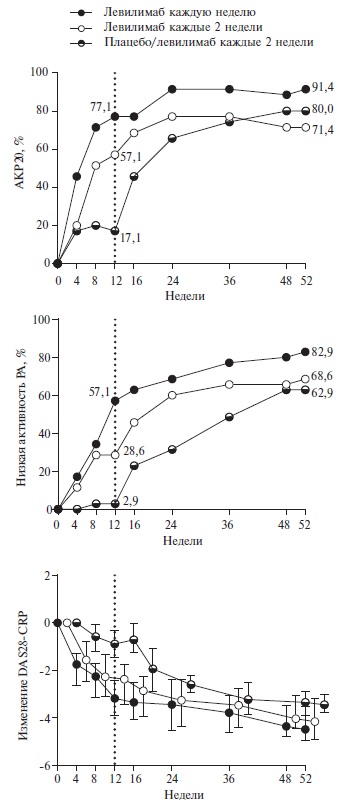
По частоте ответа по критериям АКР20 через 12 недель, который был первичной конечной точкой исследования, левилимаб в дозах 162 мг каждую неделю или каждые две недели (77,1% и 57,1%, соответственно) достоверно превосходил плацебо (17,1%) (рис. 1). Сходные результаты были получены при анализе частоты более выраженного ответа на лечение. Так, через 12 недель ответа по критериям АКР50 достигли 51,4% и 31,4% больных, получавших левилимаб каждую неделю или один раз в две недели, соответственно, а ответа по критериям АКР50 – 28,6% и 20,0% пациентов, в то время как в группе плацебо доля таких пациентов составляла всего 5,7% и 2,9%, соответственно. Частота достижения низкой активности РА при лечении левилимабом также достоверно превышала таковую при приеме плацебо (рис. 1). Эффективность левилимаба в обеих дозах подтверждалась более значительным снижением счета DAS28-СРБ и других индексов активности РА, в частности CDAI, который не предполагает оценку уровня СРБ, значительно снижающегося при введении ингибиторов рецепторов ИЛ-6.
При продолжении терапии левилимабом было отмечено постепенное нарастание ответа на лечение. Через 52 недели частота ответа по критериям АКР20 в группах левилимаба в дозах 162 мг каждую неделю или каждые две недели увеличилась до 91,4% и 80,0%, соответственно, АКР50 – до 74,3% и 65,7%, АКР70 – до 65,7% и 48,6%. Существенно возросла и частота достижения низкой активности РА (82,9% и 68,6% в двух группах, соответственно). Если через 12 недель доля больных, достигших ремиссии РА, была небольшой, то к концу исследования ремиссия определялась более чем у четверти пациентов, получавших левилимаб (28,6%). Как указано выше, после оценки первичного показателя эффективности через 12 недель всех больных группы плацебо переводили на подкожные инъекции левилимаба каждые 2 недели. Это привело к быстрому улучшению показателей эффективности терапии, которые к концу 52-недельного исследования соответствовали таковым в двух других группах (рис. 1). Приведенные выше данные свидетельствуют о том, что введение ингибитора ИЛ-6 каждую неделю по эффективности имело преимущества перед его применением каждые две недели. Однако исследование не обладало статистической мощностью, достаточной для сравнения двух режимов введения левилимаба между собой, а выявленные различия между ними в большинстве случаев не достигли статистической значимости.
Сывороточная концентрация левилимаба перед следующим введением (Ctrough) препарата при еженедельном применении была выше, чем при применении препарата каждые 2 недели. В качестве маркеров фармакодинамики левилимаба анализировали сывороточные концентрации СРБ, ИЛ-6 и его рецепторов. Левилимаб в обеих группах пациентов вызывал значительное снижение уровня СРБ, причем минимальные его значения достигались быстрее при введении препарата каждую неделю. Повышение концентраций рецепторов ИЛ-6 и ИЛ-6 было отмечено только при применении левилимаба, а различия максимальной концентрации рецепторов ИЛ-6 между двумя группами достигли статистической значимости (p=0,01). Антител к левилимабу во время исследования выявлено не было.
Переносимость левилимаба была хорошей, а профиль нежелательных реакций соответствовал таковому других ингибиторов ИЛ-6. Чаще всего регистрировали отклонения лабораторных показателей, включая нейтропению, повышение активности печеночных аминотрансфераз (в 1,5-2 раза по сравнению с исходной) и содержания липидов. Следует отметить, что случаев лекарственного повреждения печени, характеризовавшегося одновременным повышением активности АЛТ или АСТ по крайней мере в 3 раза по сравнению с верхней границей нормы и содержания общего билирубина по крайней мере в 2 раза по сравнению с верхней границей нормы, зарегистрировано не было. Повышение концентрации общего холестерина по сравнению с исходным уровнем наблюдалось примерно у 15–20% пациентов. Только у 6 из 105 пациентов, включенных в исследование, лечение было прекращено досрочно изза нежелательных явлений. Через 12 недель после начала терапии в обеих группах левилимаба было отмечено увеличение средней концентрации гемоглобина на 8,710,1 г/л, в то время как при введении плацебо концентрация его снизилась на 2,2 г/л. Приведенные данные подтверждают, что применение левилимаба может уменьшить анемию хронических заболеваний, которая часто встречается при длительном течении РА.
SOLAR. В международное многоцентровое, сравнительное, рандомизированное, двойное слепое, плацебоконтролируемое клиническое исследование 3 фазы SOLAR, проводившееся в 19 российских центрах и 2 центрах в Республике Беларусь, включали пациентов с активным РА несмотря на монотерапию метотрексатом в стабильной дозе 15-25 мг/нед в течение по крайней мере 4 недель. Применение глюкокортикостероидов в дозе более 10 мг/сут в пересчете на преднизолон и ГИБП не допускалось в течение предыдущих 8 недель. Терапия ингибиторами ИЛ-6, рецепторов ИЛ-6 или янус-киназ в анамнезе была критерием невключения. После 4-6-недельного периода скрининга пациенты получали левилимаб в дозе 162 мг/нед или плацебо в сочетании с метотрексатом в течение 24 недель. После завершения двойного слепого периода пациентов группы плацебо переводили на еженедельные инъекции активного препарата. При этом всех пациентов продолжали наблюдать еще в течение 32 недель. Если через 12 недель не удавалось добиться уменьшения счета болезненных/припухших суставов по крайней мере на 20%, то допускалось применение глюкокортикостероидов, БПВП или нестероидных противовоспалительных препаратов, однако в этом случае пациентов считали не ответившими на исследуемую терапию.
Эффективность терапии оценивали на основании двух первичных показателей, в том числе (1) доли пациентов, достигших ответа по критериям АКР20 через 12 недель, и (2) доли пациентов с низкой активностью РА (DAS28-СРБ <3,2) через 24 недели. Кроме того, оценивали различные вторичные показатели эффективности, такие как долю пациентов с удовлетворительным и хорошим ответом по критериям EULAR, частоту достижения низкой активности и ремиссии РА, изменения индексов активности РА (DAS28, CDAI, SDAI) и лабораторных показателей воспаления и динамику рентгенологических признаков деструкции суставов по методу Шарпа в модификации van der Heijde (mTSS).
К настоящему времени опубликованы результаты двойной слепой части исследования SOLAR [18]. На этапе скрининга были обследованы 246 пациентов с активным РА, 154 из которых были рандомизированы (2:1) на группы левилимаба (n=102) или плацебо (n=52). Две группы были сопоставимы по демографическим и исходным клиническим показателям. Большинство больных составили женщины, а средний возраст – около 50 лет. У всех пациентов определялась умеренная или высокая активность РА несмотря на лечение метотрексатом (средняя доза около 16 мг/нед). 148 больных завершили основной период исследования. Из-за нежелательных явлений выбыли только 2 (2,0%) пациентов из группы левилимаба и 1 (1,9%) больной из группы плацебо. В связи с неэффективностью терапии через 12 недель назначение дополнительных препаратов потребовалось 9 (8,8%) больным группы левилимаба и 9 (17,3%) пациентам группы плацебо.
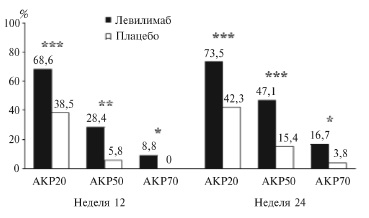
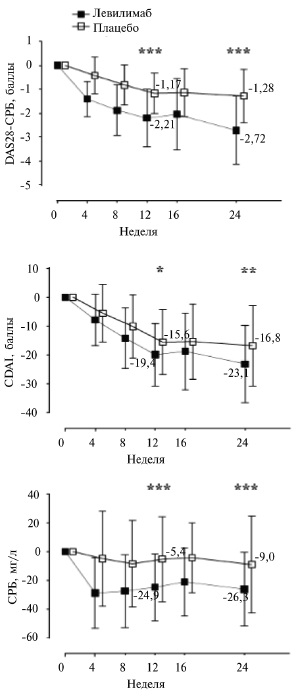
По обоим первичным показателям эффективности левилимаб достоверно превосходил плацебо. Через 12 недель частота ответа по критериям АКР20 составила 68,6% и 38,5% в группах левилимаба и плацебо, соответственно (p=0,0003; рис. 2), а через 24 недели частота достижения низкой активности РА – 60,8% и 3,8% (p<0,0001). При анализе частоты более выраженного ответа по критериям АКР (АКР50 и АКР70) левилимаб также имел статистически значимое преимущество перед плацебо как через 12, так и 24 недели после начала лечения (рис. 2). Подтверждением эффективности ингибитора ИЛ-6 послужила и более выраженная положительная динамика индексов активности РА, в частности DAS28-СРБ и CDAI, а также СОЭ и концентрации СРБ (рис. 3). Частота достижения низкой активности и ремиссии РА в обеих группах отличапациента, получавших активный препарат, были вынуждены прекратить лечение из-за гиперемии в месте его введения. В то же время частота инфекций в основной группе была даже ниже, чем в контрольной (6,9% и 11,5%, соответственно). Более выраженные нежелательные явления (3-4-й степени) чаще встречались при лечении левилимабом, однако они были в основном представлены отклонениями лабораторных показателей, такими как повышение активности аминотрансфераз, содержания холестерина/триглицеридов и общего билирубина. Случаев тяжелой лейкопении/ нейтропении не зарегистрировали.
В целом результаты исследований 2 и 3 фаз подтвер дили эффективность и благоприятный профиль без опасности левилимаба в лечении РА у пациентов, неответивших на монотерапию метотрексатом. Инги биторы ИЛ-6 не сравнивали друг с другом в рандомизи рованных клинических исследованиях, а сопоставлениерезультатов разных исследований некорректно из-заразличий выборок пациентов. Тем не менее, в регистра ционных исследованиях разница частоты ответа налечение другими ингибиторами рецепторов ИЛ-6 иплацебо соответствовала таковой в исследованиях леви лимаба. Например, в исследовании SARIL-RA-MOBILITYчастота ответа по критериям АКР20 приприменении сарилумаба в зарегистрированной дозе 200мг каждые 2 недели в сочетании с метотрексатом через12 недель у пациентов с РА, не ответивших на моноте рапию последним, составила 65%, а в группе плацебо –46% [19]. Как указано выше, в исследовании SOLAR вте же сроки ответ по критериям АКР20 был достигнут у68,6% и 38,5% больных группы левилимаба и плацебо,соответственно. Похожие результаты были получены ив исследовании BREVACTA, в котором сравнивалитоцилизумаб в дозе 162 мг подкожно каждые 2 недели иплацебо у пациентов с РА, не ответивших на БПВП[20]. Частота ответа по критериям АКР20 через 24 неде ли в двух группах составила 60,9% и 31,5%, соответ ственно (р<0,0001).
| Критерии оценки | Левилимаб | Плацебо | p |
|---|---|---|---|
| Низкая активность РА | |||
| DAS28-СРБ<3,2 | 52,0 | 5,8 | <0,0001 |
| DAS28-СОЭ<3,2 | 60,8 | 3,8 | <0,0001 |
| CDAI≤10 | 35,3 | 5,8 | 0,0001 |
| SDAI≤11 | 44,1 | 7,7 | <0,0001 |
| Ремиссия РА | |||
| DAS28-СРБ<2,6 | 22,5 | 1,9 | 0,0008 |
| DAS28-СОЭ<2,6 | 42,2 | 0 | <0,0001 |
| CDAI≤2,8 | 6,9 | 0 | 0,0960 |
| SDAI≤3,3 | 9,8 | 0 | 0,0167 |
| ACR/EULAR (2011) | 6,9 | 0 | 0,0960 |
Приведенные данные свидетельствуют о том, чтолевилимаб по эффективности в лечении РА не уступаетдругим моноклональным антителам, блокирующимрецепторы ИЛ-6, хотя подтвердить эту гипотезу можнотолько в рандомизированных контролируемых исследо ваниях.
Лечение ингибиторами ИЛ-6 во время пандемии COVID-19
Ингибиторы ИЛ-6 в настоящее время широко приме няют для лечения больных со средне-тяжелым и тяже лым течением COVID-19 [5]. В Российской Федерациилевилимаб одобрен для патогенетической терапии этогозаболевания на основании результатов рандомизиро ванного (1:1), двойного слепого, плацебо-контролируе мого исследования CORONA, в которое быливключены 206 пациентов с COVID-19 ассоциированнойпневмонией, у которых имелся по крайней мере одинпоказатель тяжести заболевания, такой как тахипноэ,снижение SpO2 ≤93%, увеличение распространенностипоражения легких более чем на 50% в течение 24-48 ч идр. [21]. Пациентам основной группы в дополнение кстандартной терапии вводили подкожно левилимаб вдозе 324 мг (две инъекции по 162 мг одновременно), вто время как больные контрольной группы получалиплацебо и стандартное лечение. В обеих группахдопускалось дополнительное введение левилимаба вдозе 324 мг открытым методом в случае ухудшениясостояния пациентов. На 14-й день доля пациентов,состояние которых стабильно улучшилось без дополни тельных инъекций левилимаба открытым методом (пер вичный показатель эффективности), в группелевилимаба достоверно превосходила таковую в группеплацебо (63,1% и 42,7%, соответственно; р=0,0017), авыявленные различия между двумя группами сохраня лись на 21-й и 28-й дни наблюдения. Эффективностьлевилимаба у пациентов с COVID-19 подтверждаласьтакже снижением потребности в дополнительном вве дении исследуемого препарата открытым методом(12,6% и 40,8% в основной и контрольной группах,соответственно), увеличением доли пациентов, не нуж давшихся в оксигенотерапии на 5-й день после включе ния в исследование (41,8% и 26,2%), и доливыписанных пациентов на 30-й день (84,5% и 55,3%) иснижением частоты перевода пациентов в отделениереанимации и интенсивной терапии (2,9% и 9,7%).Кроме того, лечение ингибитором рецепторов ИЛ-6вызывало более быстрое улучшение лабораторных при знаков воспаления. Летальность достоверно не отлича лась между группами левилимаба и плацебо, однако онабыла низкой в обеих группах.
С одной стороны, сегодня не вызывает сомнения,что глюкокортикостероиды и ингибиторы ИЛ-6 улуч шают исходы у части пациентов с COVID-19. С другойстороны, терапия любыми иммуносупрессивными пре паратами у больных с аутоиммунными заболеваниями,включая РА, может, наоборот, способствовать развитиюи более тяжелому течению новой коронавируснойинфекции за счет подавления противовирусногоиммунного ответа. Анализ течения COVID-19 у 600пациентов с различными ревматическими заболевания ми, включенных в регистр COVID-19 GlobalRheumatology Alliance, показал, что исходное примене ние глюкокортикостероидов в дозе ≥10 мг/сут повыша ет вероятность госпитализации в случае развитиявирусной инфекции, в то время как у пациентов, полу чавших ингибиторы фактора некроза опухоли альфаона снижалась [22]. J. Sparks и соавт. изучили влияниетерапии различными ГИБП и таргетными БПВП натечение COVID-19 у 2869 пациентов с РА (средний воз раст 56,7 лет, 80,8% женщин), которые были включеныв тот же регистр с марта 2020 г. по апрель 2021 г. [23].237 из них до заражения новым коронавирусом получа ли абатацепт, 364 – ритуксимаб, 317 – ингибиторырецепторов ИЛ-6, 563 – ингибиторы янус-киназ и 1388– ингибиторы ФНО-альфа. Тяжесть течения COVID-19оценивали по следующей шкале: (1) госпитализация непотребовалась; (2) госпитализация, но оксигенотерапияне проводилась; (3) госпитализация и необходимость воксигенотерапии или искусственной вентиляции лег ких; (4) смерть. Легкое течение COVID-19, не потребо вавшее госпитализации, в целом было отмечено у 78,6%из 2869 больных РА (табл. 2). Доля таких пациентовбыла выше среди больных, получавших ингибиторыИЛ-6 (85,5%) и ингибиторы ФНО-альфа (85,4%), иниже при лечении ритуксимабом (57,7%).Подтверждением неблагоприятного влияния ритукси маба на течение COVID-19 были также самые высокиечастота респираторной поддержки в случае госпитали зации и летальность. Те же показатели оказались самы ми низкими в группах пациентов, получавшихингибиторы ИЛ-6 или ФНО-альфа. По влиянию напоказатели тяжести течения COVID-19 абатацепт иингибиторы янус-киназ занимали промежуточное поло жение между ритуксимабом и ингибиторами ИЛ-6 илиФНО-альфа. По данным многофакторного анализа,вероятность тяжелого течения COVID-19 при леченииритуксимабом и ингибиторами янус-киназ была в 4,15(95% доверительный интервал 3,40-4,80) и 2,06 (1,60 2,65) раза выше, соответственно, чем при леченииингибиторами ФНО-альфа. Таким образом, в проведен ном исследовании исходная терапия ритуксимабом илиингибиторами янус-киназ, в отличие от ингибиторовИЛ-6 или абатацепта, способствовала более тяжеломутечению COVID-19 по сравнению с ингибиторамиФНО-альфа. Полученные данные свидетельствуют отом, что во время пандемии COVID-19 нет необходимо сти как-то ограничивать применение ингибиторов ИЛ 6 для лечения РА.
| Исходы | Все (n=2869) | Абатацепт (n=237) | Ритуксимаб (n=364) | Ингибиторы ИЛ-6 (n=317) | Ингибиторы JAK (n=563) | Ингибиторы ФНО (n=1388 |
|---|---|---|---|---|---|---|
| Госпитализация не потребовалась | 2256 (78,6) | 181 (76,4) | 210 (57,7) | 271 (85,5) | 409 (72,6) | 1185 (85,4) |
| Госпитализация, без оксигенотерапии | 137 (4,8) | 12 (5,1) | 20 (5,5) | 13 (4,1) | 28 (5,0) | 64 (4,6) |
| Госпитализация, необходимость в респираторной поддержке | 319 (11,1) | 26 (11,0) | 80 (22,0) | 24 (7,6) | 86 (15,3) | 1043 (7,4) |
| Смерть | 157 (5,5) | 18 (7,6) | 54 (14,8) | 9 (2,8) | 40 (7,1) | 36 (2,6) |
Еще одной важной проблемой является возможноевлияние иммуносупрессивной терапии на эффектив ность вакцинации против COVID-19, которую считаютнеобходимой пациентам с ревматическими заболева ниями [24]. V. Furer и соавт. в многоцентровом иссле довании оценили иммуногенность и безопасностьдвухдозовой мРНК-вакцины BNT162b2 у 686 пациентовс РА и другими аутоиммунными воспалительными рев матическими заболеваниями [25]. 95,2% больных,включенных в это исследование, получали различныеиммуносупрессивные препараты. Иммуногенность вак цины оценивали на основании титров нейтрализующихIgG антител к S-антигену SARS-CoV-2 через 2-6 недельпосле введения второй дозы. Иммунный ответ на вак цину был достигнут у всех больных, получавших инги биторы ИЛ-6 как в виде монотерапии, так и вкомбинации с метотрексатом, в то время как частотасеропозитивности при применении глюкокортикосте роидов составила 66%, а при лечении ритуксимабом –всего 41%. По данным многофакторного анализа, фак торы риска пониженной иммуногенности вакцинывключали в себя пожилой возраст и применение глюко кортикостероидов, ритуксимаба, микофенолата мофе тила и абатацепта. В рекомендациях Американскойколлегии ревматологов по вакцинации пациентов с рев матическими заболеваниями указано, что у больных,получающих ингибиторы рецепторов ИЛ-6, не следуетоткладывать вакцинацию, подбирать сроки введениявакцины или менять схему лечения препаратами этойгруппы [26].
Заключение
Левилимаб – это оригинальный отечественный ингиби тор ИЛ-6, который представляет собой моноклональноеантитело, блокирующее рецепторы цитокина.Эффективность и благоприятный профиль безопасно сти левилимаба в сочетании с метотрексатом были уста новлены в двух рандомизированных, двойных слепых,плацебо-контролирующих исследованиях у пациентов сактивным РА, не ответивших на монотерапию мето трексатом. В этих исследованиях левилимаб статистиче ски значимо превосходил плацебо по первичным иразличным вторичным показателям эффективности.
Используемые источники
- Smolen JS, Landew ОRBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological diseasemodifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020;79:685–99.
- Srirangan S, Choy CH. The role of interleukin 6 in the pathophysiology of rheumatoid arthritis. Ther Adv Musculoskel Dis 2010;2(5):247–56.
- Dayer JM, Choy E. Therapeutic targets in rheumatoid arthritis: the interleukin-6 receptor. Rheumatology (Oxford) 2010;49:15–24.
- Насонов Е.Л., Мазуров В.И., Усачева Ю.В. и др. Разработки отечественных оригинальных генно-инженерных биологических препаратов для лечения иммуновоспалительных ревматических заболеваний. Научно-практическая ревматология 2017;55(2):201-10 [Nasonov EL, Mazurov VI, Usacheva YuV, et al. Developments of Russian original biological agents for the treatment of immunoinflammatory rheumatic diseases. Nauchno-Practicheskaya Revmatologia = Rheumatology Science and Practice 2017;55(2):201-10 (In Russ.)].
- Новиков П.И., Бровко М.Ю., Шоломова В.И. и др. Левилимаб в лечении COVID-19. Клин фармакол тер 2021;30(3):67-75 [Novikov P, Brovko M, Sholomova V, et al. Levilimab, a monoclonal antibody to IL-6 receptors, in COVID-19. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(3):67-75 (In Russ.)].
- Моисеев С.В., Новиков П.И., Чеботарева Н.В. и др. Внесуставные (системные) проявления ревматоидного артрита. Клин фармакол тер 2020;29(1):53-60 [Moiseev SV, Novikov PI, Chebotareva NV, et al. Extraarticular (systemic) manifestations of rheumatoid arthritis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(1):53-60 (In Russ.)].
- Moreland LW, Curtis JR. Systemic nonarticular manifestations of rheumatoid arthritis: focus on inflammatory mechanisms. Semin Arthritis Rheum 2009;39:132-43.
- Саркисова И.А., Рамеев В.В., Козловская Л.В. Факторы риска развития и прогрессирования АА-амилоидоза у больных ревматоидным артритом. Нефрология и диализ 2007;9(3):346 [Sarkisova IA, Rameev VV, Kozlovskaya LV. Risk factors for development and progression of AA-amyloidosis in patients with rheumatoid arthritis. Nefrologiya i dializ 2007;9(3):346 (In Russ.)].
- Heinrich PC, Behrmann I, Haan S, et al. Principles of interleukin (IL)-6-type cytokine signalling and its regulation. Biochem J 2003;374:1–20.
- Favalli EG. Understanding the role of interleukin-6 (IL-6) in the joint and beyond: A comprehensive review of IL-6 inhibition for the management of rheumatoid arthritis. Rheumatol Ther 2020;7:473–516.
- Удачкина Е.В., Новикова Д.С., Попкова Т.В., Насонов Е.Л. Роль интерлейкина 6 в развитии атеросклероза при ревматоидном артрите. Современная ревматология 2013;3:25–32 [Udachkina EV, Novikova DS, Popkova TV, Nasonov EL. Role of interleukin-6 in the development of atherosclerosis in rheumatoid arthritis. Modern Rheumatology 2013;3:25–32 (In Russ.)].
- Ridker PM. C-reactive protein: eighty years from discovery to emergence as a major risk marker for cardiovascular disease. Clin Chem 2009;55:209–15.
- Lee P, Peng H, Gelbart T, et al. The IL-6- and lipopolysaccharide-induced transcription of hepcidin in HFE-, transferrin receptor 2-, and beta 2-microglobulindeficient hepatocytes. Proc Natl Acad Sci USA 2004;101:9263–5.
- van Staa TP, Geusens P, Bijlsma JW, et al. Clinical assessment of the long-term risk of fracture in patients with rheumatoid arthritis. Arthritis Rheum 2006;54:3104–12.
- Bastard J-P, Maachi M, van Nhieu JT, et al. Adipose tissue IL-6 content correlates with resistance to insulin activation of glucose uptake both in vivo and in vitro. J Clin Endocrinol Metab 2002;87:2084–9.
- Albrecht K, Luque Ramos A, Hoffmann F, et al. High prevalence of diabetes in patients with rheumatoid arthritis: results from a questionnaire survey linked to claims data. Rheumatology (Oxford). 2018;57:329–36.
- Мазуров В.И., Зоткин Е.Г., Гайдукова И.З. и др. Эффективность и безопасность применения левилимаба в комбинации с метотрексатом у пациентов с ревматоидным артритом: результаты II фазы исследования AURORA. Научно-практическая ревматология 2021;59(2):141–51 [Mazurov VI, Zotkin EG, Gaydukova IZ, et al. Efficacy and safety of levilimab in combination with methotrexate in subjects with rheumatoid arthritis: Results of phase II AURORA study. Nauchno-Practicheskaya Revmatologia = Rheumatology Science and Practice 2021;59(2):141–51 (In Russ.)].
- Мазуров В.И., Королев М.А., Пристром А.М. и др. Эффективность и безопасность левилимаба в сочетании с метотрексатом при лечении пациентов с активным ревматоидным артритом, устойчивым к монотерапии метотрексатом (двойное слепое рандомизированное плацебо-контролируемое исследование III фазы, SOLAR). Современная ревматология 2021;15(4):13–23 [Mazurov VI, Korolev MA, Prystrom AM, et al. Effectiveness and safety of levilimab in combination with methotrexate in treatment of patients with active rheumatoid arthritis resistant to methotrexate monotherapy (double-blinded randomized placebo controlled phase III clinical study SOLAR). Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2021;15(4):13–23 (In Russ.)].
- Huizinga TW, Fleischmann RM, Jasson M, et al. Sarilumab, a fully human monoclonal antibody against IL-6R in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results from the randomised SARIL-RA-MOBILITY Part A trial. Ann Rheum Dis 2014;73(9):1626-34.
- Kivitz A, Olech E, Borofsky M, et a. Subcutaneous tocilizumab versus placebo in combination with disease-modifying antirheumatic drugs in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2014;66(11):1653-61.
- Lomakin NV, Bakirov BA, Protsenko DN, et al. The efficacy and safety of levilimab in severely ill COVID-19 patients not requiring mechanical ventilation: results of a multicenter randomized double-blind placebo-controlled phase III CORONA clinical study. Inflamm Res 2021; Sep 29:1–14. Epub ahead of print.
- Gianfrancesco M, Hyrich KL, Al-Adely S, et al. Characteristics associated with hospitalisation for COVID-19 in people with rheumatic disease: data from the COVID-19 global rheumatology alliance physician-reported registry. Ann Rheum Dis 2020;79:859–66.
- Sparks JA, Wallace ZS, Seet AM, et al; COVID-19 Global Rheumatology Alliance. Associations of baseline use of biologic or targeted synthetic DMARDs with COVID-19 severity in rheumatoid arthritis: Results from the COVID-19 Global Rheumatology Alliance physician registry. Ann Rheum Dis 2021;80(9):1137-46.
- Насонов Е.Л., Лила А.М., Мазуров В.И. и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания. Рекомендации Общероссийской общественной организации “Ассоциация ревматологов России”. Научно-практическая ревматология 2021;59(3):239-54 [Nasonov EL, Lila AM, Mazurov VI, et al. Coronavirus Disease 2019 (COVID-19) and Immune-mediated Rheumatic Diseases. Recommendations of the Association of Rheumatologists of Russia. Rheumatology Science and Practice 2021;59(3):239-54 (In Russ.)].
- Furer V, Eviatar T, Zisman D, et al. Immunogenicity and safety of the BNT162b2 mRNA COVID-19 vaccine in adult patients with autoimmune inflammatory rheumatic diseases and in the general population: a multicentre study. Ann Rheum Dis 2021;80(10):1330-8.
- Сurtis JR, Johnson SR, Anthony DD, et al. American College of Rheumatology Guidance for COVID-19 vaccination in patients with rheumatic and musculoskeletal diseases: Version 2. Arthritis Rheumatol. 2021 Jun 15. doi: 10.1002/art.41877.
