Элиминация вируса гепатита С у пациентов в листе ожидания трансплантации печени
Изучить динамику показателей функции печени, портальной гипертензии и клинические исходы после элиминации вируса гепатита С (HCV) в результате лечения препаратами прямого противовирусного действия у пациентов с циррозом печени (ЦП), ожидающих ортотопическую трансплантацию печени (ОТП).
У 45 больных декомпенсированным ЦП, ожидающих ОТП, оценивали параметры функции печени, портальной гипертензии, индексы Child-Turcotte-Pugh (CTP) и модели терминальной стадии заболевания печени (MELD), а также осложнения каждые 1-3 месяца после противовирусной терапии. Пациентов исключали из листа ожидания (делистинг) в случае достижения компенсации ЦП и индекса MELD <15 баллов. Медиана наблюдения составила 24 (12; 27) мес.
К концу наблюдения индекс MELD снизился с 16 до 13 баллов (р<0,001), индекс CTP – с 8 до 7 баллов (р<0,001). 26 (57,8%) пациентов были исключены из листа ожидания. Независимыми факторами, ассоциировавшимися с отсутствием делистинга, были мужской пол (отношение рисков [ОР] 3,28; р=0,022), ЦП класса С до лечения (ОР 4,81; р=0,003) и разница протромбинового индекса <2% между исходным значением и на момент устойчивого вирусологического ответа (ОР 3,82; р=0,091). Развитие гепатоцеллюлярной карциномы (ГЦК) наблюдали у 2 (7,7%) и 6 (31,6%) пациентов, исключенных из листа ожидания и оставшихся в нем, соответственно. Во второй группе варикозное кровотечение было отмечено в 3 (15,8%) случаях, спонтанный бактериальный перитонит – в 2 (10,5%).
Элиминация HCV у пациентов с декомпенсированным ЦП, ожидающих ОТП, приводит к улучшению параметров функции печени, портальной гипертензии и исключению из листа ожидания более половины из них. После делистинга риск ГЦК снижается, но не устраняется полностью, что требует пожизненного динамического наблюдения.
Согласно оценкам Всемирной организации здравоохранения общее число инфицированных вирусом гепатита С (HCV) в мире составляет 130-170 млн человек (2-3% мировой популяции), из них 71 млн страдают хронической формой инфекции [1]. Распространенность хронического гепатита С (ХГС) в России остается неизвестной, однако общее число пациентов может достигать 4,9 млн человек [2]. ХГС является одной из ведущих причин развития цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и "печеночной" смертности [3]. По данным экспертов, в России около 42000 человек ежегодно умирают от декомпенсации ЦП и ГЦК, что составляет 2,2% от общей смертности. 43% случаев декомпенсированного ЦП и 16,5% случаев ГЦК ассоциированы с HCV-инфекцией [2,4]. В течение многих лет ортотопическая трансплантация печени (ОТП) была единственным радикальным методом лечения у пациентов с терминальной стадией заболевания печени. Однако рецидив HCV после ОТП (частота до 100% при наличии виремии перед ОТП) приводил к быстрому развитию гепатита в трансплантате, прогрессирующего до ЦП у 10-20% пациентов в течение 5 лет [5,6]. Успешная противовирусная терапия (ПВТ) у этих пациентов способствует уменьшению клинических проявлений заболевания, предотвращению рецидива HCV-инфекции и улучшению выживаемости после трансплантации [7-9].
К настоящему времени доказаны эффективность и безопасность препаратов прямого противовирусного действия в лечении ХГС, в том числе у больных с декомпенсированным ЦП, находящихся в листе ожидания ОТП [10-12]. По обобщенным данным литературы, частота устойчивого вирусологического ответа у данной группы пациентов превышает 80% [10,13]. Первые результаты применения препаратов прямого противовирусного действия демонстрируют значительное улучшение функции печени, включая снижение индексов Child-Turcotte-Pugh (CTP) и модели терминальной стадии заболевания печени (MELD), что привело к исключению из листа ожидания части пациентов [14,15]. В то же время влияние элиминации вируса на отдаленный прогноз заболевания у пациентов, исключенных из листа ожидания или по-прежнему нуждающихся в ОТП, остается предметом активного изучения. Целью исследования было изучение динамики параметров функции печени, портальной гипертензии и клинических исходов (исключение из листа ожидания, ГЦК, опасные для жизни осложнения) после элиминации HCV в результате лечения препаратами прямого противовирусного действия у пациентов, ожидающих ОТП.
Материал и методы
В проспективное когортное исследование включали пациентов с декомпенсированным ЦП, вызванным HCV, которые ожидали ОТП и достигли устойчивого вирусологического ответа после лечения препаратами прямого противовирусного действия в период с 2015 по 2019 г. Пациенты были включены в лист ожидания при наличии декомпенсированного ЦП (класс B/C по CTP) в сочетании с индексом MELD ≥15 баллов или тяжелыми осложнениями портальной гипертензии (рефрактерный асцит, хроническая печеночная энцефалопатия, рецидивирующее кровотечение из варикозно расширенных вен пищевода – ВРВП). Критериями исключения из исследования были возраст младше 18 лет, острая печеночная недостаточность, ГЦК, другие показания к ОТП (аутоиммунные и холестатические болезни печени, HBV-инфекция, сочетанная дельта-инфекция), злокачественные новообразования, ОТП в анамнезе.
Каждый пациент проходил повторное обследование во время и после лечения с оценкой параметров функции печени, портальной гипертензии, включая оценку MELD и CTP. Пациентов исключали из листа ожидания (делистинг) при наличии: (1) снижения индексов MELD <15 баллов и CTP <7 баллов после достижения устойчивого вирусологического ответа и/или последующего наблюдения; (2) стойкого клинического улучшения при значении MELD <15 баллов и CTP = 7 баллов во время последнего визита.
После делистинга у пациентов определяли следующие клинические исходы: выживаемость, развитие ГЦК, декомпенсация ЦП и повторное включение в лист ожидания. У пациентов, которые оставались в листе ожиданция, дополнительно определяли следующие исходы: ОТП, исключение из листа ожидания вследствие клинического ухудшения, прогрессирующей ГЦК и т.д.
Статистическая обработка данных выполнена с помощью программ IBM SPSS Statistics 21.0 (IBM Corporation, США) и GraphPad Prism 8 (GraphPad Software, США). Нормальность распределения количественных переменных проверяли с помощью критерия Колмогорова–Смирнова. В связи с ненормальным распределением для анализа данных использовали непараметрические методы статистики. Количественные переменные представлены в виде медианы и межквартильного интервала, качественные признаки – в виде абсолютного числа и процента. Изучение динамики показателей проведено с помощью критерия знаков. Сравнительный анализ двух независимых групп проводился при помощи U-критерия Манна-Уитни для количественных переменных, X2 критерия – для качественных переменных. Сравнение в двух зависимых группах проводилось с помощью критерия Уилкоксона. Одномерный и многомерный регрессионный анализ Кокса использовался для выявления факторов, связанных с отсутствием делистинга. Для преобразования количественных переменных в номинальные признаки (0 – нет признака, 1 – есть признак) использовали стандартные пороговые значения (лабораторные параметры) или медианы количественного ряда (возраст, индекс массы тела, площадь селезенки, индекс MELD). Однофакторный анализ проводился методом пошагового включения параметров, многофакторный анализ выполнен на основании результатов однофакторного анализа. Результат представлен в виде отношения рисков (ОР) и 95% доверительного интервала (ДИ). Достоверным считали уровень значимости р<0,05.
Результаты
В проспективное когортное исследование были включены 45 пациентов с декомпенсированным ЦП, вызванным HCV (табл. 1). У всех пациентов был достигнут устойчивый вирусологический ответ на лечение асунапревиром и даклатасвиром (11,1%), софосбувиром и велпатасвиром (11,1%), софосбувиром и даклатасвиром (66,7%), омбитасвиром/паритапревиром/ритонавиром + дасабувиром (2,2%), софосбувиром и ледипасвиром (6,7%), софосбувиром и рибавирином (2,2%). Критерием устойчивого вирусологического ответа было отсутствие РНК вируса в сыворотке крови через 12 недель после завершения ПВТ. Медиана наблюдения составила 24 (12; 27) мес после окончания ПВТ.
Динамика показателей функции печени и портальной гипертензии во всей выборке. На момент устойчивого вирусологического ответа средняя активность АЛТ уменьшилась с 64 до 32 Ед/л (р<0,001), АСТ – с 78 до 35 Ед/л (р<0,001), уровень общего билирубина – с 35 до 31 мкмоль/л (р=0,003), в то время как среднее содержание альбумина увеличилось с 31 до 33 г/л (р<0,001), а протромбиновый индекс – с 58 до 62% (р=0,001). После достижения устойчивого вирусологического ответа наблюдалось дальнейшее увеличение содержания альбумина (с 33 до 37 г/л, р<0,001) и протромбинового индекса (с 62 до 68%, р=0,001). Активность сывороточных аминорансфераз и уровень общего билирубина оставались стабильными. Количество тромбоцитов достоверно не изменилось за период исследования (с 70×109/л до 75×109/л, р=0,271).
К концу наблюдения значения АЛТ, АСТ, альбумина, общего билирубина и протромбинового индекса нормализовались в 67,7% (21/31), 42,8% (18/42), 56,4% (22/39), 32,5% (13/40) и 41,5% (17/41) случаев, соответственно. У 18 (52,9%) пациентов отмечено купирование асцита, а у 12 (60,0%) наблюдался регресс печеночной энцефалопатии.
Динамика индексов MELD и CTP во всей выборке. К концу наблюдения индекс MELD снизился с 16 до 13 баллов (р<0,001), индекс CTP – с 8 до 7 баллов (р<0,001). У 36 (80,0%) пациентов наблюдалось улучшение индекса MELD, медиана улучшения составила 3 (1; 4) балла, у 5 (11,1%) пациентов он не изменился, у 4 (8,9%) – ухудшился.
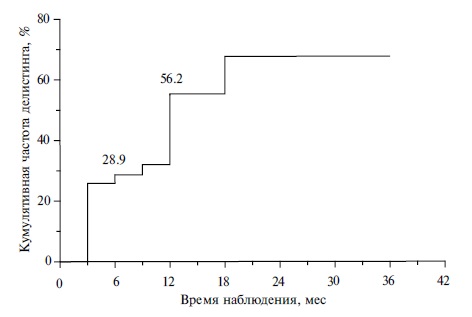
У 26 (57,8%) пациентов наблюдалось улучшение клинико-лабораторных показателей, достаточное для исключения из листа ожидания. Двенадцать из них были исключены на момент устойчивого вирусологического ответа, остальные 14 пациентов – в ходе последующего наблюдения. Время наблюдения от окончания ПВТ до делистинга составило 6 (3; 12) мес, после делистинга – 21 (12; 25) мес. Кумулятивная частота делистинга через 6 и 12 месяцев составила 28,8% и 56,2%, соответственно (рис. 1).
Индекс MELD в группе пациентов, исключенных из листа ожидания, снизился с 15 до 13 баллов (р<0,001) баллов и с 13 до 12 (р<0,001) баллов на момент устойчивого вирусологического ответа и последнего визита, соответственно. Делистинг наблюдался только у пациентов с исходным MELD≤18 баллов. Аналогично, индекс CTP улучшался в течение всего периода наблюдения (с 8 до 6 баллов, р<0,001). У 21 (80,8%) пациента отмечена компенсация ЦП (переход в класс А по CTP), индекс MELD составил менее 15 баллов.
К концу наблюдения 19 (42,2%) пациентов остались в листе ожидания. Медиана наблюдения составила 18 (6-24) мес. после окончания лечения. В этой группе индекс MELD снизился с 17 до 16 баллов (р=0,007) на момент устойчивого вирусологического ответа и не изменился в ходе дальнейшего наблюдения (р=0,702). В целом, у 14 (73,7%) пациентов индекс MELD улучшился на 1 балл, у 2 (10,5%) не изменился, у 3 (15,8%) ухудшился. Индекс CTP достоверно не изменился за весь период наблюдения (с 9 до 8 баллов, р=0,112).
| Все, n=45 | Исключены из листа ожидания (n=26) | Остались в листе ожидания (n=19) | p | |
|---|---|---|---|---|
| Примечание: данные представлены как мeдиана (25-й и 75-й процентили), если не указано иное, р – достоверность различий показателей между двумя группами. ИМТ – индекс массы тела | ||||
| Мужчины, n (%) | 27 (60) | 27 (60) | 15 (78,9) | 0,027 |
| Возраст на момент начала ПВТ, лет | 52 (47; 59) | 55 (47; 63) | 50 (47; 56) | 0,140 |
| ИМТ, кг/м2 | 27 (26; 31) | 28 (25; 32) | 27 (26; 28) | 0,548 |
| Сахарный диабет, n (%) | 9 (20,0) | 6 (23,1) | 3 (15,8) | 0,546 |
| Злоупотребление алкоголем в анамнезе, n (%) | 11 (24,4) | 4 (15,4) | 7 (36,8) | 0,098 |
| Генотип HCV, n (%): | 0,019 | |||
| 1 | 30 (66,7) | 21 (80,8) | 9 (47,4) | |
| 3 | 15 (33,3) | 5 (19,2) | 10 (52,6) | |
| Класс ЦП, n (%): | 0,015 | |||
| B | 36 (80,0) | 24 (92,3) | 12 (63,2) | |
| C | 9 (20,0) | 2 (7,7) | 7 (36,8) | |
| Балл CTP | 8 (7; 9) | 8 (7; 9) | 9 (8; 10) | 0,002 |
| Индекс MELD | 16 (14; 18) | 15 (14; 16) | 17 (15; 19) | 0,001 |
| Индекс MELD, n (%) | 0,102 | |||
| <16 | 20 (44,5) | 15 (57,7) | 5 (26,3) | |
| 16-20 | 24 (53,3) | 11 (42,3) | 13 (68,4) | |
| >20 | 1 (2,2) | 0 | 1 (5,3) | |
Сравнительная характеристика пациентов двух групп. Доля мужчин (78,9% против 46,1%, р=0,029) и инфицированных 3 генотипом HCV (52,6% против 19,2%, р=0,019) была выше среди пациентов, оставшихся в листе ожидания (табл. 1). Кроме того, у этих пациентов были выше CTP (9 против 8 баллов, р=0,002), MELD (17 против 15 баллов, р=0,001) и содержание общего билирубина (39 против 30 мкмоль/л, р=0,027) до лечения и отмечалось менее выраженное улучшение протромбинового индекса (+1,0% против +4,7%, р=0,002) на момент устойчивого вирусологического ответа по сравнению с таковыми у пациентов, исключенных из листа ожидания (табл. 2).
| Показатель | Исключены из листа ожидания (n=26) | Остались в листе ожидания (n=19) | p | ||
|---|---|---|---|---|---|
| До лечения1 | УВО2 | До лечения3 | УВО4 | ||
| Примечание: данные представлены как мeдиана (25-й и 75-й процентили), если не указано иное, р – достоверность различий соответствующих показателей. *минимальное количество жидкости в брюшной полости, определяется только при ультразвуковом исследовании брюшной полости; **минимальная печеночная энцефалопатия согласно критериям West-Haven | |||||
| АСТ, ед/л | 70 (57; 111) | 32 (27; 41) | 79 (61; 143) | 35 (31; 60) | 1-2<0,001; 3-4<0,001; 1-3=0,323; 2-4=0,060 |
| АЛТ, ед/л | 66 (48; 101) | 28 (21; 37) | 64 (38; 89) | 39 (26; 52) | 1-2<0,001; 3-4=0,004; 1-3=0,795; 2-4=0,815 |
| Тромбоциты, 109/л | 75 (55; 110) | 110 (77; 150) | 68 (48; 78) | 62 (51; 79) | 1-2<0,001; 3-4=0,817; 1-3=0,160; 2-4<0,001 |
| Альбумин, г/л | 33 (30; 34) | 35 (33; 38) | 30 (27; 32) | 31 (28; 35) | 1-2=0,001; 3-4=0,008; 1-3=0,079; 2-4=0,004 |
| Общий билирубин, мкмоль/л | 30 (25; 44) | 21 (19; 33) | 39 (34; 51) | 35 (34; 48) | 1-2=0,008; 3-4=0,346; 1-3=0,033; 2-4=0,116 |
| Протромбиновый индекс, % | 59 (52; 63) | 65 (58; 70) | 55 (51; 68) | 59 (53; 64) | 1-2=0,001; 3-4=0,549; 1-3=0,919; 2-4=0,082 |
| Альфа-фетопротеин, МЕ/мл | 6,0 (4,7; 28,1) | 3,4 (2,6; 4,7) | 4,8 (3,6; 7,2) | 5,3 (3,9; 10,7) | 1-2<0,001; 3-4=0,037; 1-3=0,091; 2-4=0,650 |
| Асцит, n (%) | 18 (69,2) | 3 (11,5)* | 16 (84,2) | 13 (68,4) | 1-2<0,001; 3-4=0,058; 1-3=0,065; 2-4<0,001 |
| ВРВП 2/3 степени, n (%) | 16 (61,5) | 15 (57,7) | 14 (73,7) | 14 (73,7) | 1-2=1,000; 3-4=1,000; 1-3=0,393; 2-4=0,055 |
| Печеночная энцефалопатия, n (%) | 12 (46,5) | 2 (7,7)** | 8 (42,1) | 2 (13,3) | 1-2=0,008; 3-4=0,021; 1-3=0,787; 2-4=0,071 |
Факторы, ассоциированные с отсутствием делистинга. По данным многофакторного регрессионного анализа, независимыми факторами, ассоциированными с отсутствием делистинга, были мужской пол (ОР 3,28, 95% ДИ 1,01–10,63, р=0,022), ЦП класса С по CTP до лечения (ОР 4,81, 95% ДИ 1,71–13,5, р=0,003) и увеличение протромбинового индекса менее чем на 2% на момент устойчивого вирусологического ответа по сравнению с исходным значением (ОР 3,82: 95% ДИ 1,38-10,56, р=0,01).
Развитие неблагоприятных исходов после элиминации HCV. В ходе исследования ГЦК развилась у 8 (17,8%) пациентов, в том числе у 6 из 19 (31,6%) пациентов, оставшихся в листе ожидания и 2 из 26 (7,7%) пациентов, исключенных из него. В целом, 1- и 3-летняя кумулятивная заболеваемость ГЦК составила 12,2% и 22,5%, соответственно. Кумулятивная частота ГЦК была достоверно выше у пациентов, оставшихся в листе ожидания (ОР 6,87, 95% ДИ 1,53-30,99, р=0,004) (рис. 2). Среди пациентов, оставшихся в листе ожидания, медиана времени от окончания лечения до постановки диагноза ГЦК составила 12 (6; 24) мес. У 5 пациентов распространенность опухолевого процесса соответствовала Миланским критериям (наличие одного узла до 5 см в диаметре или двух-трех узлов в сумме до 6,5 см, отсутствие признаков сосудистой инвазии и отдаленных метастазов). У одного пациента обнаружена быстро прогрессирующая ГЦК. Среди 2 пациентов, исключенных из листа ожидания, ГЦК была диагностирована через 12 и 24 мес после окончания терапии и соответствовала Миланским критериям. Пациенты были повторно включены в лист ожидания.

Опасные для жизни осложнения, не связанные с ГЦК, развились у 5 из 19 пациентов, оставшихся в листе ожидания, в том числе кровотечение из ВРВП у 3 (15,8%) больных и спонтанный бактериальный перитонит у 2 (10,5%). Все опасные для жизни осложнения произошли в течение первых 6 мес после окончания ПВТ. У пациентов, исключенных из листа ожидания, опасные для жизни осложнения не зарегистрированы.
На момент проведения анализа 1 пациент с прогрессирующей ГЦК, оставшийся в листе ожидания, умер. ОТП выполнена 10 пациентам, из них 4 – с ГЦК. Восемь пациентов, оставшихся в листе ожидания, и 2 пациента, повторно включенных в него, ожидают ОТП.
Обсуждение
В настоящей работе представлены результаты проспективного наблюдения за пациентами с декомпенсированным ЦП, ожидающих ОТП, после достижения устойчивого вирусологического ответа в результате лечения препаратами прямого противовирусного действия. Мы показали достоверное снижение индексов MELD (с 16 до 13 баллов, р<0,001) и CTP (с 8 до 7 баллов, р<0,001), а также компенсацию ЦП у 46,7% пациентов в течение 24 месяцев после окончания терапии. Наши данные сопоставимы с рядом зарубежных исследований, в которых наряду с улучшением показателей MELD и CTP установлена компенсация ЦП у 40-62% пациентов в течение 6-12 месяцев после окончания ПВТ [12,16,17]. Полученные результаты внесли существенные изменения в сценарий ОТП. E. Saez-Gonzalez и соавт. [18] и J.A. Flemming и соавт. [19] выявили снижение частоты включения пациентов с декомпенсированным ЦП, вызванным HCV, в лист ожидания после начала применения препаратов прямого противовирусного действия на 21% и 32%, соответственно, по сравнению с периодом, когда использовались интерферон-содержащие схемы лечения. Более того, у пациентов, которые уже были включены в лист ожидания, устойчивый вирусологический ответ ассоциировался со значительным улучшением параметров функции печени и портальной гипертензии, достаточным для делистинга. В нашем исследовании 57,8% пациентов были исключены из листа ожидания в течение 6 мес после окончания ПВТ. Другие исследования продемонстрировали более низкую частоту делистинга пациентов с декомпенсированным ЦП после лечения препаратами прямого противовирусного действия: A. Coilly и соавт. – 16% в течение 68 недель наблюдения [20], J.M. Pascasio и соавт. – 24% в течение 50 недель наблюдения [21], J. Perricone и соавт. – 30,9% в течение 14,8 мес от начала лечения [22]. Выявленные различия, вероятно, связаны с меньшей тяжестью ЦП в нашей когорте. Среди наших пациентов медиана индекса MELD составила 16 баллов, индекса CTP – 8 баллов, при этом высокое значение MELD (более 20 баллов) наблюдалось у 2,2% пациентов. В исследовании J.M. Pascasio и соавт., включавшем 16% пациентов без устойчивого вирусологического ответа, медиана индекса CTP составила 9 баллов, а увеличение индекса MELD ≥20 баллов наблюдалось в 5,7% случаев [21]. В работе J. Perricone и соавт. медиана индекса MELD равнялась 16 баллам, индекса CTP – 10 баллам, а значение индекса MELD >20 баллов было отмечено у 10,6% пациентов [22].
Мужской пол, исходный ЦП класса C по CTP и увеличение протромбинового индекса <2% на момент устойчивого вирусологического ответа по сравнению с исходным значением оказались независимыми факторами риска отсутствия делистинга в нашем исследовании. В других работах факторами риска отсутствия делистинга были также исходный показатель MELD и меньшее его снижение после ПВТ [14,21]. В нашем исследовании индекс MELD не ассоциировался с делистингом, вероятно, из-за меньшей доли пациентов с высоким значением данного показателя. Однако мы не наблюдали значительного улучшения функции печени у пациентов с показателем MELD >18 баллов, достаточного для исключения из листа ожидания. Этот результат соответствует предложенному алгоритму ПВТ у пациентов с декомпенсированным ЦП, ожидающих ОТП. Согласно данному алгоритму, пациентам с декомпенсированным ЦП и показателем MELD <18-20 баллов рекомендовано проведение ПВТ до выполнения ОТП, учитывая большую вероятность значительного клинического улучшения после элиминации HCV и последующего исключения из листа ожидания [22,23]. Данные рекомендации одобрены Европейской ассоциацией по изучению печени в 2020 году [24].
В настоящее время широко изучается влияние устойчивого вирусологического ответа на отдаленные исходы у пациентов с декомпенсированным ЦП. В нашем исследования у 2 (7,7%) пациентов развилась ГЦК через 21 (12; 25) месяц после делистинга. Ежегодная кумулятивная частота ГЦК составила 2,8%. J.M. Pas casio и соавт. выявили ГЦК в 10,3% случаев в течение 88 недель после исключения из листа ожидания [21]. В другом исследовании сообщалось о 2 (4,5%) случаях ГЦК в течение 22,1 месяца после делистинга [22]. В итальянском многоцентровом проспективном исследовании ежегодная кумулятивная частота ГЦК составила 2,8% у пациентов с декомпенсированным ЦП после успешной ПВТ, что в 2,5 раза выше по сравнению с пациентами с компенсированным ЦП (ОР 2,5; 95% ДИ 1,4-4,8, р=0,004) [26].
В России, несмотря на ежегодный рост количества операций по пересадке печени и открытие новых центров, доступность этого вида высокотехнологичной медицинской помощи остается низкой. Так, в 2019 году показатель обеспеченности населения трансплантацией печени составил 4,0 на 1 млн населения, тогда как, например в Испании и США он достигает 26,7 и 25,1, соответственно [27-29].
В нашем исследовании 19 пациентов по-прежнему нуждались в ОТП после элиминации HCV. В ходе наблюдения (медиана 18 мес после окончания лечения) у 6 (31,6%) из них отмечено развитие ГЦК. Ежегодная кумулятивная частота составила 12,9%. Аналогичные результаты были получены у пациентов с декомпенсированным ЦП, не достигших устойчивого вирусологичекого ответа после лечения препаратами прямого противовирусного действия. По данным V. Calvaruso и соавт., среди 25 пациентов с ЦП класса B по CTP кумулятивная частота ГЦК составила 12,4% в течение 1 года после окончания безуспешного лечения [30]. В работе L.I. Backus и соавт. у пациентов с ЦП, не достигших устойчивого вирусологического ответа, частота ГЦК составила 11,5 на 100 пациенто-лет и на 83,5% превышала таковую при наличии устойчивого вирусологического ответа (1,9 на 100 пациенто-лет, р<0,001) [31].
В нашем исследовании смертность пациентов была низкой. Один (2,2%) пациент, оставшийся в листе ожидания после элиминации HCV, умер от быстропрогрессирующей ГЦК. Полученные результаты в целом соответствуют данным зарубежных исследований, в которых показатель смертности пациентов, оставшихся в листе ожидания, составил 5,9% и 6,3% в течение 35 и 42 мес после окончания лечения препаратами прямого противовирусного действия, соответственно [21,22].
A. Kwong и соавт. на основании изучения базы данных OPTN (Organ Procurement and Transplantation Network – Сеть по закупкам и трансплантации органов) США выявили снижение смертности среди пациентов, находящихся в листе ожидания, на 21% с момента внедрения препаратов прямого противовирусного действия (ОР 0,79; 95% ДИ 0,67-0,93, р<0,05) [32]. В другом крупном когортном исследовании отмечено, что устойчивый вирусологический ответ ассоциируется со снижением ежегодной смертности на 79% у пациентов с прогрессирующим заболеванием печени (2,6% и 12,3% у пациентов, ответивших и не ответивших на лечение, соответственно, р<0,001) [31].
Ограничениями нашей работы являются небольшой размер выборки, а также относительно невысокие значения MELD, что затрудняет экстраполяцию полученных результатов на пациентов с более высоким показателем. Возможность системной ошибки, которая связана со смещением выборки пациентов в нашей клинике, не позволяет экстраполировать данные на российскую популяцию в целом. Требуется дальнейшее изучение влияния устойчивого вирусологического ответа на прогноз пациентов с ЦП, находящихся в листе ожидания, в рамках более крупных долгосрочных исследований.
Заключение
Элиминация HCV у пациентов с декомпенсированным ЦП, ожидающих ОТП, приводит к улучшению параметров функции печени, портальной гипертензии и исключению из листа ожидания более половины из них. Мужской пол, ЦП класса С по CTP до лечения и увеличение протромбинового индекса <2% на момент устойчивого вирусологического ответа по сравнению с исходным значением являются независимыми факторами риска отсутствия делистинга. Определение факторов риска может помочь выявить пациентов с более высокими шансами на исключение из листа ожидания, что позволит снизить потребность в ОТП и сохранить органы для нуждающихся пациентов. После делистинга риск ГЦК снижается, но не устраняется полностью, что требует пожизненного динамического наблюдения.
Используемые источники
- Global hepatitis report. 2017:1-83.
- Пименов Н.Н., Комарова С.В., Карандашова И.В. и др. Гепатит С и его исходы в России: анализ заболеваемости распространенности и смертности до начала программы элиминации инфекции. Инфекционные болезни 2018;16(3):37–45.
- Perz JF, Armstrong GL, Farrington LA, Hutin YJF et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006;45(4):529–38.
- Оксенойт Г.К., Никитина С.Ю., Агеева Л.И. Здравоохранение в России. 2017: Статистический сборник. Москва: Росстат, 2017:21.
- Yilmaz N, Shiffman ML, Stravitz RT, et al. A prospective evaluation of fibrosis progression in patients with recurrent hepatitis C virus following liver transplantation. Liver Transpl 2007;13:975–83.
- Sheiner P, Rochon C. Recurrent hepatitis C after liver transplantation. Mt Sinai J Med 2012;79(2):190–8.
- Curry MP, Forns X, Chung RT, et al. Sofosbuvir and ribavirin prevent recurrence of HCV infection after liver transplantation: an open-label study. Gastroenterology 2015;148(1):100–7.
- Yoshida EM, Kwo P, Agarwal K, et al. Persistence of virologic response after liver transplant in hepatitis C patients treated with ledipasvir/sofosbuvir plus ribavirin pretransplant. Ann Hepatol 2017;16(3):375–81.
- Fortune BE, Martinez-Camacho A, Kreidler S, et al. Post-transplant survival is improved for hepatitis C recipients who are RNA negative at time of liver transplantation. Transplant Intern 2015;28(8):980–9.
- Curry MP, O’Leary JG, Bzowej N, et al. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015;373:2618–28.
- Foster GR, Irving WL, Cheung MC et al. Impact of direct acting antiviral therapy in patients with chronic hepatitis C and decompensated cirrhosis. J Hepatol 2016;64:1224–31.
- Gentile I, Scotto R, Coppola C, et al. Treatment with direct-acting antivirals improves the clinical outcome in patients with HCV-related decompensated cirrhosis: results from an Italian real-life cohort (Liver Network Activity - LINA cohort). Hepatol Int 2019;13(1):66-74.
- Charlton M, Everson GT, Flamm SL, et al. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. Gastroenterology 2015;149:649–59.
- Belli LS, Berenguer M, Cortesi PA, et al. Delisting of liver transplant candidates with chronic hepatitis C after viral eradication: A European study. J Hepatol 2016;65:524-31.
- Al-Judaibi B, Thomas B, et al. Sofosbuvir-based therapy in the pre-liver transplant setting: The Canadian National Experience. Ann Hepatol 2018;17:437-43.
- Kozbial K, Moser S., Al-Zoairy R, et al. Follow-up of sustained virologic responders with hepatitis C and advanced liver disease after interferon/ribavirin-free treatment. Liver Int 2018;38(6):1028-35.
- Sabry A, Abdelsameea E, Tharwa E, et al. Impact of new direct-acting antiviral drugs on hepatitis C virus-related decompensated liver cirrhosis. Eur J Gastro enterol Hepatol 2019;31(1):53–8.
- Saez-Gonzalez E, Vinaixa C, San Juan F, et al. Impact of hepatitis C (HCV) antiviral treatment on the need for liver transplantation. Liver Int 2018;38:1022–7.
- Flemming J, Kim W, Brosgart C, Terrault N. Reduction in liver transplant waitlisting in the era of direct acting anti-viral therapy. Hepatology 2017;65:804–12.
- Coilly A, Pageaux G-P, Houssel-Debry P, et al. Improving liver function and delisting of patients awaiting liver transplantation for HCV cirrhosis: do we ask too much to DAAs? Hepatology 2015;62:257A.
- Pascasio JM, Vinaxia C, Ferrer MT, et al. Clinical outcomes of undergoing antiviral therapy while awaiting liver transplantation. J Hepatol 2017;67(6):1168–76.
- Perricone J, Duvoux C, Berenguer M, et al. Delisting HCV infected transplant candidates who improved after viral eradication: Outcome 2 years after delisting. Liver Int 2018;38(12):2170–7.
- Verna EC. The dynamic landscape of liver transplant in the era of effective hepatitis C virus therapy. Hepatology 2017;65:763–s6.
- Little EC, Berenguer M. The new era of hepatitis C therapy in liver transplant recipient. Clin Liver Dis 2017;21(2):421–34.
- European Association for the Study of the Liver. EASL recommendation on treatment of hepatitis C 2020: Final update of the series. J Hepatol 2020;73:1170-218.
- Romano A, Angeli P, Piovesan S, et al. Newly diagnosed hepatocellular carcinoma in patients with advanced hepatitis C treated with DAAs: A prospective population study. J Hepatol 2018;69:345–52.
- Готье С.В., Хомяков C.М. Донорство и трансплантация органов в Российской Федерации в 2019 году. XII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов 2020;21(3):8-34.
- International registry in organ donation and transplantation June 2018 [Internet]. Available from: http://www.irodat.org/img/database.
- Kim WR, Lake JR, Smith JM, et al. OPTN/SRTR 2016 annual data report: liver. Am J Transplant 2018;18(1):172-253.
- Calvaruso V, Cabibbo G, Cacciola I, et al. Incidence of hepatocellular carcinoma in patients with HCV-associated cirrhosis treated with direct-acting antiviral agents. Gastroenterology 2018;155:411-21.
- Backus LI, Belperio PS, Shahoumian TA, et al. Impact of sustained virologic response with direct-acting antiviral treatment on mortality in patients with advanced liver disease. Hepatology 2019;69(2):487–97.
- Kwong A, Kim RW, Mannalithara A, et al. Decreasing mortality and disease severity in hepatitis C patients awaiting liver transplantation in the United States. Liver Transpl 2018;24(6):735–43.
