Реальная практика проведения фармакоэкономических исследований лекарственных средств, применяемых при орфанных заболеваниях в Российской Федерации
Высокие утилитарные затраты, связанные с лекарственным обеспечением пациентов с орфанными заболеваниями, требуют проведения исследований по изучению экономической целесообразности предлагаемых лекарств. Авторы оценили реальную практику проведения фармакоэкономических исследований лекарственных препаратов, применяемых для лечения орфанных заболеваниях, в Российской Федерации (РФ) в период 2015-2021 гг. При поиске в открытых базах данных были найдены 14 фармакоэкономических исследований, которые были включены в анализ. Обсуждаются методологические сложности фармакоэкономических исследований орфанных лекарственных препаратов: несовершенство применяемых методов сравнения эффективности альтернативных стратегий; несовершенство методики оценки затрат при применении альтернативных стратегий; выбор горизонта моделирования; отсутствие доступной информации о размере целевой популяции пациентов; узкий спектр переменных в рамках анализа чувствительности; сравнение расчетных значений дополнительной эффективности и полезности с порогом готовности общества платить. Эти методологические ограничения не позволяют корректно оценить клинико-экономические показатели и социально-экономическое влияние орфанных заболеваний на систему здравоохранения РФ и общества в целом.
Число заболеваний, которые на сегодняшний день относят к редким или так называемым орфанным (от лат. orphos — сирота), составляет около 7 тыс. Обычно заболевание считают орфанным, если его распространенность составляет 1 случай на 2000 жителей и менее. Данная статистика весьма условна, так как одно и то же заболевание может быть редким в одном регионе, популяции или народности и распространенным в другом [1]. Например, проказа до сих пор распространена в Индии, но редко встречается в России, Европе и Северной Америке. Распространенность болезни Тея–Сакса низкая, однако частота носительства мутантного гена у евреевашкенази достигает 1:25. Туберкулез редко встречается в США и одновременно входит в число 10 основных причин смерти во всем мире по данным Всемирной организации здравоохранения. Таким образом, “редкость" заболевания определяется не только реальной частотой и распространенностью, но и точкой зрения исследователей [2]. Термин “орфанное заболевание" был впервые использован в 1983 г. в США для обозначения “болезни или состояния, затрагивающих менее 200 000 американцев" (1 на 1 500 населения) [3]. В Японии орфанными считают заболевания, распространенность которых составляет менее 1 на 2 500 населения, в странах Европейского Союза – менее 1 на 2 000 населения. В законодательных актах, действующих на территории Европейского Союза, также указано, что “орфанное заболевание – это угрожающее жизни и здоровью хроническое заболевание, которое имеет настолько низкую распространенность, что необходимы специальные усилия для предотвращения заболеваемости, ранней смертности и повышения качества жизни больных". Этим подчеркиваются дополнительные сложности, связанные с диагностикой, профилактикой и лечением пациентов с орфанными заболеваниями.
В Российской федерации (РФ) впервые понятие “редкое (орфанное) заболевание" появилось в Федеральном законе № 323-ФЗ “Об основах охраны здоровья граждан в Российской Федерации" с последующим формированием системы учета пациентов (Федерального регистра), страдающих жизнеугрожающими и хроническими прогрессирующими редкими (орфанными) заболеваниями, приводящими к сокращению продолжительности жизни или к инвалидности [4]. Согласно данному закону, к редким (орфанным) отнесены заболевания, которые имеют распространенность не более 10 случаев на 100 000 населения. Таким образом, порог “редкости" многократно выше значений, которые приняты во всем мире, вследствие чего количество заболеваний, относящихся к орфанным, в России меньше, чем в странах Европы и США. В список орфанных болезней Министерства здравоохранения по состоянию на 23.06.2021 включены 267 редких заболеваний, вне зависимости от того, существуют ли на сегодняшний день патогенетическая или только симптоматическая терапия. По этим нозологиям ведется федеральный регистр, который носит исключительно информационный характер и не является финансовым документом. Федеральный закон от 22 декабря 2014 г. N429-ФЗ “О внесении изменений в Федеральный закон “Об обращении лекарственных средств" определил понятие “орфанные лекарственные препараты" как лекарственные средства, предназначенные исключительно для диагностики или патогенетического лечения редких (орфанных) заболеваний [5].
Суммируя перечисленные выше определения, можно сделать вывод, что для орфанных (редких) болезней характерны три ключевых признака: (1) низкая распространенность в популяции (от 1 случая на 10 000 населения до 1 случая на 1 500 населения); (2) хроническое жизнеугрожающее или вызывающее инвалидизацию заболевание; (3) необходимость применения специальных лекарственных средств (орфанных). Поскольку ввиду экономических ограничений ни одна система здравоохранения в мире не может охватить всех пациентов с редкими заболеваниями, разрабатываются различные инструменты для принятия решений о финансировании лечения.
С 2008 г. в Российской Федерации реализуется программа “7 высокозатратных нозологий (7 ВЗН)" – программа льготного обеспечения пациентов в амбулаторных условиях лекарственными средствами, централизованно закупаемыми Минздравом России за счет средств федерального бюджета. К ним относили лекарственные препараты, предназначенные для лечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также пациентов, перенесших трансплантацию органов и (или) тканей [6]. С 2018 г. этот список был расширен за счет лекарств, используемых для лечения гемолитикоуремического синдрома, юношеского артрита с системным началом и мукополисахаридоза I, II и VI типов (“12 ВЗН") [9]. В 2020 г. программа была дополнена апластической анемией и наследственным дефицитом факторов свертывания крови II, VII и X. Таким образом, к 2021 г. по программе “высокозатратных нозологий" обеспечиваются пациенты с 14 нозологическими группами (“14 ВЗН"), финансирование которых осуществляется за счет средств федерального бюджета [10].
С 2008 г. в Российской Федерации реализуется программа “7 высокозатратных нозологий (7 ВЗН)" – программа льготного обеспечения пациентов в амбулаторных условиях лекарственными средствами, централизованно закупаемыми Минздравом России за счет средств федерального бюджета. К ним относили лекарственные препараты, предназначенные для лечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также пациентов, перенесших трансплантацию органов и (или) тканей [6]. С 2018 г. этот список был расширен за счет лекарств, используемых для лечения гемолитикоуремического синдрома, юношеского артрита с системным началом и мукополисахаридоза I, II и VI типов (“12 ВЗН") [9]. В 2020 г. программа была дополнена апластической анемией и наследственным дефицитом факторов свертывания крови II, VII и X. Таким образом, к 2021 г. по программе “высокозатратных нозологий" обеспечиваются пациенты с 14 нозологическими группами (“14 ВЗН"), финансирование которых осуществляется за счет средств федерального бюджета [10].
С 2012 г. существует также “Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности", включающий на сегодняшний день 17 заболеваний. Льготное лекарственное обеспечение пациентов с заболеваниями, вошедшими в указанный перечень, возложено на субъекты РФ [6]. Первоначально “перечень редких жизнеугрожающих заболеваний" включал 24 нозологии, однако позднее 7 из них были переведены в перечень лекарственных средств для обеспечения “ВЗН", т.е. обязательства возложены на федеральный бюджет. Лекарственное обеспечение пациентов с редкими заболеваниями, не вошедшими в указанные выше льготные программы, при наличии у больного статуса “инвалид" финансируется за счет средств субъекта РФ или из средств федерального бюджета, если необходимый препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов, а также в случае выделения межбюджетных трансфертов из федерального бюджета, предоставляемых субъектам РФ [810].
Смыслом создания подобных ограничительных перечней является снижение финансового бремени для регионов РФ, связанного с необходимостью лекарственного обеспечения пациентов с редкими жизнеугрожающими заболеваниями. Абсолютные расходы на орфанные заболевания отражают экономические возможности страны. По различным данным, доступность лечения варьируется от 30% в странах Восточной Европы (доля бюджета на орфанные заболевания менее 0,5% бюджета системы здравоохранения) до 90% во Франции, Австрии и Бельгии (соответствующая доля бюджета от 4 до 5%) [11].
Орфанные лекарственные препараты имеют ограниченный рынок сбыта, а их разработка, регистрация и вывод на фармацевтический рынок часто убыточны, что требует финансирования расходов государством или софинансирования в рамках создания государственночастных партнерств. Так, в США, Европейском Союзе, Австралии и Японии действуют законодательные акты, предоставляющие различные бонусы разработчикам и исследователям орфанных лекарственных средств: упрощенная схема проведения клинических исследований, налоговые льготы и удлиненный период эксклюзивного права на производство и реализацию лекарственного средства и т.д.
Высокие утилитарные затраты, связанные с лекарственным обеспечением пациентов с орфанными заболеваниями, определяют необходимость изучения экономической целесообразности предлагаемых лекарств. Сложности такой оценки связаны как с очень высокой стоимостью орфанных препаратов, так и с трудностями, возникающими при выборе препарата сравнения, отсутствием жестких клинических конечных точек и малыми выборками пациентов в клинических исследованиях, невозможностью проведения рандомизированных клинических исследований, проблемами, возникающими при статистическом подтверждении результатов исследований, малой предполагаемой продолжительностью жизни пациентов [11].
Целью исследования была оценка реальной практики проведения фармакоэкономических исследований лекарственных препаратов, применяемых для лечения орфанных заболеваниях, в РФ в 2015-2021 гг.
Материал и методы
Для выявления круга лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) в период 2015-2021 гг. из числа используемых для лечения орфанных заболеваний была применена следующая методика:
- 1 этап: при сравнении перечней ЖНВЛП за 2015 и 2021 гг. выявлены все вновь включенные лекарственные
препараты, число которых составило 333 международных непатентованных названий (МНН).
- 2 этап: из перечня вновь включенных лекарственных препаратов выделены те, которые применяют при лечении
заболеваний, относящихся в РФ к орфанным [12]. В результате поиска отобрано 24 МНН.
- 3 этап: двумя независимыми исследователями в базах данных Киберленинка и Elibrary произведен поиск
клинико-экономических исследований отобранных на предыдущих этапах лекарственных препаратов. Для поиска
соответствующих статей, опубликованных с 2010 по август 2021 гг., была использована стратегия поиска,
которая включала название лекарства и методы экономических оценок с использованием логического оператора
“И". Стратегия поиска: блинатумомаб, бозутиниб, брентуксимаб ведотин, венетоклакс, галсульфаза, даратумумаб,
дорназа альфа, ибрутиниб, идурсульфаза бета, иксазомиб, карфилзомиб, ларонидаза, ниволумаб, нонаког альфа,
нусинерсен, обинутузумаб, пембролизумаб, руксолитиниб, талиглюцераза альфа, элотузумаб, элтромбопаг,
эмицизумаб, эптаког альфа, идурсульфаза и фармакоэкономическая оценка или фармакоэкономический анализ или
анализ влияния на бюджет или экономическая оценка или экономическая целесообразность или оценка технологий
здравоохранения или анализ эффективности затрат.
Критерии включения: фармакоэкономический анализ включает анализ “затраты-эффективность/полезность" и/или анализ влияния на бюджет (АВБ); публикация на русском языке. Критерии исключения: отсутствие полнотекстовой версии отчета о результатах исследования; иные виды фармакоэкономических исследований, например, анализ стоимости болезни.
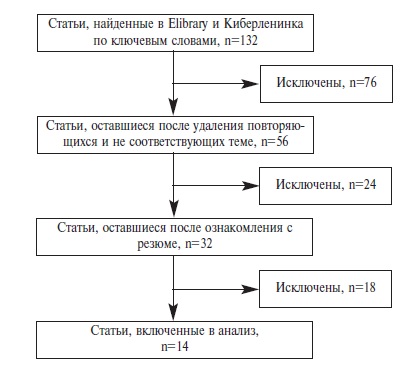
Результаты поиска приведены на рис. 1. Были получены данные о 14 фармакоэкономических исследованиях для 16 препаратов, используемых при лечении орфанных заболеваний: остром и хроническом лимфобластном лейкозе, хроническом миелоидном лейкозе, ходжкинской лимфоме, мукополисахаридозе I, II и VI типа, множественной миеломе, муковисцидозе, меланоме, гемофилии, спинальной мышечной атрофии, полицитемии, миелофиброзе, болезни Гоше I типа и апластической анемии. Во всех исследованиях оценивали методическое качество проведенного фармакоэкономического исследования: анализировали выбранный метод, возникшие методологические сложности при проведении оценки экономической эффективности, а также способы их преодоления.
| № | Год | Заболевание | Исследуемый препарат | Фармакоэкономический метод | Горизонт моделирования | Ссылка |
|---|---|---|---|---|---|---|
| Примечание: АВБ – анализ влияния на бюджет, АИИК – антиингибиторный коагулянтный комплекс | ||||||
| 1 | 2018 | Хронический миелолейкоз | Бозутиниб | Затраты-эффективность, АВБ | 4 года | [13] |
| 2 | 2017 | Системная апластическая | Брентуксимаб | АВБ | 3 года | [14] |
| 3 | 2016 | Системная апластическая крупноклеточная лимфома | Брентуксимаб | Затраты-эффективность, АВБ | 2 года | [15] |
| 4 | 219 | Множественная миелома | Даратумумаб, иксазомиб, карфилзомиб,элотузумаб | Затраты-эффективность | 5 лет | [16] |
| 5 | 2015 | Мантийноклеточная лимфома | Ибрутиниб | Затраты-эффективность, АВБ | 1 год | [17] |
| 6 | 2019 | Мукополисахаридоз 2 типа | Идурсульфаза, идурсульфаза бета | Минимизация затрат, АВБ | 5 лет | [18] |
| 7 | 2017 | Меланома | Ниволумаб | Затраты-эффективность, АВБ | 5-11 мес | [19] |
| 8 | 2020 | Ходжкинская лимфома | Брентуксимаб, ниволумаб, пембролизумаб | АВБ | 6 лет | [20] |
| 9 | 2020 | Ходжкинская лимфома | Брентуксимаб, ниволумаб, пембролизумаб | АВБ | 6 лет | [20] |
| 10 | 2017 | Меланома | Пембролизумаб | Затраты-эффективность, АВБ | 5 лет | [22] |
| 11 | 2015 | Первичный миелофиброз | Руксолитиниб | Затраты-полезность, АВБ | 2 года | [23] |
| 12 | 2017 | Идиопатическая тромбоцитопеническая пурпура | Элтромбопаг | Затраты-полезность, АВБ | 5 лет | [24] |
| 13 | 2013 | Гемофилия А | АИИК | АВБ | 1 год | [25] |
| 14 | 2017 | Гемофилия А | АИИК, эптаког альфа | АВБ | 1 год | [26] |
Результаты оценки проведенных фармакоэкономических исследований указанных лекарственных препа ратов представлены в табл. 1 и 2. К ключевым методологическим сложностям, идентифицированным в рамках проведенного анализа, можно отнести:
| № | Заболевание | Получено QALYs | ICER | Анализ чувствительности | Ссылка |
|---|---|---|---|---|---|
| Примечание: QALYs (Quality-adjusted life years) – добавленные годы жизни с поправкой на качество, ICER (Incremental cost-effectivenessratio) – инкрементальный коэффициент “затраты-эффективность", алло-ТГСК – аллогенная трансплантация гемопоэтических стволовых клеток | |||||
| 1 | Хронический миелолейкоз | Не применимо | Не применимо | 25% цены препарата | [13] |
| 2 | Системная апластическая крупноклеточная лимфома | Не применимо | Не применимо | Частота назначения и стоимость препаратов | [14] |
| 3 | Системная апластическая крупноклеточная лимфома | Не применимо | BV/HDT+аллоТГСК var-1 –187 429 руб.; BV+CHPcomb HDT + аллоТГСК var-1 – 139 680 руб.; BV+CHPcomb HDT+ аллоТГСК var-2 – 45 413 руб. | Эффективность, стоимость | [15] |
| 4 | Множественная миелома | Не применимо | Даратумумаб –10,26 млн руб.; карфилзомиб – 11,88 млн руб.; иксазомиб – 20,27 млн руб.; элотузумаб – 27,6 млн руб. | Эффективность, стоимость | [16] |
| 5 | Мантийноклеточная лимфома | Ибрутиниб – 0,68,темсиролимус – 0,59 | Не рассчитывали | Не проводился | [17] |
| 6 | Мукополисахаридоз 2 типа | Не применимо | Не применимо | Стоимость препаратов | [18] |
| 7 | Меланома | Не применимо | Не применимо | Стоимость препаратов | [19] |
| 8 | Ходжкинская лимфома | Не применимо | Не применимо | Стоимость препаратов, доля пациентов, получающих альтернативу | [20] |
| 9 | Хронический лимфолейкоз | Не применимо | Не применимо | Стоимость препаратов, доля лиц с коморбидными заболеваниями, процент лиц в состоянии “жив без прогрессирования" | [21] |
| 10 | Меланома | Не применимо | Дабрафениб – 149 043 руб; вемурафениб – 222 027 руб. | Стоимость препаратов, общая выживаемость (достраивание горизонтального плато) | [22] |
| 11 | Первичный миелофиброз | 1,28 – руксолитиниб; для референтных препаратов значения не приведены | Руксолитинб – 1 812 748 руб.; экулизумаб – 41 375 750 руб.; флударабин – 2 990 851 руб. | Не проводился | [23] |
| 12 | Идиопатическая тромбоцитопеническая пурпура | Элтромбопаг – 4145,25 на 1000 человек за 5 лет; иммуносупрессивная терапия – 4023,24 на 1000 человек за 5 лет; ромиплостим – 4267,11 на 1000 человек за 5 лет | Элтромбопаг – 1,33 млн руб.; ромиплостим – 4,2 млн руб. | Стоимость препаратов | [24] |
| 13 | Гемофилия А | Не оценивали | Не измеряли | Не проводился | [25] |
| 14 | Гемофилия А | Не применимо | Не применимо | Не проводился | [26] |
1. Несовершенство применяемых методов сравнения эффективности альтернативных стратегий. В четырех исследованиях эффективность альтернативных стратегий сравнивали в рамках нескорректированного непрямого сравнения, т.е. сопоставления абсолютных значений точечных оценок эффектов, полученных в отдельных группах разных исследований, как если бы эти значения были получены в одном исследовании [13,17,19,26]. Это приводит к игнорированию влияния случайности на наблюдаемые различия, которые должны быть оценены при помощи статистических методов [27]. Еще в двух исследованиях отсутствует информация о методологии сравнения эффективности альтернатив, тем не менее, вероятно, сравнение также было нескорректированным [15,22].
2. Несовершенство методики оценки затрат при применении альтернативных стратегий. В четырех исследованиях в расчетах были учтены региональные тарифы на оказание медицинской помощи в Москве и СанктПетербурге, которые могут значимо отличаться от таковых в других регионах [14,15,18,19]. В трех исследованиях учитывали только прямые медицинские затраты на препараты сравнения и не учитывали иные прямые медицинские расходы, в частности затраты на купирование нежелательных явлений, в том числе в рамках внеплановых госпитализаций [20,23,26]. В одном исследовании источники данных о прямых медицинских затратах на амбулаторное и стационарное лечение не представлены [24].
3. Выбор горизонта моделирования. Горизонт моделирования в представленных исследованиях составил от 5 мес до 6 лет. Так, в одном исследовании эффективности применения брентуксимаба ведотина, ниволумаба и пембролизумаба для терапии пациентов с рецидивом ходжкинской лимфомы горизонт моделирования составил 6 лет [20]. В то же время наблюдение в рамках рандомизированного клинического исследования брентуксимаба продолжалось 2 года с медианой выживаемости без прогрессирования 5,6 мес (количество пациентов в состоянии “жив без прогрессирования" – 0 через 24 мес от начала терапии). То же самое касается ниволумаба (2 года наблюдения в рандомизированном клиническом исследовании, 0 – в состоянии “жив без прогрессирования" через 24 мес от начала терапии, медиана выживаемости без прогрессирования – 14,7 мес) и пембролизумаба (длительность наблюдения – 30 мес, медиана безрецидивной выживаемости – 13,7 мес) [28-30]. В рамках анализа произведена аппроксимация кривых выживаемости для каждой из альтернатив. Однако с учетом несопоставимости реальных значений показателей общей и безрецидивной выживаемости выбранному горизонту моделирования его длительность кажется избыточной. При этом для гемофилии – хронического заболевания с продолжительностью жизни, соответствующей популяционной, горизонт моделирования составлял только 1 год, что крайне мало для оценки реальных экономических последствий внедрения в клиническую практику препаратов для терапии данного заболевания.
4. Отсутствие доступной информации о размере целевой популяции пациентов. В большинстве приведенных исследований отсутствуют данные о точном количестве пациентов с рассматриваемой патологией в РФ. Сведения из отечественных регистров пациентов использованы только при фармакоэкономическом анализе препаратов, предназначенных для лечения гемофилии [26], идиопатической тромбоцитопенической пурпуры [24] и мукополисахаридоза 2 типа [18]. Еще в одном исследовании в расчетах учитывали размер популяции пациентов по заболеваемости в СанктПетербурге, где такой учет в рамках научной деятельности ведется, с экстраполяцией данных на всю РФ [21]. Все остальные данные о численности популяции пациентов носят расчетный характер, в том числе на основании зарубежных эпидемиологических исследований.
5. Узкий спектр переменных в рамках проводимого ана-лиза чувствительности. Анализ чувствительности про- водился в 11 из 14 исследований и касался допущений по стоимости лекарственных препаратов, эффективно- сти стратегий в 4 из 11 исследований и частоты назначения препаратов в 3 из 11 исследований.
6. Сравнение расчетных значений дополнительной эффективности и полезности с порогом готовности общества платить. Расчет ICER (Incremental cost-effectiveness ratio, инкрементального коэффициента затраты-эффективность) проводили в 5 исследованиях [15,16,22-24]. В 2 исследованиях полученные значения сравнивали с порогом готовности общества платить, официально принятая методологии расчета которого в РФ отсутствует [15,24]. Еще в одном исследовании уже рассчитанные референтные значения ICUR (Incremental cost-utility ratio, инкрементального коэффициента затраты-полезность) были заимствованы из зарубежных исследований с последующим пересчетом иностранной валюты в рубли по текущему курсу [23]. В 2 других исследованиях [16,22] были получены наименьшие значения ICER для рассматриваемого препарата по сравнению со стоимостью дополнительной эффективности для возможных альтернатив.
Обсуждение
Обеспечение лекарственными препаратами пациентов, страдающих орфанными заболеваниями, требует значительных расходов системы здравоохранения. Согласно данным бюллетеня по редким и орфанным заболеваниям (2020 г.), в 2019 г. бюджет РФ на редкие заболевания по программе “редких жизнеугрожающих заболеваний" составил 32,4 млрд. рублей: 36% были выделены из региональных средств и 64% – из средств Федеральных программ [31]. Понятно, что планирование столь значимых расходов должно учитывать как эпидемиологические, так и клинические и социальные аспекты заболевания: численность популяции пациентов, возрастной и половой состав, показатели заболеваемости, смертности, выживаемости, распределения пациентов по стадиям и тяжести заболевания, осложнениям, текущую практику лекарственного обеспечения, долю лиц с инвалидностью/сохраненной трудоспособностью, потребность в средствах реабилитации и т.д.
В настоящее время доступ к подобным сведениям крайне ограничен, что требует при осуществлении фармакоэкономического моделирования использования в качестве источников информации расчетных показателей, причем как показал проведенный анализ, для отдельных нозологий расчет размера популяции пациентов произведен на основании эпидемиологии заболеваний в США и Европе. В то же время все указанные показатели могут быть получены при ведении регистров пациентов [32]. Ограниченное количество регистров (доступа к ним) как источника информации о клинических, демографических и социальных особенностях популяций пациентов повышает вероятность ошибки при построении фармакоэкономических моделей и снижает валидность результатов проводимых исследований, которые не позволяют оценить истинные затраты, связанные с заболеванием. При этом проводимый в рамках моделирования анализ чувствительности результатов не восполняет в полной мере дефицит информации, а лишь дает возможность оценить степень влияния отдельных факторов, учтенных при построении модели, на окончательный результат.
Безусловно, важным фактором, способствующим совершенствованию методов проведения клинико-экономических исследований, является аудит их результатов: сравнение результатов, полученных в рамках моделирования, с затратами в реальной клинической практике. Тем не менее, в настоящее время такие исследования не проводятся.
Многие орфанные заболевания определяются исключительно как педиатрические. Это означает, что при современном лечении такие пациенты никогда не доживают до “взрослой сети". Именно поэтому экономические последствия конкретного заболевания изучаются с помощью анализа социально-экономического бремени, результаты которого подчеркивают, что невозможно только в денежном эквиваленте выразить нагрузку в связи с орфанным заболеванием на систему здравоохранения и общество в целом.
В то же время существует нехватка исследований стоимости болезни (сost of illnesses, COI) в области редких заболеваний. В рамках проведенного систематического обзора А. Angelis с соавт. (2015 г.) нашли всего 77 исследований, предполагавших оценку стоимости редких заболеваний [33]. При этом вне зависимости от страны, в которой проводили фармакоэкономический анализ, наиболее часто исследования касались муковисцидоза и гемофилии, что, вероятно, связано с имеющимися средствами патогенетического или симптоматического лечения, позволяющего добиться хорошего качества и продолжительности жизни таких пациентов. В то же время для большинства редких заболеваний исследование стоимости болезни не представляется возможным, так как помощь, которая на сегодняшний день доступна таким пациентам, лежит вне медицинской плоскости (социальная, педагогическая, психологическая и т.д.).
Основным ограничением исследований стоимости болезни является отсутствие возможности для сравнения преимуществ альтернативных стратегий, что не дает возможность использовать исследования социально-экономического бремени заболевания в качестве инструмента оценки экономической эффективности при принятии решений о включении лекарственных препаратов в ограничительные списки на государственном уровне.
Анализ затраты-эффективность (сost-еffectiveness analysis, CEA) с расчетом коэффициента затратыэффективность (cost-effectiveness ratio, CER) практически не применим к редким заболеваниям. Тем не менее, в рамках проведенного нами исследования в 5 случаях (системная крупноклеточная лимфома, множественная миелома, меланома, первичный миелофиброз, идиопатическая тромбоцитопеническая пурпура) был проведен расчет CER для альтернативных стратегий с последующим расчетом стоимости дополнительной эффективности (ICER, incremental cost-effectiveness ratio). Результаты сравнивали с порогом готовности общества платить, методология расчета и пороговые значения которого в РФ отсутствуют [15,16,22-24].
Заключение
При проведении исследований экономической целесообразности использования лекарственных препаратов, применяемых при редких заболеваниях, выявлен ряд методологических ограничений. Это не позволяет корректно оценить клинико-экономические показатели и измерить социально-экономическое влияние орфанных заболеваний на систему здравоохранения РФ и общества в целом.
Используемые источники
- Haendel M, Vasilevsky N, Unni D, et al. How many rare diseases are there? Nat Rev Drug Discov 2020;19(2):77-8.
- Austin C, Cutillo C, Lau L, et al. International Rare Diseases Research Con sortium (IRDiRC). Future of Rare Diseases Research 2017-2027: An IRDiRC Perspective. Clin Transl Sci 2018;11(1):21-7.
- Henkel J. Orphan drug law matures into medical mainstay. FDA Consumer. 1999;33(3):29-32.
- Об основах охраны здоровья граждан в Российской Федерации: федеральный закон от 21.11.2011 № 323-ФЗ. [Электронный ресурс]. http://base.garant.ru/12191967/.
- Федеральный закон “О внесении изменений в Федеральный закон “Об обращении лекарственных средств” от 22.12.2014 N 429-ФЗ.
- Федеральный Закон № 323 от 21.11.2011 г. “Об основах охраны здоровья граждан в Российской Федерации”. https://minzdrav.gov.ru/documents/7025-federalnyy-zakon-323-fz-ot-21-noyabrya-2011-g.
- Приказ Министерства здравоохранения РФ от 15 февраля 2013 г. № 69н “О мерах по реализации постановления Правительства Российской Федерации от 26 апреля 2012 г. № 404 “Об утверждении Правил ведения Федерального регистра лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей”. [Электронный ресурс]. URL: http://base.garant.ru/70362290. Дата обращения: 20.07.2021.
- Постановление от 28 августа 2014 года №871 “О Правилах формирования перечней лекарственных препаратов, необходимых для оказания медицинской помощи, и их минимального ассортимента”. [Электронный ресурс]. URL: http://government.ru/docs/14540/.
- Распоряжение Правительства РФ от 10.12.2018 №2738-р “Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2019 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи”. [Электронный ресурс]. URL: https://www.garant.ru/products/ipo/prime/doc/72023048/.
- Распоряжение Правительства Российской Федерации №2406-р от 12 октября 2019 об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, перечня лекарственных препаратов для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственной им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей, перечня лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций, а также минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи. URL: https://www.garant.ru/products/ipo/prime/doc/72761778/. Дата обращения: 20.07.2021.
- Szegedi M, Zelei T, Arickx F, et al. The European challenges of funding orphan medicinal products. Orphan J Rare Dis 2018;13(1):184.
- Перечень редких (орфанных) заболеваний от 4 марта 2021 года и от 23 июня 2021 года. https://minzdrav.gov.ru/documents/9641-perechen-redkih-orfannyhzabolevaniy
- Авксентьев Н. А., Фролов М. Ю., Макаров А. С. Фармакоэкономическое исследование применения препарата нилотиниб у больных с хроническим миелоидным лейкозом во второй линии терапии. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология 2018;11(2):27-37 [Avksentiev NA, Frolov MYu, Makarov AS. Pharmacoeconomical study of the use of the drug nilotinib in patients with chronic myeloid leukemia in the second line of therapy. Pharmacoeconomics. Modern Pharmacoeconomics and Pharmacoepidemiology 2018;11(2):27-37. (In Russ.)].
- Колбин А.С., Вилюм И.А., Проскурин М.А., Балыкина Ю.Е. Фармакоэкономический анализ применения брентуксимаба ведотина в терапии рецидивирующей или рефрактерной CD30+ системной анапластической круп но клеточной лимфомы у пациентов старше 18 лет: результаты анализавлияния на бюджет здравоохранения. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология 2017;10(1):39-45 [Kolbin AS, Vilyum IA, Proskurin MA, Balykina YuE. Pharmacoeconomical analysis of the use of brentuximab vedotin in the treatment of recurrent or refractory CD30+ systemic anaplastic large cell lymphoma in patients over 18 years of age: the results of the analysis of the impact on the health budget. Pharmacoeconomics. Modern Pharmacoeconomics and Pharmacoepidemiology 2017;10(1):39-45 (In Russ.)].
- Колбин А.С., Вилюм И.А., Проскурин М.А., Балыкина Ю.Е. Фармакоэкономический анализ применения брентуксимаба ведотина в терапии рецидивирующей или рефрактерной CD30+ системной анапластической крупноклеточной лимфомы у пациентов старше 18 лет. Клиническая фармакология и терапия 2016;25(2):90-6 [Kolbin AS, Vilyum IA, Proskurin MA, Balykina YuE. Pharmacoeconomical analysis of the use of brentuximab vedotin in the treatment of recurrent or refractory CD30+ systemic anaplastic large cell lymphoma in patients older than 18 years. Klinicheskaya farmakolo giya i terapiya = Clin Pharmacol Ther 2016;25(2):90-6 (In Russ.)].
- Авксентьев Н.А., Деркач Е.В., Макаров А.С. Клинико-экономическое исследование даратумумаба в составе комбинированной терапии у пациентов с множественной миеломой, ранее получавших лечение. Медицинские технологии. Оценка и выбор 2019;4:62–75 [Avksentiev NA, Derkach EV, Makarov AS. Clinical and economic study of daratumumab as part of combination therapy in patients with multiple myeloma who had previously received treatment. Medical technologies. Assessment and choice 2019;4:62-75. (In Russ.)].
- Куликов А.Ю., Комаров И.А. Фармакоэкономический анализ лекарственного средства ибрутиниб в лечении мантийноклеточной лимфомы. Фармакоэкономика. Теория и практика 2015;3(1):26-30 [Kulikov AYu, Komarov IA. Pharmacoeconomical analysis of the drug ibrutinib in the treatment of mantle cell lymphoma. Pharmacoeconomics. Theory and Practice 2015;3(1):26-30 (In Russ.)]
- Куликов А.Ю., Костина Е.О. Фармакоэкономическая оценка препаратов, используемых при ферментной заместительной терапии в лечении мукополисахаридоза II типа. Фармакоэкономика: Теория и практика 2019;7(2):10-5 [Kulikov AYu, Kostina EO. Pharmacoeconomical evaluation of drugs used in enzyme replacement therapy in the treatment of type II mucopolysaccharidosis. Pharmacoeconomics: Theory and Practice 2019;7(2):10-5 (In Russ.)].
- Куликов А.Ю., Бабий В.В. Фармакоэкономический анализ лекарственного средства ниволумаб у ранее не получавших лечение больных с неоперабельной меланомой 3-4 стадии и мутацией BRAF на территории Российской Федерации. Фармакоэкономика. Теория и практика 2017;5(2):41-6 [Kulikov AYu, Babiy VV. Pharmacoeconomical analysis of the drug nivolumab in previously untreated patients with inoperable stage 3-4 melanoma and BRAF mutation on the territory of the Russian Federation. Pharmacoeconomics. Theory and Practice 2017;5(2):41-6 (In Russ.)].
- Авксентьев Н.А., Пазухина Е.М., Тумян Г.С., Зейналова П.А. Фармакоэкономическая оценка применения препаратов брентуксимаб ведотин, ниволумаб и пембролизумаб для терапии пациентов с рецидивом лимфомы Ходжкина. Онкогематология 2020;15(4):103–12 [Avksentiev NA, Pazukhina EM, Tumyan GS, Zeynalova PA. Pharmacoeconomical evaluation of the use of drugs brentuximab vedotin, nivolumab and pembrolizumab for the treatment of patients with recurrent Hodgkin's lymphoma. Oncohematology 2020;15(4):103-12 (In Russ.)].
- Деркач Е.В., Федяева В.К., Реброва О.Ю., Никитин Е.А. Сравнительный фармаэкоэкономический анализ применения лекарственных препаратов обинутузумаб и ибрутиниб при хроническом лимфоцитарном лейкозе в рамках программы обеспечения дорогостоящими лекарственными препаратами. Медицинские технологии. Оценка и выбор 2016;1:58-72 [Derkach EV, Fedyaeva VK, Rebrova OYu, Nikitin EA. Comparative pharmacoeconomical analysis of the use of drugs obinutuzumab and ibrutinib in chronic lymphocytic leukemia in the framework of the program of providing expensive drugs. Medical technologies. Assessment and choice 2016;1:58-72 (In Russ.)].
- Косолапов Е.Г., Коченков В.С., Зырянов С.К., Гладков О.А. Клинико-экономический анализ применения препарата пембролизумаб при нерезектабельной и метастатической меланоме по сравнению с таргетной терапией. Качественная клиническая практика 2017;2:12-24 [Kosolapov EG, Kochetkov VS, Zyryanov SK, Gladkov OA. Clinical and economic analysis of the use of lambrolizumab in unresectable and metastatic melanoma compared with targeted therapy. Good Clinical Practice 2017;2:12-24. (In Russ.)].
- Серпик В.Г. Фармакоэкономическая оценка терапии редких заболеваний на примере лечения первичного миелофиброза препаратом руксолитиниб. Фармакоэкономика: Теория и практика 2015;3(2):20-3 [Serpik VG. Pharma -coeconomical evaluation of rare disease therapy on the example of treatment of primary myelofibrosis with ruxolitinib. Pharmacoeconomics: Theory and Practice 2015;3(2):20-3 (In Russ.)].
- Шуваев В.А., Волошин С.В., Хаджидис А.К., Чечеткин А.В. Фармако экономический анализ использования агонистов рецепторов тромбопоэтина при идиопатической тромбоцитопенической пурпуре. Клиническая онкогематология 2017;10(4):435–42 [Shuvaev VA, Voloshin SV, Hadzhidis AK, Chechetkin AV. Pharmacoeconomical analysis of the use of thrombopoietin receptor agonists in idiopathic thrombocytopenic purpura. Clinical Oncohematology 2017;10(4):435-42 (In Russ.)].
- Ягудина Р.И., Зинчук И.Ю. Фармакоэкономический анализ включения в схемы лечения ингибиторной формы гемофилии А лекарственного средства антиингибиторный коагулянтный комплекс (АИКК). Фармакоэкономика 2013; 6(4):2013 [Yagudina RI, Zinchuk IYu. Pharmacoeconomical analysis of the inclusion of the drug anti-inhibitory coagulant complex (AICC) in the treatment regimens of the inhibitory form of hemophilia A. Pharmacoeconomics 2013;6(4):7-12 (In Russ.)].
- Серпик В.Г., Ягудина Р.И. Анализ “влияния на бюджет” применения шунтирующих препаратов антиингибиторный коагулянтный комплекс и эптаког альфа (активированный) при профилактике развития кровотечений у пациентов с ингибиторной формой гемофилии. Фармакоэкономика: Теория и практика 2017;5(1):6-12 [Serpik VG, Yagudina RI. Analysis of the “impact on the budget” of the use of shunting drugs anti-inhibitory coagulant complex and eptacog alpha (activated) in the prevention of bleeding in patients with an inhibitory form of hemophilia. Pharmacoeconomics: Theory and Practice 2017;5(1):6-12 (In Russ.)].
- Реброва О.Ю., Горяйнов С.В. Непрямые и смешанные сравнения медицинских технологий, сетевой мета-анализ. Медицинские технологии. Оценка и выбор 2013;14(4):8-14 [Rebrova OYu, Goryainov SV. Indirect and mixed comparisons of medical technologies, network meta-analysis. Medical technologies. Assessment and choice 2013;14(4):8-14 (In Russ.)].
- Armand P, Engert A, Younes A, et al. Nivolumab for relapsed/refractory classic Hodgkin lymphoma after failure of autologous hematopoietic cell transplantation: extended follow up of the multicohort single arm phase II CheckMate 205 trial. J Clin Oncol 2018;36(14):1428–39.
- Younes A, Gopal AK, Smith SE, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol 2012;30(18):2183–9.
- Chen R, Luigi Zinzani P, Ju Lee H, et al. Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2 -year follow up of KEYNOTE 087. Blood 2019;134(14): 1144–53.
- Ежегодный бюллетень Экспертного совета по редким (орфанным) заболеваниям. М., 2020, 332 с.
- Иванов А. В. Регистры как основа для сбора данных и построения доказательств. Реальная клиническая практика: данные и доказательства 2021;1(1):10-5 [Ivanov A.V. Registers as a basis for data collection and evidence construction. Real World Data and Evidence 2021;1(1):10-5 (In Russ.)].
- Angelis A, Tordrup D, Kanavos P. Socio-economic burden of rare diseases: A systematic review of cost of illness evidence. Health Policy 2015;119(7):964-79.
