Системная красная волчанка: эпидемиология, отдаленные исходы и бремя болезни
В странах Европы заболеваемость системной красной волчанкой (СКВ) составляет 1,5-4,9 на 100000 человеко-лет, а распространенность – от 30 до 70 на 100000 населения. Благодаря иммуносупрессивной терапии выживаемость больных СКВ за последние 50 лет значительно увеличилась, а в структуре причин смертности уменьшилась доля проявлений активности заболевания и возросла роль инфекций и сердечно-сосудистых заболеваний. Хотя при СКВ могут наблюдаться как многолетние ремиссии, так и постоянное сохранение воспалительной активности, у 70% пациентов течение заболевания характеризуется чередующимися обострениями и ремиссиями. Ежегодно средне-тяжелые или тяжелые обострения развиваются примерно у каждого третьего больного. Повторные обострения СКВ, осложнения иммуносупрессивной терапии и сопутствующие заболевания приводят к накоплению повреждения органов, которое сопровождается увеличением риска смерти. СКВ вызывает значительное ухудшение качества жизни, коррелирующее как с активностью заболевания, так и с повреждением органов. Самым частым симптомом, причиняющим пациентам наибольшее беспокойство, является усталость. Подавление активности СКВ приводит к улучшению исходов заболевания, в том числе снижению смертности, риска обострений, повреждения органов, частоты госпитализаций и затрат и улучшению качества жизни. Важную роль в лечении СКВ по-прежнему играют глюкокортикостероиды, хотя их применение по возможности следует ограничивать, в частности путем назначения иммуносупрессивных/противовоспалительных препаратов, обладающих стероидосберегающей активностью. Большое значение для дальнейшего улучшения отдаленных исходов СКВ имеют лечение и профилактика инфекций и сердечно-сосудистых заболеваний.
Термин "волчанка" (lupus) использовали для обозначения некоторых поражений кожи еще несколько столетий назад, однако представления о красной волчанке как о системном заболевании сформировались только в начале XX века благодаря работам M. Kaposi, W. Osler, E. Libman, B. Sacks и др. В 40-х гг. прошлого столетия P. Klemperer предложил концепцию диффузных заболеваний коллагена, к которым была отнесена и системная красная волчанка (СКВ). В нашей стране большой вклад в изучение СКВ внесли Е.М. Тареев и его ученики (В.А. Насонова, О.М. Виноградова, И.Е. Тареева и др.), которые изучали весь спектр многообразных проявлений этого заболевания и аутоиммунных механизмов его развития. Крупнейшим достижением в изучении СКВ стало применение глюкокортикостероидов, за разработку которых P. Hench, работавший ревматологом в клинике Мейо, и два биохимика были удостоены Нобелевской премии. Уже в начале 60-х гг. эти препараты начали использовать для лечения СКВ и других ревматических заболеваний в институте ревматологии АМН и клинике, которая сегодня носит имя Е.М. Тареева [1].
В первой половине прошлого века СКВ встречалась очень редко. По словам Е.М. Та реева: "До 1949 г. мне, несмотря на многолетние контакты с дерматологами, не пришлось видеть больной СКВ", в то время как сегодня количество больных СКВ в мире исчисляется миллионами. В статье рассматриваются эпидемиология СКВ, современные особенности ее течения и отдаленные исходы, влияние проявлений заболевания на качество жизни, структура причин смертности.
Эпидемиология СКВ
Данные об эпидемиологии СКВ в мире неоднозначные, даже для одного региона или страны, что отражает не только истинные различия заболеваемости и распространенности заболевания в разных популяциях, которые отличаются по демографическим, социальноэкономическим и другим факторам, но и связано с особенностями дизайна эпидемиологических исследований и используемых определений или классификационных критериев СКВ [2,3]. Например, применение критериев SLICC (Systemic Lupus International Collaborating Clinics) 2012 г. вместо критериев Американской коллегии ревматологов (ACR) 1997 г. в одной и той же популяции привело к увеличению показателя заболеваемости на 40% [4]. В 2019 г. экспертами Европейской антиревматической лиги (EULAR) и ACR были предложены новые классификационные критерии СКВ, которые, в отличие от предыдущих критериев, предполагают обязательное наличие антиядерных антител в титре по крайней мере 1:80 [5], что создает дополнительные трудности при сравнении результатов исследований, проводившихся в разное время, и анализе динамики заболеваемости и распространенности СКВ. По тем же причинам приводимые показатели могут быть как значительно заниженными, так и завышенными. Кроме того, количество эпидемиологических исследований, как и их качество, значительно отличается в разных регионах. Эпидемиология СКВ лучше изучена в США, Великобритании, скандинавских странах, в то время как в Восточной Европе, включая Россию, Австралии, Новой Зеландии и Африке, эпидемиологических данных очень мало [3].
По данным мета-анализа эпидемиологических исследований [2], заболеваемость и распространенность СКВ в США превышают таковые в Европе. Например, в 2016 г. среди более 5 млн американцев, охваченных системой Medicare, заболеваемость СКВ составила 49,0 на 100000 человеко-лет, а распространенность – 366,6 на 100000 населения [6]. Однако нельзя исключить, что эти показатели завышены с учетом исследуемой популяции. В нескольких региональных регистрах, которые финансировались Американским центром по контролю за заболеваемостью (CDC) и считаются более надежным источником информации об эпидемиологии заболевания, были получены более низкие значения: заболеваемость СКВ варьировалась от 4,6 до 5,5 на 100000 человеко-лет, а распространенность – от 72,8 до 84,8 на 100000 населения [7-9]. Сопоставимость данных, полученных в разных регионах США, является дополнительным доводом в пользу того, что они точнее отражают реальную картину. По данным крупных исследований, проводившихся в европейских странах, заболеваемость СКВ составила 4,9 на 100000 человеколет в Великобритании [10], 3,3 на 100000 человеко-лет во Франции [11], 2,3 на 100000 человеко-лет в Дании [12] и 1,5-1,8 на 100000 человеко-лет в Эстонии [13], в то время как распространенность в большинстве регистров варьировалась от 30 до 70 на 100000 населения [3]. Последний показатель был выше в Вели кобритании (97,0 на 100000 населения) [10]. Результаты ряда исследований свидетельствуют о том, что распространенность СКВ в обшей популяции постепенно увеличивается, что, вероятно, в первую очередь отражает увеличение выживаемости пациентов с этим заболеванием на фоне современной иммуносупрессивной терапии [6,10,14].
Заболеваемость СКВ у женщин примерно в 5 раз выше, чем у мужчин, и достигает пика в более молодом возрасте (30-50 лет против 50-70 лет) [10,11]. Распространенность заболевания у женщин также значительно превышает таковую у мужчин (примерно 9:1), а в большинстве эпидемиологических исследований доля женщин среди больных СКВ составляла более 85% [3]. Эпидемиология СКВ зависит от этнической принадлежности. Так, у афроамериканок показатели распространенности и заболеваемости были в несколько раз выше, чем у американок европеоидной расы [9]. В то же время в некоторых странах Азии эти показатели в целом соответствовали таковым в США и Европе. Например, в Тайване и Южной Корее ежегодная заболеваемость СКВ составила 8,1 и 2,8 на 100000 человеколет, соответственно, а распространенность – 67,4 и 26,5 на 100000 населения [15,16].
Выживаемость и структура причин смерти больных СКВ
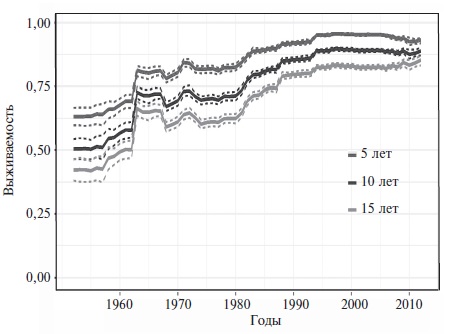
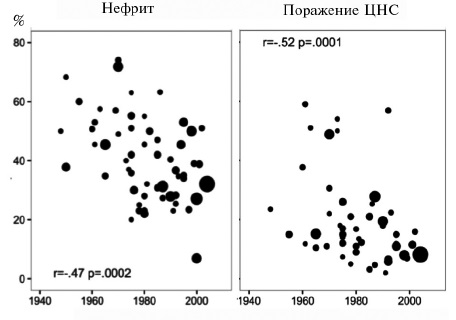
За последние десятилетия выживаемость больных СКВ значительно увеличилась, а структура причин смертности изменилась. По данным мета-анализа большого числа исследований, в 50-х гг. прошлого столетия около половины таких пациентов умирали в течение 5 лет, в то время как в 2008-2016 гг. 5-летняя, 10-летняя и 15-летняя выживаемость достигла 95%, 89% и 82%, соответственно (рис. 1) [17]. Одновременно значительно сократилась доля проявлений активной СКВ в структуре причин смертности (с 42,4% до 12,3%). В исследованиях, проводившихся после 2000 г., ведущими причинами смертности были также инфекции (15,1%), сердечно-сосудистые заболевания (11,3%) и злокачественные опухоли (7,5%). Указанные изменения в первую очередь отражают повышение эффективности лечения за счет применения глюкокортикостероидов и других иммуносупрессивных препаратов. Однако обращает на себя внимание, что в последних исследованиях в когортах пациентов с СКВ уменьшилась доля больных с поражением почек и центральной нервной системы (ЦНС), которые представляют собой наиболее тяжелые проявления заболевания (рис. 2). Нельзя исключить, что определенный вклад в улучшение выживаемости могло внести увеличение количества пациентов с более легкими формами СКВ в результате более ранней ее диагностики за счет широкого тестирования на антинуклеарные антитела. Несмотря на улучшение прогноза для жизни, среди пациентов с СКВ смертность примерно в 1,5-3 раза выше, чем в общей популяции [3], и превышает таковую среди пациентов с другими аутоиммунными заболеваниями, включая системную склеродермию, идиопатические воспалительные миопатии, синдром Шегрена и АНЦА-ассоциированные васкулиты [18]. Более того, СКВ является одной из ведущих причин смертности среди женщин молодого возраста. В США это заболевание находилось на 10-м месте среди причин смерти женщин в возрасте 15-24 года и на 14-м месте среди причин смерти женщин в возрасте 25-44 года [19]. Доля СКВ в структуре смертности оказалась еще выше среди афроамериканок и латиноамериканок.
В большинстве исследований ведущими причинами смертности больных СКВ были сердечно-сосудистые заболевания (27-52%), инфекции (15-43%) и злокачественные опухоли (13-33%) [3]. Y. Lee и соавт. провели мета-анализ 15 исследований, в которые были включены около 26100 пациентов с СКВ из Европы, Северной Америки и Азии [20]. 4640 из них умерли. Среди больных СКВ смертность от любых причин не зависела от расы (европеоидная или монголоидная) и пола и была примерно в 2,6 раза выше, чем в общей популяции среди людей сходного возраста и пола. Кроме того, авторы выявили увеличение смертности от заболевания почек в 4,7 раза, от сердечно-сосудистых заболеваний в 2,3 раза и от инфекций в 5,0 раз, в то время как смертность от злокачественных опухолей была сходной с таковой в общей популяции (отношение смертности 1,2).
Поражение почек относится к основным висцеральным проявлениям СКВ и наблюдается у 40% больных [21]. Примерно у каждого пятого пациента с волчаночным гломерулонефритом в течение 15 лет развивается хроническая почечная недостаточность, требующая заместительной почечной терапии, риск которой выше у больных гломерулонефритом IV класса [22]. В последние десятилетия течение волчаночного гломерулонефрита улучшилось. G. Moroni и соавт. в когортном исследовании изучали почечные исходы у 499 больных волчаночным гломерулонефритом на протяжении 50 лет [23]. В 2000-е гг. авторы выявили значительное снижение частоты почечной недостаточности на момент развития волчаночного гломерулонефрита и увеличение частоты изолированных изменений в моче (p<0,0001). Десятилетняя почечная выживаемость увеличилась с 87% в 1970-1985 гг. до 94% в 1986-2001 гг. и 99% в 20022016 гг. По данным многофакторного анализа, независимыми предикторами потребности в заместительной почечной терапии были мужской пол, артериальная гипертония, отсутствие поддерживающей иммуносупрессивной терапии, повышенный сывороточный уровень креатинина и высокий индекс активности. Значительное снижение риска развития терминальной хронической почечной недостаточности у пациентов с волчаночным гломерулонефритом было отмечено в 80-х гг. и, по-видимому, отражало широкое внедрение в клиническую практику циклофосфамида, а также улучшение контроля артериальной гипертонии и протеинурии [22]. Интересно, что начиная с середины 90-х гг., частота развития хронической почечной недостаточности, требующей заместительной почечной недостаточностью, у пациентов с СКВ стабилизировалась, а в исследованиях, проводившихся в 2000-е гг., даже несколько повысилась. Таким образом, создается впечатление, что дальнейшее совершенствование схем лечения волчаночного гломерулонефрита, включая применение ритуксимаба, не привело к улучшению почечных исходов. Однако делать такой вывод следует осторожно, так как приведенные выше данные были получены в разных когортах пациентов, которые могли быть не вполне сопоставимыми.
Риск развития сердечно-сосудистых заболеваний, в том числе инфаркта миокарда и инсульта, и сердечнососудистой смерти у пациентов с СКВ по крайней мере в 2-3 раза выше, чем в общей популяции [24]. Более значительное увеличение относительного риска сердечно-сосудистых исходов наблюдается у людей молодого возраста, хотя абсолютный риск выше у пациентов старшего возраста. В шведском исследовании у 2000 пациентов с СКВ риск развития инфаркта миокарда в течение 7 лет был в 2,3 раза выше, чем в общей популяции у людей того же пола и возраста, а у женщин в возрасте от 40 до 49 лет – в 8,7 раза выше [25]. В другом исследовании риск развития инсульта в течение 8 лет у всех пациентов с СКВ был увеличен в 2 раза, а у больных молодого возраста – в 22 раза, причем в возрасте старше 60 лет частота цереброваскулярных осложнений у обследованных пациентов существенно не отличалась от таковой в общей популяции [26]. Сходные результаты были получены и при анализе сердечно-сосудистой смертности [27]. Существенный вклад в ранний и ускоренный атерогенез у пациентов с СКВ вносят традиционные факторы риска атеросклероза, такие как артериальная гипертония, дислипидемия, ожирение и т.п., однако их наличие не позволяет в полной мере объяснить повышение риска сердечно-сосудистых осложнений у таких больных [28]. Не меньшее значение придают специфическим для СКВ факторам риска, прежде всего персистирующему воспалению, которое приводит к нарушению липидного профиля и способствуют развитию эндотелиальной дисфункции и повреждения сосудов, считающихся начальными этами атерогенеза [29]. Механизмы влияния воспаления на атерогенез сложные и до конца не изучены. Ключевую роль, вероятно, играют различные провоспалительные медиаторы, такие как интерлейкин-1b, которые повышают экспрессию молекул адгезии и усиливают нарушение функции эндотелия. Недавно в эксперименте было показано, что интерфероны I типа обладают атерогенными свойствами за счет подавления экспрессии NO-синтазы и продукции оксида азота [30]. В некоторых исследованиях показатели активности СКВ, в частности индекс SLEDAI, позволяли предсказать повышение риска сердечно-сосудистых заболеваний при последующем наблюдении [24]. Еще одним фактором, способствующим ускоренному развитию атеросклероза у пациентов с ревматическими заболеваниями, является лечение глюкокортикостероидами. Хотя эти препараты обладают выраженными противовоспалительными свойствами и, соответственно, должны подавлять атерогенез, одновременно они вызывают появление или нарастание традиционных сердечнососудистых факторов риска, таких как дислипидемия, гипергликемия, избыточная масса тела и артериальная гипертония. Подтвердить вклад глюкокортикостероидов в раннее развитие атеросклероза достаточно сложно, так как их дозы тесно коррелируют с активностью СКВ. В некоторых исследованиях лечение глюкокортикостероидами ассоциировалось с повышенным риском сердечно-сосудистых исходов [31,32], однако их неблагоприятный эффект на течение заболеваний, связанных с атеросклерозом, не был подтвержден в других исследованиях [24].
Инфекции остаются ведущей причиной смертности больных СКВ, в том числе в экономически развитых странах. В исследовании, проводившемся в США на основании анализа национальной базы данных госпитализированных пациентов, инфекционные осложнения оказались основной причиной госпитализации пациентов с СКВ (16%) и главной причиной их смерти (38%) [33]. Сходные данные были получены в Канаде, Корее и Испании [34-36]. Риск инфекций увеличивается при применении практически всех препаратов, которые используются для патогенетической терапии СКВ, в том числе глюкокортикостероидов, особенно в высоких дозах, иммуносупрессивных препаратов и генно-инженерных биологических препаратов. Единственным исключением является гидроксихлорохин, который, наоборот, дает защитный эффект [37]. Дополни тель ными факторами риска инфекционных осложнений служат пожилой возраст, активность заболевания, повреждение внутренних органов, в частности почек, сопутствующие заболевания, такие как сахарный диабет, и низкое социально-экономическое положение. Спектр инфекций, развивающихся у пациентов с СКВ, соответствует таковому в общей популяции [38]. Чаще всего встречаются бактериальные инфекции дыхательных и мочевыводящих путей, кожи и бактериемия, реже – микобактериальные и вирусные инфекции, вызванные вирусами герпеса, цитомегаловирусом и вирусом папилломы человека. Хотя оппортунистические инфекции, обусловленные грибами, Pneumocystis jirovecii и другими возбудителями, развиваются реже, они сопровождаются значительным увеличением риска смерти госпитализированных пациентов с СКВ [39]. Диагно сти ровать инфекцию у пациентов с СКВ бывает не так легко, так как лихорадка и повышение уровней воспалительных маркеров могут быть связаны с активностью заболевания. В ретроспективном исследовании у пациентов с СКВ, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ), неадекватная антимикробная терапия сопровождалась увеличением риска смерти в 12 раз [40]. Эти данные указывают на важность не только быстрой диагностики инфекций у пациентов с СКВ, получающих иммуносупрессивные препараты, но и своевременного назначения эмпирической антибиотикотерапии. Разработаны несколько индексов, позволяющих предсказать развитие тяжелых инфекций у больных СКВ, например, SLESIS (SLE Severe Infection Score) [41], однако они нуждаются в дополнительном изучении и в обычной клинической практике не используются.
Результаты мета-анализа более 40 исследований у 80833 больных СКВ показали, что это заболевание сопровождается увеличением риска любых злокачественных опухолей на 18% по сравнению с таковым в общей популяции [42]. В наибольшей степени у пациентов с СКВ был повышен риск развития неходжкинской и ходжкинской лимфом (в 3 раза), миеломы и рака печени (в 2 раза), а также опухолей шейки матки, легких, мочевого пузыря, щитовидной железы, желудка и головного мозга. В то же время риск развития других опухолей был ниже такового в общей популяции или существенно не отличался от него. Возможными причинами увеличения частоты злокачественных опухолей у пациентов с СКВ могут быть персистирующее воспаление, хроническая стимуляция иммунной системы на фоне активности болезни, хронические вирусные инфекции, традиционные факторы риска, такие как курение, и иммуносупрессивная терапия, в частности циклофосфамидом.
Риск обострений и повреждения органов и частота госпитализаций у пациентов с СКВ
У 20-30% больных СКВ отмечается стойкое сохранение воспалительной активности или, наоборот, развиваются многолетние ремиссии, которые иногда даже позволяют отменить поддерживающую иммуносупрессивную терапию. Однако в большинстве случаев течение заболевания характеризуется чередующимися ремиссиями и обострениями [43]. Повторные обострения СКВ, особенно тяжелые, с одной стороны, служат причиной частых госпитализаций и, соответственно, увеличения затрат для системы здравоохранения, а, с другой стороны, приводят к накоплению повреждения внутренних органов [44]. Ежегодно обострения СКВ наблюдаются у 65-70% больных. В большинстве случаев развиваются легкие или средне-тяжелые обострения заболевания, характеризующиеся появлением или нарастанием конституциональных симптомов, миалгий, артрита, кожных высыпаний и изменений со стороны крови. Однако риск развития тяжелых обострений у больных СКВ также высокий. Например, в исследованиях белимумаба в группах плацебо тяжелые обострения, которые оценивали по шкале BILAG, в течение года развивались почти у каждого четвертого больного СКВ (23%), а средне-тяжелые и тяжелые в целом – у каждого третьего (32%) [45]. При этом даже легкие обострения СКВ неблагоприятно сказываются на качестве жизни и работоспособности больных [46], в то время как более тяжелые обострения требуют назначения глюкокортикостероидов в высоких дозах и иммуносупрессивных препаратов, которые сами по себе могут вызывать повреждение органов и тканей.
Для оценки повреждения внутренних органов у больных СКВ используют индекс SLICC/ACR Damage Index, который рассчитают в баллах на основании анализа состояния 12 систем органов. Следует отметить, что при определении индекса повреждения учитывают любые необратимые изменения со стороны внутренних органов (соответственно, со временем индекс не может уменьшиться), которые могут быть связаны не только с СКВ, но и с проводимой терапией (например, остеопороз или катаракта при лечении глюкокортикостероидами) или сопутствующими заболеваниями (например, инфаркт миокарда или инсульт, сахарный диабет, злокачественные опухоли). В ряде исследований продемонстрирована тесная связь между более высокими значениями индекса повреждения и риском смерти больных СКВ [47]. По данным мета-анализа, увеличение индекса повреждения на 1 балл сопровождается увеличением риска смерти в 1,34 раза (95% доверительный интервал 1,24-1,44, p<0,001) [48]. M. Danila и соавт. оценили влияние повреждения различных органов на смертность у 635 больных СКВ, которых наблюдали в течение в среднем около 6 лет [49]. В течение указанного срока развитие повреждения почек наблюдалось у 19,8% пациентов, сердечно-сосудистой системы – у 9,3%, легких – у 7,8% и периферических сосудов – у 5,4%. По данным многофакторного анализа, только поражение почек было независимым предиктором летального исхода. Тяжелые и необратимые изменения внутренних органов могут иметь для больного не меньшее или даже большее клиническое значение, чем проявления активности заболевания, а накопление повреждения фактически сводит к нулю усилия ревматологов, направленные на лечение и профилактику обострений СКВ [50].
Повторные обострения СКВ и прогрессирующее повреждение внутренних органов, осложнения иммуносупрессивной терапии и сопутствующие заболевания приводят к инвалидизации пациентов и служат причиной частых визитов к врачу и госпитализаций, которые являются одним из основных факторов, определяющих высокие прямые затраты для системы здравоохранения. По данным исследования ESSENCE, которое проводилось в Российской Федерации, Казахстане и Украине, в течение года 39,2-75,5% пациентов с СКВ по крайней мере однократно обращались к ревматологу по поводу обострения заболевания, 74,1-100% – посещали других специалистов, в том числе нефрологов, кардиологов, дерматологов и неврологов, а 71,6-99,1% – госпитализировались в связи с основным заболеванием [51]. При экстраполяции полученных данных на общую популяцию авторы сделали вывод, что количество больных, которые ежегодно госпитализируются по поводу СКВ, составляет 8000 человек в России, 3000 – в Казахстане и 5000 – в Украине. В большинстве фармакоэкономических исследований затраты на стационарную помощь были основным компонентом в структуре прямых затрат на лечение СКВ [52].
В зарубежных исследованиях основными причинами госпитализации больных СКВ были обострение заболевания и инфекции, более редкими – сердечно-сосудистые и другие сопутствующие заболевания, тромбоэмболические осложнения, осложнения медикаментозной терапии и др. [53-55]. Каждый шестой пациент с СКВ нуждается в повторной госпитализации в течение первого месяца после выписки [56]. Вероятность повторных госпитализаций выше при наличии тяжелых проявлений СКВ, таких как поражение почек, тромбоцитопения, серозит и судороги, а также сопутствующих заболеваний, в том числе сердечно-сосудистых, сахарного диабета и злокачественных опухолей. Среди аутоиммунных заболеваний СКВ является одной из основных причин госпитализации в ОРИТ. По данным мета-анализа почти у 1000 пациентов с СКВ, которым потребовалась интенсивная терапия, на первом месте среди причин поступления в ОРИТ находились инфекции (40%), а на втором – проявления активности заболевания, в частности поражение легких и почек [57].
Влияние СКВ на качество жизни пациентов
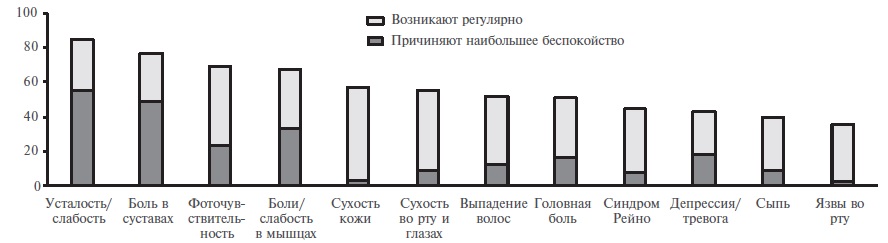
СКВ – это системное заболевание, многочисленные проявления которого ухудшают качество жизни пациентов. Для оценки последнего используют как генерические, в том числе опросники 36 Health Survey (SF-36) и EuroQol-5D (EQ-5D), так и специфические, в частности Lupus Quality of Life (LupusQoL) и Lupus PatientReported Outcome (LupusPRO), инструменты. По данным опроса 4375 пациентов с СКВ (96% женщин, медиана возраста – 45 лет, 71% представителей европеоидной расы), проживающих в 35 странах Европы, практически у всех респондентов имелись многочисленные симптомы (медиана их количества – 9), которые включали в себя усталость (85%), боли в суставах (77%), фоточувствительность (69%), боли и слабость в мышцах (68%) (рис. 3) [58]. Примерно у половины пациентов наблюдались также сухость кожи или слизистых оболочек, выпадение волос и головные боли. Наибольшее беспокойство больным причиняли усталость и слабость, боли и скованность в суставах и миалгии. Каждый шестой пациент жаловался на тревогу или депрессию, хотя антидепрессанты или анксиолитики принимали менее половины таких больных. Около 60% пациентов сообщили, что СКВ оказала негативное влияние на их карьеру, а 15% больных были вынуждены прекратить работу по медицинским причинам. Кроме того, многие пациенты отмечали по крайней мере умеренное ограничение повседневной активности и нарушение эмоциональной и сексуальной жизни и испытывали беспокойство по поводу возможного прогрессирования СКВ.
Сходные данные получили C. Gordon и соавт., которые провели онлайн опрос 2070 европейцев с СКВ (93% женщин, 87% в возрасте до 50 лет) [59]. Авторы оценивали качество жизни с помощью опросника LupusQoL, а также выраженность усталости (Fatigue Severity Scale – FSS) и нарушение работоспособности и активности (Work Productivity and Activity Impairment (WPAI)-Lupus v2.0). Более двух третей респондентов (70%) сообщили, что СКВ оказала влияние на их карьеру, а около четверти (28%) были вынуждены сменить работу в течение года после установления диагноза. При анализе качества жизни было выявлено его ухудшение по всем доменам опросника LupusQoL. Как и в предыдущем исследовании, наиболее выраженное влияние на качество жизни оказывала усталость, которая наблюдалась у 83% больных (индекс по шкале FSS ≥4). Около половины пациентов сообщили, что усталость является одним из трех наиболее важных симптомов, ухудшает мотивацию и снижает физическую функцию. СКВ оказывала также значительно влияние на работоспособность и повседневую активность пациентов. Наиболее выраженное ухудшение по всем доменам WPAI было отмечено у пациентов, жаловавшихся на усталость.
Хотя нарушение качества жизни часто сохраняется и после достижения ремиссии СКВ, что может отражать развитие необратимого повреждения органов, тем не менее, активность заболевания является одним из факторов, вызывающих более выраженное ухудшение качества жизни. В швейцарской когорте индексы физического и психического компонентов опросника SF-36 у пациентов с активной СКВ были достоверно ниже, чем у больных, у которых признаки активности отсутствовали, причем оба индекса имели негативную корреляцию со счетом SELENA-SLEDAI [60]. Недавно были опубликованы результаты систематизированного обзора и мета-анализа 40 исследований, в которых изучалось влияние активности и повреждения органов на качество жизни (опросники SF-36, EQ-5D, LupusQoL и LupusPRO) у 6079 взрослых пациентов с СКВ [61]. Авторы выявили отрицательную корреляцию между показателями активности СКВ и различными доменами опросников SF-36 и LupusPRO, хотя эта связь была умеренной, учитывая сравнительно невысокие значения коэффициентов корреляции. Нараста ю щее повреждение органов также сопровождалось умеренным ухудшением качества жизни, которое оценивали с помощью тех же опросников. Активность заболевания и повреждение органов в большей степени отражались на физическом, а не психическом состоянии больных. Следует отметить, что в мета-анализ включали исследования, проводившиеся в разных географических регионах, включая Европу, Америку, Африку и Азию, что могло отразиться на общих результатах оценки качества жизни, учитывая различия социально-экономического положения пациентов и качества медицинской помощи.
Можно ли уменьшить клиническое и экономическое бремя СКВ?
СКВ представляет большое бремя для системы здравоохранения и общества в целом, учитывая увеличение распространенности заболевания, развитие его в трудоспособном возрасте, рецидивирующее течение, прогрессирующее повреждение органов, высокую потребность в дорогостоящей медицинской помощи, ухудшение трудоспособности и качества жизни и т.д. Основные цели лечения СКВ – подавление активности заболевания и профилактика обострений, хотя для улучшения отдаленных исходов не меньшее значение имеют предупреждение прогрессирующего повреждения органов, например, путем ограничения приема глюкортикостероидов, профилактика и лечение инфекционных осложнений, адекватный контроль сердечнососудистых факторов риска, нефропротективная терапия. В соответствии с рекомендациями EULAR 2019 г. лечение СКВ должно быть направлено на достижение полной ремиссии (отсутствие клинической активности на фоне приема только гидроксихлорохина) или по крайней мере низкой активности (SLEDAI≤4 при приеме гидроксихлорохина, преднизолона в дозе ≤7,5 мг/сут и/или хорошо переносимых иммуносупрессивных препаратов в стабильных дозах) [62]. Последняя цель является более реальной в клинической практике. Например, в американской когорте пациентов с СКВ низкая активность заболевания при повторных визитах определялась примерно в половине случаев, в то время как ремиссия была достигнута только у 27% больных [63]. По данным систематизированного обзора клинических исследований, подавление активности СКВ сопровождалось улучшением исходов заболевания, в том числе снижением смертности, риска обострений, повреждения органов, частоты госпитализаций и затрат и улучшением качества жизни, хотя авторам не удалось провести мета-анализ полученных данных, учитывая вариабельность использованных критериев оценки низкой активности и ремиссии в разных исследованиях [64]. Улучшение исходов отмечалось даже при непродолжительном снижении активности СКВ, однако более выраженный положительный эффект наблюдался при стойком сохранении низкой активности или ремиссии.
Для патогенетической терапии СКВ сегодня ис пользуют широкий спектр препаратов, в том числе глюкокортикостероиды, гидроксихлорохин, иммуносупрессивные средства (метотрексат, азатиоприн, ингибиторы кальциневрина, микофенолата мофетил, циклофосфамид) и генно-инженерные биологические препараты (ритуксимаб, белимумаб) [62]. Перспек тив ными считаются также блокаторы рецепторов интерферона I типа. Тем не менее, основой лечения по-прежнему остаются глюкокортикостероиды, хотя еще 70 лет назад Е.М. Тареев и В.А. Насонова обращали внимание на ограничения препаратов этой группы:"В период генерализации волчанки ... гормоны являются единственным надежным методом. Как правило, однако, гормональная терапия, к сожалению, подавляет на какой-то срок некоторые общие симптомы ... Больные "прикованы" к постели и гормонам. Назначение таким больным высоких доз гормонов является своего рода "терапией отчаяния" [65]. По данным опроса около 4300 европейцев с СКВ, более половины из них принимали глюкокортикостероиды, хотя дозы препаратов в большинстве случаев были сравнительно небольшими и составляли <5 мг/сут или 5-15 мг/сут в пересчете на преднизолон [58]. Однако в других исследованиях частота применения глюкокортикостероидов у пациентов с СКВ была существенно выше. Глюкокортикостероиды быстро подавляют активность СКВ, однако их длительный прием вызывает повреждение органов (катаракта, аваскулярный некроз и т.д.), повышает риск развития и более тяжелого течения инфекционных осложнений, включая COVID-19, способствует нарастанию сердечно-сосудистых факторов риска. Неблагоприятные эффекты глюкокортикостероидов более выражены при их применении в средних и высоких дозах, однако они наблюдаются и при лечении низкими дозами этих препаратов [66,67].
Чтобы ограничить нежелательные последствия терапии глюкокортикостероидами, эксперты EULAR рекомендуют стремиться к полной их отмене или по крайней мере снижению дозы до 7,5 мг и менее в пересчете на преднизолон, в частности путем раннего назначения иммуносупрессивных препаратов [62]. У пациентов с волчаночным гломерулонефритом, достигших полного почечного ответа (протеинурия <0,5-0,7 г/сут), деэскалацию терапии рекомендуется начинать со снижения доз глюкокортикостероидов [21]. Всем больным СКВ следует также назначать гидроксихлорохин, который дает многочисленные благоприятные эффекты при этом заболевании [68]. Важное значение для улучшения отдаленных исходов имеет снижение токсичности cовременных схем иммуносупрессивной терапии. Например, для индукционной терапии волчаночного гломерулонефрита вместо циклофосфамида в высокой дозе, который обладает выраженной кумулятивной токсичностью, сегодня применяют циклофосфамид в низкой дозе (500 мг внутривенно каждые 2 недели) или микофенолата мофетил [21].
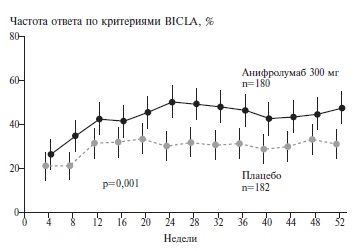
Чтобы повысить эффективность лечения у больных со средне-тяжелым или тяжелым течением СКВ и одновременно ограничить дозы глюкокортикосте роидов, целесообразно применять препараты, которые обладают иммуносупрессивной и противовоспалительной активностью и оказывают стероидосберегающее действие. Изучение роли интерферонов (ИФН) I типа (α и β) в патогенезе СКВ послужило основанием для разработки препаратов, блокирующих рецепторы этих цитокинов [69]. Одним из них является анифролумаб – человеческое моноклональное антитело, взаимодействующее с субъединицей 1 ИФН рецепторов и подавляющее эффекты всех ИФН 1 типа. В рандомизированном клиническом исследовании 3 фазы (TULIP-2) применение анифролумаба по сравнению с плацебо в дополнение к стандартной терапии у больных среднетяжелой или тяжелой СКВ привело к значительному увеличению частоты ответа (с 30,7% до 48,0%; р=0,002) (рис. 4) и доли больных, у которых доза глюкокортикостероидов была снижена до целевой (с 30,2% до 51,5%; р=0,01) [70].
Одной из основных причин госпитализаций, в том числе в ОРИТ, и смертности больных СКВ являются инфекции. Полностью избежать инфекционных осложнений на фоне иммуносупрессивной терапии у пациентов с ревматическими заболеваниями невозможно, однако некоторые из них (например, грипп и пневмококковую инфекцию) можно предупредить с помощью вакцинации [71]. Инактивированные вакцины можно вводить всем больным, даже на фоне иммуносупрессии, хотя вакцинацию предпочтительно проводить до начала иммуносупрессивной терапии. Лечение иммуносупрессивными препаратами, особенно глюкокортикостероидами в дозе ≥10 мг/сут и ритуксимабом, ухудшает течение COVID-19 [72]. Данные об эффективности и безопасности вакцин против новой коронавирусной инфекции у пациентов с СКВ ограничены, однако профессиональные общества, включая Ассоциацию ревматологов России, рекомендуют вакцинацию больным с ревматическими заболеваниями [72]. При онлайн опросе более 150 пациентов с различными ревматическими болезнями, включая СКВ, мы не выявили увеличения частоты нежелательных эффектов при введении вакцины Спутник V по сравнению с контролем, хотя у небольшой части пациентов отмечалось ухудшение симптомов заболевания после вакцинации.
Ключевое значение для профилактики сердечнососудистых осложнений у пациентов с СКВ имеют подавление активности заболевания, ограничение приема глюкокортикостероидов и контроль традиционных факторов риска, таких как артериальная гипертония, дислипидемия, избыточная масса тела и курение.
Высказано предположение, что можно рассматривать СКВ как "эквивалент" коронарной болезни сердца и проводить таким больным более агрессивную профилактику сердечно-сосудистых болезней, предполагающую более низкие целевые уровни липидов и назначение аспирина даже при отсутствии признаков атеросклероза [73]. При оценке целесообразности широкого применения аспирина с целью первичной профилактики следует учитывать, что у молодых пациенток с СКВ абсолютный риск сердечно-сосудистых осложнений остается относительно невысоким, поэтому возможная польза антиагреганта может нивелироваться увеличением частоты геморрагических осложнений. В то же время применение аспирина для первичной профилактики может быть оправданным у части пациентов с СКВ, у которых определяются антифосфолипидные антитела.
В рандомизированных контролируемых исследованиях лечение статинами по сравнению с плацебо не влияло на развитие субклинического атеросклероза у пациентов с СКВ [74,75], поэтому назначать препараты этой группы следует с учетом стандартных показаний, в том числе 10-летнего риска сердечно-сосудистых исходов, который оценивают с помощью индекса SCORE [62].
Заключение
За последние десятилетия возможности лечения СКВ расширились, а выживаемость больных значительно увеличилась, однако бремя болезни остается большим, что объясняется разными причинами, включая увеличение распространенности заболевания, рецидивирующее его течение, возможность стойкого сохранения воспалительной активности, постепенное накопление повреждения органов, в том числе за счет сопутствующих заболеваний и терапии глюкокортикостероидами, частые госпитализации, высокие прямые и непрямые затраты, ухудшение трудоспособности и качества жизни больных. Для уменьшения бремени СКВ необходимо дальнейшее повышение эффективности и безопасности противовоспалительной/иммуносупрессивной терапии, в частности путем применения препаратов, обладающих стероидосберегающей активностью, в том числе новых, таких как ингибиторы рецепторов ИФН 1 типа. Не менее важное значение имеют эффективное лечение и профилактика инфекций и сердечно-сосудистых заболеваний, которые являются одними из основных причин госпитализаций и смертности больных СКВ.
Используемые источники
- Остапенко В.М. Из истории изучения системной красной волчанки (вклад академика Е.М. Тареева и его клинической школы). Научно-практическая ревматология 2004;1:94-7.
- Rees F, Doherty M, Grainge MJ, et al. The worldwide incidence and prevalence of systemic lupus erythematosus: a systematic review of epidemiological studies. Rheumatology 2017;56:1945-61.
- Barber M, Drenkard C, Falasinnu T, et al. Global epidemiology of systemic lupus erythematosus. Nat Rev Rheumatol 2021;17:515-32.
- Ungprasert P, Sagar V, Crowson CS. et al. Incidence of systemic lupus erythematosus in a population-based cohort using revised 1997 American College of Rheumatology and the 2012 Systemic Lupus International Collaborating Clinics classification criteria. Lupus 2017;26:240–7.
- Aringer M, Costenbader K, Daikh Dб et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis 2019;78:1151–9.
- Li S, Gong T, Peng Y, Nieman KM, Gilbertson DT. Prevalence and incidence of systemic lupus erythematosus and associated outcomes in the 2009-2016 US Medicare population. Lupus 2020;29(1):15-26.
- Somers EC, Marder W, Cagnoli P, et al. Population-based incidence and prevalence of systemic lupus erythematosus: the Michigan Lupus Epidemiology and Surveillance program. Arthritis Rheumatol 2014;66(2):369-78.
- Lim SS, Bayakly AR, Helmick CG, et al. The incidence and prevalence of systemic lupus erythematosus, 2002-2004: The Georgia Lupus Registry. Arthritis Rheumatol 2014;66(2):357-68.
- Dall'Era M, Cisternas MG, Snipes K, et al. The incidence and prevalence of systemic lupus erythematosus in San Francisco County, California: the California Lupus Surveillance Project. Arthritis Rheumatol 2017;69(10):1996-2005.
- Rees F, Doherty M, Grainge M, et al. The incidence and prevalence of systemic lupus erythematosus in the UK, 1999-2012. Ann Rheum Dis 2016;75(1):136-41.
- Arnaud L, Fagot JP, Mathian A, et al. Prevalence and incidence of systemic lupus erythematosus in France: a 2010 nation-wide population-based study. Autoimmun Rev 2014;13(11):1082-9.
- Hermansen ML, Lindhardsen J, Torp-Pedersen C, et al. Incidence of systemic lupus erythematosus and lupus nephritis in Denmark: A nationwide cohort study.J Rheumatol 2016;43(7):1335-9.
- Otsa K, Talli S, Harding P, et al. Prevalence and incidence of systemic lupus erythematosus in the adult population of Estonia. Lupus 2017;26(10):1115-20.
- Fatoye F, Gebrye T, Svenson LW. Real-world incidence and prevalence of systemic lupus erythematosus in Alberta, Canada. Rheumatol Int 2018;38(9):1721-6.
- Chiu YM, Lai CH. Nationwide population-based epidemiologic study of systemic lupus erythematosus in Taiwan. Lupus 2010;19(10):1250-5.
- Shim JS, Sung YK, Joo YB, et al. Prevalence and incidence of systemic lupus erythematosus in South Korea. Rheumatol Int 2014;34(7):909-17.
- Tektonidou MG, Lewandowski LB, Hu J, et al. Survival in adults and children with systemic lupus erythematosus: a systematic review and Bayesian meta-analysis of studies from 1950 to 2016. Ann Rheum Dis 2017; 76(12):2009-16.
- Scherlinger M, Mertz P, Sagez F, et al. Worldwide trends in all-cause mortality of auto-immune systemic diseases between 2001 and 2014. Autoimmun Rev 2020;19(6):102531.
- Yen EY, Singh RR. Brief Report: Lupus – an unrecognized leading cause of death in young females: A population-based study using nationwide death certificates, 2000-2015. Arthritis Rheumatol 2018;70(8):1251-5.
- Lee YH, Choi SJ, Ji JD, Song GG. Overall and cause-specific mortality in systemic lupus erythematosus: an updated meta-analysis. Lupus 2016;25(7):727-34.
- Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal AssociationEuropean Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020;79(6):713-23.
- Tektonidou MG, Dasgupta A, Ward MM. Risk of end-stage renal disease in patients with lupus nephritis, 1971-2015: a systematic review and Bayesian metaanalysis. Arthritis Rheumatol 2016;68:1432–41.
- Moroni G, Vercelloni PG, Quaglini S, et al. Changing patterns in clinical-histological presentation and renal outcome over the last five decades in a cohort of 499 patients with lupus nephritis. Ann Rheum Dis 2018;77:1318–25.
- Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum 2013;43:77–95.
- Bengtsson C, Ohman ML, Nived O, Rantapaa Dahlqvist S. Cardiovascular eventin systemic lupus erythematosus in northern Sweden — incidence and predictors in a 7-year follow up study. Lupus 2012;21:452–9.
- Mok CC, Ho LY, To CH. Annual incidence and standardized incidence ratio ofcerebrovascular accidents in patients with systemic lupus erythematosus. Scand J Rheumatol 2009;385:362–8.
- Bjornadal L, Yin L, Granath F, Klareskog L, Ekbom A. Cardiovascular disease ahazard despite improved prognosis in patients with systemic lupus erythematosus:results from a Swedish population based study 1964–95. J Rheumatol 2004; 314:713–9.
- Esdaile JM, Abrahamowicz M, Grodzicky T, et al. Traditional Framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus. Arthritis Rheum 2001;44(10):2331-7.
- Reiss AB, Jacob B, Ahmed S, et al. Understanding accelerated atherosclerosis in systemic lupus erythematosus: toward better treatment and prevention. Inflammation 2021;44(5):1663-82.
- Buie JJ, Renaud LL, Muise-Helmericks R, Oates JC. IFN-a negatively regulates the expression of endothelial nitric oxide synthase and nitric oxide production: implications for systemic lupus erythematosus. J Immunol 2017;199(6):1979-88.
- Petri M, Perez-Gutthann S, Spence D, Hochberg MC. Risk factors for coronaryartery disease in patients with systemic lupus erythematosus. Am J Med 1992; 935:513–9.
- Nikpour M, Urowitz MB, Ibanez D, et al. Importance of cumulative exposure to elevated cholesterol and blood pressure in development of atherosclerotic coronary artery disease in systemic lupus erythematosus: a prospective proof-of-concept cohort study. Arthritis Res Ther 2011;135:R156.
- Dhital R, Pandey RK, Poudel DR, et al. All-cause hospitalizations and mortality in systemic lupus erythematosus in the US: results from a national inpatient database. Rheumatol Int 2020;40(3):393-7.
- Lee J, Dhillon N, Pope J. All-cause hospitalizations in systemic lupus erythematosus from a large Canadian referral centre. Rheumatology (Oxford) 2013; 52(5):905–9.
- Lee JW, Park DJ, Kang JH, et al. The rate of and risk factors for frequent hospitalization in systemic lupus erythematosus: results from the Korean lupus network registry. Lupus 2016;25(13):1412–9.
- da Rosa GP, Ortega MF, Teixeira A, et al. Causes and factors related to hospitalizations in patients with systemic lupus erythematosus:analysis of a 20-year period (1995–2015) from a single referral centre in Catalonia. Lupus 2019;28(9):1158–66.
- Yuan Q, Xing X, Lu Z, Li X. Clinical characteristics and risk factors of infection in patients with systemic lupus erythematosus: A systematic review and metaanalysis of observational studies. Semin Arthritis Rheum 2020;50(5):1022-39.
- Barber MRW, Clarke AE. Systemic lupus erythematosus and risk of infection. Expert Rev Clin Immunol 2020;16(5):527-38.
- Tektonidou MG, Wang Z, Dasgupta A, et al. Burden of serious infections in adults with systemic lupus erythematosus: A national population-based study, 1996-2011. Arthritis Care Res 2015;67(8):1078–85.
- Feng PH, Lin SM, Yu CT, et al. Inadequate antimicrobial treatmentfor nosocomial infection is a mortality risk factor for systemic lupus erythematous patients admitted to intensive care unit. Am J Med Sci 2010;340:64–8.
- Tejera Segura B, Rua-Figueroa I, et al. Can we validate a clinical score to predict the risk of severe infection in patients with systemic lupus erythematosus? A longitudinal retrospective study in a British Cohort. BMJ Open 2019;9(6):e028697.
- Clarke AE, Pooley N, Marjenberg Z, et al. Risk of malignancy in patients with systemic lupus erythematosus: Systematic review and meta-analysis. Semin Arthritis Rheum 2021;51(6):1230-41.
- Tselios K, Gladman DD, Touma Z, Su J, et al. Disease course patterns in systemic lupus erythematosus. Lupus 2019;28(1):114-22.
- Thanou A, Jupe E, Purushothaman M, et al. Clinical disease activity and flare in SLE: Current concepts and novel biomarkers. J Autoimmun 2021;119:102615.
- Petri MA, van Vollenhoven RF, Buyon J, et al; BLISS-52 and BLISS-76 Study Groups. Baseline predictors of systemic lupus erythematosus flares: data from the combined placebo groups in the phase III belimumab trials. Arthritis Rheum 2013;65(8):2143-53.
- Drenkard C, Bao G, Dennis G, et al. Burden of systemic lupus erythematosus on employment and work productivity: data from a large cohort in the southeastern United States. Arthritis Care Res (Hoboken) 2014;66(6):878-87.
- Nived O, Jonsen A, Bengtsson AA, et al. High predictive value of the Systemic Lupus International Collaborating Clinics/American College of Rheumatology damage index for survival in systemic lupus erythematosus. J Rheumatol 2002;29(7):1398-400.
- Murimi-Worstell IB, Lin DH, Nab H, et al. Association between organ damage and mortality in systemic lupus erythematosus: a systematic review and metaanalysis. BMJ Open 2020;10(5):e031850.
- Danila MI, Pons-Estel GJ, Zhang J, et al. Renal damage is the most important predictor of mortality within the damage index: data from LUMINA LXIV, a multiethnic US cohort. Rheumatology (Oxford) 2009;48(5):542-5.
- Соловьева Е.С., Асеева Е.А., Лисицына Т.А. и др. Необратимые органные повреждения у больных СКВ. Индекс повреждения SLICC. Современная ревматология 2016;10(1):56–62 [Solovyevа ES, Aseeva EA, Lisitsyna TA, et al. Irreversible organ damages in patients with systemic lupus erythematosus. SLICC damage index. Sovremennaya Revmatologiya=Modern Rheumatology Journal. 2016;10(1):56–62 (In Russ.)].
- Nasonov E, Soloviev S, Davidson JE, et al. Systemic lupus erythematosus and associated healthcare resource consumption in selected cities from the Russian Federation, Republic of Kazakhstan and Ukraine: the ESSENCE study. J Med Econ 2018;21(10):1006-15.
- Zhu TY, Tam LS, Li EK. Cost-of-illness studies in systemic lupus erythematosus: A systematic review. Arthritis Care Res (Hoboken) 2011;63(5):751-60.
- Thorburn CM, Ward MM. Hospitalizations for coronary artery disease among patients with systemic lupus erythematosus. Arthritis Rheum 2003;48(9):2519–23.
- Edwards CJ, Lian TY, Badsha H, Teh CL, et al. Hospitalization of individuals with systemic lupus erythematosus: characteristics and predictors of outcome. Lupus 2003;12(9):672-6.
- Lee J, Dhillon N, Pope J. All-cause hospitalizations in systemic lupus erythematosus from a large Canadian referral centre. Rheumatology (Oxford) 2013; 52(5):905-9.
- Yazdany J, Marafino BJ, Dean ML, et al. Thirty-day hospital readmissions in systemic lupus erythematosus: predictors and hospital- and state-level variation. Arthritis Rheumatol 2014;66(10):2828-36.
- Suárez-Avellaneda A, Quintana JH, Aragón CC, et al. Systemic lupus erythematosus in the intensive care unit: a systematic review. Lupus 2020;29(11):1364-76.
- Cornet A, Andersen J, Myllys K, et al. Living with systemic lupus erythematosus in 2020: a European patient survey. Lupus Sci Med 2021;8(1):e000469.
- Gordon C, Isenberg D, Lerstrњm K, et al. The substantial burden of systemic lupus erythematosus on the productivity and careers of patients: a European patient-driven online survey. Rheumatology 2013;52:2292-301.
- Chaigne B, Chizzolini C, Perneger T, et al. Impact of disease activity on healthrelated quality of life in systemic lupus erythematosus – a cross-sectional analysis of the Swiss Systemic Lupus Erythematosus Cohort Study (SSCS). BMC Immunology 2017;18:17.
- Shi Y, Li M, Liu L, et al. Relationship between disease activity, organ damage and health-related quality of life in patients with systemic lupus erythematosus: A systemic review and meta-analysis. Autoimm Rev 2021;20: 102691.
- Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019;78:736–745.
- Babaoglu H, Li J, Goldman D, et al. Time to lupus low disease activity state in the Hopkins Lupus Cohort: role of African American ethnicity. Arthritis Care Res (Hoboken) 2020;72:225–32.
- Ugarte-Gil MF, Mendoza-Pinto C, ReЗtegui-Sokolova C, et al. Achieving remission or low disease activity is associated with better outcomes in patients with systemic lupus erythematosus: a systematic literature review. Lupus Sci Med 2021;8:e000542.
- Тареев Е.М., Насонова В.А. Место стероидных гормонов в комплексном лечении так называемых больших коллагенозов. Сов мед 1960;12:3-12.
- Al Sawah S, Zhang X, Zhu B, et al. Effect of corticosteroid use by dose on the risk of developing organ damage over time in systemic lupus erythematosus – the Hopkins Lupus Cohort. Lupus Sci Med 2015;2:e000066.
- Ruiz-Arruza I, Barbosa C, Ugarte A, et al. Comparison of high versus low–medium prednisone doses for the treatment of systemic lupus erythematosus patients with high activity at diagnosis. Autoimmun Rev 2015;14:875–9.
- Ruiz-Irastorza G, Ramos-Casals M, Brito-Zeron P, et al. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis 2010;69:20–8.
- Bengtsson AA, RЪnnblom L. Role of interferons in SLE. Best Pract Res Clin Rheumatol 2017;31(3):415-28.
- Morand EF, Furie R, Tanaka Y, et al.; TULIP-2 Trial Investigators. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med 2020; 382(3):211-21
- Furer V, Rondaan C, Heijstek MW, et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 2020;79(1):39-52.
- Gianfrancesco M, Hyrich KL, Al-Adely S, et al. Characteristics associated with hospitalisation for COVID-19 in people with rheumatic disease: data from the COVID-19 global rheumatology alliance physician-reported registry. Ann Rheum Dis 2020;79:859–66.
- Насонов Е.Л., Лила А.М., Мазуров В.И. и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания. Рекомендации Общероссийской общественной организации “Ассоциация ревматологов России”. Научно-практическая ревматология 2021;59(3):239-54 [Nasonov EL, Lila AM, Mazurov VI, et al. Coronavirus Disease 2019 (COVID19) and Immune-mediated Rheumatic Diseases. Recommendations of the Association of Rheumatologists of Russia. Rheumatology Science and Practice 2021;59(3):239-54 (In Russ.)].
- Bruce IN. Cardiovascular disease in lupus patients: should all patients betreated with statins and aspirin? Best Pract Res Clin Rheumatol 2005;195:823–38.
- Petri MA, Kiani AN, Post W, et al. Lupus atherosclerosis prevention study (LAPS). Ann Rheum Dis 2011;70:760–5.
- Schanberg L, Sandborg C, Barnhart H, et al. Use of atorvastatin in systemic lupus erythematosus in children and adolescents. Arthritis Rheum 2012;64:285–96.
