Факторы, уменьшающие нефротоксичность анти-VEGF противоопухолевых препаратов
Одним из лимитирующих факторов длительной терапии анти-VEGF препаратами является нефротоксичность. Определение факторов, снижающих риск нефротоксичности, позволит проводить профилактику нежелательных явлений и избежать преждевременной отмены препаратов вследствие токсичности.
Оценить факторы, влияющие на риск нефротоксичности анти-VEGF препаратов.
В исследование были включены 50 пациентов, получавших антиVEGF препараты в составе противоопухолевой химиотерапии. Оценивали демографические показатели, индекс массы тела, АД, тип антиангиогенного препарата, сопроводительную терапию. До начала лечения и в течение 8 недель определяли уровень гемоглобина, тромбоцитов, шистоцитов, D-димера, ЛДГ, креатинина, суточную протеинурию и расчетную скорость клубочковой фильтрации (СКФ). Для оценки факторов риска нефротоксичности проводили логистический регрессионный анализ
Снижение СКФ, рассчитанной по формуле СKD-EPI, менее 60 мл/мин/1,73 м2 через 8 недель после начала лечения отмечено у 21 (42%) больных. Формулы Кокрофта-Голта и MDRD были менее информативными в оценке нефротоксичности. Факторами риска снижения СКФ через 8 недель были исходное снижение СКФ менее 80 мл/мин/1,73 м2 и артериальная гипертония, а отмены анти-VEGF препарата вследствие нефротоксичности в отдаленном периоде – женский пол и прогрессирующее снижение СКФ. Напротив, благоприятными факторами оказались коррекция артериальной гипертонии с достижением целевых показателей и нормальный уровень Dдимера в течение всего времени наблюдения.
Для снижения риска нефротоксичности анти-VEGF препаратов необходима коррекция АД с достижением целевых показателей не более 130/80 мм рт ст. Контроль СКФ в процессе лечения целесообразно производить по формулам CKD-EPI или MDRD, особенно у пациентов с исходным снижением СКФ менее 80 мл мин/1,73 м2.
Таргетные противоопухолевые препараты препараты, в том числе анти-VEGF, обладают высокой противоопухолевой активностью и позволяют существенно улучшить выживаемость пациентов со злокачественными новообразованиями, однако их применение связано с развитием некоторых серьезных нежелательных явлений, в том числе нефротоксичности [1,2].
Роль эндотелиального фактора роста (VEGF) как проангиогенного фактора, ответственного за неоангиогенез, достаточно хорошо изучена в экспериментальных и клинических исследованиях [3]. Терапия антиVEGF, приводящая к снижению уровня свободного VEGF или ингибированию его рецепторов, может вызывать нарушение трофики и функции гломерулярных эпителиальных клеток (подоцитов) и эндотелия капилляров, что клинически проявляется протеинурией, артериальной гипертонией и почечной дисфункцией [4-6]. Описаны случаи острого почечного повреждения при приеме анти-VEGF препаратов [7,8]. Кроме того, возможно постепенное, но необратимое снижение почечной функции вплоть до терминальной хронической болезни почек (ХБП) [9]. Признаки нефротоксичности могут варьироваться от бессимптомной протеинурии до выраженного снижения функции почек с тяжелой артериальной гипертонией, а их своевременное выявление и профилактика имеют важное значение для определения оптимальной тактики ведения. Оценка риска повреждения почек и выявление факторов, ослабляющих нефротоксичность анти-VEGF препаратов, позволяют улучшить результаты терапии и продлить сроки эффективного лечения [10].
Целью нашего исследования было оценить факторы, снижающие риск нефротоксичности анти-VEGF препаратов, у пациентов, получающих химиотерапию по поводу метастатических опухолей различной локализации.
Материал и методы
В проспективное исследование включали пациентов, получавших терапию внутривенными антиангиогенными препаратами (афлиберцептом, бевацизумабом, рамуцирумабом) по поводу злокачественных новообразований различной локализации. Критерием исключения было исходное снижение СКФ, рассчитанной по формуле CKD-EPI, менее 60 мл/мин/1,73 м2.
Регистрировали пол, возраст больных, индекс массы тела, наличие артериальной гипертонии до лечения, АД, антиангиогенный препарат, прием антикоагулянтов (низкомолекулярный гепарин, ингибиторы Xa фактора), нестероидных противовоспалительных и антигипертензивных средств на момент назначения анти-VEGF препаратов. Целевыми показателями артериального давления считали 130/80 мм рт. ст. и ниже. Среди лабораторных параметров оценивали содержание гемоглобина, количество тромбоцитов и шистоцитов, уровень D-димера, лактатдегидрогеназы (ЛДГ) сыворотки крови, суточную альбуминурию и содержание креатинина сыворотки крови. Скорость клубочковой фильтрации (СКФ) рассчитывали по формулам CKD-EPI, MDRD и Кокрофта-Голта. Лабораторные показатели оценивали исходно и в конце 1, 2, 4 и 8-й недели лечения. Критерием нефротоксичности (первичная конечная точка) служило снижение СКФ менее 60 мл/мин/1,73м2 через 8 недель. Кроме того, в течение 9 мес определяли частоту развития протеинурии более 1 г/сут и/или снижения СКФ менее 30 мл/мин/1,73 м2, а также частоту других осложнений терапии – тромбозов, кровотечений, неконтролируемой артериальной гипертонии, потребовавших отмены препарата.
Статистический анализ проводили с помощью программы Jamovi (версия 2.2.0). При анализе выборки в связи с ненормальным распределением показателей для статистической обработки использовали непараметрический критерий Фридмана и критерий Манна-Уитни. Для попарного анализа выборок применяли критерий Дарбина-Коновера. Для оценки факторов риска нефротоксичности выполнили логистический регрессионный анализ с включением следующих факторов – возраст, пол, индекс массы тела, наличие сопутствующих сердечно-сосудистых заболеваний (инфаркт миокарда, стенокардия, нарушение мозгового кровообращения, артериальная гипертония), сахарного диабета, курения, прием нестероидных противовоспалительных препаратов и антикоагулянтов, тип антиангиогенного препарата, расчетная СКФ до лечения, а также достижение целевых показателей АД и нормального уровня D-димера и мочевой кислоты. Проведено сравнение чувствительности применения формул рассчета СКФ (CKD-EPI, MDRD и Кокрофта-Голта) для выявления нефротоксичности препаратов. Оценивали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ). Стати стически значимыми считали показатели с уровнем значимости р<0,05.
| Показатели | Значение |
|---|---|
| Возраст, лет | 46 (24–80) |
| Женщины, n (%) | 28 (56) |
| Локализация злокачественной опухоли, n (%) | |
| Желудок | 4 (8) |
| Ободочная кишка | 14 (28) |
| Ректосигмоидное соединение | 6 (12) |
| Прямая кишка | 6 (12) |
| Молочная железа | 10 (20) |
| Яичник | 10 (20) |
| Индекс массы тела, кг/м2 | 27,3 (16,4–40,3) |
| Курение, n (%): | 9 (18) |
| Сопутствующие заболевания, n (%) | |
| Инсульт в анамнезе | 1 (2) |
| Инфаркт миокарда в анамнезе | 2 (4) |
| ИБС | 14 (28) |
| Артериальная гипертония | 15 (30) |
| Сахарный диабет | 6 (12) |
| Режим химиотерапии, n (%) | |
| Монотерапия | 17 (34) |
| Полихимиотерапия | 33 (66) |
| 5-фторурацил + иринотекан | 14 (28) |
| иринотекан | 7 (14) |
| капецитабин | 7 (14) |
| паклитаксел | 3 (6) |
| эрибулин | |
| 2 (4) | |
| Антиангиогенный препарат, n (%) | |
| Афлиберцепт | 10 (20) |
| Бевацизумаб | 29 (58) |
| Рамуцирумаб | 11 (22) |
| Антигипертензивные препараты, n (%) | 15 (30) |
| Ингибиторы АПФ | 5 (10) |
| БРА | 7 (14) |
| Бета-адреноблокаторы | 1 (2) |
| Диуретики | 2 (4) |
| Анальгетики, n (%) | 12 (24) |
| Парацетамол | 3 (6) |
| Ибупрофен | 2 (4) |
| Нимесулид | 2 (4) |
| Трамадол | 2 (4) |
| Фентанил | 3 (6) |
| Антикоагулянты, n (%) | 13 (26) |
| Низкомолекулярные гепарины | 6 (12) |
| Ингибиторы Ха фактора | 7 (14) |
Результаты
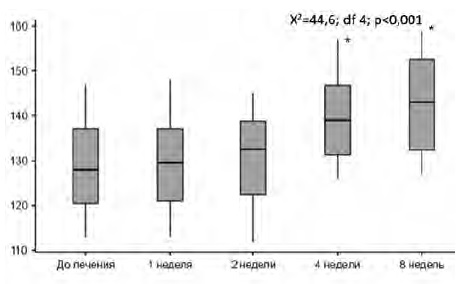
В исследование были включены 50 пациентов со злокачественными опухолями, получавших терапию внутривенными антиангиогенными препаратами (табл. 1). Артериальная гипертония (>130/80 мм рт. ст.) развилась у 26 (52%) из 50 пациентов. Медиана систолического АД во всей выборке пациентов составила 128 [120-137] мм рт. ст. до начала терапии и 143 [132-153] мм рт. ст. через 8 недель, при этом статистически значимое повышение АД отмечено уже через 4 недели от начала терапии (p<0,001) (рис. 1).
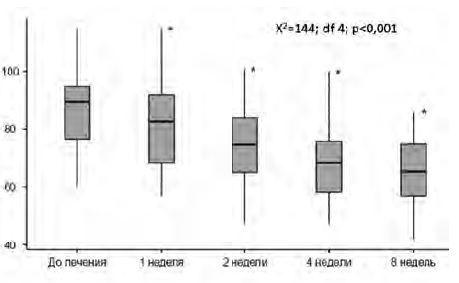
Снижение СКФ, рассчитанной по формуле СKDEPI, менее 60 мл/мин/1,73 м2 через 8 недель отмечено у 21 (42%) больных. Медиана СКФ составила 90 [76; 95] мл/мин/1,73 м2 до начала лечения и 65 [57; 74] мл/мин/1,73 м2 через 8 недель. При этом статистически значимое снижение СКФСKD-EPI отмечено уже через 1 неделю от начала терапии (p<0,001) (рис. 2). Нефро токсичность достоверно не зависела от применения конкретного антиангиогенного препарата или их комбинаций с другими химиотерапевтическими схемами. При сопоставлении медианы СКФ через 8 недель в группах пациентов, получавших и не получавших антикоагулянтную терапию, статистически значимых отличий получено не было (p=0,793). Медиана СКФ через 8 недель также не отличалась между группами пациентов, получавших и не получавших терапию антигипертензивными препаратами (p=0,958).
Снижение СКФ, рассчитанной по формулам Кокрофта-Голта и MDRD, через 8 недель выявлено у 6 (12%) и 19 (38%) из 50 пациентов, соответственно. Следовательно, при использовании формулы Кок рофта-Голта развитие нефротоксичности через 8 недель было пропущено у 71% пациентов, MDRD – у 9%.
Во время лечения отмечено постепенное увеличение суточной альбуминурии, медиана которой составила исходно 15 [10; 31] мг/сут, через 2 недели – 41 [20; 35] мг/сут и через 8 недель – 50 [35; 100] мг/сут.
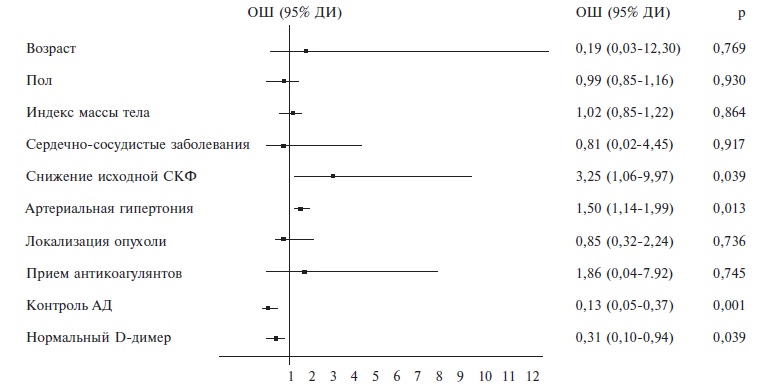
По данным логистического регрессионного анализа, факторами риска снижения СКФ менее 60 мл/мин/1,73 м2 через 8 недель были исходное значение СКФ менее 80 мл/мин/1,73 м2 и сохранение повышенного АД. В то же время достижение целевых значений АД и сохранение нормального уровня D-димера ассоциировались со стабильными значениями СКФ при лечении антиангиогенными препаратами (ОШ 0,13, 95% ДИ 0,050,37, p=0,0001, и ОШ 0,31, 95% ДИ 0,10-0,94, p=0,039, соответственно; рис. 3).
Анти-VEGF препараты были отменены у всех пациентов в течение 9 месяцев наблюдения, в том числе изза нефротоксичности (нарастания протеинурии более 1 г/сут или снижения СКФ менее 30 мл/мин/1,73 м2 ) у 14 (28%), неконтролируемой артериальной гипертонии – у 7 (14%), тромботических осложнений – у 5 (10%) и кровотечения – у 1 (2%). У 16 (32%) больных лечение было прекращено из-за неэффективности и прогрессирования заболевания, у 7 (14%) пациентов точная причина отмены препарата неизвестна. Факторами риска отмены препарата вследствие нефротоксичности были женский пол (ОШ 7,60, 95% ДИ 1,98-26,6, p=0,003) и снижение СКФ менее 60 мл/мин/1,73 м2 через 8 недель (ОШ 1,18, 95% ДИ 1,00-1,20, p=0,001).
Обсуждение
VEGF является одним из наиболее важных факторов роста, способствующих ангиогенезу и изменениям в опухолевом микроокружении. Антиангиогенная терапия нацелена на ингибирование пролиферации и выживания эндотелия сосудов (т.е. на торможение ангиогенеза). Поэтому антиангиогенные препараты с успехом применяют для лечения различных солидных опухолей, таких как метастатический колоректальный рак, немелкоклеточный рак легкого, глиобластома и др. [11-13]. Поскольку ангиогенез не инициирует, а поддерживает прогрессирование и метастазирование злокачественной опухоли, ингибиторы ангиогенеза по большей части сдерживают, но не устраняют опухоль полностью. В связи с этим требуется длительное лечение этими препаратами, лимитирующим фактором которого являются нежелательные эффекты, в том числе артериальная гипертония, нефротоксичность, тромбозы (в том числе артериальные) и тромбоэмболии [14].
В нашем исследовании артериальная гипертония часто (в 52% случаев) развивалась у больных, получающих анти-VEGF терапию, что согласуется с данными литературы о высокой частоте повышения АД при лечении этими препаратами (у 30–80% пациентов) [15,16]. По-видимому, контроль АД способствует лучшей почечной выживаемости и снижению частоты сердечно-сосудистых осложнений терапии. Мы установили, что сохранение повышенного АД в течение первых 8 недель сопровождается увеличением риска снижения СКФ менее 60 мл/мин/1,73 м2 .
Накапливается все больше доказательств того, что пациенты со злокачественными новообразованиями, получающие антиангиогенную терапию, имеют повышенный риск развития сердечно-сосудистых заболеваний [17]. Фактически, 25–66% смертельных исходов у онкологических больных при лечении антиангиогенными препаратами имеют сосудистую природу и связаны с тяжелой артериальной гипертонией, артериальными тромбоэмболиями, инфарктом миокарда и цереброваскулярными осложнениями [18,19].
Примечательно, что эпизоды повышения АД при приеме анти-VEGF-препаратов могут быть зафиксирована самим пациентом в домашних условиях даже чаще, чем при измерении АД на приеме у врача (55% против 24%) [20]. Мониторинг АД на дому, проводимый надлежащим образом, обладает большей чувствительностью в диагностике артериальной гипертонии на начальных этапах ее развития. Следует рекомендовать пациентам, получающим анти-VEGF препараты, вести контроль АД в домашних условиях (например, заполняя дневник) и предоставлять эти данные врачу.
Выбор антигипертензивных препаратов должен производиться с учетом сопутствующей терапии и метаболизма антиангиогенных препаратов. Некоторые из них подвергаются метаболизму в печени через систему цитохрома P450, особенно CYP3A4. Поскольку блокаторы кальциевых каналов (верапамил и дилтиазем) конкурентно подавляют систему CYP3A4, это приводит к повышению концентрации препарата в плазме крови, в связи с чем лучше избегать одновременного назначения этих препаратов с анти-VEGF. Также было показано, что нифедипин индуцирует продукцию VEGF, поэтому для коррекции АД предпочтителен прием фелодипина или амлодипина [21].
Некоторые исследователи рекомендуют использование ингибиторов ангиотензинпревращающего фермента (АПФ) или блокаторов рецепторов ангиотензина II (БРА), учитывая их нефропротективное действие. Использование агентов, повышающих NO, также патогенетически обосновано для лечения артериальной гипертонии, ассоциированной с анти-VEGF терапией, поскольку одним из механизмов повышения АД является снижение NO с последующей вазоконстрикцией и повышением системного сосудистого сопротивления. Dire и соавт. сообщили о хорошем ответе на нитраты длительного действия у этой группы больных [22]. Хотя не стоит забывать о том, что использование нитратов для контроля артериальной гипертонии может опосредованно (через повышение уровня NO) приводить к прогрессированию опухолевого процесса.
При лечении артериальной гипертонии, развивающейся при применении ингибиторов ангиогенеза, возможно применение небиволола, снижающего общее периферическое сосудистое сопротивление [23]. Oliver и соавт. сообщили об эффективности ингибитора фосфодиэстеразы 5 типа (силденафила) [24]. Наконец, для достижения целевого АД могут потребоваться другие антигипертензивные агенты, такие как диуретики, α-адреноблокаторы, препараты центрального действия и прямые вазодилататоры [25].
Для своевременного выявления нефротоксичности анти-VEGF препаратов необходим тщательный мониторинг СКФ. По данным настоящего исследования, для динамической оценки и более точного определения СКФ следует использовать формулы CKD-EPI или MDRD, учитывая их высокую чувствительность и специфичность. У больных, получающих анти-VEGF препараты, формула Кокрофта-Голта значительно завышала значения СКФ, при этом снижение СКФ менее 60 мл/мин/1,73 м2 было пропущено у 71% пациентов на 8-й неделе лечения. С помощью формулы CKD-EPI небольшое снижение СКФ выявляли, начиная уже с 1-й недели лечения.
Сходные результаты об информативности применения различных формул были получены в исследовании у 24516 пациентов с диабетической нефропатией. В этом исследовании формула Кокрофта-Голта завышала, тогда как формулы MDRD и CKD-EPI несколько занижали истинные значения СКФ. При хронической болезни почек 3-5 стадий у пациентов моложе 40 лет высокая точность в оценке СКФ была получена для формулы CKD-EPI, а у пациентов старше 60 лет наиболее точно СКФ оценивала формула MDRD [26].
Лечение анти-VEGF препаратами сопровождается повышенным риском тромботических осложнений, в том числе артериальных, включая инсульт, транзиторную ишемическую атаку, инфаркт миокарда и стенокардию, особенно у пациентов старше 65 лет или с тромбоэмболическими событиями в анамнезе. В исследуемой группе пациентов частота тромботических осложнений анти-VEGF терапии в течение 9 мес превышала частоту кровотечений. Механизмы тромбообразования связаны со способностью анти-VEGF снижать регенераторные свойства эндотелиальных клеток и вызывать дефекты, которые открывают прокоагулянтные фосфолипиды на плазматической мембране, что, в свою очередь, приводит к тромбозу [27]. Снижение содержания NO и простагландина I2 может способствовать тромбоэмболическим событиям, так как VEGF увеличивает выработку NO и простациклина, препятствует прокоагулянтным изменениям, а также подавляет пролиферацию гладкомышечных клеток сосудов [28].
Мы наблюдали прогрессирование ухудшения функции почек при стойком повышении уровня D-димера, что, по-видимому, связано с тромбозами микроциркуляторного русла почек, учитывая отсутствие признаков тромбоза другой локализации. Cохранение нормального уровня D-димера в течение всего времени наблюдения отмечалось у пациентов со стабильной нормальной функцией почек. Наши данные согласуются с результатами исследования M. Mischi и соавт., которые показали, что повышение уровня D-димера на фоне лечения бевацизумабом позволяет предсказать развитие тромботических осложнений в течение последующих 4 недель [29].
При анализе 5 клинических исследований бевацизумаба при злокачественных новообразованиях различной локализации общая частота тромбоэмболических осложнений составила 4% у пациентов, получавших бевацизумаб в сочетании с другими химиопрепаратами, и 2% у пациентов, получавших только химиотерапию без включения бевацизумаба. Смертность, связанная с тромбоэмболическими событиями, составила около 0,4-0,8% [30]. В настоящее время рутинная тромбопрофилактика всем амбулаторным пациентам, получающим антиангиогенные препараты, не рекомендуется, однако она может быть оправдана у пациентов группы высокого риска (по шкале Khorana) [31].
Появление протеинурии при лечении анти-VEGF препаратами связывают с нарушением экспрессии нефрина – трансмембранного подоцитарного белка, который составляет основу щелевой диафрагмы и регулируется VEGF. При применении анти-VEGF препаратов происходит отщепление молекул нефрина от подоцита и разрущение щелевой диафрагмы и гломерулярного фильтра [32,33]. Протеинурия занимает второе место среди побочных эффектов анти-VEGF препаратов, однако протеинурия более 3,5 г в сутки и нефротический синдром встречаются редко, в среднем у 6,5% пациентов [34,35]. У обследованных нами пациентов наблюдалось постепенное увеличение медианы суточной альбуминурии, однако через 8 недель не было выявлено ни одного случая высокой протеинурии или нефротического синдрома. Нефротоксичность с развитием протеинурии более 1 г/сут и/или снижением СКФ менее 30 мл/мин/1,73 м2 отмечалась в более поздние сроки (от 6 до 9 мес терапии). Отмена препарата вследствие тяжелой нефротоксичности потребовалось у 28% пациентов к 9 месяцу лечения. Независимыми факторами риска развития тяжелой нефротоксичности лечения были женский пол и прогрессирующее снижение СКФ в течение первых 8 недель.
Заключение
Таким образом, для снижения риска нефротоксичности анти-VEGF препаратов необходим строгий контроль АД с достижением целевых показателей 130/80 мм рт ст. и менее. В процессе лечения необходим контроль расчетной СКФ, предпочтительно с использованием формул CKD-EPI или MDRD, для своевременного выявления почечной дисфункции. У больных группы риска следует включать в план обследования определение D-димера, что позволит принять решение о назначении антикоагулянтной терапии.
Используемые источники
- Capasso A, Benigni A, Capitanio U, et al. International conference on onconephrology participants. Summary of the international conference on onconephrology: An emerging field in medicine. Kidney Int 2019;96:555–67.
- Abbas A, Mirza M, Ganti A, et al. Renal toxicities of targeted therapy. Targ Oncol 2015;10:487–99.
- Kitamoto Y, Tokunaga H, Miyamoto K, et al. VEGF is an essential molecule for glomerular structuring. Nephrol Dial Transplant 2002;17(Suppl 9):25–7.
- Toriu A. Renal-limited thrombotic microangiopathy due to bevacizumab therapy for metastatic colorectal cancer: A case report. Case Rep Oncol 2019;12:391–400.
- Hayman S, Leung N, Grande J, et al. VEGF inhibition, hypertension, and renal toxicity. Curr Oncol Rep 2012;14(4):285-94.
- Izzedine H, Escudier B, Lhomme C, et al. Kidney diseases associated with antivascular endothelial growth factor (VEGF): an 8-year observational study at a single center. Medicine (Baltimore) 2014;93(24):333-9.
- Hanna R, Tran N, Patel S, et al. Thrombotic microangiopathy and acute kidney injury induced after intravitreal injection of vascular endothelial growth factor inhibitors. VEGF blockade related TMA after intravitreal use. Front Med 2019;7:579-603.
- Piscitani L, Sirolli V, Di Liberato L, et al. Nephrotoxicity associated with novel anticancer agents (aflibercept, dasatinib, nivolumab): case series and nephrological considerations. Int J Mol Sci 2020;21(14):4878.
- Morales E, Moliz C, Gutierrez E. Renal damage associated to intravitreal administration of ranibizumab. Nefrologia 2017;37:653–5.
- Rhian M, Sandra M, Joerg H. Vascular toxicities with VEGF inhibitor therapies–focus on hypertension and arterial thrombotic events. J Amer Soc Hypert 2018;12(6):409-25.
- Jain R, Duda D, Clark J, et al. Lessons from phase III clinical trials on antiVEGF therapy for cancer. Nat Clin Pract Oncol 2006;3:24–40.
- Arrillaga-Romany I, Norden A. Antiangiogenic therapies for glioblastoma. CNS Oncol 2014;3:349–358.
- Manzo A, Montanino A, Carillio G, et al. Angiogenesis inhibitors in NSCLC. Int J Mol Sci 2017;18.
- Rodriguez-Vida A, Hutson T, Bellmunt J, et al. New treatment options for metastatic renal cell carcinoma. ESMO Open 2017;2:e000185.
- Small H, Montezano A, Rios F, et al. Hypertension due to antiangiogenic cancer therapy with vascular endothelial growth factor inhibitors: understanding and managing a new syndrome. Can J Cardiol 2014;30:534–43.
- Robinson E, Khankin E, Karumanchi S, et al. Hypertension induced by vascular endothelial growth factor signaling pathway inhibition: mechanisms and potential use as a biomarker. Semin Nephrol 2010;30:591–601.
- Oppelt P, Betbadal A, Nayak L. Approach to chemotherapy-associated thrombosis. Vasc Med 2015;20:153–61.
- Cooney M, Tserng K, Makar V, et al. A phase IB clinical and pharmacokinetic study of the angiogenesis inhibitor SU5416 and paclitaxel in recurrent or metastatic carcinoma of the head and neck. Cancer Chemother Pharmacol 2005;55:295–300.
- Zangari M, Fink L, Elice F, et al. Thrombotic events in patients with cancer receiving antiangiogenesis agents. J Clin Oncol 2009;27:4865–73.
- Mir O, Coriat R, Cabanes L, et al. An observational study of bevacizumabinduced hypertension as a clinical biomarker of antitumor activity. Oncologist 2011;16:1325–32.
- Miura S, Fujino M, Matsuo Y, et al. Nifedipine-induced vascular endothelial growth factor secretion from coronary smooth muscle cells promotes endothelial tube formation via the kinase insert domain-containing receptor/fetal liver kinase1/NO pathway. Hypertens Res 2005;28:147–53.
- Dire L, Maes H, Sweldens C. Treatment of arterial hypertension (AHT) associated with angiogenesis inhibitors. Ann Oncol 2007;18:1121–2.
- Izzedine H, Ederhy S, Goldwasser F, et al. Management of hypertension in angiogenesis inhibitor-treated patients. Ann Oncol 2009;20:807–15.
- Oliver J, Melville V, Webb D. Effect of regular phosphodiesterase type 5 inhibition in hypertension. Hypertension 2006;48:622–7.
- Chobanian A, Bakris G, Black H, et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003;42:1206–1252.
- Schwandt A, Denkinger M, Fasching P, et al. Comparison of MDRD, CKD-EPI, and Cockcroft-Gault equation in relation to measured glomerular filtration rate among a large cohort with diabetes. J Diabetes Complications 2017;31(9):1376-83.
- Kilickap S, Abali H, Celik I. Bevacizumab, bleeding, thrombosis, and warfarin. J Clin Oncol 2003;21:3542.
- Zachary I. Signaling mechanisms mediating vascular protective actions of vascular endothelial growth factor. Am J Physiol Cell Physiol 2001;280:1375–86.
- Mischi M, Czabanka M, Dengleri J, et al. D-dimer elevation and paresis predict thromboembolic events during bevacizumab therapy for recurrent malignant glioma. NTI Cancer Res 2013;33:2093-8.
- Skillings J, Johnson D, Miller K, et al. Arterial thromboembolic events (ATEs) in a pooled analysis of 5 randomized, controlled trials (RCTs) of bevacizumab (BV) with chemotherapy. J Clin Oncol 2005;23:3019
- Key N, Khorana A, Kuderer N, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO clinical practice guideline update. J Clin Oncol 2020;38:496–520.
- Hauser PV, Collino F, Bussolati B, Camussi G. Nephrin and endothelial injury. Curr Opin Nephrol Hypert 2009;18(1):3–8.
- Patrakka J, Tryggvason K. Nephrin - a unique structural and signaling protein of the kidney filter. Trends Mol Med 2007;9(13):396–403.
- Azad N, Posadas E, Kwitkowski V, et al. Combination targeted therapy with sorafenib and bevacizumab results in enhanced toxicity and antitumor activity. J Clin Oncol 2008;26:3709–14.
- Feldman D, Baum M, Ginsberg M, et al. Phase I trial of bevacizumab plus escalated doses ofsunitinib in patients with metastatic renal cell carcinoma. J Clin Oncol 2009;27:1432–9.
