Регистрация сообщений о нежелательных лекарственных реакциях при лечении COVID-19 в Российской Федерации и США
Существуют различные подходы к организации системы фармаконадзора, включая базы данных спонтанных сообщений, электронные системы мониторинга с вовлечением в процесс репортирования информации различных звеньев системы здравоохранения.
Сравнить системы репортирования сообщений о нежелательных явлениях при терапии COVID-19 в Российской Федерации (РФ) и США.
Провели ретроспективный анализ спонтанных сообщений, зарегистрированных в национальных базах РФ и США (АИС РЗН и FAERS, соответственно). Нежелательные реакции фиксировали при применении лекарственных средств для лечения COVID-19 в период с 28.04.2020 по 11.07.2021.
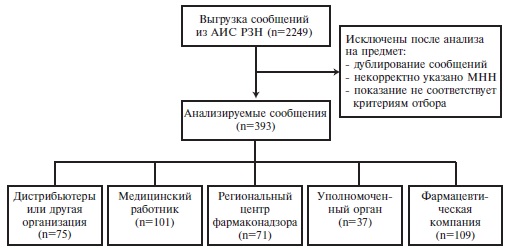
За отчетный период из национальной базы РФ было выгружено 2249 сообщений. После проверки сообщений на предмет дублирования информации, корректности указанного показания к назначению лекарств (в качестве терапии COVID-19), проверки необходимого минимума информации в финальный анализ вошли 393 сообщения. Аналогичный показатель в США был значительно выше и составил 9413 сообщений. Сведения, направленные в национальную базу РФ, в основном были предоставлены держателями регистрационных удостоверений (28%). В целом информация о нежелательных реакциях в российскую базу данных преимущественно поступала от немедицинских служб (74%), а в американскую национальную базу данных FAERS – от медицинских работников (61%).
Метод спонтанных сообщений оказался неэффективным во время пандемии. Создание и постоянное обновление системы прямой онлайн-отчетности с помощью различных программ, открытый доступ к информации о нежелательных лекарственных реакциях для всех участникам системы фармаконадзора будут способствовать увеличению количества сообщений.
Цель системы фармаконадзора – выявление, оценка, изучение и предотвращение нежелательных реакций и других проблем, связанных с лекарственными средствами (ЛС) [1]. Всемирной организацией здравоохранения (ВОЗ) разработана программа по международному мониторингу лекарственных средств [2]. Данная программа способствует получению информации о профиле безопасности лекарств и повышению качества медицинской помощи как на амбулаторном, так и на стационарном этапах и обеспечивает содействие программам охраны общественного здоровья за счет снижения рисков развития нежелательных лекарственных реакций (НЛР).
Реализация текущей системы фармаконадзора осуществляется, в том числе, и посредством анализа сигналов о безопасности лекарств из международных и национальных баз данных, таких как VigiBase ВОЗ (The World Health Organization’s global database of individual case safety reports) и FAERS США (FDA Adverse Event Reporting System). В Российской Федерации (РФ) субъекты обращения ЛС обязаны предоставлять данные о нежелательных реакциях в уполномоченный федеральный орган исполнительной власти – Росздравнадзор [3]. С целью оптимизации этой работы была внедрена автоматизированная информационная система Росздрав над зора (АИС РЗН), которая в настоящее время является национальной базой данных.
Тенденцией 2019-2021 гг. стало увеличение потребления ЛС по незарегистрированным показаниям (оff-label) для лечения новой коронавирусной инфекции (COVID19) [4]. Подобная тенденция сопряжена с риском возникновения НЛР различной степени тяжести, формированием “фармакотерапевтических каскадов", когда одно назначение фармакотерапевтического средства влечет за собой применение нескольких других препаратов для борьбы с последствиями первичного назначения [5]. Необходимо также отметить, что данные клинических исследований, в которых изучают в том числе и профиль безопасности ЛС, могут не соответствовать данным реальной клинической практики (RWD, Real-World Data) [6] [[7].
Целью исследования было сравнение систем репортирования НЛР при лечении COVID-19 в РФ и США.
Материал и методы
Провели ретроспективный анализ НЛР, зарегистрированных в национальных базах РФ и США при применении ЛС для лечения COVID-19 в период с 28.04.2020 г. по 11.07.2021 г. В АИС анализировали следующие международные непатентованные названия (МНН): гидроксихлорохин; лопинавир + ритонавир; мефлохин; тоцилизумаб; азитромицин; барицитиниб; олокизумаб; тофацитиниб; фавипиравир. В выгрузке указывали следующие данные: дозировка; даты начала и окончания НЛР; степень достоверности причинно-следственной связи события с применением подозреваемого ЛС; данные о сопутствующей терапии; пробы с повторным назначением (rechallenge) и отменой подозреваемого лекарства (если применимо); тяжесть НЛР; наличие/отсутствие критерия(ев) серьезности [8]. Кроме того, оценивали источники сообщений и основные тенденции репортирования с момента начала пандемии COVID-19. Следует отметить, что доступ к национальной российской базе данных по нежелательным явления ограничен.
Работа с национальной базой США (FAERS) имела некоторые отличия. В частности, система лекарственного мониторинга, которую осуществляет Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA; Food and Drug Administration), ведется в открытом режиме онлайн [9]. В то же время информация о НЛР представлена в меньшем объеме, чем в АИС (дозы и т.д.).
Результаты
За отчетный период из национальной базы РФ было выгружено 2249 сообщений. После проверки сообщений на предмет дублирования информации, корректности указанного показания к назначению ЛС (для лечения COVID-19), проверки необходимого минимума информации в финальный анализ вошли 393 сообщения (рис. 1).
Распределение сообщений по ЛС было следующим: фавипиравир – 96, олокизумаб – 86, гидроксихлорохин – 77, лопинавир + ритонавир – 52, азитромицин – 46, тоцилизумаб – 29, мефлохин – 4 и барицитиниб – 3.
При анализе типа отправителя были представлены следующие категории: держатель регистрационного удостоверения (ДРУ) – 109 сообщений, медицинские работники – 101, дистрибьюторы или другая организация – 75, региональный центр фармаконадзора – 71, орган, уполномоченный осуществлять фармаконадзорную деятельность, – 37. Таким образом, в целом большинство сообщений поступали от немедицинской службы (74,3%), прежде всего ДРУ, а не от медицинских работников (25,7%).
Динамика доли различных типов отправителей сообщений за период 2020-2021 гг. представлена на рис. 2. В начале пандемии (28.04.2020 – 09.07.2020) основным источником информации были медицинские работники (48,7%). На втором и третьем месте по количеству зарегистрированных сообщений были региональные центры фармаконадзора (24,7%) и уполномоченный орган (17,3%), соответственно. Четвертое место (8,7%) за этот период занимали ДРУ, а минимальное количество сообщений было получено от дистрибьюторов. Второй выделенный период (10.07. 2020 – 10.12.2020) характеризовался некоторым снижением количества полученных сообщений (со 150 до 86), а также перераспределением доли различных источников информации. На первом месте оказались ДРУ (53,5%), на втором – дистрибьютеры и другие источники информации (26,7%), на третьем – медицинские работники (11,6%).
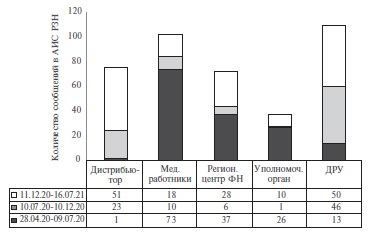
Во время третьего периода (11.12.2020 – 16.07.2021) количество предоставленных сообщений вновь увеличилось (до 157). Большинство из них были получены от ДРУ и дистрибьютеров и других источников информации (31,8% и 32,5%, соответственно). Реже сообщения поступали из региональных центров фармаконадзора (17,8%) и от медицинских работников (11,5%).
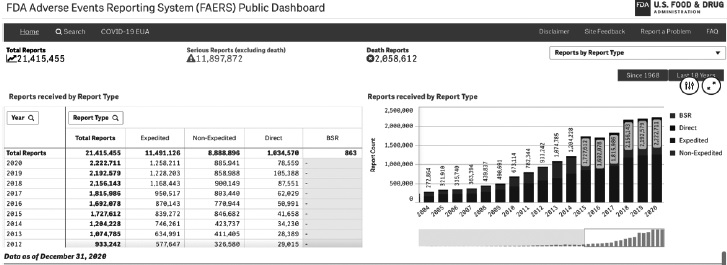
Информация о сообщениях в системе FAERS имеет ключевые отличия. Во-первых, система является открытой с вынесением на стартовую страницу сайта основных показателей и тенденций репортирования. “Глубина" репортирования составляет десятилетия, что позволяет оценить динамику количества сообщений о том или ином событии (рис. 3).
Типы сообщений классифицируются следующим образом:
Direct (прямое) – непосредственное заполнение медицинским работником или самим пациентом формы на веб-сайте FDA (программа MedWatch) для отправки сообщения о нежелательной реакции; такое репортирование не предполагает участие ДРУ в процессе отправки первоначального сообщения.
Expedited (срочное) и non-expedited (несрочное) – репортирование выполняется ДРУ или исследователями в рамках клинических исследований или стандартных процедур фармаконадзора.
В отношении НЛР информация также находится в открытом доступе с указанием аналогичных параметров (относительно источника предоставления информации), в том числе динамики количества и качества сообщений о НЛР в режиме реального времени (рис. 4). Сайт позволяет не только отслеживать источники сообщений, но и оценить характеристики НЛР, в частности наличие критериев серьезности (Serious Reports) и летальные исходы (Death Reports) [10].
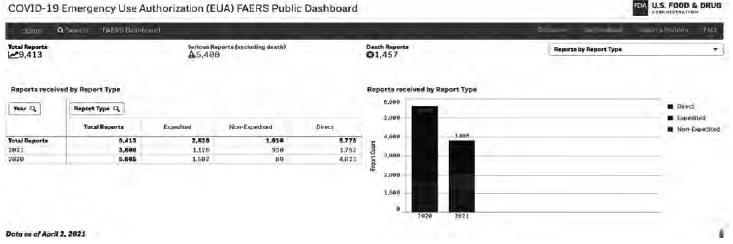
За период с 2020 по 2021 гг. количество включенных в национальную базу США сообщений о НЛР при лечении COVID-19 составило 9413, т.е. значительно превосходило таковое в РФ. Кроме того, в отличие от РФ, в национальную базу США 61% сообщений было загружено медицинскими работниками, а оставшиеся – в основном ДРУ, в том числе на основе данных проводимых клинических исследований. Представленные данные характерны, по всей видимости, именно для пандемии COVID-19. При анализе данных за последние 10 лет среди источников сообщений о НЛР очевидно преобладание ДРУ или исследователей в рамках клинических исследований или стандартных процедур фармаконадзора.
Обсуждение
Основными задачами фармаконадзора являются обеспечение безопасности использования ЛС, оценка соотношения риск/польза при назначении фармакотерапии, обучение и информирование врачей и пациентов, а также осуществление превентивных действий со стороны медицинских работников для предотвращения НЛР. Во многом поставленные цели достигаются формированием баз данных, информация в которые поступает посредством внесения информации из спонтанных сообщений. В соответствии с определением “спонтанные сообщения – это региональная или федеральная система оповещения о подозрениях на нежелательную реакцию при применении лекарственного препарата" [2].
Система фармаконадзора в РФ, с одной стороны, основана на добровольном внесении спонтанных сообщений в национальную базу, а, с другой, фармаконадзорная деятельность регламентирована федеральным законодательством [11]. Метод спонтанных сообщений подразумевает заполнение карты-извещения на официальном сайте Росздравнадзора в режиме online. В РФ динамика сообщений свидетельствует о том, что в начале пандемии данные о НЛР при лечении COVID-19 в основном поступали от медицинских работников (48,7%). Со временем данный показатель снизился практически в три раза. Вероятно, это было связано с высокой загруженностью медицинского персонала в “красных зонах", низкой информированностью о системе фармаконадзора, невозможностью своевременного распознавания НЛР, а также сложностью определения причинно-следственной связи. Хотя в РФ существуют региональные центры фармаконадзора, одной из целей которых является снижение нагрузки на медицинский персонал при передаче информации в АИС, их вовлеченность в процесс информирования регулятора была невысокой (18% от всех зарегистрированных сообщений).
Ввиду сложности структуры и большого количества промежуточных звеньев в системе получения информации о безопасности ЛС, система фармаконадзора РФ была значительно усилена в 2019 г., когда после запуска обновленной национальной базы нежелательных реакций “Фармаконадзор" 2.0. Росздравнадзор стал одним из первых регуляторных агентств мира, перешедшим на третью версию (R3) международного формата Совета по гармонизации ICH E2B, что предусматривает новые процессы, возможности, обязанности и инструменты [12].
До пандемии COVID-19 по уровню отчетности о НЛР уверенно лидировали ДРУ. К сожалению, их отчеты отличает предвзятость и отсутствие клинически значимых данных о тяжести течения и исходе заболевания [13], что подчеркивает важность сравнительного анализа профиля безопасности различных терапевтических агентов при использовании в популяции пациентов с COVID-19 с применением национальной база АИС.
Показателем эффективности работы системы, обеспечивающей безопасность ЛС, являются количество и качество спонтанных сообщений о НЛР при применении ЛС. Наши данные, к сожалению, свидетельствуют о том, что закрытая система фармаконадзора (как было упомянуто ранее, доступ в АИС закрыт и возможен только после получение разрешения от Рос здрав надзора) оказывается неэффективной при столкновении с глобальными событиями, такими как пандемия COVID-19. Вероятно, система требует некоторых изменений, чтобы стимулировать медицинских работников сообщать о НЛР. Кроме того, возможно совмещение существующей методологии спонтанных сообщений с системой активного мониторинга, которая внедрена в Великобритании. Суть данной методологии состоит в том, что постмаркетинговые когортные исследования проводит независимая служба по исследованию безопасности лекарств (Drug Safety Research Unit – DSRU). При этом изучаются медицинские документы всех пациентов, которым назначали определенные ЛС [14]. Такая методика позволяет снизить субъективность при сборе и анализе данных и провести объективную оценку профиля безопасности конкретного ЛС.
Несмотря на определенные преимущества, система спонтанных сообщений имеет ряд ограничений. Система спонтанных сообщений в США демонстрирует так называемую “стимулированную отчетность" — это увеличение количества сообщений о НЛР после получения предупреждений о безопасности от регулирующих органов или после публикации соответствующих результатов исследования. Кроме того, стимулированная отчетность может проявляться в виде кластеризации отчетов о неблагоприятных событиях, вызванных действиями групп поддержки потребителей или отчетной деятельностью, связанной с судебными разбирательствами.
Так, M. Dörks и соавт. зафиксировали увеличение количества сообщений о НЛР при применении гидроксихлорохина, что было связано с повышенным вниманием средств массовой информации и населения к этому препарату во время пандемии. Увеличение количества сообщений о НЛР при применении ранитидина, скорее всего, не было связано с пандемией и стало результатом недавнего ухода ранитидина с мирового фармацевтического рынка из соображений безопасности. Учитывая, что такие изменения могут привести к неправильной интерпретации сигналов фармаконадзора, необходимы дальнейшие исследования для оценки воздействия пандемии COVID-19 на динамику отчетности о НЛР [15].
Серьезную озабоченность организаторов здравоохранения по всему миру вызывает проблема занижения отчетности о НЛР. A. Al-Mutairi и соавт. подтвердили эти опасения при опросе 289 фармацевтических работников в Саудовской Аравии. Большинство опрошенных не смогли правильно ответить на вопросы, связанные с купированием НЛР, лекарственной непереносимостью и системами репортирования. Несмотря на общее положительное отношение (96%), фармацевты заявили, что основными препятствиями, мешающими сообщать о НЛР, являются недостаточная осведомленность о такой необходимости и нехватка времени. Только 69,2% фармацевтов отметили, что прошли обучение по составлению отчета, хотя 70,0% из них сообщают о НЛР более одного раза в неделю [16].
Результаты настоящего исследования подтверждают необходимость создания благоприятных условий для более активной отчетности о НЛР среди медицинских работников и общества в целом, в том числе при помощи образовательных программ.
Чтобы избежать фрагментации данных, возможно объединение разных источников данных о безопасности ЛС путем сближения системы спонтанных сообщений с общими (стандартизованными) моделями данных из электронных медицинских карт клинических центров и социальных сетей [17,18].
Заключение
Выделяют несколько типов систем фармаконадзора: централизованный, децентрализованный и смешанный. Централизованный тип, созданный, например, в США, подразумевает использование централизованной базы данных о НЛР и управление одним центральным органом. Информация о НЛР поступает от всех участников системы фармаконадзора страны, вовлеченных в процесс сбора и репортирования данных о безопасности ЛС. Децентрализованный тип организации системы фармаконадзора предусматривает поступление данных о НЛР от участников системы фармаконадзора в региональные центры с последующей передачей информации в национальный центр [19]. В РФ все контролирующие функции в сфере оборота лекарственных средств возложены на Росздравнадзор, в США – на Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). В то же время, в РФ сбор информации осуществляется двумя путями – централизованно и децентрализовано, что, очевидно, влияет на количество и качество сообщений, поступающих в АИС РЗН. Структура Росздравнадзора включает центральный аппарат, 78 территориальных органов и три подведомственных Федеральных государственных бюджетных учреждения [20]. Наряду с федеральным центром фармаконадзора также функционируют региональные центры по контролю безопасности ЛС. Вероятно, сложность организационной структуры, достаточно большое количество нормативной документации затрудняют передачу информации для своевременного реагирования на сигналы безопасности относительно тех или иных ЛС, а также негативно влияют на коммуникацию между различными звеньями системы фармаконадзора. Когда количество сообщений о НЛР относительно невелико, необходимо более тщательное наблюдение за пациентами, которые получают те или иные ЛС. В связи с этим возрастает роль ответственного за фармаконадзор в медицинских организациях [21].
Приведенные данные, полученные во время пандемии COVID-19, демонстрируют преимущество централизованного типа системы фармаконадзора. Создание и постоянное обновление системы прямой онлайн-отчетности с помощью различных программ, открытый доступ к информации о безопасности ЛС для всех участников системы фармаконадзора страны будут способствовать увеличению количества добровольных сообщений о НЛР.
Используемые источники
- Справочная информация Федеральный закон от 12.04.2010 г. №61-ФЗ (ред. от 03.04.2020 г.) “Об обращении лекарственных средств”, статья 64 “Фармаконадзор”. http://www.consultant.ru
- Казаков А.С., Шубникова Е.В., Дармостукова М.А. и др. Международный мониторинг безопасности лекарственных средств. Безопасность и риск фармакотерапии. 2019;7(3):120-6 [Kazakov AS, Shubnikova EV, Darmostukova MA, et al. International drug safety monitoring. Safety and Risk of Pharma cotherapy 2019;7(3):120-6 (In Russ.)].
- Глаголев С.В. Надлежащая практика фармаконадзора Российской Федерации и Евразийского экономического союза, гармонизация с международными подходами и практиками. Международная научно-практическая конференция ФАРМАКОНАДЗОР. Современные вызовы и возможности, 2012 г. Москва.
- Романов Б.К. Безопасность гидроксихлорохина, фавипиравира и комбинации лопинавира с ритонавиром при терапии “первой волны” новой коронавирусной инфекции COVID-19. Ведомости Научного центра экспертизы средств медицинского применения. 2020;10(3):148-51 [Romanov BK. Safety of hydroxychloroquine, favipiravir, and the combination of lopinavir and ritonavir in the treatment of the “first wave” of the New Coronavirus Infection COVID-19. The Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products 2020;10(3):148-51 (In Russ.)].
- Итоги 2018 года. Розничный сегмент фармацевтического рынка России [Электронный ресурс]. URL: https://dsm.ru/news/566/ (дата обращения: 21.12.2019)]. farmakonadzora/viewer.
- Колбин А.С. и др. Исследования реальной клинической практики. М., Издательство ОКИ: Буки Веди, 2020, 208 с.
- Мишинова С.А., Журавков А.А., Журавко В.К. Назначение официально не разрешенных к применению лекарственных средств и использование лекарственных средств с нарушением инструкции по применению: фокус на COVID-19. Качественная клиническая практика. 2020;4S:120-9 [Mishinova SA, Zhuravkov AA, Zhuravko VK. Use of unlicensed drugs and off-label drug use: focus on COVID-19. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice 2020;4S:120-9 (In Russ.)].
- Gholami K, Shalviri G. Factors associated with preventability, predictability, and severity of adverse drug reactions. Ann Pharmacother 1999;33(2):236-40.
- Wu L, Ingle T, Liu Z, et al. Study of serious adverse drug reactions using FDAapproved drug labeling and MedDRA. BMC Bioinformatics 2019;20:97.
- U.S. Food and Drug Administration [Электронный ресурс]. URL: https://fis.fda.gov/sense/app/d10be6bb-494e-4cd2-82e4-0135608ddc13/ sheet/ 7a47a261-d58b-4203-a8aa-6d3021737452/state/analysis (дата обращения: 21.11.2021).
- Алгоритм взаимодействия участников системы фармаконадзлора по выявлению и работе со спонтанными сообщениями. Методические рекомендации. [Электронный ресурс]. URL: http://npr52.ru/userfiles/files/2022_10_2009.pdf (дата обращения: 21.11.2021).
- Официальный сайт Росздравнадзора РФ [Электронный ресурс]. URL: https://roszdravnadzor.gov.ru/news/16096 (дата обращения: 21.12.2019).
- Beyzarov E, Chen Y, Julg R, et al. Global safety database summary of COVID19-related drug utilization-safety surveillance: A sponsor’s perspective. Drug Saf 2021;44:95–105.
- Шубникова Е.В., Букатина Т.М., Каперко Д.А. и др. Постмаркетинговые исследования безопасности лекарственных средств: анализ рекомендаций зарубежных регуляторных органов. Безопасность и риск фармакотерапии 2018;6(3):130-7 [Shubnikova EV, Bukatina TM, Kaperko DA, et al. Post-marketing drug safety research: analysis of recommendations of foreign regulators. Safety and Risk of Pharmacotherapy 2018;6(3):130-7 (In Russ.)].
- Dörks M, Jobski K, Hoffmann F, Douros A. Global COVID-19 pandemic and reporting behavior - An analysis of the Food and Drug Administration adverse events reporting system. Pharmacoepidemiol Drug Saf 2021;30:707– 15.
- AL-Mutairi A., Isamme A, Youssef M. Medication safety knowledge, attitude, and practice among hospital pharmacists in tertiary care hospitals in Saudi Arabia: a multi-center study. Arch Publ Health 2021. doi: 79.10.1186/s13690-021-00616-1.
- Shin H, Lee S. An OMOP-CDM based pharmacovigilance data-processing pipeline (PDP) providing active surveillance for ADR signal detection from realworld data sources. BMC Med Inform Dec Making 2021.doi: 21.10.1186/s12911-021-01520-y.
- Lavertu A, Vora B, Giacomini KM, et al. A new era in pharmacovigilance: toward real-world data and digital monitoring. Clin Pharmacol Ther 2021;109:1197-202.
- Мониторинг безопасности лекарственных препаратов. Руководство по организации и функционированию центров фармаконадзора [Электронный ресурс]. URL: https://www.who-umc.org/media/1711/24750.pdf (дата обращения: 15.11.2021)
- Журавлева М.В., Романов Б.К., Городецкая Г.И. и др. Актуальные вопросы безопасности лекарственных средств, возможности совершенствования системы фармаконадзора. Безопасность и риск фармакотерапии 2019;7(3):109-19 [Zhuravleva MV, Romanov BK, Gorodetskaya GI, et al. Topical issues of drug safety, possibilities of improving of pharmacovigilance. Safety and Risk of Pharmacotherapy 2019;7(3):109-19 (In Russ.)].
- Raschi E, Caraceni P, Poluzzi E, De Ponti F. Baricitinib, JAK inhibitors and liver injury: a cause for concern in COVID-19? Expert Opin Drug Saf 2020;19(10):1367-9.
