Влияние хирургической коррекции массы тела на альбуминурию и нефринурию у больных с морбидным ожирением
Изучить альбуминурию и нефринурию у пациентов с морбидным ожирением (ОЖ) и оценить влияние на эти показатели бариатрических операций (БО).
Обследовано 99 пациентов с ОЖ, в том числе II степени у 23, III степени у 48 и со сверхожирением (индекс массы тела [ИМТ] ≥50 кг/м2) у 28. До и после БО измеряли основные антропометрические показатели (масса тела, ИМТ, окружность талии – ОТ), показатели углеводного и жирового обмена, скорость клубочковой фильтрации (СКФ), содержание альбумина и нефрина (у 33) в моче.
В целом БО привели к значительному снижению массы тела (в среднем на 50,3 кг) и улучшению показателей углеводного и жирового обмена. В среднем в течение 16,7 месяца после БО медиана СКФ достоверно увеличилась (p<0,001), главным образом, у пациентов с исходной СКФ<90 мл/мин/1,73 м2, а медиана отношения альбумин/креатинин в моче (ACR) достоверно снизилась (р=0,005). Снижение ACR наблюдалось только у пациентов с СКФ≥90 мл/мин/1,73 м2, включая пациентов с гиперфильтрацией, у которых исходная альбуминурия была выше, чем у пациентов с СКФ <90 мл/мин/1,73 м2. Исходное содержание нефрина в моче у больных ОЖ с альбуминурией и без нее было достоверно выше, чем в контроле, и прямо коррелировало с исходными массой тела (R=0,462, р<0,01), избытком массы тела (R=0,648, р<0,01), ИМТ (R=0,755, р<0,05), ОТ (R=0,383, р<0,05) и уровнем С-пептида (R=0,534, р<0,05). В целом по группе после БО отмечена тенденция к снижению нефринурии, значимо она снизилась у пациентов с ОЖ и сопутствующим сахарным диабетом. Снижение нефринурии прямо коррелировало с потерей массы тела (R=0,518, р<0,01), уменьшением уровня в крови холестерина (R=0,886, р<0,05) и глюкозы (R=0,890, р<0,05). После БО альбуминурия достоверно снизилась у пациентов с исходной нефринурией ниже медианы (<14,89 нг/мл), у которых реже встречались тяжелое ОЖ в сочетании с нарушением углеводного обмена, высокой артериальной гипертонией и хронической болезнью почек 2-3 стадии, и достоверно не изменилась у пациентов с нефринурией выше указанного значения.
Определение уровня нефрина в моче может рассматриваться как перспективный метод ранней (до повышения альбуминурии) диагностики функциональных и структурных нарушений в почке при морбидном ОЖ, как инструмент мониторирования течения, прогнозирования ответа на лечение.
Ожирение (ОЖ) в настоящее время признано фактором риска развития хронической болезни почек (ХБП) [1]. Клиническим признаком ассоциирован ного с ОЖ поражения почек, даже при отсутствии сопутствующего сахарного диабе та или артериальной гипертонии, является протеинурия, обычно не достигающая неф ротического уровня. Биопсия почки таким пациентам обычно не проводится, а при ее выполнении чаще всего обнаруживают гло меруломегалию и фокальный сегментарный гломерулосклероз. При этом наличие проте инурии, как правило, отражает уже далеко зашедший процесс [2].
В клинической практике для диагностики ранних стадий поражения почек у лиц с факторами риска ХБП, в том числе ОЖ, рекомендуется определение альбуминурии [3,4]. В то же время в ряде исследований, в первую очередь при сахарным диабете, убе дительно показано, что этот показатель не позволяет выявить начальные структурные и функциональные нарушения, которые развиваются в почках задолго до повышения экскреции альбумина с мочой [5]. Это стало причиной поиска более информативных маркеров для ранней диагности ки и мониторирования течения ХБП.
В последние десятилетия в качестве таких маркеров при нефропатиях разной этиологии активно изучаются структурные белки подоцитов – ключевых компонентов гломерулярного барьера, определяющих его проницае мость [6-8]. У пациентов с морбидным ОЖ экскреция нефрина с мочой ранее не изучалась, поэтому характер изменений нефринурии у данной категории больных, в том числе после эффективного снижения массы тела, требует уточнения.
В качестве действенного метода борьбы с морбид ным ОЖ сегодня рассматриваются бариатрические операции (БО), выполняемые на органах желудочно кишечного тракта не только с целью эффективного снижения массы тела, но и улучшения течения связан ных с ОЖ заболеваний, в том числе поражения почек [9]. В ряде публикаций сообщалось об улучшении тече ния ХБП у пациентов с ОЖ после БО, в частности об уменьшении альбуминурии, наблюдающемся одновре менно с нормализацией метаболических показателей и устранением нарушений внутриклубочковой гемодина мики [10-13].
Целью исследования было изучение альбуминурии и нефринурии у пациентов с морбидным ОЖ и влияния на эти показатели снижения массы тела в ближайшие сроки после БО.
Материал и методы
В исследование включали пациентов с ОЖ, проходивших лечение в Центре эндохирургии и литотрипсии и Институте пластической хирургии и косметологии. БО выполнялись пациентам по следующим показаниям: ИМТ >40 кг/м2 вне зависимости от наличия сопутствующих заболеваний или ИМТ 35–40 кг/м2 при наличии сопутствующих ОЖ заболе ваний [14]. Из исследования исключали пациентов с ост рым и хроническим гломерулонефритом, системными аутоиммунными заболеваниями с поражением почек, ами лоидозом, поликистозной болезнью почек, опухолями, сер дечной недостаточностью III-IV функционального класса и беременных женщин.
Для определения степени ОЖ использовали ИМТ, а для оценки типа распределения подкожно-жировой клетчатки – окружность талии (ОТ) [16]. Избыток массы тела опреде ляли как разницу между фактической и идеальной массой тела. Наличие ХБП и его стадию диагностировали согласно рекомендациям KDIGO 2012 г. [15]. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI. Содержание альбумина в порции утренней мочи до и после БО определяли иммунотурбодиметрическим методом с использованием коммерческого набора (BioSystems S.A., Испания). Рассчитывали отношение концентрации альбу мина к креатинину мочи (ACR, мг/ммоль). За норму при нимали значения ACR менее 1 мг/ммоль. Согласно градациям KDIGO 2012 г., выделяли повышенную (1-2,9 мг/ммоль; А1), высокую (3-29,9 мг/ммоль; А) и очень высо кую (≥30 мг/ммоль; А3) альбуминурию.
До и после БО выполняли клинические анализы крови и мочи, определяли содержание глюкозы, гликированного гемоглобина, общего холестерина, триглицеридов, холестерина липопротеидов высокой (ЛВП) и низкой плотности (ЛНП), креатинина, инсулина и С-пептида в сыворотке. Содержание нефрина в порции утренней мочи измеряли с помощью иммуноферментного анализа (Cloud-Clone Corp., США).
Эффективность хирургического лечения определяли на основании степени потери избыточной массы тела (%EWL) по формуле: послеоперационная потеря массы тела/исходная масса тела × 100%.
Статистический анализ проводился с использованием программы IBM SPSS Statistics 2 (IBM Corporation, США). Анализ соответствия вида распределения признака закону нормального распределения проведен с помощью критерия Колмогорова-Смирнова. Так как большинство величин не соответствовали закону нормального распределения, при описании количественных данных использовали медиану и интерквартильный размах – Ме [25;75%]. Качественные показатели представлены в виде абсолютного числа наблюдений и доли (в %) от количества обследованных в соответствующей группе или от общего числа обследованных. Для выявления взаимосвязи между количественными переменными использовали непараметрический тест ранговой корреляции Спирмена. При сравнении групп пациентов использовали критерии Манна-Уитни (для двух групп) и Краскала-Уоллиса (для трех и более групп). Критическое значение уровня статистической значимости при проверке нулевых гипотез принимали равным 5% (р=0,05).
Результаты
Исходная характеристика больных. В исследование включены 99 пациентов (38 мужчин, 61 женщина) в возрасте от 18 до 68 лет (медиана 44,4 лет) с абдоминальным типом ОЖ (ОТ – 135 [120; 143] см). ОЖ II степени диагностировано у 23 (23,2%) пациентов, III степени – у 48 (48,5%), сверхожирение (ИМТ>50 кг/м2) – у 28 (28,3%). Артериальная гипертония наблюдалась у 69 (69,7%) пациентов, нарушение углеводного обмена – у 45 (45,5%), в том числе сахарный диабет 2 типа – у 18 (18,3%) и нарушенная толерантность к глюкозе (НТГ) – у 27 (27,2%). У 75 (75,8%) пациентов диагностирована ХБП, в том числе ХБП С1 – у 51 (51,5%), ХБП С2 – у 21 (21,2%), ХБП С3 – у 3 (3,1%). Альбуминурия выявлена у 75 (75,8%) пациентов, в том числе А1 – у 49 (49,5%), A2 – у 23 (23,2%) и А3 – у 3 (3,1%). Контрольную группу составили 11 здоровых добровольцев с нормальной массой тела (ИМТ 21,1 кг/м2 [20,1; 25,4]), в том числе 5 мужчин и 6 женщин в возрасте от 26 до 59 лет (медиана 31 год).
Результаты оперативного лечения ОЖ. Пациентам были выполнены следующие виды операций: 36 (36,4%) – продольная резекция желудка, 40 (40,4%) – минигастрошунтирование и 23 (23,2%) – билиопанкреатическое шунтирование в модификациях Scopinaro и SADI-S. Летальных исходов в раннем послеоперационном периоде (первые 30 суток) не было. В течение от 7 до 38 мес (в среднем – 16,7 мес) после БО медиана массы тела снизилась со 137 до 81 кг, ИМТ – с 44,6 до 28,4 кг/м2 и ОТ – со 135 до 98 см. Наибольшая потеря массы тела наблюдалась у больных со сверхожирением (табл. 1). По принятой в бариатрической хирургии шкале R. Reinhold [9] у 53,5% пациентов зарегистрированы отличные результаты операции (%EWL≥75), а у 34,3% – хорошие (50≤%EWL<75). Средний %EWL составил 80,3%. Наибольшим значение %EWL было у больных с ОЖ II cтепени (табл. 1), что, вероятно, связано с относительно меньшим исходным избытком массы тела и наиболее часто выполнявшимся в этой группе видом операции – продольной резекцией желудка, максимальный эффект от которой фиксируется к 1-му году наблюдения. У больных со сверхожирением, которым проводились более сложные операции (минигастрошунтирование и билиопанкреатическое шунтирование), максимальное снижение массы тела ожидается после 2 лет от момента операции.
| Показатели | Ожирение II,n=23 | Ожирение III, n=48 | Сверхожирение, n=28 |
|---|---|---|---|
| Примечание: **p<0,01, ***p<0,001 по сравнению с исходными | |||
| Масса тела, кг | |||
| исходно | 110,0±17,1 | 132,9±17,2 | 165,7±34,2 |
| после БО | 77,4±13,3*** | 86,0±18,7*** | 93,6±25,8*** |
| ИМТ, кг/м2 | |||
| исходно | 37,9±1,5 | 45,1±2,7 | 55,9±7,4 |
| после БО | 26,7±1,7*** | 29,0±4,3*** | 31,5±4,9*** |
| ОТ, см | |||
| исходно | 116,3±12,6 | 132,6±11,8 | 147,6±20,2 |
| после БО | 91,6±7,4** | 98,3±9,3*** | 102,3±16,1*** |
| Потеря МТ, кг | 32,6±6,5 | 46,9±11,5 | 72,1±22,5 |
| EWL, % | 88,9±14,7 | 80,5±20,6 | 79,1±15,9 |
| Наблюдение, мес | 15,0±5,9 | 16,9±5,5 | 16,4±5,4 |
У 40 (78,4%) из 51 пациента с артериальной гипертонией после БО были отменены антигипертензивные препараты в связи с нормализацией АД после снижения массы тела. Кроме того, у 24 (96,0%) из 25 пациентов с нарушением углеводного обмена (сахарный диабет 2 типа у 17 и нарушенная толерантность к глюкозе у 7) были отменены сахароснижающие препараты, которые они принимали до БО. Ремиссия сахарного диабета не была достигнута только у 1 пациентки из-за развившейся через 5 месяцев после билиопанкреатического шунтирования белково-энергетической недостаточности. Динамика метаболических показателей у пациентов с ОЖ после хирургической коррекции массы тела приведена в табл. 2.
| Показатели | Исходно | После БО | p |
|---|---|---|---|
| Примечание: ОХС - общий холестерин сыворотки, ТГ - триглицериды | |||
| Глюкоза, ммоль/л | 7,2 [6,6;9,7] | 5,0 [4,6;5,5] | <0,001 |
| HbA1C, % | 6,7 [6,2;7,5] | 4,7 [4,2;5,3] | 0,002 |
| ОХС, ммоль/л | 4,7 [4,0;5,6] | 3,9 [3,2;4,4] | <0,001 |
| ЛНП, ммоль/л | 2,42 [1,85;2,65] | 2,12 [1,67;2,50] | <0,001 |
| ЛВП, ммоль/л | 0,91 [0,67;1,18] | 1,22 [1,08;1,43] | 0,02 |
| ТГ, ммоль/л | 2,43 [1,71;5,08] | 0,83 [0,66;1,41] | <0,001 |
| Креатинин, мкмоль/л | 70,6 [58,7;89,8] | 60,2 [56,2;81,8] | <0,001 |
| СКФ, мл/мин/1,73 м2 | 101,1 [88,9;115,9] | 109,6 [91,0;119,1] | <0,001 |
| ACR, мг/ммоль | 4,49 [2,37;10,50] | 1,93 [1,66;3,36] | 0,005 |
Изменения альбуминурии, нефринурии и функции почек после БО. После оперативного лечения ОЖ выявлено достоверное увеличение медианы СКФ (plt;0,001) (табл. 2), главным образом, у пациентов с исходной СКФ<90 мл/мин/1,73 м2 (с 75,8 [68,6; 81,8] до 93,4 [77,5; 101,9] мл/мин/1,73 м2; p=0,002). В трех случаях повышение СКФ достигало уровня гиперфильтрации (>120 мл/мин/1,73м2). У 9 пациентов с абсолютной гиперфильтрацией (до 187,3 мл/мин/1,73 м2) полной нормализации СКФ в ближайшие сроки наблюдения после БО не отмечено (медиана СКФ снизилась со 139,1 до 121,5 мл/мин/1,73 м2, p=0,2). По-видимому, для нормализации гемодинамических нарушений в почке, ассоциированных с ОЖ, требуется бóльший период времени, что вполне объяснимо, поскольку при сложных операциях максимальное снижение массы тела ожидается после 2 лет.
Медиана СКФ достоверно увеличилась у пациентов без нарушений углеводного обмена (с 91,9 [76,7; 107,9] до 105,9 [96,9; 116,7] мл/мин/1,73 м2, р=0,001), но существенно не изменилась у пациентов с сахарным диабетом 2 типа и нарушенной толерантностью к глюкозе (с 107,1 [84,3; 108,3] до 104,9 [96,7; 112,1] мл/мин/1,73 м2, р=0,3), что, по-видимому, обусловлено большей частотой выявления сверхожирения и гиперфильтрации, более длительными сроками нормализации гемодинамических нарушений и более выраженными структурными нарушениями у данной категории больных.
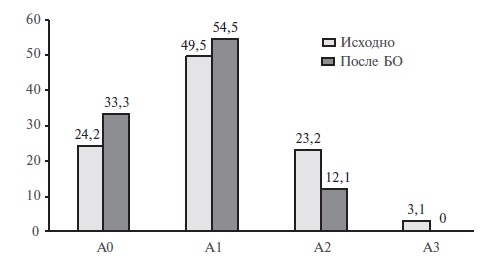
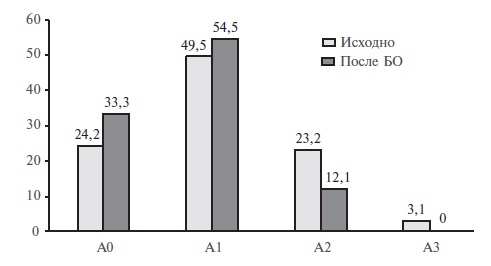
В целом, характеризуя течение ХБП в группе больных ОЖ, можно отметить, что в среднем через 16,7 мес после БО наблюдалось улучшение функционального состояния почек и снижение альбуминурии. В частности, у всех пациентов, которые до оперативного вмешательства имели ХБП 2 и 3 стадии, после БО отмечался переход в ХБП 1 стадии (рис. 1). После бариатрического лечения в 1,6 раз увеличилась доля пациентов, у которых отсутствовали признаки ХБП (сохранная функция почек, нормальная альбуминурия) (рис. 1). После снижения массы тела у двух пациентов с ОЖ и исходной протеинурией белок в общем анализе моче не определялся, а альбуминурия А3 уменьшилась до степени А2 (3,09 мг/ммоль) и А1 (1,92 мг/ммоль) (рис. 2).
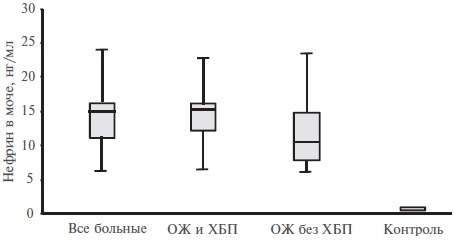
Исходное содержание нефрина в моче у больных ОЖ было достоверно выше, чем в контрольной группе (14,89 [11,89; 16,00] и 0,21 [0,18; 0,28] нг/мл, соответственно, p<0,001), причем нефринурия была повышена как у пациентов, не имеющих традиционных маркеров ХБП, так и у больных с ОЖ и ХБП (рис. 3). У пациентов с ОЖ и альбуминурией А1 и А2 экскреция нефрина с мочой была одинаково высокой (15,00 [13,50; 16,00] и 14,50 [11,90; 15,40] нг/мл, соответственно, р>0,05), самые высокие концентрации нефрина в моче отмечены у двух больных ОЖ с протеинурией/альбуминурией А3 (15,50 и 15,10 нг/мл). У пациентов с ОЖ без альбуминурии уровень нефрина в моче был повышен несколько в меньшей степени, чем у пациентов с альбуминурией, однако эти различия не достигали статистической значимости (11,17 [8,88; 16,36] нг/мл, р>0,05).
Во всей группе исходный уровень нефрина в моче прямо коррелировал с исходными антропометрическими показателями, в том числе с массой тела (R=0,462, р<0,01), избытком массы тела (R=0,648, р<0,01), ИМТ (R=0,755, р<0,01), ОТ (R=0,383, р<0,05) и уровнем Спептида (R=0,534, р<0,05), отражая патофизиологическую общность ожирения, инсулинорезистентности и повреждения подоцитов. У больных со сверхожирением наряду с вышеописанными корреляциями была выявлена сильная отрицательная связь исходных нефринурии и СКФ (R=-0,929, р<0,01).
После БО медиана нефринурии снизилась недостоверно (с 14,89 [11,89; 16,00] до 12,56 [10,50; 15,27] нг/мл, p=0,13). Статистически значимое снижение медианы нефринурии было отмечено у пациентов с ОЖ и сопутствующимими сахарным диабетом (с 15,09 [12,38; 16,37] до 11,67 [9,81; 15,07] нг/мл, р=0,05) и артериальной гипертонией (с 15,03 [12,38; 16,00] до 11,87 [10,42; 15,36] нг/мл, р=0,05). Степень снижения нефринурии в общей группе пациентов с ОЖ прямо коррелировала с потерей массы тела (R=0,518, р<0,01). В самой многочисленной группе пациентов с ОЖ II cтепени установлены сильные достоверные корреляции снижения содержания нефрина в моче после БО со снижением сывороточных уровней холестерина (R=0,886, р<0,05) и глюкозы (R=0,890, р<0,05). У пациентов с нормальной и сниженной СКФ (<90 мл/мин/ 1,73 м2), исключая пациентов с абсолютной гиперфильтрацией, снижение нефринурии тесно ассоциировалось со снижением сывороточного уровня креатинина (R=0,687, р<0,05).
| Показатели | Нефринурия ≥14,89 нг/мл, n=21 | Нефринурия <14,89 нг/мл,n=11 |
|---|---|---|
| ОЖ III степени и сверхожирение | 21 (100) | 5 (45,5) |
| Инсулинорезистентность | 7/17 (41,2) | 3/10 (30,0) |
| Нарушения углеводного обмена | 14 (66,7) | 5 (45,5) |
| ХБП 2-3 стадии | 7 (33,3) | 1 (9,1) |
| Альбуминурия А2-А3 | 19 (90,5) | 7 (63,6) |
| АГ III степени (%) | 10 (47,6) | 1 (9,1) |
Мы выявили прямую достоверную взаимосвязь между исходной нефринурией и послеоперационной альбуминурией (R=0,411, р<0,05). Это позволило предположить, что исходная экскреция нефрина с мочой может рассматриваться не только в качестве маркера тяжести подоцитарного повреждения, но и показателя, который позволит оценить прогноз пациентов, в частности, предсказать изменение альбуминурии после хирургической коррекции массы тела. Мы проанализировали динамику АСR на фоне снижения массы тела у больных в зависимости от исходной нефринурии. По дискриминационному уровню 14,89 нг/мл, равному медиане этого показателя в общей группе больных, были выделены подгруппы с высоким (≥14,89 нг/мл, 17/33, 51,5%) и низким (<14,89 нг/мл, 16/33, 48,5%) уровнем нефрина в моче. У пациентов с нефринурией ≥14,89 нг/мл чаще определялись тяжелые степени ОЖ в сочетании с инсулинорезистентностью, нарушениями углеводного обмена, тяжелой артериальной гипертонией, альбуминурией и ХБП 2-3 стадии (табл. 3). В этой группе пациентов с ОЖ после БО снижение ACR было менее выраженным (на 0,3 нг/мл, р>0,05). И наоборот, среди пациентов с нефринурией <14,89 нг/мл выявлялось преимущественно ОЖ II степени, реже встречались сопутствующие нарушения углеводного обмена и артериальная гипертония, была выше доля пациентов без альбуминурии или с ХБП С1. Именно в группе пациентов с ОЖ и низкой нефринурией снижение АСR после БО оказалось статистически достоверным (на 0,74 нг/мл; р=0,04). Полученные данные подтверждают прогностическое значение нефринурии для пациентов с морбидным ожирением.
Обсуждение
Стремительный рост заболеваемости ОЖ является серьезной проблемой современного здравоохранения. Уже в первое десятилетие XXI века стало практически невозможным вернуться к показателям распространенности избыточной массы тела и ОЖ, наблюдавшимся в конце XX века [1,18]. ОЖ сопровождается десятикратным увеличением риска одного из прогностически неблагоприятных системных проявлений – поражения почек [19], которое реализуется через прямое воздействие непосредственно связанных с ОЖ факторов, определяющих развитие специфической гломерулопатии, а также через инсулинорезистентность, сахарный диабет, гиперлипидемию, артериальную гипертонию и другие факторы [2,20]. Одним из ведущих патофизиологических механизмов поражения почек при ОЖ являются нарушения внутрипочечной гемодинамики с развитием гиперфильтрации, приводящей к появлению альбуминурии, протеинурии и, в конечном итоге, развитию гломерулосклероза. Важную роль играет также непосредственное влияние жировой ткани на почки путем продукции адипоцитокинов, которые вызывают воспаление, оксидативный стресс, апоптоз, активируют ренин-ангиотензин-альдостероновую систему [2,20]. Эффективная коррекция массы тела посредством БО, приводящих к существенному уменьшению объема жировой ткани и устранению ее токсических эффектов, коррекции метаболических и гемодинамических нарушений, является важной составляющей нефропротективной стратегии, направленной на уменьшение риска развития терминальной хронической почечной недостаточности.
В нашем исследовании у 76% пациентов с морбидным ОЖ до БО наблюдалось повышение экскреции с мочой альбумина, причем у трети из них альбуминурия была высокой и очень высокой (А2 и А3). Среди этих пациентов преобладали лица с высокой степенью ОЖ, сопутствующими нарушениями углеводного обмена и гиперфильтрацией, что представляется вполне обоснованным в свете современных представлений о механизмах развития альбуминурии при морбидном ОЖ.
Мы выявили достоверное уменьшение альбуминурии, которую оценивали с помощью ACR, у пациентов с ОЖ после БО, что может быть прямым следствием потери массы тела с улучшением внутриклубочковой гемодинамики, а также устранением неблагоприятного воздействия на почечную функцию ассоциированных с ОЖ сопутствующих состояний, уменьшением массы жировой ткани и токсического действия адипоцитокинов. Наши данные согласуются с результатами других авторов, которые наблюдали достоверное снижение альбуминурии на фоне снижения массы тела после БО, коррелирующее с улучшением метаболических показателей, уменьшением выраженности системного воспаления [21-23]. Результаты крупного проспективного шведского исследования SOS (1987-2001 гг.) продемонстрировали достоверное снижение частоты впервые возникшей альбуминурии через 15 лет после оперативного лечения у 1498 пациентов с ОЖ по сравнению с контрольной группой из 1610 пациентов с морбидным ОЖ [24].
Предпосылками к изучению экскреции нефрина с мочой у больных с морбидным ОЖ послужили экспериментальные и клинические исследования, в которых изучались мочевые подоцитарные биомаркеры гломерулярного повреждения при заболеваниях почек иммунного и неиммунного генеза [25-28]. В этих исследованиях было показано, что ультраструктурные и функциональные нарушения в подоцитах, приводящие к повышенной экскреции с мочой нефрина, предшествуют развитию альбуминурии. Эти данные позволили рассматривать нефрин в моче в качестве раннего маркера поражения почек, а установленные тесные взаимосвязи между выраженностью нефринурии и тяжестью клинико-лабораторных проявлений заболевания предполагали возможность использования этого показателя для мониторирования активности и оценки прогноза поражения почек. В ряде работ, главным образом экспериментальных, было убедительно показано, что повреждение подоцитов может происходить вследствие растяжения гломерулярной базальной мембраны под действием гидравлического “пресса" на фоне внутриклубочковой гипертензии. В качестве повреждающих факторов могут выступать провоспалительные цитокины, конечные продукты гликозилирования, гиперлипидемия, оксидативный стресс, ряд адипокинов, компоненты активированной ренин-ангиотензин-альдостероновой системы и т.д. [29-31]. Данные процессы и факторы активированы у пациентов с ОЖ, что предполагает вклад вызванного ими подоцитарного повреждения в общий механизм повреждения почек при морбидном ОЖ.
В нашем исследовании у пациентов с морбидным ОЖ было выявлено повышение экскреции нефрина с мочой, тесно коррелирующее с исходными антропометрическими (ИМТ, избытком массы тела, ОТ) и метаболическими параметрами. Примечательно, что нефринурия была высокой не только у пациентов с альбуминурией разной степени выраженности, но и у пациентов без традиционных признаков ХБП (с нормальными СКФ и альбуминурией). Эти результаты согласуются с данными других исследований о раннем вовлечении подоцитов в механизмы повреждения почечной ткани, например, при сахарном диабете, при котором многие пути воздействия на подоциты очень схожи с ОЖ [8,29]. Ожидаемо, что у пациентов с ОЖ и очень высокой альбуминурией (А3) мы обнаружили наиболее высокие показатели нефринурии.
В подгруппе пациентов со сверхожирением наряду с вышеописанными корреляциями была выявлена сильная отрицательная связь исходных нефринурии и СКФ, что отражает роль подоцитарного повреждения не только в нарушении проницаемости гломерулярного фильтра, но и в развитии гломерулосклероза и формировании дисфункции почек (особенно при тяжелых формах ОЖ). Как было показано при сахарном диабете, длительное и интенсивное воздействие на подоциты повреждающих факторов, многие из которых сходны при сахарном диабете и ОЖ, вызывает усиленное слущивание подоцитов с гломерулярной базальной мембраны и появление их в моче (подоцитурия). Усиленная подоцитурия приводит к уменьшению числа подоцитов в клубочке (подоцитопения), что не только усугубляет нарушение гломерулярной проницаемости, но и способствует развитию гломерулосклероза и снижению функции почек [30,31].
В нашем исследовании после БО во всей группе пациентов с ОЖ снижение нефринурии не достигло статистической значимости, что, с одной стороны, могло объясняться небольшим объемом выборки или необходимостью в более длительном наблюдении. С другой стороны, отсутствие значимой динамики нефринурии у части пациентов могло свидетельствовать о более тяжелом исходном поражении подоцитов. У большинства больных с исходно высокой нефринурией после снижения массы тела не наблюдалось полной нормализации уровня альбумина в моче, что косвенно отражает бóльшую тяжесть гломерулярного повреждения как следствие ассоциированных с ОЖ нарушений внутрипочечной гемодинамики и нефротоксичности продуцируемых жировой тканью цитокинов. Можно полагать, что высокая нефринурия, особенно длительно сохраняющаяся, является неблагоприятным прогностическим признаком, косвенно указывающим на риск развития в почке стойких изменений, в том числе, формирование свойственного ОЖ фокального сегментарного гломерулосклероза. По-нашему мнению, персистирующая высокая нефринурия может обосновывать более длительное применение современных средств нефропротекции (препаратов, блокирующих неблагоприятные эффекты активированной ренинангиотензин-альдостероновой системы, ингибиторов глюкозо-натриевых котранспортеров 2 типа) у пациентов, не достигших целевых значений ИМТ после БО, а, возможно, и у части пациентов с достаточной потерей массой тела, но с сохраняющимися последствиями метаболических и гемодинамических нарушений, ассоциированных с ОЖ.
В то же время, в нашем исследовании у пациентов с менее высокой исходной нефринурией и менее тяжелым ОЖ после эффективной хирургической коррекции массы тела наблюдалось значимое снижение экскреции альбумина с мочой, коррелирующе с выраженностью потери массы тела, степенью коррекции сопутствующих нарушений жирового и углеводного обмена. У большинства таких пациентов исходно отсутствовали признаки ХБП, а у пациентов, у которых исходно определялись традиционные маркеры ХБП, поражение почек было обратимым. Полученные нами данные позволяют рассматривать низкий уровень нефрина в моче у пациентов с морбидным ОЖ как признак благоприятного прогноза, указывающий на возможную обратимость альбуминурии после коррекции массы тела.
Ограничением настоящего исследования является небольшой объем выборки пациентов, что требует дальнейших исследований для уточнения информативности определения нефрина на бóльшей популяции пациентов с морбидным ОЖ и с бóльшими сроками наблюдения после коррекции массы тела.
Заключение
У больных с морбидным ОЖ значительное снижение массы тела после БО в течение ближайших 1-1,5 года оказывает положительное влияние на альбуминурию и функциональное состояние почек как за счет снижения общей массы жировой ткани, так и эффективного воздействия на течение сопутствующих ОЖ заболеваний. У пациентов с ОЖ после БО выявлена тенденция к снижению экскреции с мочой маркера подоцитарного повреждения – нефрина (статистически значимое у пациентов с ОЖ и сахарным диабетом), уровень которого у данных пациентов значительно повышен и коррелирует с тяжестью ОЖ, метаболических и гемодинамических нарушений. Определение уровня нефрина в моче может рассматриваться как перспективный метод ранней (до повышения альбуминурии) диагностики функциональных и структурных нарушений в почках при морбидном ОЖ, как инструмент мониторирования течения и прогнозирования ответа на лечение.
Используемые источники
- Ковесди Ч., Фурс С., Зоккали К. Ожирение и заболевания почек: скрытые последствия эпидемиии. Нефрология 2017;21(2):10-9 [Kovesdy C, Furth S, Zoccali C. Obesity and kidney disease: hidden consequences of the epidemic. Nephrology 2017;21(2):10-9 (In Russ.)].
- D’Agati VD, Chagnac A, de Vries AP et al. Obesity-related glomerulopathy: clinical and pathologic characteristics and pathogenesis. Nat Rev Nephrol 2016;12:453–71.
- Шилов Е.М., Смирнов А.В., Козловская Н.Л. Нефрология. Клинические рекомендации, ГЭОТАР-Медиа, Москва, 2016;40-1. [Shilov EM, Smirnov AV, Kozlovskaya NL. Nephrology. Clinical recommendations, GEOTAR-Media, Moscow, 2016;40-1 (In Russ.)].
- Добронравов В.А., Смирнов А.В., Каюков И.Г. Многогранная альбуминурия: аспекты клинического значения. Нефрология 2009;13(3):33-8 [Dobronravov VA, Smirnov AV, Kayukov IG. Manysided albuminuria: aspects of clinical value. Nephrology 2009;13(3):33-8 (In Russ.)].
- Caramori ML, Fioretto P, Mauer M. The need for early predictors of diabetic nephropathy risk: is albumin excretion rate sufficient? Diabetes 2000;49:1399-408.
- Чеботарева Н.В., Бобкова И.Н., Козловская Л.В. Нефринурия как показатель структурно-функциональных нарушений гломерулярного фильтра у больных протеинурическими формами нефрита. Клиническая нефрология 2010;4:45-51 [Chebotareva NV, Bobkova IN, Kozlovskaya LV. Nephrinuria as an indicator of structural and functional disorders of the glomerular filter in patients with proteinuric forms of nephritis. Clinical nephrology 2010;4:45-51 (In Russ.)].
- Чеботарева Н.В., Бобкова И.Н., Лысенко Л.В. Роль подоцитарной дисфункции в прогрессировании хронического гломерулонефрита. Терапевтический архив 2018;6:92-7 [Chebotareva NV, Bobkova IN, Lysenko LV. The role of podocytes dysfunction in chronic glomerulonephritis progression. Terapevticheskii Arkhiv 2018;6:92-7 (In Russ.)].
- Щукина А.А., Бобкова И.Н., Шестакова М.В. и др. Экскреция с мочой маркеров повреждения подоцитов у больных сахарным диабетом. Терапевтический архив 2015;1:31-8 [Shchukina AA, Bobkova IN, Shestakova MV et al. Urinary excretion of markers for podocyte injury in patients with diabetes mellitus. Terapevticheskii Arkhiv 2015;1:31-8 (In Russ.)].
- Яшков Ю.И., Никольский А.В., Бекузаров Д.К. и др. Семилетний опыт применения операции билиопанкреатического отведения в модификации Hess-Marceau в лечении морбидного ожирения и сахарного диабета 2 типа. Ожирение и метаболизм 2012;2:43-8 [Yashkov YuI, Nikol'skiy AV, Bekuzarov DK et al. A 7-year experience with the surgery of biliopancreatic diversion in the modification of Hess-Marceau for the treatment of morbid obesity and type 2 diabetes. Obesity and Metabolism 2012;2:43-8 (In Russ.)].
- Agrawal V, Khan I, Rai B et al. The effect of weight loss after bariatric surgery on albuminuria. Clin Nephrol 2008;70:194–202.
- Palomar R, Fernandez-Fresnedo G, Dominguez-Diez A et al. Effects of weight loss after biliopancreatic diversion on metabolism and cardiovascular profile. Obes Surg 2005;15:794–8.
- Nair M, Roux CW, Docherty NG et al. Mechanisms underpinning remission of albuminuria following bariatric surgery. Obes Nutr 2016;23:366-72.
- Li K, Zou J, Ye Z et al. Effects of bariatric surgery on renal function in obese patients: A systematic review and meta analysis. Plos One 2016;11(10)1-18.
- Дедов И.И., Мельниченко Г.А., Шестакова М.В. и др. Национальные клинические рекомендации по лечению морбидного ожирения у взрослых. Ожирение и метаболизм 2018;15(1):53-70. [Dedov II, Melnichenko GA, Shestakova MV et al. Russian national clinical recommendations for morbid obesity treatment in adults. Obesity and metabolism 2018;15(1):53-70 (In Russ.)].
- KGIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Intern Suppl 2013;3(1):86-8.
- Шляхто Е.В., Недогода С.В., Конради А.О. и др. Концепция новых Национальных клинических рекомендаций по ожирению. Российский кардиологический журнал 2016;4:7-13 [Shlyakhto EV, Nedogoda SV, Konradi АО, et al. The concept of novel national clinical guidelines on obesity. Russ J Cardiol 2016;4:7–13 (In Russ.)].
- Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Клинические рекомендации 2019;9 [Dedov II, Shestakova MV, Mayorov AY. Standards of specialized diabetes care 2019;9 (In Russ.)].
- Sharma I, Liao Y, Zheng Х et al. New pandemic: obesity and associated nephro - pathy. Front Med 2021;8:673556.
- Koch VH. Obesity facts and their influence on renal function across the life span. Front Med 2021;8:704409.
- Yang S, Cao C, Deng T et al. Obesity-related glomerulopathy: A latent change in obesity requiring more attention. Kidney Blood Press Res 2020;45(4):510-22.
- Park S, Kim YJ, Choi C et al. Bariatric surgery can reduce albuminuria in patients with severe obesity and normal kidney function by reducing systemic onflammation. Obes Surg 2017;28(3):831-7.
- McIsaac M, Kaban G, Clay A et al. Long-term impact of bariatric surgery on renal outcomes at a community-based publicly funded bariatric program: The Regina Bariatric Study. Can J Kidn Health Dis 2019;6:1-8.
- Saeed K, Ahmed L, Suman P et al. Bariatric surgery improves renal function: a large inner-city population outcome study. Obes Surg 2021;31(1):260-6.
- Carlsson LMS, Romeo S, Jacobson P et al. The incidence of albuminuria after bariatric surgery and usual care in swedish obese subjects (SOS): a prospective controlled intervention trial. Intern J Obes 2015;39(1):169-75.
- Kandasamy Y, Smith R, Lumbers E et al. Nephrin – a biomarker of early glomerular injury. Biomarker Res 2014;2(21):1-8.
- Kostovska I, Tosheska-Trajkovska K, Topuzovska S et al. Urinary nephrin is earlier, more sensitive and specific marker of diabetic nephropathy than microalbuminuria. Med Biochem 2020;39(1):83-90.
- Chebotareva N, Bobkova I, Lysenko L, Moiseev S. Urinary markers of podocyte dysfunction in chronic glomerulonephritis. Adv Exp Med Biol 2021;1306:81-99.
- Бобкова И.Н., Шестакова М.В., Щукина А.А. Диабетическая нефропатияфокус на повреждения подоцитов. Нефрология 2015;19(2):33-44. [Bobkova IN, Shestakova MV, Schukina AA. Diabetic nephropathy – focus on podocytes damage. Nephrology 2015;19(2):33-44 (In Russ.)].
- Diez-Sampedro A, Lenz O, Fornoni A. Podocytopathy in diabetes: a metabolic and endocrine disorder. Am J Kidney Dis 2011;58(4):637-46.
- Podgórski P, Konieczny A, Lis Ł et al. Glomerular podocytes in diabetic renal disease. Adv Clin Exp Med 2019;28(12):1711-5.
- Бобкова И.Н., Шестакова М.В., Щукина А.А. Повреждение подоцитов при сахарном диабете. Сахарный диабет 2014;17(3):39-50 [Bobkova IN, Shestakova MV, Schukina AA. Damage to podocytes in diabetes mellitus. Diabetes mellitus 2014;17(3):39-50 (In Russ.)].
