Эффективность вакцины Гам-КОВИД-Вак (Спутник V) в профилактике тяжелого течения COVID-19 и смерти у госпитализированных взрослых пациентов
Изучение эффективности вакцинации Гам-КОВИД-Вак в профилактике смерти от любых причин у госпитализированных пациентов с COVID-19.
В проспективное когортное исследование, проводившееся в ноябре-декабре 2021 г., включали всех госпитализированных пациентов с COVID-19, которые ранее не были вакцинированы или получили по крайней мере первый компонент Гам-КОВИД-Вак (Спутник V) за 21 день и более до госпитализации. Первичной конечной точкой была смерть от любых причин во время госпитализации. Нейтрализующие IgG антитела к рецептор-связывающему домену (RBD) белка S1 вируса SARS-CoV-2 определяли в первые 72 ч после госпитализации с помощью хемилюминесцентного иммуноанализа (Architect, Abbott).
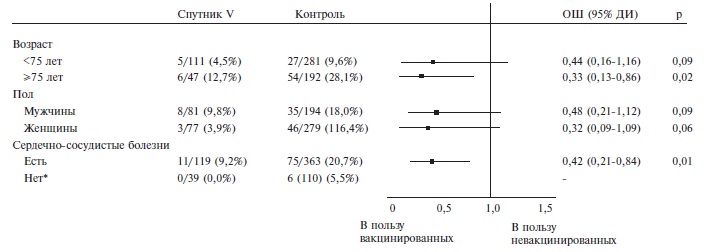
В исследование были включены 158 вакцинированных пациентов и 473 больных, не получавших какие-либо вакцины против COVID-19. По данным многофакторного регрессионного анализа, выполненная ранее вакцинация Гам-КОВИД-Вак сопровождалась достоверным снижением риска смерти от любых причин на 62% (отношение шансов 0,38, 95% доверительный интервал 0,19-0,77). Защитный эффект вакцинации на летальность проявлялся в подгруппах пациентов, выделенных с учетом пола, возраста и наличия сердечно-сосудистых заболеваний, и зависел от титра нейтрализующих антител к рецептор-связывающему домену спайкового белка вируса.
Гам-КОВИД-Вак снижает риск смерти от любых причин у госпитализированных пациентов с COVID-19, развившимся несмотря на вакцинацию.
В мае 2022 г. общее число случаев COVID-19, зарегистрированных в мире с начала пандемии, превысило 500 млн, а 6 млн человек умерли от инфекции [1]. В настоящее время для профилактики SARS-CoV-2 инфекции используется более десятка вакцин, созданных с помощью различных технологий. В крупных клинических исследованиях их эффективность достигла 95% и более [2,3]. Однако со временем стало очевидным, что вакцинация, как и перенесенная SARS-CoV-2 инфекция, далеко не всегда позволяет избежать заражения вирусом, что объясняется отсутствием адекватного иммунного ответа у части людей, прежде всего с подавленным иммунитетом, или постепенным его угасанием по мере увеличения срока после вакцинации, а также с появлением новых штаммов вируса, таких как омикрон, отличающихся большим числом мутаций. В этих условиях были пересмотрены цели вакцинации, которые сегодня в первую очередь предполагают профилактику более тяжелого течения инфекции и госпитализаций, а также развития дыхательной недостаточности и смерти у госпитализированных больных [4]. Результаты ряда клинических исследований подтвердили, что применение различных вакцин против COVID-19 оказывает благоприятное влияние на течение заболевания в случае заражения вирусом [5,6]. Например, среди 4513 американцев, перенесших COVID-19 в марте-августе 2021 года, когда альфа-вариант постепенно заменялся дельта-вариантом, вакцинация мРНК-вакцинами сопровождалась не только снижением частоты госпитализаций, но и риска перевода на искусственную вентиляцию легких (ИВЛ) и смерти у госпитализированных пациентов [7]. Сходные данные были получены в Словении осенью 2021 г., когда уже преобладал дельта-вариант вируса. В этом исследовании у 864 госпитализированных пациентов с COVID-19 выполненная ранее полная вакцинация одной из четырех вакцин против COVID-19, зарегистрированных в Европейском союзе (BNT162b2, ChAdOx-1S, mRNA-1273 или Ad.26.COV2.S), ассоциировалась с достоверным снижением риска неблагоприятных исходов заболевания, включая ИВЛ и смерть [8].
Эффективность и безопасность rAd26/rAd5 векторной вакцины Гам-КОВИД-Вак (Спутник V) в профилактике SARS-CoV-2 инфекции были установлены в рандомизированном плацебо-контролируемом исследовании почти у 22000 участников [9]. Эффектив ность вакцины составила 91,6%, а большинство зарегистрированных нежелательных явлений были легкими. Результаты клинических исследований 3 фазы rAd26 векторной вакцины (Спутник Лайт), которая представляет собой первый компонент вакцины Гам-КОВИД-Вак, не опубликованы. Тем не менее, в исследовании 1/2 фазы ее введение вызывало выраженный гуморальный и клеточный иммунный ответ против SARS-CoV-2 [10], а в крупном ретроспективном исследовании, проводившемся в Аргентине у 40387 участников в возрасте 60-79 лет, эффективность первого компонента вакцины Гам-КОВИД-Вак в профилактике лабораторно подтвержденной инфекции, госпитализаций и смерти составила 78,6%, 87,6% и 84,8%, соответственно [11].
В середине 2021 г. в российских стационарах значительно увеличилась доля пациентов с COVID-19, развившимся после перенесенной ранее SARS-CoV-2 инфекции или вакцинации. Течение заболевания у таких больных не изучалось. Целью проспективного исследования была оценка эффективности выполненной ранее вакцинации Гам-КОВИД-Вак в профилактике смерти от любых причины у госпитализированных пациентов с COVID-19.
Материал и методы
Дизайн исследования и критерии отбора. В проспективное когортное исследование, проводившееся на базе перепрофилированной клиники им. Е.М. Тареева с 26.10.2021 по 31.12.2021 гг., включали всех госпитализированных пациентов с COVID-19, которые ранее были иммунизированы вакциной Гам-КОВИД-Вак или не были вакцинированы. Пациентов считали вакцинированными, если они получили по крайней мере первый компонент вакцины Гам-КОВИ-Вак (Спутник V) за 21 день и более до госпитализации. Из исследования исключали пациентов, которые получили любые другие вакцины против COVID-19 или только первый компонент вакцины Гам-КОВИД-Вак в течение менее 21 дня до госпитализации. Протокол исследования был одобрен этическим комитетом Сеченовского Университета.
Диагноз новой коронавирусной инфекции устанавливали на основании выделения РНК вируса методом полимеразной цепной реакции (ПЦР) со слизистой оболочки верхних дыхательных путей. Если результаты вирусологического исследования были отрицательными, то критериями диагноза служили клинические признаки острой респираторной инфекции в сочетании с характерными данными компьютерной томографии органов грудной клетки (высокая вероятность COVID-19) при отсутствии других возможных причин заболевания.
Конечные точки. Пациентов наблюдали до выписки из стационара или до смерти. Первичной конечной точкой была смерть от любых причин во время госпитализации, вторичными – доля пациентов, которым не потребовались введение кислорода или респираторная поддержка, максимальный уровень респираторной поддержки (введение кислорода через канюли, высокопоточная оксигенотерапия [ВПО], неинвазивная вентиляция легких [НИВЛ] или ИВЛ) и длительность госпитализации. Анализ конечных точек проводили у вакцинированных (основная группа) и невакцинированных (контрольная группа) больных.
У всех пациентов регистрировали демографические, клинические и лабораторные показатели и сопутствующие заболевания, которые могли оказать влияние на течение COVID-19, в том числе артериальную гипертонию, ишемическую болезнь сердца (ИБС), инсульт в анамнезе, фибрилляцию предсердий, ожирение, сахарный диабет, заболевания органов дыхания (хроническая обструктивная болезнь легких, бронхиальная астма, интерстициальные болезни легких), ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы. Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании величины индекса массы тела (≥30,0 кг/м2). При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты. При компьютерной томографии оценивали распространенность двусторонней вирусной пневмонии.
Анализ антител. Эффективность вакцины Гам-КОВИД-Вак анализировали также в зависимости от наличия нейтрализующих IgG антител к рецептор-связывающему домену (RBD) белка S1 вируса SARS-CoV-2, которые определяли в первые 72 ч с помощью хемилюминесцентного иммуноанализа (Architect, Abbott) количественным методом. Результаты интерпретировали в соответствии с инструкциями производителя.
Статистический анализ. Описательный статистический анализ проводили с использованием программы JAMOVI 2.2.5 (Cидней, Австралия). Нормальность распределения определяли с помощью критерия Шапиро-Уилка. Данные для количественных показателей представлены в виде медианы и межквартильного размаха (при распределении, отличающемся от нормального) или в виде среднего арифметического и среднеквадратического отклонения (при нормальном распределении). Данные для качественных переменных представлены в виде абсолютных значений и доли в процентах. Медианы количественных показателей в двух группах сравнивали с помощью U-критерия МаннаУитни. Сравнение групп по качественным признакам проводилось с помощью критерия χ2 Пирсона (при количестве наблюдений в группе ≥10) и точного критерия Фишера (при количестве наблюдений в группе <10). Расчет отношения шансов (ОШ) для факторов, ассоциированных с развитием летального исхода, проводили с помощью логистической регрессионной модели. Исходную однофакторную модель корректировали по возрасту и полу. Данные о времени до события оценивали с использованием метода Каплана-Мейера и логарифмического рангового теста. Различия считали достоверными при величине p<0,05. Результаты приведены с двусторонним уровнем значимости.
Результаты
Характеристика больных. С 26.10.2021 по 31.12.2021 в клинику им. Е.М. Тареева были госпитализированы 753 пациента с COVID-19. 122 пациента, привитых вакцинами ЭпиВакКорона (n=56), КовиВак (n=29) или получивших только первый компонент Гам-КОВИД-Вак менее, чем за 21 день до госпитализации (n=37), были исключены из исследования. У 607 (95,3%) из 631 пациента, включенного в исследование, диагноз COVID-19 был подтвержден с помощью ПЦР, у остальных – установлен на основании клинической картины и характерных изменений при компьютерной томографии легких. Основную группу составили 158 пациентов, получивших ранее оба компонента вакцины ГамКОВИД-Вак (у 145) или только первый компонент вакцины (у 13). Медиана срока от введения последней дозы вакцины до госпитализации составила 20 недель (14;26). В контрольную группу были включены 473 невакцинированных пациента.
Хотя вакцинированные пациенты были досто верно моложе невакцинированных больных (табл. 1), тем не менее, в обеих группах преобладали лица пожилого и старческого возраста (медианы возрас та 67 и 71 год, соответственно; р=0,001). Доля муж чин в основной группе была выше, чем в контрольной (50,6% и 41,0%, соответственно; р=0,02). У большинства пациентов имелись сопут ствующие заболевания, прежде всего сердечно сосудистые, ожирение и сахарный диабет 2 типа. Реже встречались заболевания органов дыхания, опухоли, гемобластозы и аутоиммунные ревмати ческие болезни. Частота сопутствующих заболева ний была сопоставимой в двух группах, за исключением ишемической болезни сердца, кото рая чаще наблюдалась у пациентов контрольной группы. Доля больных, у которых распространен ность поражения легких при поступлении превы шала 50%, в двух группах была практически одинаковой (10,2% и 11,3%, соответственно), одна ко медиана насыщения крови кислородом (SpО2) при поступлении была ниже у невакцинированных пациентов. Достоверные различия между группами были выявлены при анализе лабораторных показателей при поступлении. Медиана содержания С-реактивного белка у вакцинированных пациентов достоверно превы шала таковую у невакцинированных больных, однако медианы содержания ферритина и ЛДГ, наоборот, были выше в контрольной группе. Кроме того, у невакцини рованных пациентов была выше медиана содержания D-димера и ниже количество лейкоцитов и лимфоци тов в крови. Пациенты в обеих группах были госпита лизированы в среднем на 7-й день болезни (p=0,10 между группами). Большинство пациентов в основной и контрольной группе во время госпитализации получа ли лечение глюкокортикостероидами (93,0% и 89,2%). Доля больных, которым вводили различные ингибито ры интерлейкина-6, также была сопоставимой (44,1% и 44,7%, соответственно), в то время как частота приме нения фавипиравира была ниже в основной группе (19,1% и 27,1%, р=0,04).
| Показатели | Спутник V (n=158) |
Контроль (n=473) |
p |
|---|---|---|---|
| Примечание: *при поступлении. Приведены медианы и межквартильный размах, если не указано иное. Ингибиторы интерлейкина (ИЛ)-6: олокизумаб, левилимаб, сарилумаб и/или тоцилизумаб | |||
| Возраст, лет | 67 (52;76) | 71 (61;81) | 0,001 |
| Мужчины, n (%) | 80 (50,6) | 194 (41,0) | 0,02 |
| КТ 3-4*, n (%) | 16 (10,2) | 53 (11,3) | 0,71 |
| SpO2* | |||
| Сопутств. заболевания, n (%) | |||
| Сердечно-сосудистые | 119 (75,3) | 363 (76,5) | 0,90 |
| Артериальная гипертония | 115 (72,7) | 350 (73,9) | 0,85 |
| Ишемическая болезнь сердца | 23 (14,5) | 108 (22,8) | 0,02 |
| Инсульт в анамнезе | 12 (7,5) | 43 (9,0) | 0,57 |
| Фибрилляция предсердий | 19 (12,0) | 77 (16,2) | 0,20 |
| ХСН | 18 (11,5) | 59 (12,5) | 0,75 |
| Сахарный диабет 2 типа | 37 (23,4) | 108 (22,8) | 0,84 |
| Ожирение | 62 (39,2) | 173 (36,5) | 0,54 |
| Респираторные | 25 (15,9) | 96 (20,3) | 0,22 |
| Опухоли | 12 (7,5) | 45 (9,5) | 0,47 |
| Гемобластозы | 2 (1,2) | 3 (0,6) | 0,62 |
| Лабораторные показатели* | |||
| С-реактивный белок, мг/л | 69,8 (21,8;116) | 46,8 (17,9;89,9) | 0,006 |
| Лейкоциты, ×109/л | 6,4 (4,8; 8,8) | 5,1 (3,7;6,7) | <0,001 |
| Лимфоциты, ×109/л | 1,0 (0,7;1,3) | 0,9 (0,6;1,2) | 0,002 |
| D-димер, мкг/л | 0,44 (0,30;0,68) | 0,58 (0,36;1,00) | 0,004 |
| Ферритин, нг/мл | 360 (185;530) | 396 (219;740) | 0,052 |
| ЛДГ, Ед/мл | 279 (220;371) | 318 (241;442) | <0,001 |
| Лечение, n (%) | |||
| Ингибиторы ИЛ-6 | 65 (41,1) | 211 (44,7) | 0,43 |
| Глюкокортикостероиды | 147 (93,0) | 420 (89,2) | 0,33 |
| Фавипиравир | 30 (19,1) | 124 (27,1) | 0,04 |
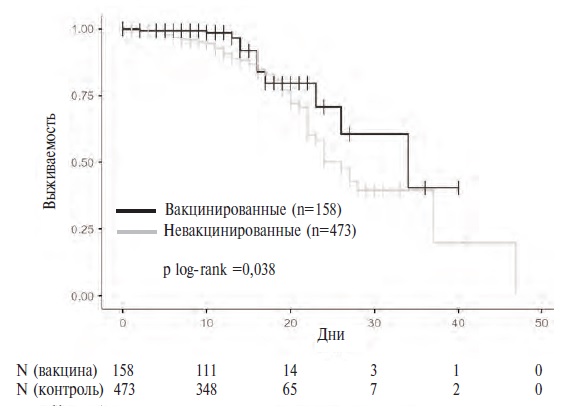
Первичная конечная точка (смерть). Во время госпитализации умерли 11 (6,9% из 158 вакцинированных пациентов и 81 (17,3%) из 473 невакцинированных больных (р=0,038). Медиана времени от момента госпитализации до летального исхода составила 16 дней (14;20) в основной группе и 13 дней (9;20) в контрольной группе (p=0,430). Выживаемость вакцинированных больных, которую анализировали с помощью метода Каплана-Мейера, была достоверно выше, чем у невакцинированных пациентов (p=0,038; рис. 1). По данным многофакторного регрессионного анализа (табл. 2), факторами риска смерти были возраст, фибрилляция предсердий, хроническая сердечная недостаточность (ХСН) и распространенное поражение легких (>50%). Выполненная ранее вакцинация вызывала достоверное снижение риска смерти примерно в 2,5 раза как при однофакторном анализе, так и в многофакторной модели с поправкой на возраст и пол (ОШ 0,38, 95% ДИ 0,19-0,77). Снижение риска было также выявлено в подгруппах пациентов, выделенных в зависимости от возраста, пола и наличия сердечно-сосудистых заболеваний, хотя эффект вакцинации не во всех случаях достиг статистической значимости (рис. 2).
| Факторы | Однофакторный анализ |
Многофакторный анализ |
||
|---|---|---|---|---|
| ОШ (95% ДИ) | p | ОШ (95% ДИ) | p | |
| Возраст старше 75 лет | 3,77 (2,36-6,00) | <0,001 | 2,96 (1,76-4,98) | <0,001 |
| Мужской пол | 1,16 (0,74-1,80) | 0,51 | - | - |
| Фибрилляция предсердий | 2,10 (1,22-3,62) | 0,01 | 2,06 (1,16-3,67) | 0,01 |
| ХСН | 2,03 (1,14-3,61) | 0,01 | 1,86 (1,01-3,44) | 0,04 |
| Ожирение | 0,91 (0,54-1,54) | 0,73 | - | - |
| ИБС | 0,72 (0,41-1,26) | 0,26 | - | - |
| Сахарный диабет | 1,61 (0,96-2,70) | 0,06 | - | - |
| Опухоль | 1,67 (0,81-3,42) | 0,15 | - | - |
| КТ 3-4 | 2,69 (1,44-5,02) | 0,002 | 2,54 (1,33-4,85) | 0,01 |
| Вакцинация | 0,41 (0,20-0,81) | 0,01 | 0,38 (0,19-0,77) | 0,01 |
Медиана возраста 11 умерших вакцинированных пациентов (8 мужчин) составила 84 года (от 65 до 86 лет). Десять из них получили две дозы вакцины Гам-КОВИД-Вак, а один – только первый компонент вакцины. У всех умерших пациентов имелись сердечно-сосудистые заболевания, а двое из них получали иммуносупрессивную терапию по поводу множественной миеломы или системной красной волчанки. Девять больных умерли от прогрессирующей дыхательной недостаточности, 1 – от повторного инсульта, а 1 – от разрыва аневризмы брюш ного отдела аорты.
Вторичные конечные точки. В основной группе доля пациентов, которым не потребовались введение кислорода и респираторная поддержка, была достоверно выше, чем в контрольной (65,8% и 43,3%, соответственно; p<0,001). При анализе максимального уровня респираторной поддержки во время госпитализации, отражающей выраженность гипоксии, в основной группе было выявлено достоверное снижение частоты оксигенотерапии через канюли (27,2% против 42,3%, p<0,001; табл. 3). Частота высокопоточной оксигенотерапии (ВПО) и НИВЛ в обеих группах была небольшой и достоверно не отличалась между ними. У вакцинированных пациентов была отмечена тенденции к снижению частоты ИВЛ, однако она не достигла статистической значимости. Медиана продолжительности госпитализации у вакцинированных пациентов была ниже, чем у невакцинированных больных (11 и 12 дней, соответственно; р=0,002).
| Показатели | Спутник V (n=158) |
Контроль (n=473) |
p |
|---|---|---|---|
| Не потребовалась респираторная поддержка, n (%) |
104 (65,8) | 205 (43,3) | <0,001 |
| Кислород, n (%) | 43 (27,2) | 200 (42,3) | <0,001 |
| ВПО, n (%) | 0 | 2 (0,4) | 1,00 |
| НИВЛ, n (%) | 2 (1,2) | 18 (3,8) | 0,18 |
| ИВЛ, n (%) | 9 (5,6) | 48 (10,1) | 0,09 |
| Длит. госпитализации, сутки | 11 (9;14) | 12 (9;16) | 0,002 |
Антитела к SARS-CoV-2. Количественный анализ нейтрализующих IgG антител к рецептор-связывающему домену (RBD) белка S1 вируса проводили у 156 пациентов основной группы и 50 пациентов контрольной группы. Медианы титров антител в двух группах составили 1237 BAU/мл (100,9;>5680), и 6,2 BAU/мл (0,6-30,0), соответственно (p<0,001). У 131 (83,9%) вакцинированных пациентов титр антител превышал 30 BAU/мл (верхняя граница межквартильного размаха в контрольной группе).
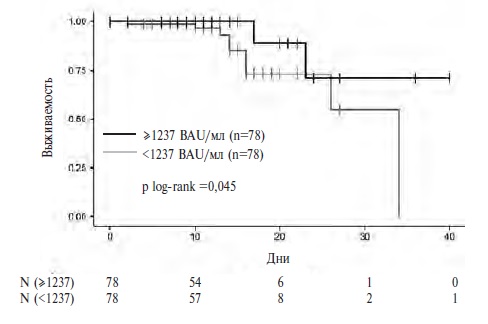
В подгруппе вакцинированных пациентов с титром антител выше медианы (≥1237 BAU/мл) летальность была ниже, чем в подгруппе пациентов с более низкими титрами антител (<1237 BAU/мл): 2/78 (2,6%) и 9/78 (11,5%), соответственно (p=0,03). Кроме того, в первой подгруппе отмечена тенденция к снижению частоты ИВЛ: 2/78 (2,6%) и 7/78 (8,9%), соответственно (р=0,09). Зави си мость летальности больных от титра нейтрализующих антител была подтверждена при анализе кривых выживаемости Каплана-Мейера (р=0,045; рис. 3). Следует отметить, что пациенты с более высокими титрами антител были старше больных группы сравнения (медианы 71 и 63 года, соответственно; р=0,006). Кроме того, у них была выше частота сердечно-сосудистых заболеваний (85,7% и 67,1%, р=0,006), сахарного диабета 2 типа (29,5% и 17,7%, р=0,08) и ожирения (46,2% и 32,5%, р=0,07), в то время как доля мужчин была сопоставимой (50,1% и 52,5%, р=0,70).
Обсуждение
Среди более 700 пациентов с COVID-19, госпитализированных в клинику в ноябре-декабре 2021 г., около четверти были ранее иммунизированы вакциной ГамКОВИД-Вак. У большинства вакцинированных пациентов (как и невакцинированных) определялись признаки синдрома гипервоспалительного ответа, в связи с чем им потребовалось введение глюкокортикостероидов и реже ингибиторов ИЛ-6. Более того, у трети пациентов наблюдалась гипоксия, потребовавшая применения кислорода или неинвазивной/инвазивной респираторной поддержки. Эти данные подтверждают, что вакцинация против COVID-19 не позволяет исключить возможность заражения вирусом и неблагоприятных исходов заболевания. Средне-тяжелое и тяжелое течение COVID-19, развившегося после вакцинации, может быть следствием наличия различных факторов риска, ухудшающих прогноз, таких как пожилой и старческий возраст, мужской пол и сопутствующие заболевания [12]. Медиана возраста вакцинированных пациентов составила 67 лет (84 года у умерших больных), а у 75,3% из них имелись сердечно-сосудистые заболевания, у 39,2% – ожирение, у 23,4% – сахарный диабет 2 типа. Сходные данные были получены в других клинических исследованиях. В Израиле среди 152 госпитализированных пациентов с COVID-19, развившимся несмотря на полную иммунизацию вакциной BNT162b2 (Pfizer/BioNTech), летальность в несколько раз превышала таковую в нашей когорте и составила 22%. Практически у всех пациентов имелись различные сопутствующие заболевания, в том числе сердечнососудистые болезни, сахарный диабет, хроническая болезнь почек, деменция, злокачественные опухоли [13].
В нашем исследовании среди вакцинированных пациентов летальность была достоверно ниже, чем среди госпитализированных больных, не прошедших вакцинацию (6,9% и 17,3%, соответственно; р=0,038), хотя в обеих группах преобладали люди пожилого и старческого возраста, страдавшие различными сопутствующими заболеваниями. Результаты многофакторного регрессионного анализа с поправкой на пол и возраст подтвердили, что выполненная ранее иммунизация вакциной Гам-КОВИД-Вак у госпитализированных пациентов с COVID-19 сопровождается снижением риска смерти от любых причин во время пребывания в стационаре примерно на 60%. Сходные результаты были получены у мужчин и женщин, лиц в возрасте старше и моложе 75 лет и пациентов с сопутствующими сердечно-сосудистыми заболеваниями.
В пользу более легкого течения COVID-19 у вакцинированных пациентов свидетельствовали также статистически значимое увеличение доли больных, которым не потребовались введение кислорода или респираторная поддержка, снижение потребности во введении кислорода, тенденция к снижению частоты интубации и сокращение длительности госпитализации. В основную группу мы включали пациентов, не только прошедших полный курс вакцинации, но и получивших один компонент вакцины Гам-КОВИД-Вак по крайней мере за 3 недели до госпитализации, так как в течение указанного срока обычно формируется поствакцинальный гуморальный и клеточный иммунный ответ [10]. Тем не менее, 92% пациентов, принявших участие в исследовании, были иммунизированы двумя дозами вакцины.
Эффективность вакцинации в профилактике неблагоприятных исходов COVID-19, в том числе у госпитализированных пациентов, была показана и в клинических исследованиях, проводившихся в других странах [5,6]. В США были изучены исходы у 1197 госпитализированных пациентов с COVID-19. 142 (11,9%) из них прошли иммунизацию мРНК вакцинами против SARS-CoV-2. Частота ИВЛ или смерти среди вакцинированных пациентов была в два раза ниже, чем среди невакцинированных (12,0% и 24,7%, соответственно) [7]. В другое американское исследование были включены 7305 взрослых пациентов с COVID-19, которые были госпитализированы в связи с необходимостью в оксигенотерапии [14]. 20% из них прошли полный курс вакцинации. Летальность в этой группе была достоверно ниже, чем среди невакцинированных больных, которые были подобраны по демографическим и клиническим показателям (propensity score matching) (9,0% и 16,3%, соответственно; p<0,0001).
К числу возможных причин развития COVID-19 у вакцинированных пациентов относят отсутствие адекватного иммунного ответа на вакцины, например, на фоне лечения иммуносупрессивными препаратами, такими как ритуксимаб, или постепенное угасание защитного иммунитета [15]. В клинических исследованиях титры нейтрализующих антител в первые месяцы после вакцинации коррелировали с эффективностью вакцин [16,17]. Тем не менее, в нашем исследовании у большинства вакцинированных пациентов, которым потребовалась госпитализации, определялись высокие титры нейтрализующих антител к рецептор-связывающему домену спайкового белка SARS-CoV-2, которые в части случаев даже превышали верхнюю границу диапазона измерений метода. Титры нейтрализующих антител, образующихся под действием любых вакцин против COVID-19, со временем постепенно уменьшаются [18-20], хотя в нашем исследовании медиана титра антител у пациентов, прошедших вакцинацию более 6 мес до госпитализации, была высокой и даже превышала таковую у пациентов, которые получили вакцину в течение меньшего срока до поступления в стационар. В целом полученные данные свидетельствуют о том, что высокий титр нейтрализующих антител после вакцинации не является показателем, позволяющим исключить риск развития COVID-19 и необходимость в госпитализации больных.
Титры антител к SARS-CoV-2, позволяющие предсказать надежность защитного эффекта вакцинации, до сих пор не определены [15]. В связи с этим для оценки течения COVID-19 в зависимости от уровня поствакцинального иммунитета мы распределили вакциниро ванных пациентов на две группы: с титрами нейтрализующих антител выше и ниже медианы (1237 BAU/мл). У пациентов с более высокими титрами антител летальность была достоверно ниже, чем у больных с более низкими титрами нейтрализующих антител (2,6% и 11,3%, соответственно; р=0,03), хотя у первых чаще встречались факторы риска неблагоприятного течения COVID. Сходные результаты были получены и при анализе кривых выживаемости Каплана-Мейера в этих двух группах. Таким образом, сохранение более высоких титров антител после вакцинации ассоциировалось со снижением летальности госпитализированных больных с COVID-19. Риск тяжелого течения COVID-19 у пациентов с более низкими титрами нейтрализующих антител отметили и некоторые другие авторы [8].
Наше исследование имеет ограничения. Набор пациентов проводился в конце 2021 года, когда в России преобладал дельта-вариант SARS-CoV-2, поэтому полученные данные сложно экстраполировать на случаи инфекции, вызванной штаммом омикрон. Мы оценивали статус вакцинации на основании опроса пациентов и не можем полностью исключить, что некоторые из них на самом деле не были вакцинированы. Однако доля случаев “ложной" вакцинации была небольшой, так как у большинства пациентов основной группы определялись нейтрализующие антитела к рецептор-связывающему домену спайкового белка SARS-CoV-2. При этом у пациентов контрольной группы нейтрализующие антитела не были выявлены или определялись в низком титре, что позволяло исключить влияние инфекции на формирование IgG антительного ответа. Мы впервые оценили влияние вакцинации Гам-КОВИД-Вак на течение COVID-19 у госпитализированных пациентов в достаточно крупном исследовании. Необходимо подчеркнуть, что мы включали в исследование всех пациентов, прошедших и не прошедших вакцинацию Гам-КОВИД-Вак, которые последовательно поступали в клинику, что позволяло исключить системную ошибку, связанную с отбором (selection bias).
Заключение
Результаты проспективного исследования показали, что выполненная ранее вакцинация Гам-КОВИД-Вак у госпитализированных пациентов с COVID-19 на 62% снижает риск смерти от любых причин, а также сопровождается увеличением доли больных, которым не потребовались введение кислорода или респираторная поддержка, снижением потребности в оксигенотерапии и длительности госпитализации. Защитный эффект вакцинации на летальность больных проявлялся в различных подгруппах пациентов, выделенных с учетом пола, возраста и наличия сердечно-сосудистых заболеваний, и зависел от титра нейтрализующих антител к рецептор-связывающему домену спайкового белка SARSCoV2.
Используемые источники
- Всемирная организация здравоохранения. Информационная панель ВОЗ по коронавирусным заболеваниям (COVID-19) https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports.
- Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020;383:2603-15.
- Baden LR, El Sahly HM, Essink B, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2021;384:403–16.
- WHO Working Group on the Clinical Characterisation and Management of COVID-19 infection. A minimal common outcome measure set for COVID-19 clinical research. Lancet Infect Dis 2020;20(8):e192-7.
- Haas EJ, Angulo FJ, McLaughlin JM, et al. Impact and effectiveness of mRNA BNT162b2 vaccine against SARS-CoV-2 infections and COVID-19 cases, hospitalisations, and deaths following a nationwide vaccination campaign in Israel: an observational study using national surveillance data. Lancet 2021;397:1819-29.
- Lopez Bernal J, Andrews N, Gower C, et al. Effectiveness of the PfizerBioNTech and Oxford-AstraZeneca vaccines on Covid-19 related symptoms, hospital admissions, and mortality in older adults in England: test negative case-control study. BMJ 2021;373:n1088.
- Tenforde MW, Self WH, Adams K, et al.; Influenza and Other Viruses in the Acutely Ill (IVY) Network. Association between mRNA vaccination and COVID19 hospitalization and disease severity. JAMA 2021;326:2043-54.
- Stupica D, Collinet-Adler S, et al. The impact of SARS-CoV-2 primary vaccination in a cohort of patients hospitalized for acute COVID-19 during Delta variant predominance. J Clin Med 2022;11(5):1191..
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, T et al; Gam-COVID-Vac Vaccine Trial Group. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021;397:671-81.
- Tukhvatulin AI, Dolzhikova IV, Shcheblyakov DV, et al. An open, non-randomised, phase 1/2 trial on the safety, tolerability, and immunogenicity of singledose vaccine "Sputnik Light" for prevention of coronavirus infection in healthy adults. Lancet Reg Health Eur 2021 Dec;11:100241.
- GonzЗlez S, Olszevicki S, Salazar M, et al. Effectiveness of the first component of Gam-COVID-Vac (Sputnik V) on reduction of SARS-CoV-2 confirmed infections, hospitalisations and mortality in patients aged 60-79: a retrospective cohort study in Argentina. EClinicalMedicine 2021;40:101126.
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармакол тер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outcomes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020; 29(3):25-36 (In Russ.)].
- Brosh-Nissimov T, Orenbuch-Harroch E, Chowers M, et al. BNT162b2 vaccine breakthrough: clinical characteristics of 152 fully vaccinated hospitalized COVID19 patients in Israel. Clin Microbiol Infect 2021;27(11):1652-7.
- Myers LC, Kipnis P, Greene J, et al. Adults hospitalized with breakthrough COVID-19 have lower mortality than matched unvaccinated adults. J Intern Med. 2022 May 9. doi: 10.1111/joim.13504.
- Lipsitch M, Krammer F, Regev-Yochay G, et al. SARS-CoV-2 breakthrough infections in vaccinated individuals: measurement, causes and impact. Nat Rev Immunol 2022;22(1):57-65.
- Khoury DS, Cromer D, Reynaldi A, et al. Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection. Nat Med 2021;27(7):1205-11.
- Earle KA, Ambrosino DM, Fiore-Gartland A, et al. Evidence for antibody as a protective correlate for COVID-19 vaccines. Vaccine 2021;39:4423-8.
- Chahla RE, Tomas-Grau RH, Cazorla SI, et al. Long-term analysis of antibodies elicited by SPUTNIK V: A prospective cohort study in Tucumán, Argentina. Lancet Reg Health Am 2022 Feb;6:100123.
- Sanchez L, Oviedo Rouco S, Pifano M, et al. Antibody durability at 1 year after Sputnik V vaccination. Lancet Infect Dis 2022;22(5):589-90.
- Levin EG, Lustig Y, Cohen C, et al. Waning immune humoral response to BNT162b2 COVID-19 vaccine over 6 months. N Engl J Med 2021;385:e84.
