Технология построения функции эффективности преднизолона на клинической модели лечения воспалительных заболеваний кишечника
Определение оптимальной дозы системных глюкокортикостероидов (преднизолона) для индукции ремиссии у больных язвенным колитом (ЯК) и болезнью Крона (БК) на основе технологии построения функции эффективности.
В исследование включены 86 больных в возрасте от 18 до 65 лет с активными воспалительными заболеваниями кишечника средней и тяжелой степени (61 – с ЯК, 25 – с БК). Для индукции ремиссии пациентам впервые назначали преднизолон в начальной дозе от 30 до 60 мг/сут с последующим снижением. Эффект терапии оценивали через две недели и на момент полной отмены преднизолона с использованием общепринятых критериев. Построение функции эффективности (зависимости “доза-эффект”) преднизолона проводилось по оригинальной методике, смысл которой заключается в статистическом преобразовании исходных клинических данных, получаемых в виде количественного выражения реально примененной совокупности доз и зарегистрированных альтернативных ответов, установленных по критериям конечной точки, в наглядный график. Среднее значение в каждой точке определяли с помощью метода ядерной оценки регрессии.
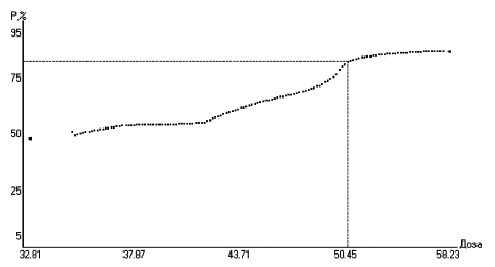
Построена зависимость “доза–эффект” на момент окончания курса лечения преднизолоном в виде графика, на котором прослеживается начальная точка выхода функции эффективности на плато. Эта точка (оптимальная клинически эффективная доза – ОКЭД) статистически отражает уровень насыщения признака, а клинически – величину максимально возможного эффекта препарата. ОКЭД преднизолона составила 50,70±0,65 мг (95% доверительный интервал [ДИ] 49,41- 51,98), а максимальный вероятностный эффект (частота достижения ремиссии) при применении этой дозы – 82,21±8,23% (95% ДИ 66,08- 98,33).
У больных ЯК и БК средней и тяжелой степени при проведении индукционной терапии определена ОКЭД преднизолона, которая составила 50,70 мг/сут и обеспечивала частоту ремиссии, равную 82%.
Определение зависимости "дозаэффект" – это основополагающий фактор при подборе адекватных доз лекарственных препаратов. Ранее в клинической практике подобные оценки не проводились по причине отсутствия соответствующей технологии построения функции эффективности. С обоснованием и разра боткой комплекса современных способов статистических оценок исходных экспериментальных и клинических показателей, объединенных в технологию построения функции эффективности (зависимости "доза-эффект"), появилась возможность определения эффективных (оптимальных) доз лекарственных препаратов для решения конкретных задач в медицинской практике [1].
Системные глюкокортикостероиды (ГКС), в том числе преднизолон и метилпреднизолон, остаются базовыми препаратами в лечении воспалительных заболеваний кишечника (ВЗК) средней и тяжелой степени [2,3]. Быстрый клинический ответ и низкая стоимость определяют их важное значение для индукции ремиссии. Положительный эффект ГКС доказан как при язвенном колите (ЯК) [4–8], так и при болезни Крона (БК) [8–11].
Вместе с тем, данные об оптимальных дозах ГКС весьма противоречивы и неоднозначны. В клинических рекомендациях указаны дозы преднизолона внутрь от 40 до 60 мг или 0,5–1 мг/кг массы тела больного [12– 16]. При тяжелой степени ЯК и БК доза преднизолона может быть увеличена до 75 мг/сут внутривенно с последующим переходом на такие же дозы внутрь [7,12–14,16]. Эти стартовые дозы были рекомендованы на основании небольшого количества рандомизированных клинических исследований [4–5, 9–10], а также их мета-анализов и систематических обзоров [6–8,11,18]. В большинстве клинических рекомендаций указано, что доза преднизолона не должна превышать 60 мг/сут.
Несмотря на огромный опыт использования системных ГКС в лечении ВЗК многие вопросы остаются нерешенными: эффективные дозы для первого и последующих курсов лечения, оптимальные дозы при пероральном и внутривенном введении, частота развития стероидорезистентности, стероидозависимости и токсичных эффектов, объективное количественное распределение доз на низкие или высокие.
В настоящее время создана универсальная технология построения и анализа функций эффективности лекарственных средств для определения оптимальных клинически эффективных доз (ОКЭД) препаратов [1]. Целью исследования было определение оптимальной дозы системных ГКС (преднизолона) для индукции ремиссии у больных ЯК и БК с помощью технологии построения функции эффекивности.
Материал и методы
В проспективное исследование включали больных в возрасте от 18 до 65 лет с ЯК и БК, которым впервые назначали преднизолон в различных дозах для индукции ремиссии заболевания. Все пациенты дали письменное информированное согласие на участие в исследовании. Больным проводилось обследование и лечение в условиях гастроэнтерологического стационара и поликлиники областной клинической больницы им. Н.А.Семашко г. Нижнего Новгорода в период с 2017 по 2019 гг. Диагноз ЯК или БК устанавливали в соответствии с международными и российскими рекомендациями с учетом клинической картины, результатов лабораторного, эндоскопического и морфологического обследования при исключении кишечных инфекций [12–14].
Всем больным проводили илеоколоноскопию для оценки распространенности и тяжести поражения слизистой оболочки кишки и прицельную биопсию (от 3 до 10 биоптатов) с помощью аппарата OLYMPUS-CF H185L (Япония). Тяжесть обострения ЯК оценивали по критериям Truelove-Witts и количественному индексу клинической активности (индексу Мэйо), тяжесть обострения БК – с использованием индекса активности болезни Крона (ИАБК) [4,19,20]. Ответ на лечение оценивали через 2 недели и после окончания курса терапии.
Преднизолон назначали в дозах от 30 до 60 мг/сут внутрь в качестве первого курса терапии. Дозу выбирали лечащие врачи в соответствии с их клинической практикой. У больных с тяжелым ВЗК лечение преднизолоном начинали с внутривенного введения с переходом на прием внутрь в той же дозе. При наличии клинического ответа через 2 недели дозу преднизолона постепенно снижали по 5 мг в неделю. Общая продолжительность терапии не превышала 16 недель. При БК преднизолон назначали в сочетании с азатиоприном в дозе 2 мг/кг. После достижении клинической ремиссии больным ЯК назначали месалазин в дозе 2 г/сут, а пациенты с БК продолжали прием азатиоприна в дозе 2 мг/кг. Пациентов, не достигших клинической ремиссии, переводили на лечение генно-инженерными биологическими препаратами.
Эффективность лечения ГКС оценивали на основании общепринятых критериев [21]. Под клиническим ответом при ЯК понимали уменьшение по сравнению с исходными индексов частоты дефекаций и количества крови в стуле более чем на 30%, при БК – снижение ИАБК более чем на 70 баллов. Критериями клинической ремиссии ЯК (конечная точка) были индекс частоты стула 0-1, индекс кровотечения 0, хорошее общее состояние, нормализация лабораторных показателей (содержания С-реактивного белка и альбумина, количества тромбоцитов), а критериями клинической ремиссии БК (конечная точка) – значение ИАБК ≤150 и нормализация лабораторных показателей (содержания С-реактивного белка и альбумина, количества тромбоцитов).
Построение графика зависимости "доза–эффект" у больных ВЗК проводилось по технологии, разработанной С.В. Криштопенко и соавт. [17]. Среднее значение в каждой точке функции эффективности определют с помощью метода ядерной оценки регрессии как взвешенное среднее переменных отклика в фиксированной окрестности точки по принципу k-ближайших соседей, на основе известного в непараметрической статистике ядра Епанечкова [22]. Рассчитывали 95% доверительные интервалы (ДИ) для средних значений [23]. Смысл построения функции эффективности заключается в адекватном статистическом преобразовании исходных клинических данных в виде количественного выражения реально примененной совокупности доз и зарегистрированных альтернативных ответов, установленных по критериям конечной точки в исследованной выборке пациентов, в наглядный график функции эффективности. Важной особенностью указанной технологии является количественная оценка итоговой погрешности выполнения исследования, основу которой составляют два ведущих фактора: индивидуальная чувствительность организма к лекарственному препарату и адекватный подбор дозы с последующей оценкой параметров конечной точки. Технология построения функции эффективности апробирована в экспериментальных и клинических исследованиях [1,24].
Результаты
В исследование были включены 86 больных в возрасте от 18 до 65 лет, в том числе 61 – с ЯК и 25 – с БК (табл. 1). Давность болезни составляла менее 1 года у 55 (64,0%) пациентов, от 1 до 2 лет – у 21 (24,4%), от 2 до 5 лет – у 10 (11,6%). У большинства пациентов с ЯК отмечалось тотальное поражение толстой кишки (78,7%), а у пациентов с БК чаще встречался терминальный илеит (40,0%). В обеих группах чаще наблюдалось острое течение заболевания (39,3% и 76,0%, соответственно). Среди пациентов с ЯК преобладали пациенты с тяжелой формой ВЗК (75,4%), а среди больных с БК – со средне-тяжелой (84,0%).
| Показатель | ЯК, n=61 | БК, n=25 |
|---|---|---|
| Примечание: *тяжесть ЯК определяли по шкале Мейо: средняя – 6-8 баллов, тяжелая – 9-12 баллов. Тяжесть БК оценивали с помо-щью ИАБК: средняя – 331-450 баллов, тяжелая – более 450 баллов | ||
| Течение, n (%) | ||
| Острое | 24 (39,3) | 19 (76,0) |
| Хроническое рецидивирующее | 21 (34,4) | 3 (12,0) |
| Хроническое непрерывное | 16 (26,3) | 3 (12,0) |
| Давность заболевания, n (%) | ||
| До 1 года | 39 (64,0) | 16 (64,0) |
| От 2 до 5 лет | 15 (24,6) | 9 (36,0) |
| Более 5 лет | 7 (11,4) | - |
| Локализация ЯК, n (%) | ||
| Тотальный | 48 (78,7) | - |
| Левосторонний | 13 (21,3) | - |
| Локализация БК, n (%) | ||
| Подвздошная кишка | - | 10 (40,0) |
| Толстая кишка | - | 8 (32,0) |
| Толстая и тонкая кишка | - | 7 (28,0) |
| Тяжесть болезни, n (%)* | ||
| Средняя | 15 (24,5) | 21 (84,0) |
| Тяжелая | 46 (75,5) | 4 (16,0) |
На основании начальных доз преднизолона и клинического ответа (0 или 1) построена зависимость "дозаэффект" на момент окончания первого курса терапии ГКС (рис. 1). На графике отчетливо прослеживается начальная точка выхода функции эффективности на плато, статистически отражающая уровень насыщения признака, а клинически – величину максимально возможного эффекта препарата. Эта точка соответствует оптимальной клинически эффективной дозе (ОКЭД), которая составила 50,70±0,65 мг (95% ДИ 49,41-51,98). Максимальный вероятностный эффект (частота достижения ремиссии) на этой дозе следует ожидать в диапазоне 82,21±8,23% (95% ДИ 66,08-98,33). Назначение более высоких доз преднизолона не приводит к достоверному увеличению ожидаемого клинического эффекта, но сопровождается увеличением риска развития нежелательных явлений. Среднее значение максимального эффекта составило 82%, а, соответственно, в 18% случаев назначение ГКС в дозах более 50 мг/сут оказалось неэффективным (первичная стероидорезистентность). Отсутствие ответа на лечение ГКС в 18-20% случаев зарегистрировано и в других клинических исследованиях [3,25]. Следует отметить, что трактовать отсутствие эффекта при применении доз преднизолона менее 50 мг/сут как стероидорезистентность некорректно, поскольку область функции эффективности до точки ОКЭД отражает недостаточную дозу ГКС.
Побочные эффекты преднизолона в дозе 40 мг/сут отмечены у 4 пациентов (головная боль, нарушение сна – у 3, крапивница – у 1). При применении препарата в дозе 60 мг/сут у 12 пациентов зарегистрированы слабость, головная боль, сердцебиение, повышения АД, у 2 – нарушение толерантности к глюкозе, у 2 – локальная герпетическая инфекция, у 1 – острый психоз).
Обсуждение
В экпериментальных исследованиях зависимости "дозаэффект" стандартными считаются линейные модели на основе пробит-анализа [26]. Однако, во многих экспериментальных и в большинстве клинических ситуаций сложные фармакокинетические и фармакодинамические составляющие процесса формирования конечного эффекта при разных дозах препарата отражаются нелинейными зависимостями, что существенно затрудняет объективизацию подбора адекватных доз лекарственных средств. В клинических исследованиях лекарственных препаратов подбор доз осуществляется преварительно в 2-4 точках с последующей оценкой частоты эффекта, как правило, в одной эмпирически выбранной точке.
Системные ГКС остаются основой лечения ЯК и БК средней и тяжелой степени, хотя оптимальные дозы этих препаратов четко не определены. В первом плацебо-контролируемом исследовании ГКС у 210 больных ЯК различной протяженности и степени тяжести изучали кортизон в начальной дозе 100 мг. Лечение продолжали в течение 6 недель. Частота ремиссии в основной группе достоверно превышала таковую в группе плацебо (41,3% и 15,8%, соответственно) [4]. В единственном сравнительном исследовании различных суточных доз преднизолона внутрь у больных ЯК легкой и средней тяжести, проведенном в 1962 г., применяли дозы 20, 40 и 60 мг/сут. Эффективность препарата была недостаточной в дозе 20 мг/сут и сопоставимой в дозе 40 и 60 мг/сут. Для лечения ЯК средней тяжести авторы рекомендовали назначать преднизолон внутрь в дозе 40 мг/сут на 7 дней с последующим снижением на 5 мг в неделю в течение 8 недель [5]. Практически такой же курс лечения рекомендуется в Европейских и Американских руководствах [12,15–16]. В руководстве Российской гастроэнтерологической ассоциации и ассоциации колопроктологов России при средне-тяжелой атаке ЯК и БК рекомендовано применять преднизолон в суточной дозе 1 мг/кг или 60 мг внутрь [13,14].
Лечение тяжелой атаки ЯК и БК предусматривает внутривенное введение ГКС. В систематическом обзоре клинических исследований у больных тяжелым ЯК показана эффективность метилпреднизолона в дозе 60 мг/сут или гидрокортизона в дозе 100 мг/сут в течение не более 7–10 дней [7]. При этом ответ на терапию был зарегистрирован у 67% больных. Увеличение доз ГКС не приводило к дальнейшему повышению эффективности лечения, в то время как при назначении более низких доз она была ниже [27]. При назначении высоких доз ГКС, а также их применении в комбинации с иммуносупрессивными препаратами отмечено увеличение частоты побочных эффектов [28]. В российских стационарах, в частности в НМИЦ колопроктологии имени А.Н. Рыжих, для купирования тяжелой атаки ВЗК используют преднизолон в дозе 2 мг/кг/сут. При таком дозировании удовлетворительный клинический ответ был получен у 67 (48,2%) из 139 больных [29].
Проведено два достаточно крупных клинических исследования, в которых изучалась эффективность индукционной терапии ГКС у пациентов с БК. В одном из них были рандомизированы 162 пациента, которые получали преднизолон в дозах 0,5–0,75 мг/кг/сут (не более 60 мг/сут) или плацебо. Дозу преднизолона снижали на 5 мг в неделю. Частота ремиссии в основной группе была в 2 раза выше, чем в группе плацебо (60% и 30%, соответственно) [9]. В другом 18-недельном европейском кооперативном исследовании участвовали 105 пациентов. Клиническая ремиссия была достигнута у 83% больных, получавших метилпреднизолон внутрь в дозе 48 мг/сут, и у 38% больных группы плацебо [10].
В российских рекомендациях при тяжелом течении ЯК и БК любой локализации допускается применение преднизолона в дозе 75 мг/сут или метилпреднизолона в дозе 60 мг/сут внутривенно в течение 7–10 дней с последующим переходом на пероральный прием в той же дозе. Одновременно с ГКС рекомендуется назначать азатиоприн в дозе 2 мг/кг или 6-меркатопурин в дозе 1,5 мг/кг [14].
Изучение зависимости "доза–эффект" ГКС с построением функции эффективности для оценки результатов лечения ВЗК никогда не проводилось. Использованный метод представляет собой перспективную технологию изучения воздействия любых лекарственных препаратов на патологические процессы в организме и позволяет определить их ОКЭД. При заданной предельной погрешности в 20% были получены монотонные по структуре функции эффективности, что доказывает адекватность исследования в целом. Максимальная погрешность при изучении процессов с нормальным распределением признака, к которым относятся исследования лекарственных средств, не может превышать 33% в соответствии с законами статистики.
Заключение
Применение технологии построения и оценки зависимости "доза–эффект" преднизолона на модели первого (индукционного) курса лечения больных ВЗК позволило определить ОКЭД препарата, которая составила 50,70±0,65 мг/сут (95% ДИ 49,41-51,98). Максимальный эффект на этой дозе следует ожидать в диапазоне 82,21±8,23 (95% ДИ 66,08-98,33).
Используемые источники
- Криштопенко С.В., Тихов М.С., Попова Е.Б. Доза-эффект. Москва: Издво Медицина; 2008 [Krishtopenko SV, Tikhov MS, Popova EB. Dose effect. Moscow, 2008 (In Russ.)].
- George LA, Cross RK. Treatment of ulcerative colitis with steroids (in whom, how long, what dose, what form). Gastroenterol Clin North Am 2020;49:705-16.
- Bruscoli S, Febo M, Riccardi C, Migliorati G. Glucocorticoid therapy in inflammatory bowel disease: mechanisms and clinical practice. Front Immunol 2021;12:691480.
- Truelove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955;2(4947):1041–8.
- Baron J, Connell A, Kanaghinis T, et al. Out-patient treatment of ulcerative colitis. Comparison between three doses of oral prednisone. Br Med J 1962;2:441-3.
- Ho GT, Chiam P, Drummond H, Let al. The efficacy of corticosteroid therapy in inflammatory bowel disease: analysis of a 5-year UK inception cohort. Aliment Pharmacol Ther 2006;24:319-30.
- Turner D, Walsh CM, Steinhart AH, Griffiths AM. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clin Gastroenterol Hepatol 2007;5(1):103-10.
- Ford AC, Bernstein CN, Khan KJ, et al. Glucocorticosteroid therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011;106(4):590–9.
- Summers RW, Switz DM, Sessions JT, et al. National Cooperative Crohn’s Disease Study: results of drug treatment. Gastroenterology 1979;77(4Pt 2):847-69.
- Malchow H, Ewe K, Brandes JW, et al. European Cooperative Crohn’s Disease Study (ECCDS): results of drug treatment. Gastroenterol 1984;86:249-66..
- Benchimol E, Seow CH, Steinhart AH, Griffiths AM. Traditional corticosteroids for induction of remission in Crohn's disease. Cochrane Database Syst Rev 2008;2:CD006792.
- GomollЧn F, Dignass A, Annese V, et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1:Diagnosis and Medical Management. J Crohn's Colitis 2017;1(11):3-25.
- Ивашкин В.Т., Шелыгин Ю.А., Халиф И.Л. и др. Рекомендации Российской гастроэнтерологической ассоциации и ассоциации колопроктологов России по диагностике и лечению язвенного колита. Колопроктология 2017;1:6-30 [Ivashkin VT, Shelygin YuA, Khalif IL, et al. Recommendations of the Russian Gastroenterological Association and the Association of Coloproctologists of Russia on the diagnosis and treatment of ulcerative colitis. Coloproctology 2017;1(59):6-30 (In Russ.)].
- Ивашкин В.Т., Шелыгин Ю.А., Халиф И.Л. и др. Рекомендации Российской гастроэнтерологической ассоциации и ассоциации колопроктологов России по диагностике и лечению болезни Крона. Колопроктология 2017;2:7-30 [Ivashkin VT, Shelygin YuA, Khalif IL, et al. Recommendations of the Russian Gastroenterological Association and the Association of Coloproctologists of Russia on the diagnosis and treatment of Crohn's disease. Coloproctology 2017;2(60):7-30 (In Russ.)].
- Lichtenstein GR, Loftus EV, Isaacs KL, et al. ACG Clinical Guideline: management of Crohn’s disease in adults. Am J Gastroenterology 2018;113:481–517.
- Torres J, Bonovas S, Doherty G, et al. ECCO Guidelines on Therapeutics in Crohn's Disease: Medical Treatment. J Crohn's Colitis 2020;1(14):4–22.
- Dubois-Camacho K, Ottum PA, Franco-Muñoz D, et al. Glucocorticosteroid therapy in inflammatory bowel diseases: From clinical practice to molecular biology. World J Gastroenterol 2017;23(36):6628-38.
- Steinhart AH, Ewe K, Griffiths AM, et al. Corticosteroids for maintaining remission of Crohn's disease. Cochrane Database Syst Rev 2003;4:CD000301.
- Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987;317(26):1625-9.
- Best WR, Becktel JM, Singleton JW, Kern Jr. Development of a Crohn's disease activity index. National Cooperative Crohn's Disease Study. Gastroenterology 1976; 70(3):439-44.
- D'Haens G, Sandborn WJ, Feagan BJ, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007;132(2):763–86.
- Хардле В. Прикладная непараметрическая регрессия (Пер. с англ.). Москва: Мир; 1993.
- Лакин Г.Ф. Биометрия. Москва: Высшая школа, 1990.
- Шаленкова М.А., Алексеева О.П., Криштопенко С.В., Семенова А.К. Эффективность совместного применения триметазидина и β-адреноблокатора для лечения стабильной стенокардии. Клин фармакол тер 2005;3(14):3 8-40 [Shalenkova MA, Alekseeva OP, Krishtopenko SV, Semenova AK. The effectiveness of the combined use of trimetazidine and β-blocker for the treatment of stable angina pectoris. Clinical Pharmacology Therapy 2005;3(14):38-40 (In Russ.)].
- Manz M, Vavricka SR, Wanner R, et al. Therapy of steroid-resistant inflammatory bowel disease. Digestion 2012;86;Suppl.1:11-5.
- Finney DJ. Probit analysis. Camdridge University Press. Cambridge, 1971, 350 с.
- Rosenberg W, Ireland A, Jewell DP. High-dose methylprednisolone in the treatment of active ulcerative colitis. J Clin Gastroenterol 1990;12(1):40-1.
- Toruner M, Loftus EV, Harmsen WS, Zinsmeister AR. et al. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology 2008;134(4):929-36.
- Головенко О.В., Головенко А.О. Современные принципы лечения воспалительных заболеваний кишечника глюкокортикостероидами. Пособие для врачей. Москва: 2015.
