Купирование воспаления ингибитором рецептора интерлейкина-1 анакинрой при рефрактерной хронической тофусной подагре
Для лечения подагрического артрита используют нестероидные противовоспалительные препараты (НПВП), колхицин и глюкокортикостероиды. У части пациентов их применение невозможно из-за противопоказаний, или эффективность терапии оказывается недостаточной. Ключевую роль в развитии острого подагрического артрита играет интерлейкин (ИЛ)-1. В последние годы разработаны несколько лекарственных препаратов, блокирующих действие этого цитокина, одним из которых является анакинра – рекомбинантный антагонист рецептора ИЛ-1. В статье представлен опыт применения анакинры для купирования приступа у 2 пациентов c тофусной подагрой, которые не отвечали на лечение стандартными препаратами.
Подагра является распространенной формой аутовоспалительного артрита, вызванного отложением кристаллов моноурата натрия в мягких тканях синовиальных суставов [1-4]. Острые приступы подагры характеризуются классическими признаками воспаления (боль, эритема, отек, локальное повышение температуры, нарушение функции), которые могут приводить к ограничению трудоспособности и снижению качества жизни пациентов [3]. Быстрое купирование воспаления и проявлений артрита представляет собой основную цель лечения острого приступа подагры.
В качестве препаратов первой линии для купирования острого подагрического приступа рекомендуется применение колхицина, нестероидных противовоспалительных препаратов (НПВП) или глюкокортикостероидов (ГКС). Однако подагра часто сочетается с другими заболеваниями, которые могут ограничивать или препятствовать назначению стандартных лекарственных средств. Более того, некоторые пациенты плохо их переносят или не в полной мере отвечают на лечение. В таких случаях, особенно при наличии частых рецидивов, в рекомендациях EULAR 2016 г. и Американ ской коллегии ревматологов (АСR) 2020 г. по лечению подагры предлагается рассмотреть возможность назначения ингибитора ИЛ-1 [5,6].
Провоспалительный цитокин ИЛ-1 играет важную роль в развитии подагрического воспаления. Кристаллы моноурата натрия активируют белок NLRP3, который участвует в образовании инфламмасом в нейтрофилах и макрофагах. В состав инфламмасомы входит прокаспаза-1, превращающуюся в активную каспазу-1 – протеазу, которая вызывает активацию и секрецию ИЛ-1β [1,7]
Единственным ингибитором ИЛ-1, зарегистрированным в Российской Федерации для лечения подагры, является канакинумаб, эффективность и безопасность которого у пациентов с этим заболеванием хорошо изучены [8,9]. Однако высокая стоимость препарата и отсутствие программ льготного лекарственного обеспечения для пациентов с подагрой без инвалидности затрудняют применение канакинумаба в реальной клинической практике. Альтернативой канакинумабу может быть антагонист рецептора ИЛ-1 анакинра. В конце 2021 г. этот препарат был зарегистрирован в Российской Федерации под торговым наименованием Кинерет при ревматоидном артрите, болезни Стилла у взрослых и детей, COVID 19, семейной средиземноморской лихорадке и криопирин-ассоциированном периодическом синдроме. Эффективность и безопасность применения анакинры при остром подагрическом артрите подтверждаются клиническими наблюдениями и результатами нескольких ретроспективных исследований и небольшого открытого проспективного исследования [7]. Было показано, что анакинра может применяться для купирования обострений подагры у пациентов, не ответивших на стандартные лекарственные средства, в том числе на фоне активной инфекции, лечения гемодиализом, после трансплантации почки, а также у больных с хронической болезнью почек, тофусами и полиартикулярной формой подагры [10-12].
В Российской Федерации данные о применении анакинры в обычной клинической практике ограничены [7]. Ниже приведены два клинических случая успешного купирования острого подагрического приступа у пациентов с полиартикулярной тофусной подагрой.
Пациент Г., 67 лет, в течение 13 лет страдает подагрой, которая дебютировала с отека правых коленного и голеностопного суставов и бурсита левого локтевого сустава. Восемь лет назад появились тофусы. Непос тоянно принимал аллопуринол в дозе 100 мг/сут, при обострениях подагры – НПВП. Предпринимались попытки лечения колхицином, однако препарат пришлось отменить из-за диареи. Сопутствующие заболевания – артериальная гипертония, ожирение (индекс массы тела – 30,1 кг/м2), двусторонний гонартроз 4-й стадии. Курит на протяжении 30 лет.
Госпитализирован в июле 2022 г. в связи с развитием подагрического полиартрита. В течение месяца до госпитализации принимал различные НПВП, однако сохранялись выраженные боли в локтевых и лучезапястных суставах, боли и припухание суставов кистей, боли и ограничение движений в коленных и голеностопных суставах (интенсивность боли по визуальной аналоговой шкале составляла 70 мм). При осмотре определялись множественные тофусы. При рентгенографии выявлены признаки остеопороза и деформирующего остеоартроза суставов с деструкцией суставных поверхностей первых плюснефаланговых суставов. Содержание С-реактивного белка (СРБ) в крови при поступлении – 51 мг/л, мочевой кислоты – 485 мкмоль/л, СОЭ – 35 мм/ч.
Диагностировано обострение хронической тофусной подагры (III рентгенологическая стадия). Учитывая наличие стойкой артериальной гипертонии и выраженного болевого синдрома несмотря на лечение НПВП, непереносимость колхицина, пациенту по решению врачебной комиссии была назначена анакинра в дозе 100 мг/сут в виде подкожных инъекций. Боль в суставах уменьшилась уже после первого введения препарата. После трех инъекций отмечено значительно снижение интенсивности боли по визуальной аналоговой шкале до 30 мм и содержания СРБ (до 12 мг/л) и нормализация СОЭ (17 мм/ч).
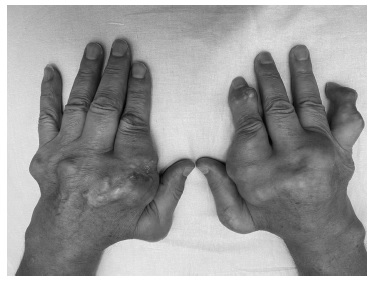
Пациент В., 62 лет, в течение 30 лет страдает хронической тофусной подагрой, осложнившейся уратной нефропатией (небольшая протеинурия, снижение расчетной скорости клубочковой фильтрации до 68 мл/мин/1,73 м2). Сопутствующие заболевания – ожирение (индекс массы тела 34,7 кг/м2) и дислипидемия. Отягощенный семейный анамнез: хроническая тофусная подагра у отца и сына пациента. У сына заболевание, резистентное к стандартной терапии, началось в возрасте 25 лет. Эти данные указывают на возможную генетическую предрасположенность к тяжелому течению подагры в данной семье.
В течение 5 лет нерегулярно обращался к ревматологу. В межприступный период принимал аллопуринол в дозе 100 мг/сут. В течение двух недель усилились боли в суставах, в связи с чем самостоятельно вводил триамцинолон в левый плечевой сустав. При поступлении жалобы на интенсивные боли и припухание второго плюснефалангового сустава левой стопы. При осмотре вскрывшийся инфицированный тофус левой кисти. СОЭ – 15 мм/ч, СРБ – 5,4 мг/л. На рентгенограмме стоп определялись множественные краевые костные эрозии в костях предплюсны по типу "пробойника", на рентгенограмме кистей – тофусы в мягких тканях, множественные эрозии в пястно-фаланговых суставах, значительное утолщение параартикулярных мягких тканей. С целью купирования обострения подагры в течение 5 дней подкожно вводилась анакинра в дозе 100 мг/сут, что привело к быстрому улучшению состояния пациента. При выписке СОЭ – 3 мм/ч, СРБ – 4,8 г/мл.
Эффективность и хорошая переносимость анакинры в лечении обострений подагры были недавно продемонстрированы в многоцентровом, двойном слепом, рандомизированном исследовании anaGO, в которое были включены 165 больных с обострением подагры (медиана возраста 55 лет, 87% мужчин, средняя длительность заболевания 8,7 лет, среднее число обострений в течение предыдущего года 4,5) [13]. Критерием отбора в исследование была невозможность применения НПВП и колхицина для купирования приступа изза неэффективности, плохой переносимости или противопоказаний к назначению. Пациенты были рандомизированы на две группы в соотношении 2:1 и получали анакинру (100 или 200 мг подкожно в течение 5 дней; n=110) или триамцинолон (40 мг однократно внутримышечно; n=55). В целом анакинру применяли для купирования 214 приступов подагры, а триамцинолон – 87. Основным показателем эффективности было уменьшение интенсивности боли в наиболее пораженном суставе (по визуальной аналоговой шкале от 0 до 100) в течение 24-72 ч после начала лечения.
Оба препарата вызывали быстрое и клинически значимое уменьшение интенсивного болевого синдрома. При лечении первого приступа интенсивность боли уменьшилась в среднем на 41,2 при применении анакинры и на 39,4 в группе триамцинолона (р=0,688). Таким образом, по первичному показателю эффективности анакинра не уступала ГКС. Медиана времени до начала действия анакинры и триамцинолона при первом приступе составила 17,8 и 22,3 ч, соответственно, а медиана времени до купирования боли – 120,5 и 167,5 ч (различия между группами не достигли статистической значимости). Анакинра имела преимущество перед триамцинолоном по нескольким вторичным показателям эффективности, включая общее мнение пациента и врача об ответе на лечение, динамику боли при пальпации, припухания суставов и эритемы кожи. Эф фективность двух доз ингибитора рецептора ИЛ-1 (100 и 200 мг/сут подкожно в течение 5 дней) была сходной, что обосновывает применение препарата для купирования приступа подагры в более низкой дозе 100 мг.
Мы также наблюдали очень быстрое уменьшение боли и синовита после начала лечения анакинрой у обоих пациентов с обострением тофусной подагры. Побочных эффектов отмечено не было.
Необходимо проведение рандомизированных клинических исследований 3 фазы для подтверждения эффективности анакинры в лечении обострений подагры, особенно у пациентов с сопутствующими заболеваниями, в частности инфекциями или недавно перенесенными хирургическими вмешательствами. Представляет интерес изучение возможности ежедневного применения анакинры для профилактики приступов подагрического артрита при наличии противопоказаний к стандартным методам лечения.
Используемые источники
- Dehlin M, Jacobsson L, Roddy E. Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors. Nat Rev Rheumatol 2020;16(7):380-90.
- Dalbeth N, Merriman TR, Stamp LK. Gout. Lancet 2016;388:2039-52.
- Choi HK, Mount DB, Reginato AM. Pathogenesis of gout. Ann Intern Med 2005;143(7):499-516.
- Галушко Е.А., Насонов Е.Л. Распространенность ревматических заболеваний в России. Альманах клинической медицины 2018;46(1):32-9 [Galushko EA, Nasonov EL. Epidemiology of rheumatic diseases in Russia. Almanakh klinicheskoy mediciny 2018;46(1):32-9 (In Russ.)].
- Fitzgerald JD, Dalbeth N, Mikuls T, et al. 2020 American College of Rheumatology guideline for the management of gout. Arthritis Care Res (Hoboken) 2020;72(6):744-60.
- Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017;76(1):29-42.
- Насонов Е.Л., Самсонов М.Ю. Роль интерлейкина 1 в развитии заболеваний человека: фокус на анакинре (рецепторном антагонисте ИЛ-1). Научно-практическая ревматология. 2022;60(3):280–98 [Nasonov EL, Samsonov MYu. The role of interleukin 1 in the development of human diseases: focus on Anakinra (IL-1 receptor antagonist). Nauchno-Prakticheskaya Revmatologia = Rheumatology Science and Practice 2022;60(3):280–98 (In Russ.)].
- Елисеев М.С., Насонов Е.Л. Применение канакинумаба при подагре. Научно-практическая ревматология 2018;56:41-8 [Eliseev MS, Nasonov EL. Therapy with canakinumab for gout. Nauchno-Prakticheskaya Revmatologia = Rheumatology Science and Practice 2018;56:41-8 (In Russ.)].
- Моисеев С.В., Новиков П.И., Рамеев В.В. Канакинумаб в лечении подагрического артрита. Клин фармакол тер 2019;28(3):85-92 [Moiseev SV, Novikov PI, Rameev VV. Canakinumab for the treatment of recurrent gouty arthritis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019;28(3):85-92 (In Russ.)].
- So A, Desmedt T, Revaz S, Tschopp J. A pilot study of IL-1 inhibition by anakinra in acute gout. Arthritis Res Ther 2007;9:R28.
- Chen K, Fields T, Mancuso C, et al. Anakinra’s efficacy is variable in refractory gout: report of ten cases. Semin Arthritis Rheum 2010;40:210–4.
- Gratton S, Scalapino K, Fye K. Case of anakinra as a steroid-sparing agent for gout inflammation. Arthritis Rheum 2009;61:1268–70.
- Saag KG, Khanna PP, Keenan RT, et al. A randomized, phase II study evaluating the efficacy and safety of anakinra in the treatment of gout flares. Arthritis Rheumatol 2021;73(8):1533-42.
