Применение ингибиторов интерлейкина-1 при перикардите
Перикардит – клинический синдром, характеризующийся воспалением и утолщением перикарда. Наиболее частым и тяжелым осложнением острого перикардита является идиопатический рецидивирующий перикардит (ИРП), неблагоприятный прогноз при котором связан с риском развития тампонады сердца и констриктивного перикардита. Патогенез перикардита связывают со сложным взаимодействием факторов окружающей среды, генетической предрасположенности и патологической активации врожденного и приобретенного иммунитета. Особое внимание привлекают аутовоспалительные механизмы, связанные с гиперпродукцией интерлейкина (ИЛ)-1. Стандартная терапия перикардита включает нестероидные противовоспалительные препараты, колхицин, глюкокортикостероиды и иммуносупрессивные препараты. Новое направление фармакотерапии перикардита связано с применением ингибиторов ИЛ-1: анакинры, рилонацепта и канакинумаба. Основное внимание уделено анакинре – рекомбинантному негликозилированному аналогу антагониста ИЛ-1 рецептора, блокирующего сигнализацию ИЛ-1β и ИЛ-1a. Представлены данные, свидетельствующие о том, что анакинра, а также рилонацепт являются эффективными препаратами для лечения пациентов с ИРП, резистентных к стандартной терапии. Предполагается, что более широкое применение анакинры, особенно на ранних стадиях перикардита, не только будет способствовать улучшению прогноза, но может иметь значение для выделения аутовоспалительного фенотипа ИРП и разработки программ персонифицированной терапии.
Перикардит – клинический синдром, характеризующийся воспалением и утолщением перикарда, относится к числу наиболее распространенных форм воспалительных заболеваний сердечно-сосудистой системы [1,2]. По данным эпидемиологических исследований, частота острого перикардита составляет 27,7 случаев на 1 млн человек в год, а госпитализаций – 0,52,6 случая на 1 млн в год [2]. Перикардит чаще развивается у мужчин молодого и среднего возраста, что отражает участие тестостерона в "чувствительности" к воспалению перикарда [3].
Выделяют первичный (идиопатический) перикардит, который большинство исследователей связывают с вирусными инфек циями [4,5], и вторичный перикардит, развивающийся как системное проявление (или осложнение) широкого спектра патологических состояний, в том числе иммуновоспалительных ревматических заболеваний (ИВРЗ) [6-8], или обусловленный разнообразными причинами, такими как инфаркт миокарда, травма грудной клетки, почечная недостаточность, постперикардиотомный синдром, злокачественные новообразования, лучевая терапия и др. [5]. Термины вирусный и идиопатический перикардит предлагается использовать как синонимы, подразумевая, что последний имеет предположительно вирусную этиологию [4].
Перикардит относится к числу характерных осложнений COVID-19 [9,10]. Он развивается в 1,5% случаев и ассоциируется с увеличением риска летальных исходов. Однако при аутопсии перикардит выявляют значительно чаще – у 20% пациентов, умерших от COVID-19 [11]. Описано развитие перикардита после вакцинации против SARS-CoV-2 в целом у 0,0001% пациентов, которые нуждались в госпитализации.
Рекомендации Европейского общества кардиологов (ESC), касающиеся клинических форм и диагностики перикардита, суммированы в табл. 1.
Диагностические критерии острого перикардита
|
Критерии высокого риска осложненного
перикардита
|
Обычно острый перикардит характеризуется доброкачественным течением и проходит без лечения. Однако у 15-30% пациентов после первого эпизода перикардита и более чем у 40% пациентов, перенесших повторное обострение заболевания, развивается идиопатический рецидивирующий перикардит (ИРП). характеризующийся неблагоприятным прогнозом, определяющимся риском развития тампонады сердца и констриктивного перикардита [15].
Развитие перикардита связывают со сложным взаимодействием факторов окружающей среды, генетической предрасположенности и патологической активации врожденного и приобретенного иммунитета, составляющей основу аутоиммунных и/или аутовоспалительных болезней [16,17]. О роли генетической предрасположенности свидетельствуют семейные случаи ИРП [18], связь между развитием ИРП и носительством определенных гаплотипов молекул главного комплекса гистосовместимости – HLA-B14, DRB1*01, HLA-A*02, HLA-Cw*07 и особенно HLA-DRB1*0202 [19], а об участии аутоиммунных механизмов – обнаружение в сыворотке пациентов антисердечных антител, реагирующих с α и β цепями миозина, антител к интеркалированным дискам и антиядерных антител (анти-Ro/SSA, антиLa/SSB и др.), ассоциирующихся с рецидивированием перикардита и риском госпитализации [20]. ИРП является нередким осложнением ИВРЗ, с которыми связывают более 20% его случаев [21]. По материалам американской национальной базы данных госпитализированных пациентов, ИРП был диагностирован у 17515 (12,2%) пациентов с аутоиммунными заболеваниями. С поправкой на потенциальные факторы риска развитие ИРП достоверно ассоциировалось с системной красной волчанкой (СКВ) (отношение шансов [ОШ] 3,671; p<0,001), системной склеродермией (ОШ 3,615; p<0,001), синдромом Шегрена (ОШ 1,631; p=0,013) и тиреоидитом Хашимото (ОШ 2,504; p>0,001) [22].
В последние годы в развитии перикардита особое внимание привлекают аутовоспалительные механизмы [23]. Напомним, что аутовоспаление, патогенетически связанное с активацией врожденного иммунитета и проявляющееся, в первую очередь, гиперпродукцией цитокинов семейства ИЛ-1, рассматривается как ведущий механизм развития врожденных и приобретенных системных аутовоспалительных заболеваний (САВЗ) у детей и взрослых [24,25]. Основной механизм образования биологически активной формы ИЛ-1β связан с расщеплением его предшественника (про-ИЛ-1β) каспазой-1, экспрессирующейся при активации NLRP3 инфламмасомы. Провоспалительные свойства ИЛ-1 определяются индукцией синтеза других провоспалительных цитокинов, в том числе фактора некроза опухоли a, ИЛ-6, ИЛ-8 и др., самого ИЛ-1β (за счет механизма аутоамплификации), а также хемокинов, низкомолекулярных медиаторов воспаления (оксида азота и простагландинов – ПГ), матриксных металлопротеиназ, экспрессией молекул адгезии на лейкоцитах и эндотелиальных клетках, стимуляцией гранулопоэза, активацией Th1 и Th17 типов иммунного ответа. Индуцируя образование ИЛ-6 и ПГ, ИЛ-1 (наряду с другими провоспалительными цитокинами) участвует в синтезе белков острой фазы воспаления, развитии лихорадки, анемии воспаления, мышечно-скелетной боли, остеопороза, усталости, депрессии и др. Следует подчеркнуть, что активация NLRP3 инфламмасомы и гиперпродукция ИЛ-1 составляют основу противовирусного иммунитета, в том числе к вирусам, индуцирующим развитие перикардита [26]. Важным (хотя и косвенным) подтверждением участия аутовоспалительных механизмов в развитии перикардита является гиперэкспрессия NLRP3 инфламмасомы в перикарде при остром перикардите, индуцированном зимозаном, у мышей [27]. В контексте аутовоспалительной природы перикардита привлекают внимание результаты сравнительного клинического и генетического анализа (секвенирования нового поколения – next generation sequencing) пациентов с ИРП и моногенными САВЗ, включая криопирин-ассоциированный периодический синдром, семейную средиземноморскую лихорадку, лихорадочный синдром, ассоциированный с ФНО рецептором (TRAPS), синдром дефицита мевалонаткиназы [28]. Развитие ИРП (хотя и редко) отмечено при всех моногенных САВЗ. Связи между воспалением перикарда и полиморфизмом генов MVK, NLRP3 и TNFRSF1A не обнаружено, но у 7,8% пациентов (10 из 128) с ИРП выявлена редкая делеция MEFV, которая у бессимптомных носителей мутации этого гена ассоциируется с увеличением концентрации воспалительных маркеров [29]. У пациентов с семейной средиземноморской лихорадкой, гомозиготных по мутации M694V, была отмечена более высокая частота болей в грудной клетке, а у 10,9% детей с кардиалгией при эхокардиографии было подтверждено наличие выпотного перикардита [30]. Кроме того, у пациентов с ИРП с высокой частотой наблюдались боли в грудной клетке, увеличение концентрации С-реактивного белка (СРБ; 89%) и признаки серозита (50%) [28]. Эти данные позволяют сделать важный вывод о том, что для ИРП характерны черты моногенных ИЛ-1 зависимых САВЗ.
Фармакотерапия перикардита
Общие подходы к фармакотерапии перикардита, включая применение нестероидных противовоспалительных препаратов (НПВП), колхицина, глюкокортикостероидов и иммуносупрессивных препаратов, рассмотрены в серии обзоров [31-35]. Особое внимание в последние годы привлечено к генно-инженерным биологическим препаратам (ГИБП), которые блокируют связывание ИЛ-1 с рецептором ИЛ-1 или эффекты самого ИЛ-1 (табл. 2) [36-41].
| Анакинра | Рилонацепт | Канакинумаб | |
|---|---|---|---|
| Примечание: обследование перед началом лечения всеми препаратами: общий анализ крови, печеночные ферменты, функция почек, профиль липидов, скрининг на туберкулезную инфекцию, маркеры гепатита В, С, ВИЧ. Противопоказания: активный гепатит В, С, ВИЧ,туберкулез. КАПС – криопирин-ассоциированный периодический синдром; DIRA – Deficiency of Interleukin-1 Receptor Antagonist | |||
| Структура | Рекомбинантный белок | Fc комплексный белок | IgG моноклональные антитела |
| Специфичность | ИЛ-1α и ИЛ-1β | ИЛ-1α и ИЛ-1β | ИЛ-1β |
| Период полувыведения | 4-6 ч | 7 дней | 2-26 дней |
| Частота введения | Ежедневно | 1 раз в неделю | Каждые 4-8 недель |
| Путь введения | Подкожно | Подкожно | Подкожно |
| Насыщающая доза | Нет | 320 мг | Нет |
| Поддерживающая доза | 2 мг/кг (в пределах 100 мг) | 160 мг | 4 мг/кг (или 150 мг) |
| Длительность тераии | 6-12 мес (в зависимости от частоты рецидивов) | 9 мес (от 3 до 14 мес и в зависимости от частоты рецидивов | До 2-х лет |
| Коррекция дозы при почечной недостаточности | Клиренс креатинина <30 мл/мин через день | - | - |
| Зарегистрированные показания | Ревматоидный артрит, КАПС, синдром DIRA | ИРП (FDA, 2022) | КАПС, подагрический артрит, синдром DIRA |
| Доказательства клинической эффективности при перикардите | Наблюдательные исследования,рандомизированное плацебо-контролируемое исследование AIRITIP, регистр IRAP | Исследование II фазы и рандомизированное плацебо-контролируемое исследование III фазы RHAPSODY | Клинические наблюдения |
Анакинра (Кинерет; Swedish Orphan Biovitrum) – рекомбинантный негликозилированный аналог антагониста ИЛ-1 рецептора, блокирующий сигнализацию ИЛ-1β и ИЛ-1α [42-44]. Стартовая дозы анакинры у взрослых, подростков и детей составляет 1-2 мг/кг/сут подкожно. Поскольку биодоступность анакинры не зависит от массы тела, коррекция дозы при ожирении не требуется [45]. Однако у пациентов с почечной недостаточностью отмечено увеличение периода полувыведения анакинры (до 7,15 ч), что диктует необходимость титрования дозы [46].
Внедрение анакинры в клиническую практику началось с 2001 г., когда препарат был зарегистрирован для лечения ревматоидного артрита (РА), а в дальнейшем криопирин-ассоциированных периодических синдромов и синдрома дефицита рецептора ИЛ-1 (DIRA). Накапливаются данные, касающиеся применения анакинры по незарегистрированным (off label) показаниям для лечения широкого круга САВЗ и гипервоспалительных синдромов, в развитии которых предполагается участие аутовоспалительных механизмов [44]. В 2015 г. применение анакинры было включено в рекомендации ESC по лечению ИРП (IIb/С) в качестве препарата третьей линии при неэффективности НПВП и глюкокортикостероидов [1]. Позднее были получены данные, свидетельствующие о более высокой эффективности анакинры по сравнению с колхицином [47]. Особый интерес представляют результаты рандомизированного плацебо-контролируемого исследования AIRTRIP [48], по данным которого на фоне лечения анакинрой рецидивы перикардита развивались у 2 из 11 пациентов с ИРП, а в группе плацебо – у 9 из 10 (p<0,001). Различий частоты рецидивов у пациентов, получавших монотерапию анакинрой или комбинированную терапию анакинрой и колхицином, не отмечено.
По данным многоцентрового наблюдательного когортного исследование IRAP [49], у 224 пациентов (средний возраст 46 лет) с различными формами ИРП лечение анакинрой привело к снижению частоты рецидивов с 2,33 до 0,39 на пациента в год (с 1 рецидива в течение 157 дней до 1 рецидива в течение 939 дней), числа госпитализаций в отделение интенсивной терапии на 91%, госпитализаций на 86%, использования глюкокортикостероидов с 80% до 27%. 135 пациентов прекратили прием анакинры. Отмечено достоверное уменьшение времени до рецидива перикардита на фоне лечения анакинрой (p<0,001). Через 18 мес в группе пациентов, получавших анакинру, у 74% отсутствовали рецидивы, через 3 года 43% пациентов находились в ремиссии, у 29% развился только один рецидив. Имеются данные об эффективности анакинры у пациентов с ИРП, резистентных к лечению канакинумабом [50].
Эффективность анакинры при ИРП подтверждена в серии систематических обзоров и мета-анализов [42,51, 52]. По данным мета-анализа S. Avondo и соавт. [51], применение ингибиторов ИЛ-1 (анакинры и рилонацепта) привело к снижению риска рецидивирования перикардита по сравнению с плацебо (10% и 78%, соответственно; относительный риск 0,14; 95% ДИ 0,050,35; p<0,001). Сходные данные получены M. Imazio и соавт. [52], которые включили в мета-анализ 7 исследований ингибиторов ИЛ-1 (анакинры и рилонацепта) у пациентов с ИРП (60% женщин, средний возраст – 42 года, длительность наблюдения – 14 мес). Применение ингибиторов ИЛ-1 ассоциировалось не только с достоверным снижением частоты рецидивов перикардита (относительный риск 0,06; 95% ДИ 0,03-0,14), но и с увеличением риска нежелательных лекарственных реакций по сравнению с контролем (относительный риск 5,38; 95% ДИ 2,08-13,92), в первую очередь инъекционных (36,6% и 0%, соответственно) и инфекций (25,5% и 7,3%). Однако нарастания частоты тяжелых нежелательных лекарственных реакций на фоне лечения ингибиторами ИЛ-1 не выявлено. Отмечен быстрый (в течение 24 ч) эффект анакинры при остром перикардите [53] и экссудативно-констриктивном перикардите [54-56]. По данным исследовании IRAP, эффективность анакинры не зависела от формы перикардита [49].
Предварительные данные свидетельствуют об эффективности анакинры при перикардите у пациентов с ИВРЗ, включая РА [57,58], болезнь Стилла взрослых [58,59], СКВ [58,60], гранулематоз с полиангиитом [61], недифференцированное заболевание соединительной ткани [58], антифосфолипидный синдром [58], а также у пациентов с СOVID-19, осложненным перикардитом, резистентным к глюкокортикостероидам и колхицину [62], и при рецидивирующем перикардите, развившемся после вакцинации против SARS-CoV-2 [63]. Получены данные об эффективности анакинры у пациентов с полисерозитом (идиопатическим или вследствие ревматических заболеваний), недостаточно контролирующимся НПВП и глюкокортикостероидами [64]. На фоне лечения у 84,5% пациентов произошло разрешение серозита, снижение СОЭ и СРБ (в течение 3 мес) и наблюдалось сохранение эффекта в течение 12 мес. У 49,0% пациентов удалось отменить терапию глюкокортикостероидами через 3 мес, у 86,5% – через 12 мес.
Лечение анакинрой редко сопровождается тяжелыми нежелательными лекарственными реакциями, развитие которых обычно не приводит к необходимости отмены препарата. Основными нежелательными эффектами у пациентов, получавших лечение анакинрой по поводу перикардита, были инъекционные реакции (38-44%), миалгии и артралгии (6%), увеличение активности печеночных ферментов (3%), нейтропения (1%), респираторные инфекции и инфекции мягких тканей (3%) [49]. Прерывание лечения Анакинрой из-за нежелательных лекарственных реакций потребовалось только у 3% пациентов. Частота нежелательных эффектов на фоне лечения анакинрой у пациентов с перикардитом сходна с таковой при применении препарата при ИВРЗ [37].
Рилонацепт (Arcalyst) – это димерный объединенный (fusion) белок, состоящий из лигандсвязывающего домена экстрацеллюлярного участка рецептора ИЛ-1 (IL1R1) и добавочного рецепторного белка (IL-1RAcP), соединенного с Fc участком IgG1 человека [65]. Рилонацепт представляет собой ловушку (trap) для циркулирующих ИЛ-1α и ИЛ-1β, имитируя "ложный" (decoy) рецептор для этих цитокинов и тем самым подавляя их связывание с соответствующими мембранными рецепторами и внутриклеточную сигнализацию. Результаты фармакокинетических исследований свидетельствуют о том, что при подкожном введении (320 мг нагрузочная доза) концентрация в равновесном состоянии составляет 23 мкг/мл, продолжительность периода полувыведения – около 7 дней. Препарат применяют в дозе 160 мг/нед.
В многоцентровое открытое исследования (фаза II) были включены 25 пациентов с рецидивирующим перикардитом (ИРП или постперикардиотомный синдром), у которых наблюдались по крайней мере два рецидива заболевания. Лечение рилонацептом привело к снижению частоты обострений перикардита, концентрации СРБ, снижению дозы (или отмене) глюкокортикостероидов, улучшению качества жизни и уменьшению признаков воспаления миокарда по данным МРТ [66].
Исследование RHAPSODY – это многоцентровое рандомизированное плацебо-контролируемое исследование [67], в которое были включены 86 пациентов с многочисленными рецидивами ИРП и признаками системного воспаления (увеличение концентрации СРБ), несмотря на лечение НПВП, колхицином и/или глюкокортикостероидами. На фоне лечения рилонацептом отмечены уменьшение интенсивности "перикардиальной" боли (в течение 5 дней), нормализация СРБ (в течение 7 дней) и снижение частоты рецидивов перикардита по сравнению с плацебо (отношение рисков 0,04; p<0,001). Рецидивы перикардита имели место у 7% пациентов, получавших рилонацепт, и 74% пациентов в группе плацебо. Стойкий клинический эффект (через 16 недель) имел место у 81% пациентов в группе рилонацепта и у 20% пациентов в группе плацебо. Инъекционные реакции наблюдались только в группе пациентов, получавших рилонацепт (34%), а инфекционные осложнений были зарегистрированы у 23% пациентов основной группы. Терапия рилонацептом по сравнению с плацебо вызывала значительное улучшение показателей качества жизни пациентов и качества сна (p<0,001) [68]. 64% пациентов группы рилонацепта, ранее получавших НПВП, колхицин и глюкокортикостероиды, были успешно "переключены" на монотерапию рилонацептом, независимо от длительности приема глюкокортикостероидов [69]. Получены данные, свидетельствующие о том, что выраженное воспаление перикарда по данным МРТ ассоциируется с более быстрым рецидивированием перикардита после завершения терапии рилонацептом [70].
Канакинумаб (Иларис). Данные, касающиеся применения канакинумаба при перикардите, крайне малочисленны. Описаны 3 пациента с колхицинрезистентным стероидозависимым перикардитом, связанным с болезнью Стилла взрослых (у 2) или серонегативным ревматоидным артритом (у 1), у которых предшествующее лечение анакинрой было неэффективным или вызывало нежелательные лекарственные реакции [71]. У пациентов с болезнью Стилла взрослых монотерапия канакинумабом привела к длительной ремиссией перикардита (более 3,5 лет) и позволила снизить дозу глюкокортикостероидов. У пациента с серонегативным ревматоидным артритом лечение анакинрой было частично эффективным, но сопровождалось развитием инъекционной реакции. Еще у одного пациента в возрасте 6,5 лет с колхицинрезистентным стероидозависимым ИРП канакинумаб применили как альтернативу анакинре, которая была отменена из-за анафилактической реакции [72]. На фоне комбинированной терапии канакинумабом и колхицином была достигнута ремиссия ИРП, которая продолжалась в течение двух лет. В то же время имеются данные о резистентности к канакинумабу у пациентов, отвечающих на терапию анакинрой [50,73].
Обсуждение
Ингибиторы ИЛ-1 (анакинра и рилонацепт) эффективны в лечении рецидивирующего перикардита (как идиопатического, так и связанного с ИВРЗ), резистентного к стандартной терапии НПВП, глюкокортикостероидами и колхицином. Примечательно, что запланированное рандомизированное плацебо-контролируемое исследование анакинры при ИРП было преждевременно завершено по этическим соображениям, так как у пациентов, получавших ингибитор ИЛ-1, уже в течение первых 24 ч отмечалась выраженная положительная динамика симптомов перикардита по сравнению с пациентами контрольной группы, получавшими плацебо [74]. Поскольку рилонацепт не зарегистрирован в России, а данные, касающиеся канакинумаба, ограничены отдельными клиническими наблюдениями только у пациентов, страдающих перикардитом на фоне САВЗ, обсуждение полученных результатов и рекомендации будут касаться только анакинры.
Основным показанием для применения анакинры является ИРП, соответствующий трем основным критериям: наличие документированных эпизодов острого перикардита, бессимптомные периоды длительностью 4-6 недель и рецидивы острого перикардита [1]. Однако пациенты с предполагаемым ИРП и выраженными хроническими болями в грудной клетке могут не вполне соответствовать этим критериям [75]. При отсутствии чувствительных и специфичных лабораторных биомаркеров перикардита особое значение для выявления воспаления перикарда придают МРТ сердца (Т2 режим, исследование с гадолинием), чувствительность и специфичность которой в диагностике рецидивирующего перикардита составляют 73% и 99%, соответственно [76]. Назначение анакинры следует обсуждать в первую очередь у пациентов с ИРП, резистентных к терапии НПВП и колхицином (острый перикардит – 3 мес, первый рецидив – в пределах 6 мес), у которых увеличена концентрация СРБ и/или имеются признаки воспаления перикарда по данным МРТ [34]. По данным исследования IRAP [49], введение анакинры в дозе 100 мг/сут в течение 3 мес с последующей отменой при наличии стойкого эффекта позволяет предупредить рецидивы перикардита у большинства пациентов. Можно предположить, что недостаточная эффективность анакинры в отношении воспаления перикарда у некоторых пациентов связана с низкой дозой препарата, не позволяющей эффективно нейтрализовать биологическую активность ИЛ-1, а развитие рецидивов – с преждевременным прекращением лечения. Установ лено, что при внутривенном введении анакинры максимальная концентрация в плазме выше и достигается быстрее, чем при подкожном введении. Имеются данные об эффективности высоких доз анакинры (до 10 мг/кг/сут) в виде внутривенных инфузий у пациентов, не отвечающих на подкожное введение стандартных доз препарата [77]. По нашему мнению, учитывая быстрый (в течение 24 ч) и мощный эффект анакинры, превосходящий таковой НПВП и колхицина, у пациентов с высокой воспалительной активностью, прогрессированием гемодинамических нарушений, риском тампонады сердца, а также при наличии противопоказаний для назначения НПВП и колхицина или плохой переносимости этих препаратов (в первую очередь колхицина) следует обсуждать возможность более раннего назначения анакинры уже при первом рецидиве перикардита. Имеются данные о том, что выраженное увеличение концентрация СРБ ассоциируется со снижением эффективности стандартной терапии [78]. Данные о высокой частоте стероидозависимости [80], риске рецидивов и нежелательных эффектов глюкокортикостероидов [13,28,79], болей в грудной клетке, хронической усталости, серозита, персистирующего увеличения концентрации СРБ [28] также свидетельствуют о целесообразности поиска альтернативных подходов к интенсификации терапии ИРП, наиболее обоснованным из которых является применение анакинры. Следует также иметь в виду возможность положительного влияния анакинры на поздние проявления перикардита (фиброзная перестройка, адгезивный и констриктивный компоненты). Представляется актуальной разработка прогностической модели эффективности терапии ингибиторами ИЛ-1 в зависимости от исходной концентрации СРБ (и, вероятно, других биомаркеров активности воспаления) и выраженности воспаления перикарда по данным МРТ. Предварительный алгоритм применения анакинры при РП представлен на рис. 1 [34, в собственное модификации].
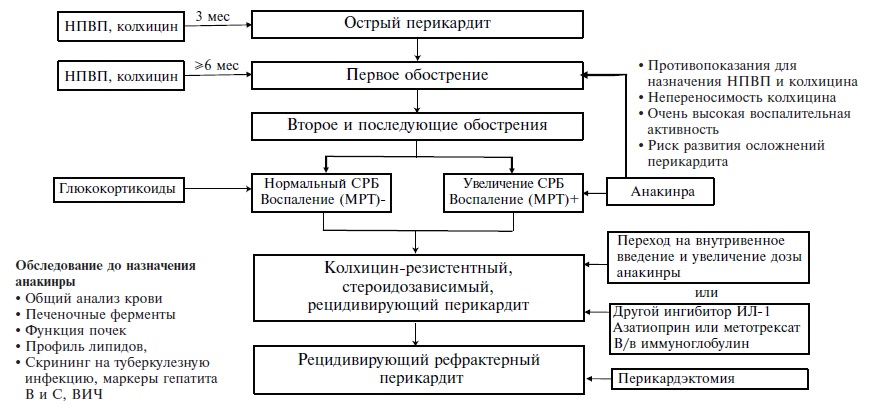
В целом анализ клинического полиморфизма и предполагаемых иммунных механизмов развития перикардита позволяет условно выделить клинические фенотипы этой патологии [80]: фенотип, связанный с аутовоспалением (лихорадка, серозит, выраженное увеличение концентрации острофазовых белков), при котором особенно показано назначение анакинры (и других ингибиторов ИЛ-1); фенотип с умеренным увеличением воспалительных биомаркеров, обнаружением аутоантител и развитием клинических проявлений, характерных для ИВРЗ (артралгии, сухой синдром, феномен Рейно, увеит и др.); фенотип с подострым течением перикардита, умеренной воспалительной активностью и отсутствием аутоиммунных нарушений, при котором для выявления перикардиального воспаления необходимо использование чувствительных методов, в первую очередь МРТ. В перспективе, в дополнении к генетическому тестированию и идентификации новых чувствительных и специфичных биомаркеров воспаления перикарда накопление опыта применения анакинры будет способствовать не только улучшению прогноза у пациентов с ИРП, но и создаст предпосылки для более строгого выделения аутовоспалительного фенотипа и разработки программ персонифицированной терапии этой патологии.
Используемые источники
- Adler Y, Charron P, Imazio M, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases. Eur Heart J 2015;36(42):2921-64.
- Klein A, Cremer P, Kontzias A, et al. Burden and unmet need in recurrent pericarditis: A systematic literature review. Cardiol Rev 2022;30(2):59-69.
- Lazaros G, Antonopoulos AS, Lazarou E, et al. Age- and sex-based differences in patients with acute pericarditis. Eur J Clin Invest 2021;51(3):e13392.
- Brucato A, Imazio M, Cremer PC, et al. Recurrent pericarditis: still idiopathic? The pros and cons of a well-honoured term. Intern Emerg Med 2018;13:839-44.
- Lazarou E, Tsioufis P, Vlachopoulos C, et al. Acute pericarditis: update. Curr Cardiol Rep 2022;24(8):905-13.
- Kontzias A, Barkhodari A, Yao Q. Pericarditis in systemic rheumatologic diseases. Curr Cardiol Rep 2020;22(11):142.
- Sen G, Gordon P, Sado DM. Cardiac manifestations of rheumatological disease: a synopsis for the cardiologist. Heart 2021;107(14):1173-81.
- Белов Б.С., Тарасова Г.М. Перикардиты в ревматологии: современные клинико-диагностические аспекты и вопросы терапии. Consilium Medicum 2020;22(1):26–30 [Belov BS, Tarasova GM. Pericarditis in rheumatology: modern clinical and diagnostic aspects and treatment aspects. Consilium Medicum 2020;22(1):26–30 (In Russ.)].
- Furqan MM, Verma BR, Cremer PC, et al. Pericardial diseases in COVID-19: a contemporary review. Curr Cardiol Rep 2021;23(7):90.
- Ghantous E, Szekely Y, Lichter Y, et al. Pericardial involvement in patients hospitalized with COVID-19: prevalence, associates, and clinical implications. J Am Heart Assoc 2022;11(7):e024363.
- Hanley B, Naresh KN, Roufosse C, et al. Histopathological findings and viral tropism in UK patients with severe fatal COVID-19: a post-mortem study. Lancet Microbe 2020;1(6):e245-53.
- Cremer PC, Kumar A, Kontzias A, et al. Complicated pericarditis: understanding risk factors and pathophysiology to inform imaging and treatment. J Am Coll Cardiol 2016;68(21):2311-28.
- Imazio M, Cecchi E, Demichelis B, et al. Indicators of poor prognosis of acute pericarditis. Circulation 2007;115(21):2739-44.
- Cremer PC, Kumar A, Kontzias A, et al. Complicated pericarditis: understanding risk factors and pathophysiology to inform imaging and treatment. J Am Coll Cardiol 2016;68(21):2311-28.
- Hagerty T, Kluge MA, LeWinter MM. Recurrent pericarditis: a stubborn opponent meets new treatments in 2022. Curr Cardiol Rep 2022;24(8):915-23.
- Bizzi E, Trotta L, Pancrazi M, et al. Autoimmune and autoinflammatory pericarditis: definitions and new treatments. Curr Cardiol Rep 2021;23(9):128.
- Lopalco G, Rigante D, Cantarini L, et al. The autoinflammatory side of recurrent pericarditis: Enlightening the pathogenesis for a more rational treatment. Trends Cardiovasc Med 2021;31(5):265-74.
- Brucato A, Brambilla G. Recurrent idiopathic pericarditis: familial occurrence. Int J Cardiol 2005;102(3):529.
- Lazaros G, Karavidas A, Spyropoulou M, et al. The role of the immunogenetic background in the development and recurrence of acute idiopathic pericarditis. Cardiology 2011;118(1):55-62.
- Caforio AL, Brucato A, Doria A, et al. Anti-heart and anti-intercalated disk autoantibodies: evidence for autoimmunity in idiopathic recurrent acute pericarditis. Heart 2010;96(10):779-84.
- Goldar G, Garraud C, Sifuentes AA, et al. Autoimmune pericarditis: multimodality imaging. Curr Cardiol Rep 2022;24(11):1633-45.
- Al-Khadra Y, Darmoch F, Moussa Pacha H, et al. Autoimmune disease association with pericardial diseases: an analysis of the national inpatient sample. Europ Heart J, 2018;39(suppl 1):ehy566.P5341.
- VecchiО A, Del Buono MG, Chiabrando GJ, et al. Interleukin-1 and the NLRP3 inflammasome in pericardial disease. Curr Cardiol Rep 2021;23(11):157.
- Насонов Е.Л., Елисеев М.С. Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология 2016;54(1):60-77 [Nasonov EL, Eliseev MS. Role of interleukin 1 in the development of human diseases. Rheumatology Science and Practice 2016;54(1):60-77 (In Russ.)].
- Mantovani A, Dinarello CA, Molgora M, Garlanda C. Interleukin-1 and related cytokines in the regulation of inflammation and immunity. Immunity 2019;50(4): 778-95.
- Carty M, Guy C, Bowie AG. Detection of viral infections by innate immunity. Biochem Pharmacol 2021;183:114316.
- Mauro AG, Bonaventura A, Vecchie A, et al. The role of NLRP3 inflammasome in pericarditis: potential for therapeutic approaches. JACC Basic Transl Sci 2021;6(2):137–50.
- Peet CJ, Rowczenio D, Omoyinmi E, et al. Pericarditis and autoinflammation: a clinical and genetic analysis of patients with idiopathic recurrent pericarditis and monogenic autoinflammatory diseases at a National Referral Center. J Am Heart Assoc 2022;11(11):e024931.
- Lachmann HJ, Sengül B, Yavuzşen TU, et al. Clinical and subclinical inflammation in patients with familial Mediterranean fever and in heterozygous carriers of MEFV mutations. Rheumatology (Oxford) 2006;45(6):746-50.
- Kilic A, Varkal MA, Durmus MS, et al. Relationship between clinical findings and genetic mutations in patients with familial Mediterranean fever. Pediatr Rheumatol Online J 2015;13:59.
- Imazio M, Lazaros G, Brucato A, Gaita F. Recurrent pericarditis: new and emerging therapeutic options. Nat Rev Cardiol 2016;13(2):99-105.
- Hagerty T, Kluge MA, LeWinter MM. Recurrent pericarditis: a stubborn opponent meets new treatments in 2022. Curr Cardiol Rep 2022;24(8):915-23.
- Vecchié A, Del Buono MG, Mauro AG, et al. Advances in pharmacotherapy for acute and recurrent pericarditis. Expert Opin Pharmacother 2022;23(6):681-91.
- Kumar S, Khubber S, Reyaldeen R, et al. Advances in imaging and targeted therapies for recurrent pericarditis: A review. JAMA Cardiol 2022;7(9):975-85.
- Melendo-Viu M, Marchán-Lopez Á, Guarch CJ, et al. A systematic review and meta-analysis of randomized controlled trials evaluating pharmacologic therapies for acute and recurrent pericarditis. Trends Cardiovasc Med 2022:S1050-1738(22)00024-X.
- Broderick L, Hoffman HM. IL-1 and autoinflammatory disease: biology, pathogenesis and therapeutic targeting. Nat Rev Rheumatol 2022;18(8):448-63.
- Arnold DD, Yalamanoglu A, Boyman O. Systematic review of safety and efficacy of IL-1-targeted biologics in treating immune-mediated disorders. Front Immunol 2022;13:888392.
- Lo Presti S, Elajami TK, Reyaldeen R, et al. Emerging therapies for recurrent pericarditis: interleukin-1 inhibitors. J Am Heart Assoc 2021;10(19):e021685.
- Abadie BQ, Cremer PC. Interleukin-1 antagonists for the treatment of recurrent pericarditis. BioDrugs 2022;36(4):459-72.
- Imazio M, Lazaros G, Gattorno M, et al. Anti-interleukin-1 agents for pericarditis: a primer for cardiologists. Eur Heart J 2022;43(31):2946-57.
- Imazio M, Andreis A, Piroli F, et al. Anti-interleukin 1 agents for the treatment of recurrent pericarditis: a systematic review and meta-analysis. Heart 2021 Mar 18:heartjnl-2020-318869.
- Cheema AH, Chaludiya K, Khalid M, et al. Efficacy of anakinra in pericarditis: a systematic review. Cureus 2022;14(10):e29862.
- Cvetkovic RS, Keating G. Anakinra. BioDrugs 2002;16(4):303-11.
- Насонов Е.Л., Самсонов М.Ю. Роль интерлейкина 1 в развитии заболеваний человека: фокус на анакинре (рецепторном антагонисте ИЛ-1). Научно-практическая ревматология 2022;60(3):280-98 [Nasonov EL, Samsonov MYu. The role of interleukin 1 in the development of human diseases: focus on Anakinra (IL-1 receptor antagonist). Rheumatology Science and Practice 2022;60(3):280-98. (In Russ.)].
- Yang BB, Gozzi P, Sullivan JT. Pharmacokinetics of anakinra in subjects of heavier vs. lighter body weights. Clin Transl Sci 2019;12:371-8.
- Yang BB, Baughman S, Sullivan JT. Pharmacokinetics of anakinra in subjects with different levels of renal function. Clin Pharmacol Ther 2003;74(1):85-94.
- Imazio M, Brucato A, Pluymaekers N, et al. Recurrent pericarditis in children and adolescents: a multicentre cohort study. J Cardiovasc Med (Hagerstown) 2016;17(9):707-12.
- Brucato A, Imazio M, Gattorno M, et al. Effect of anakinra on recurrent pericarditis among patients with colchicine resistance and corticosteroid dependence: The AIRTRIP randomized clinical trial. JAMA 2016;316(18):1906–12.
- Imazio M, Andreis A, De Ferrari GM, et al. Anakinra for corticosteroid-dependent and colchicine-resistant pericarditis: The IRAP (International Registry of Anakinra for Pericarditis) study. Eur J Prev Cardiol 2020;27(9):956-64.
- Theodoropoulou K, von Scheven-GРte A, Bressieux-Degueldre S, et al. A case of corticosteroid-dependent recurrent pericarditis with different response to two IL-1 blocking agents. Pediatr Rheumatol Online J 2015;13(Suppl 1):P155-P155.
- Avondo S, Andreis A, Casula M, et al. Pharmacologic treatment of acute and recurrent pericarditis: a systematic review and meta-analysis of controlled clinical trials. Panminerva Med 2021;63(3):314-23.
- Imazio M, Andreis A, Piroli F, et al. Anti-interleukin 1 agents for the treatment of recurrent pericarditis: a systematic review and meta-analysis. Heart 2021:heartjnl-2020-318869.
- Wohlford GF, Buckley LF, VecchiО A, et al. Acute effects of interleukin-1 blockade using anakinra in patients with acute pericarditis. J Cardiovasc Pharmacol 2020;76(1):50–2.
- Lazaros G, Vasileiou P, Danias P, et al. Effusive-constrictive pericarditis successfully treated with anakinra. Clin Exp Rheumatol 2015;33(6):945.
- Brucato A, Emmi G, Cantarini L, et al. Management of idiopathic recurrent pericarditis in adults and in children: a role for IL-1 receptor antagonism. Intern Emerg Med 2018;13(4):475–89.
- Andreis A, Imazio M, Giustetto C, et al. Anakinra for constrictive pericarditis associated with incessant or recurrent pericarditis. Heart 2020;106(20):1561-5.
- Schatz A, Trankle C, Yassen A, et al. Resolution of pericardial constriction with Anakinra in a patient with effusive-constrictive pericarditis secondary to rheumatoid arthritis. Int J Cardiol 2016;223:215-6.
- Shaukat MH, Singh S, Davis K, et al. Efficacy of anakinra for idiopathic and non-idiopathic pericarditis refractory or intolerant to conventional therapy. Eur Heart J Acute Cardiovasc Care 2020;9(8):888-92.
- Ocon AJ, Kwiatkowski AV, Peredo-Wende R, Blinkhorn R. Adult-onset Still's disease with haemorrhagic pericarditis and tamponade preceded by acute Lyme disease. BMJ Case Rep 2018;2018:bcr2018225517.
- Cafarelli F, Coladonato L, et al. Successful treatment with anakinra of refractory pericarditis in systemic lupus erythematosus. Clin Exp Rheumatol 2021;39:227.
- Ahmed T, Meredith D, Klein AL. Granulomatosis with polyangiitis (Wegener's granulomatosis) complicated by pericarditis: our experience of two cases and comparative review of literature. CASE (Phila) 2021;5(2):126-36.
- Karadeniz H, Yamak BA, Еzger HS, et al. Anakinra for the treatment of COVID19-associated pericarditis: a case report. Cardiovasc Drugs Ther 2020;34(6):883-5.
- Perna F, Verecchia E, Pinnacchio G, et al. Rapid resolution of severe pericardial effusion using anakinra in a patient with COVID-19 vaccine-related acute pericarditis relapse: a case report. Eur Heart J Case Rep 2022;6(4):ytac123.
- Lopalco G, Venerito V, Brucato A, et al. Anakinra effectiveness in refractory polyserositis: An Italian multicenter study. Joint Bone Spine 2022;89(2):105299..
- Schwier NC. Rilonacept: a newly approved treatment for recurrent pericarditis. Ann Pharmacother 2022;56(5):572-81.
- Lin D, Klein A, Cella, D, et al. Health-related quality of life in patients with recurrent pericarditis: results from a phase 2 study of rilonacept. BMC Cardiovasc Disord 2021;21:201.
- Klein AL, Imazio M, Cremer P, et al. Phase 3 trial of interleukin-1 trap rilonacept in recurrent pericarditis. N Engl J Med 2021;384:31-41.
- Brucato A, Wheeler A, Luis SA, et al. Transition to rilonacept monotherapy from oral therapies in patients with recurrent pericarditis. Heart 2022; 31 October 2022.
- Brucato A, Lim-Watson MZ, Klein A, et al.; RHAPSODY Investigators. Interleukin-1 trap rilonacept improved health-related quality of life and sleep in patients with recurrent pericarditis: results from the phase 3 clinical trial RHAPSODY. J Am Heart Assoc 2022;11(20):e023252.
- Cremer P, Lin D, Wheeler A, et al. Cardiac magnetic resonance imaging for guiding decision-making on treatment duration: data from RHAPSODY, a Phase 3 Clinical Trial of Rilonacept in Recurrent Pericarditis [abstract]. Arthritis Rheumatol 2021;73(suppl 9).
- Kougkas N, Fanouriakis A, Papalopoulos I, et al. Canakinumab for recurrent rheumatic disease associated-pericarditis: a case series with long-term follow-up. Rheumatology (Oxford) 2018;57(8):1494-5.
- EpНaНan S, Sahin S, Kasapcopur O. Anaphylactic reaction to anakinra in a child with steroid-dependent idiopathic recurrent pericarditis and successful management with canakinumab. Cardiol Young 2019;29(4):549-51.
- Signa S, D'Alessandro M, Consolini R, et al. Failure of anti Interleukin-1 β monoclonal antibody in the treatment of recurrent pericarditis in two children. Pediatr Rheumatol Online J 2020;18(1):51.
- Treatment of Acute Pericarditis With Anakinra. [Aug; 2022]. 2021. https://clinicaltrials.gov/ct2/show/NCT03224585.
- Kumar A, Sato K, Verma BR, et al. Quantitative assessment of pericardial delayed hyperenhancement helps identify patients with ongoing recurrences of pericarditis. Open Heart 2018;5(2):e000944.
- Imazio M, Pivetta E, Palacio Restrepo S, et al. Usefulness of cardiac magnetic resonance for recurrent pericarditis. Am J Cardiol 2020;125(1):146-51.
- Ajeganova S, De Becker A, Schots R. Efficacy of high-dose anakinra in refractory macrophage activation syndrome in adult-onset Still's disease: when dosage matters in overcoming secondary therapy resistance. Ther Adv Musculoskelet Dis 2020;12:1759720X20974858.
- Kumar AK, Yesilyaprak A, Furqan MM, et al. Prognostic value of inflammatory markers in idiopathic recurrent pericarditis. J Am Coll Cardiol 2022;79:1644-5.
- Imazio M, Brucato A, Cumetti D, et al. Corticosteroids for recurrent pericarditis: high versus low doses:a nonrandomized observation. Circulation 2008;118:667-71.
- Tombetti E, Giani T, Brucato A, Cimaz R. Recurrent pericarditis in children and adolescents. Front Pediatr 2019;7:419.
