Изучение фармакокинетики и межлекарственного взаимодействия мелатонина и мемантина как компонентов нового оригинального комбинированного препарата Миладеан®
Сравнительное изучение фармакокинетики исследуемого препарата Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг (АО “Валента Фарм”, Россия), и препаратов Акатинол Мемантин, таблетки, покрытые пленочной оболочкой, 10 мг (Мерц Фарма ГмбХ и Ко. КГаА, Германия), и Мелаксен, таблетки, покрытые оболочкой, 3 мг (Юнифарм Инк, США), с оценкой межлекарственного взаимодействия.
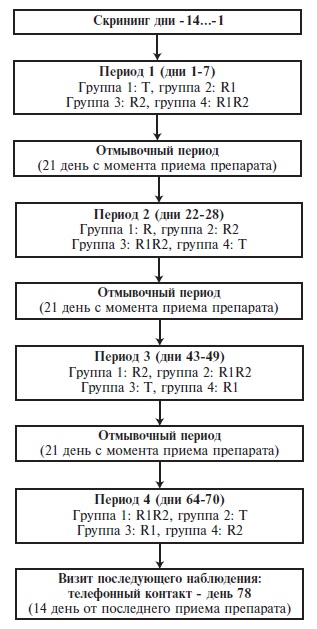
Проведено открытое рандомизированное четырехпериодное перекрестное исследование сравнительной фармакокинетики комбинированного препарата Миладеан® в сравнении с референтными монокомпонентными препаратами Акатинол Мемантин и Мелаксен. Добровольцев рандомизировали на 4 группы по 6 человек в зависимости от схемы приема изучаемых препаратов: T-R1-R2-R1R2, R1-R2-R1R2-T, R2-R1R2-T-R1 или R1R2-T-R1-R2, где T – исследуемый препарат Миладеан®, R1 – Акатинол Мемантин, R2 – Мелаксен, R1R2 – комбинация референтных препаратов. Количественное определение мелатонина и мемантина в плазме крови проводилось с использованием предварительно валидированного метода высокоэффективной жидкостной хроматографии (ВЭЖХ) с тандемным масс-спектрометрическим детектированием.
При сравнении фармакокинетических параметров мемантина при приеме препарата Миладеан® и изолированном и сочетанном приеме референтных препаратов здоровыми добровольцами не выявлено статистически значимых различий между оцениваемыми показателями. Отношения средних геометрических значений фармакокинетических параметров мемантина не выходили за пределы доверительного интервала (ДИ) 80,00–125,00%, установленного для исследований биоэквивалентности. В то же время отношения средних геометрических параметров мелатонина для исследуемого и референтных препаратов при изолированном и сочетанном приеме выходили за пределы ДИ 80,00–125,00%, что, вероятно, отражало известную физиологическую вариабельность фармакокинетики мелатонина. Отмечено значительное уменьшение времени достижения максимальной концентрации мелатонина после приема препарата Миладеан® по сравнению с референтными препаратами. Во время исследования не было зарегистрировано нежелательных явлений и клинически значимых отклонений лабораторных показателей.
Результаты исследования свидетельствуют об отсутствии межлекарственного взаимодействия между компонентами исследуемого препарата Миладеан® и его хорошей переносимости.
В настоящее время более 35 миллионов человек во всем мире страдают деменцией, а, по прогнозам, к 2030 г. количество таких пациентов удвоится [1]. Чаще всего деменцию диагностируют у пожилых людей с когнитивными и психоэмоциональными нарушениями. По данным международных наблюдательных исследований, деменцией страдает каждый двадцатый человек в возрасте старше 65 лет и каждый третий – старше 85 лет [2-3].
Мелатонин является гормоном эпифиза, регулирующим циркадные ритмы. Кроме того, он обладает выраженным антиоксидантным действием [4,5]. Данная особенность позволяет применять его для лечения состояний, сопровождающихся тканевой гипоксией и дегенеративными процессами. На различных биологических моделях показана эффективность мелатонина при ишемическом поражении сердца и головного мозга [6-8].
Мемантин – это неконкурентный ингибитор NMDA-рецепторов, модулирующий глутаматергическую передачу и улучшающий кортикокортикальные и кортикосубкортикальные взаимосвязи в головном мозге. В ряде клинических исследований продемонстрирована его эффективность при лечении деменции различного генеза (при болезни Альцгеймера, деменции на фоне сосудистых нарушений, деменции с тельцами Леви, ВИЧ-энцефалопатии, постинсультной деменции, алкогольной деменции, корсаковском амнестическом синдроме и черепно-мозговой травме). Прием мемантина у пациентов с деменцией приводил к улучшению когнитивных способностей, памяти и внимания, а также способствовал нормализации психоэмоционального статуса пациентов [3,9-10].
Компанией АО "Валента Фарм" был разработан комбинированный препарат, содержащий в качестве действующих веществ мелатонин и мемантин (Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг). Препарат показан для лечения легких или умеренных когнитивных нарушений у взрослых пациентов в возрасте старше 18 лет. В доклинических исследованиях на культуре нейронов in vitro комбинация мелатонина и мемантина оказывала более выраженное нейропротекторное действие, чем два препарата по отдельности. В эксперименте in vivo на модели нейродегенерации у мышей комбинация мелатонина и мемамнтина вызывала более значительное улучшение эпизодической памяти, моторной активности, уменьшение признаков нейровоспаления и нейродегенерации, а также снижение концентрации бета-амилоида.
Целью клинического исследования было сравнительное изучение фармакокинетики нового оригинального препарата Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг (АО "Валента Фарм", Россия), и референтных препаратов Акатинол Мемантин, таблетки, покрытые пленочной оболочкой, 10 мг (Мерц Фарма ГмбХ и Ко. КГаА, Германия) и Мелаксен, таблетки, покрытые оболочкой, 3 мг (Юнифарм Инк, США), с оценкой межлекарственного взаимодействия.
Материал и методы
Исследование было открытым рандомизированным сравнительным четырехпериодным перекрестным с четырьмя последовательностями приема препаратов. Оно было проведено после получения разрешения Министерства здравоохранения РФ (№839 от 14 декабря 2021 г.), одобрения Совета по Этике Министерства здравоохранения РФ (№290 от 26 октября 2021 г.) и одобрения Независимого (локального) этического комитета исследовательского центра (№35 от 09 декабря 2021 г.). Исследование соответствовало принципам Хельсинкской Декларации Всемирной медицинской ассоциации, трехстороннему соглашению по Надлежащей клинической практике (Good Clinical Practice, GCP), принятому Международным советом по гармонизации технических требований к лекарственным препаратам для медицинского применения у людей E6(R2) от 09.11.2016 г., и регламентировалось действующим законодательством Евразийского экономического союза (ЕАЭС) и Российской Федерации.
В исследовании участвовали здоровые добровольцы обоих полов в возрасте от 18 до 45 лет. Критерии включения: наличие добровольно подписанной формы информированного согласия; систолическое АД от 100 до 130 мм рт. ст., диастолическое АД от 70 до 89 мм рт. ст.; частота сердечных сокращений (ЧСС) от 60 до 80 в минуту; частота дыхательных движений (ЧДД) от 12 до 18 в минуту; температура тела от 36,0 до 36,9°C; индекс массы тела в диапазоне от 18,5 до 30 кг/м2 (масса тела у мужчин ≥55 кг, у женщин – ≥45 кг); согласие использовать адекватные методы контрацепции на протяжении исследования и в течение 30 дней после его завершения, для женщин – отрицательный тест на беременность; адекватное поведение, способность соблюдать режим дня и режим питания, предусмотренные протоколом исследования.
Критерии невключения: отягощенный аллергологический анамнез; непереносимость действующих и/или вспомогательных веществ исследуемых препаратов в анамнезе; хронические заболевания; хирургические вмешательства на желудочно-кишечном тракте в анамнезе (за исключением аппендэктомии, выполненной более 1 года до проведения скрининга); заболевания/состояния, которые, по мнению исследователя, могут повлиять на абсорбцию, распределение, метаболизм или экскрецию исследуемых лекарственных препаратов; острые инфекционные заболевания менее, чем за 4 недели до скрининга; прием лекарственных препаратов, оказывающих выраженное влияние на гемодинамику или функцию печени, менее, чем за 2 месяца до скрининга; регулярный прием лекарственных препаратов менее, чем за 2 недели до скрининга и разовый прием лекарственных препаратов менее, чем за 7 дней до скрининга; применение гормональных контрацептивов (у женщин) менее, чем за 2 месяца до начала скрининга; беременность или период лактации, в том числе положительный тест на беременность для женщин с сохраненным репродуктивным потенциалом; невозможность либо неспособность выполнять процедуры, предписанные протоколом, соблюдать диету, режим активности и др.
Скрининг прошли 36 добровольцев, 24 из которых были рандомизированы в соотношении 1:1:1:1 на четыре группы по 6 человек (рис. 1):- группа 1: в периоде 1 принимали 2 таблетки (6 мг + 10 мг) препарата Миладеан® (T), в периоде 2 – 1 таблетку (10 мг) препарата Акатинол Мемантин (Мерц Фарма ГмбХ и Ко. КГаА, Германия) (R1), в периоде 3 – 2 таблетки (6 мг) препарата Мелаксен (Юнифарм Инк, США) (R2), в периоде 4 – 1 таблетку (10 мг) препарата Акатинол Мемантин и 2 таблетки (6 мг) препарата Мелаксен (R1R2);
- группа 2: в периоде 1 принимали 1 таблетку (10 мг) препарата Акатинол Мемантин (R1), в периоде 2 – 2 таблетки (6 мг) препарата Мелаксен (R2), в периоде 3 – 1 таблетку (10 мг) препарата Акатинол Мемантин и 2 таблетки (6 мг) препарата Мелаксен (R1R2), в периоде 4 – 2 таблетки (6 мг + 10 мг) препарата Миладеан® (T); (10 мг) препарата Миладеан® (T);
- группа 3: в периоде 1 принимали 2 таблетки (6 мг) препарата Мелаксен (R2), в периоде 2 – 1 таблетку (10 мг) препарата Акатинол Мемантин и 2 таблетки (6 мг) препарата Мелаксен (R1R2), в периоде 3 – 2 таблетки (6 мг + 10 мг) препарата Миладеан® (T), в периоде 4 – 1 таблетку (10 мг) препарата Акатинол Мемантин (R1);
- группа 4: в периоде 1 принимали 1 таблетку (10 мг) препарата Акатинол Мемантин и 2 таблетки (6 мг) препарата Мелаксен (R1R2), в периоде 2 – 2 таблетки (6 мг + 10 мг) препарата Миладеан® (T), в периоде 3 – 1 таблетку (10 мг) препарата Акатинол Мемантин (R1), в периоде 4 – 2 таблетки (6 мг) препарата Мелаксен (R2).
Причинами выбывания на скрининге (невключения в исследование) были несоответствие критериям включения/невключения в исследование (11 добровольцев), отзыв информированного согласия добровольцем (1 доброволец).
Добровольцы принимали препараты утром не ранее, чем через 2 ч после подъема. Поскольку мелатонин является эндогенным соединением, секреция которого зависит от светового режима [11], подъем всех добровольцев в день госпитализации осуществлялся в 6:00, а яркое освещение (≈ 300 лк), необходимое для подавления эндогенной секреции мелатонина [12], поддерживалось вплоть до окончания отбора проб в первые 12 ч после приема препарата. В последующие дни пребывания в стационаре световой режим поддерживался аналогичным образом.
В каждом периоде исследования фармакокинетики у добровольцев отбирали пробы крови для определения кон центрации мелатонина и мемантина:- -60 мин, -30 мин, 0 мин (в течение 1–2 мин до приема препарата) и через 10 мин, 20 мин, 30 мин, 40 мин и 50 мин, а затем через 1 ч, 1 ч 15 мин, 1 ч 30 мин, 2 ч, 2 ч 30 мин, 3 ч, 4 ч и 6 ч после приема препаратов для определе ния концентраций мелатонина (16 образцов);
- 0 мин (в течение 1–2 мин до приема препарата) и через 30 мин, 1 ч, 2 ч, 3 ч, 4 ч, 5 ч, 6 ч, 7 ч, 8 ч, 10 ч, 12 ч, 24 ч, 48 ч, 72 ч, 96 ч и 120 ч после приема препаратов для опре деления концентраций мемантина (17 образцов).
Количественное определение мелатонина и мемантина в плазме крови добровольцев проведено с использованием предварительно валидированного метода высокоэффектив ной жидкостной хроматографии (жидкостный хроматограф Shimadzu Prominence) с тандемным масс-спектрометриче ским детектированием (масс-спектрометр с электроспрей ионизацией и квадрупольным масс-анализатором AB Sciex). Нижний предел количественного определения (НПКО) мемантина был не выше, чем 5% от максимальной кон центрации (Cmax) и составил 0,3 нг/мл. НПКО мелатонина был не выше, чем 5% от Cmax и составил 10 пг/мл. Линейный диапазон метода для мелатонина составил 10– 45000 пг/мл, а для мемантина – 0,3–50 нг/мл.
Для каждого добровольца рассчитывали следующие фармакокинетические (ФК) параметры мелатонина и мемантина: Cmax – максимальная концентрация в плазме крови; tmax – время достижения Cmax ; AUC(0-t) – площадь под кривой "плазменная концентрация – время" с момента приема до последней определяемой концентрации во временной точке t; AUC(0-∞) – площадь под фармакокинетической кривой "плазменная концентрация – время" с момента приема лекарственного препарата до бесконечности; AUC(0-∞) – остаточная (экстраполируемая) площадь под кривой, определяемая по формуле (AUC(0-∞)– AUC(0-t))/AUC(0-∞); t1/2 – период полувыведения из плазмы крови; kel – константа скорости терминальной элиминации; MRT – среднее время удержания препарата в плазме крови.
Поскольку мелатонин представляет собой эндогенное соединение, расчеты ФК параметров выполняли как по нескорректированным концентрациям, так и с учетом поправки на эндогенный уровень мелатонина, что предполагало вычитание из каждой нескорректированной концентрации среднего арифметического значения концентраций, измеренных в точках -60, -30 и 0 мин до приема препарата. Для оценки сравнительной фармакокинетики препаратов следовало применять показатели, рассчитанные по скорректированным концентрациям.
Оценку безопасности проводили путем регистрации и мониторинга нежелательных явлений (НЯ), оценки их типа, частоты и тяжести (жалобы и физическое обследование); ЧСС, АД, ЧДД и температуры тела; лабораторного мониторинга (клинический и биохимический анализы крови, общий анализ мочи); оценки электрокардиограммы (ЭКГ).
Для анализа фармакокинетики использовали программное обеспечение Phoenix™ WinNonlin® (версия 8.3, PharsightCorp, St.Louis, MO). Результаты сравнительного анализа фармакокинетических параметров были сверены с результатами программы SAS версии 9.4 (SAS Institute, Cary, NC, USA). Для всех параметров фармакокинетики были определены: среднее геометрическое, медиана, среднее арифметическое, стандартное отклонение, коэффициенты вариации (внутрииндивидуальный и межиндивидуальный разброс), минимальное и максимальное значения. Для оценки сравнительной фармакокинетики использовали AUC(0-t) и Сmax, однако если AUC(0-t) составляло менее 80% от AUC(0-∞), могли быть использованы AUC(0-t) и AUC(0-∞).
Статистический анализ был проведен с учетом предполагаемого логнормального распределения параметров AUC и Сmax и нормального распределении остальных параметров, за исключением tmax. После проведения логарифмического преобразования эти показатели были проанализированы с помощью дисперсионного анализа (analysis of variance, ANOVA, параметрический метод).
Статистический анализ безопасности проводился при помощи программного обеспечения SAS® версии 9.4 (SAS Institute, Cary, NC, USA). Для вспомогательных вычислений, а также импорта данных в программное обеспечение для статистического анализа использовалось программное обеспечение R версии 4.0.2. Количественные показатели были представлены в виде количества наблюдений, среднего арифметического, 95% доверительного интервала (ДИ) для среднего, стандартного отклонения, медианы, межквартильного размаха (квартилей), минимума и максимума. Качественные показатели были представлены в виде абсолютных частот (количества наблюдений) и относительных частот (процентов). Все исходные данные (демографические и антропометрические данные, лабораторные данные, данные инструментальных и физических методов обследования, показатели жизнедеятельности и т.п.) сравнивали между группами по последовательности с целью определения сопоставимости групп для анализа. Качественные показатели сравнивали с помощью точного критерия Фишера либо критерия χ2 в зависимости от ожидаемого значения в ячейках таблицы сопряженности. Для сравнения количественных показателей использовали критерий Краскела-Уоллиса. При выявлении статистически значимых различий количественных показателей между группами проводилось попарное сравнение между группами с использованием критерия Уилкоксона. Сводные данные по всем демографическим показателям и другим исходным характеристикам были представлены для популяции безопасности.
В популяцию для анализа фармакокинетики были включены данные всех рандомизированных добровольцев. В популяцию безопасности были включены все здоровые добровольцы, получившие в рамках исследования исследуемый препарат или препарат сравнения хотя бы один раз. Все виды анализа безопасности проводились в совокупности данных для анализа безопасности.
Результаты
В исследовании приняли участие 24 добровольца (18 мужчин и 6 женщин) европеоидной расы в возрасте от 18 до 45 лет. Два из 24 добровольцев завершили исследование досрочно до начала периода 4 в связи с пребыванием на карантине по поводу контакта с больными COVID-19 и отсутствием у них возможности явиться в исследовательский центр для проведения процедур исследования.
Расчет ФК параметров и их статистическую обработку выполнили на основе данных о концентрациях мемантина/мелатонина, полученных от всех 24 добровольцев. В анализ сравнительной фармакокинетики включили данные всех 24 рандомизированных добровольцев. Случаев исключения добровольцев из популяции для анализа фармакокинетики не было.

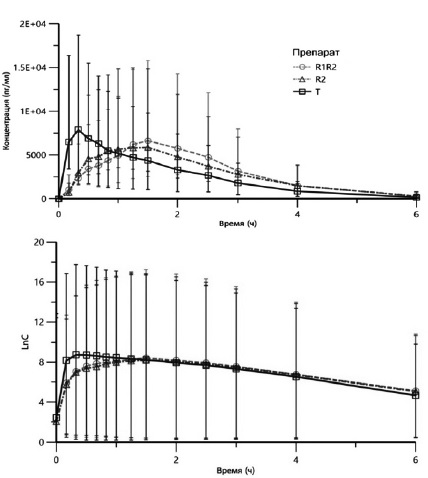
На рис. 2 и 3 представлены усредненные концентрации мелатонина и мемантина в образцах плазмы крови добровольцев в линейных и полулогарифмических координатах. Результаты сравнительной оценки ФК параметров мелатонина и мемантина приведены в табл. 1 и 2, соответственно.
| Показатель | Т | R2 | R1R2 |
|---|---|---|---|
| Cmax, нг/мл | 9281±6898,9 | 8692,1±9004,4 | 8524±7326,344 |
| tmax, ч | 0,504±0,414 | 1,451±0,779 | 1,370±0,800 |
| AUC(0-t), нг×ч/мл | 15141,27±8631,096 | 16755,44±19540,04 | 17660,17±16695,3 |
| AUC(0-∞), нг×ч/мл | 15388,79±8762,871 | 16368,86±20060,93 | 18633,92±17349,97 |
| t½, ч | 0,824±0,262 | 0,910±0,207 | 0,790±0,122 |
| Kel, ч-1 | 0,915±0,257 | 0,801±0,187 | 0,886±0,131 |
| MRT, ч | 1,612±0,317 | 2,089±0,548 | 2,047±0,459 |
| Показатель | Т | R2 | R1R2 |
|---|---|---|---|
| Cmax, нг/мл | 13,709±2,489 | 14,384±4,195 | 14,357±3,234 |
| tmax, ч | 5,261±3,151 | 5,292±3,057 | 5,130±3,079 |
| AUC(0-t), нг×ч/мл | 879,788±181,225 | 873,218±226,354 | 854,824±135,288 |
| AUC(0-∞), нг×ч/мл | 1220,844±470,265 | 1196,688±587,118 | 1177,495±398,594 |
| t½, ч | 63,028±23,262 | 57,467±24,455 | 61,626±20,711 |
| Kel, ч-1 | 0,012±0,003 | 0,013±0,003 | 0,012±0,003 |
| MRT, ч | 46,343±2,835 | 45,758±3,129 | 46,546±3,299 |
Оценивая представленные в таблице ФК параметры, следует отметить значительное уменьшение времени достижения максимальной концентрации мелатонина после приема препарата Миладеан® . Время достижения максимальной концентрации мелатонина после приема T, R2 и R1R2 составило 0,504±0,414, 1,451±0,779, 1,370±0,800 ч, соответственно, что демонстрирует уменьшение времени достижения максимальной концентрации мелатонина при приеме новой лекарственной формы таблетки, диспергируемой в полости рта, препарата Миладеан® фактически в 3 раза по сравнению с референтными препаратами.
В табл. 3 представлены результаты сравнительной оценки ФК параметров мелатонина. При оценке фармакокинетических показателей мелатонина необходимо отметить, что отношение средних геометрических AUC(0-t), AUC(0-∞) и Cmax для всех сравниваемых групп выходило за границы критериев биоэквивалентности 80,00-125,00%. При оценке фармакокинетических показателей мелатонина отношение средних геометрических AUC(0-t), AUC(0-∞) и Cmax для R2 и R1R2 приближалось к 100%, однако ДИ выходил за границы критериев биоэквивалентности. Для групп Т и R2, T и R1R2 границы ДИ были еще более широкими.
| Параметр | Отношение геометрических средних значений (90% ДИ), % |
|---|---|
| T и R2 | |
| AUC(0-t) (ч×пг/мл) | 125,23 (88,96–176,27) |
| AUC(0-∞) (ч×пг/мл) | 121,85 (86,15–172,35) |
| Cmax (пг/мл) | 143,89 (96,79–213,90) |
| T и R1R2 | |
| AUC(0-t) (ч×пг/мл) | 117,15 (82,78–165,78) |
| AUC(0-∞) (ч×пг/мл) | 118,08 (82,47–169,06) |
| Cmax (пг/мл) | 137,21 (91,73–205,23) |
| R1R2 и R2 | |
| AUC(0-t) (ч×пг/мл) | 106,90 (75,94–150,47) |
| AUC(0-∞) (ч×пг/мл) | 103,19 (72,07–147,75) |
| Cmax (пг/мл) | 104,87 (70,54–155,89) |
| Параметр | Отношение геометрических средних значений (90% ДИ), % |
|---|---|
| T и R2 | |
| AUC(0-t) (ч×пг/мл) | 102,23 (98,05–106,59) |
| AUC(0-∞) (ч×пг/мл) | 104,68 (98,62–111,12) |
| Cmax (пг/мл) | 97,77 (92,65–103,16) |
| T и R1R2 | |
| AUC(0-t) (ч×пг/мл) | 102,68 (98,42–107,13) |
| AUC(0-∞) (ч×пг/мл) | 102,97 (96,91–109,40) |
| Cmax (пг/мл) | 96,53 (91,40–101,94) |
| R1R2 и R2 | |
| AUC(0-t) (ч×пг/мл) | 99,56 (95,49–103,81) |
| AUC(0-∞) (ч×пг/мл) | 101,67 (95,78–107,92) |
| Cmax (пг/мл) | 101,28 (95,99–106,87) |
В табл. 4 представлены результаты сравнительной оценки ФК параметров мемантина. Отношения средних геометрических оцениваемых ФК параметров мемантина при приеме исследуемого препарата Миладеан® (T) и референтного препарата Акатинол Мемантин (R1), препарата Миладеан® (T) и комбинации референтных препаратов (R1R2) находились в пределах ДИ 80,00–125,00%. Вариабельность оцениваемых показателей мемантина была невысокой.
В анализ безопасности включили данные всех 24 рандомизированных добровольцев. За время исследования не зарегистрировали НЯ, случаев смерти, серьезных НЯ или иных значимых НЯ, а также клинически значимых отклонений результатов лабораторных показателей, ЭКГ и других исследований. Все выявленные отклонения от нормы не имели клинического значения и не были зарегистрированы как НЯ. Кроме того, отсутствовали статистически значимые различия частоты выявленных отклонений от нормы по терапевтическим группам.
По результатам сравнения количественных параметров безопасности при помощи ANOVA с учетом перекрестного дизайна установили некоторое статистически значимое влияние факторов периода (или дня измерения, где применимо) и/или препарата на некоторые показатели жизненно важных функций, лабораторные показатели и ЭКГ, однако все эти различия не имели клинического значения.
Обсуждение
Мелатонин чаще всего применяют для профилактики и лечения нарушений циркадного ритма сон-бодрствование [13]. Однако, благодаря известному выраженному антиоксидантному действию, в настоящее время изучается эффективность мелатонина в комплексной терапии различных ишемических и дегенеративных нарушений [14-17]. Мемантин в 2003 г. был одобрен Администрацией США по контролю за пищевыми продуктами и лекарствами (FDA) для клинического применения при лечении среднетяжелой и тяжелой формы деменции при болезни Альцгеймера и в настоящее время является препаратом выбора при терапии когнитивных расстройств различного генеза [18]. В доклинических исследованиях, проведенных АО "Валента Фарм", было выявлено усиление эффективности комбинации мелатонина и мемантина по сравнению с таковой при их изолированном применении.
Представленные результаты изучения фармакокинетики комбинированного препарата Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг, по сравнению с изолированным и сочетанным приемом референтных препаратов позволили сделать вывод об отсутствии ФК взаимодействий между компонентами исследуемого препарата.
Препарат Акатинол Мемантин, таблетки, покрытые пленочной оболочкой, 10 мг, не оказывал влияния на ФК параметры мемантина (Мелаксен, таблетки, покрытые оболочкой, 3 мг). При приеме препарата Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг, показатели ФК мемантина были сопоставимыми с таковыми при совместном приеме референтных препаратов в соответствующих дозах, так как отношения средних геометрических значений ФК параметров мемантина исследуемого препарата и референтного препарата не выходили за пределы ДИ 80,00–125,00%.
После однократного приема здоровыми добровольцами препарата Миладеан®, таблетки, диспергируемые в полости рта, 3 мг + 5 мг, и совместного и изолированного приема референтных препаратов Акатинол Мемантин, таблетки, покрытые пленочной оболочкой, 10 мг, и Мелаксен, таблетки, покрытые оболочкой, 3 мг, отношение средних геометрических AUC(0-t), AUC(0-∞) и Cmax мелатонина для всех сравниваемых групп выходило за границы критериев биоэквивалентности 80,00-125,00%. Отношение средних геометрических AUC(0-t), AUC(0-∞) и Cmax мелатонина при изолированном приеме Мелаксена (R2) и сочетанном приеме препаратов Мелаксена и Акатинол Мемантин (R1R2) приближалось к 100%, однако ДИ выходил за границы критериев биоэквивалентности, что, вероятно, обусловлено известной высокой физиологической вариабельностью ФК мелатонина и необходимостью в большей мощности исследования. Необходимо отметить 3-кратное уменьшение времени достижения максимальной концентрации мелатонина после приема препарата Миладеан® по сравнению с референтными препаратами. При изолированном приеме препаратов Миладеан® (Т) и Мелаксен (R2), изолированном приеме препарата Миладеан® (T) и сочетанном приеме препаратов Мелаксен и Акатинол Мемантин (R1R2) границы ДИ были еще более широкими, что, с одной стороны, также обусловлено высокой физиологической вариабельностью ФК мелатонина, а с другой – применением новой лекарственной формы препарата Миладеан®, фармакокинетические параметры которой существенно отличаются от параметров референтных препаратов.
В проведенном исследовании показан хороший профиль безопасности препарат Миладеан®. Ни у одного из добровольцев не было зарегистрировано НЯ, серьезных НЯ, случаев смерти или иных значимых НЯ, а также клинически значимых отклонений результатов лабораторно-инструментальных исследований.
Заключение
Результаты проведенного исследования свидетельствуют об отсутствии межлекарственного взаимодействия между компонентами исследуемого препарата и его хорошей переносимости.
Используемые источники
- Климак А.В., Харькова О.А. Характеристика когнитивных психических процессов у пациентов с деменцией: обзор литературы. Инновационная наука 2020;7:103-6 [Klimak AV, Kharkova OA. Characterization of cognitive mental processes in patients with dementia: a review of the literature. Innovative science 2020;7:103-6 (In Russ.)].
- Пилипович А.А. Мемантин в терапии когнитивных расстройств. Доктор.ру. 2017;8(137):50–8 [Pilipovich AA. Memantine in the therapy of cognitive disorders. Doctor.ru. 2017;8(137):50–8 (in Russ.)]
- Колыхалов И.В. Поведенческие и антипсихотические эффекты мемантина у пациентов с деменцией. Психиатрия. 2008;4-6:65-9 [Kolykhalov IV. Behavioral and antipsychotic effects of memantine in patients with dementia. Psychiatry 2008;4-6:65-9 (in Russ.)].
- Lieberman HR, Waldhauser F, Garfield G, et al. Effects of melatonin on human mood and performance. Brain Research 1984;323(2):201–7.
- Tordjman S, Chokron S, Delorme R, et al. Melatonin: pharmacology, functions and therapeutic benefits. Curr Neuropharmacol 2017;15(3):434-43.
- Тунсер М., Пехливаноглу Б., Суруджу С.Х. и др. Мелатонин улучшает сниженную активность мембранных АТФаз и сохраняет ультраструктуру серого и белого вещества в модели ишемии/реперфузии головного мозга крыс. Биохимия 2021;86(5);711–23 [Tuncer M, Pehlivanoglu B, SЯrЯcЯ SH, et al. Melatonin improves reduced activities of membrane ATPASES and preserves ultrastructure of gray and white matter in the rat brain ischemia/reperfusion model. Biochemistry 2021;86(5):711-23 (in Russ.)].
- Попова Т.Н., Сафронова О.А., Столярова А.О. и др. Активность глутатионовой системы и НАДФ-генерирующих ферментов при действии мелатонина на фоне ишемии/репефузии головного мозга у крыс. Патологическая физиология и экспериментальная терапия 2018;62(3):19-24 [Popova TN, Safonova OA, Stolyarova AO, et al. Activity of glutathione system and NADPHgenerating enzymes at the melatonin action on the background of brain ischemia/reperfusion in rats. Patologicheskaya fiziologiya i eksperimental`naya terapiya 2018;62(3):19-24 (in Russ.)].
- Mao Z-J, Lin H, Xiao F-Y, et al. Melatonin against myocardial ischemia-reperfusion injury: a meta-analysis and mechanism insight from animal studies. Oxid Med Cell Longevity 2020;2020:1241065.
- McShane R, Sastre AA, Minakaran N. Memantine for dementia. Cochrane Database 2006;2:CD003154.
- Litvinenko IV, Odinak MM, Mogil’naya VI, et al. Use of Memantine (akatinol) for the correction of cognitive impairments in Parkinson’s disease complicated by dementia. Neurosci Behav Physiol 2010;40(2):149–55.
- Skene DJ, Arendt J. Human circadian rhythms: physiological and therapeutic relevance of light and melatonin. Ann Clin Biochem 2006;43(Pt 5):34u4–53.
- Arendt J, Aulinas A. Physiology of the pineal gland and melatonin. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000. Available from: http://www.ncbi.nlm.nih.gov/books/NBK550972/.
- Poza JJ, Pujol M, Ortega-AlbЗs JJ, et al. Melatonin in sleep disorders. Neurologia (Engl Ed) 2022;37(7):575-85.
- Sumsuzzman D, Choi J, Jin Y, et al. Neurocognitive effects of melatonin treatment in healthy adults and individuals with Alzheimer's disease and insomnia: A systematic review and meta-analysis of randomized controlled trials. Neurosci Biobehav Rev 2021;127:459-73.
- Sun H, Gusdon AM, Qu S. Effects of melatonin on cardiovascular diseases: progress in the past year. Curr Opin Lipidol 2016;27(4):408-13.
- Chitimus DM, Popescu MR, Voiculescu SE, et al. Melatonin's impact on antioxidative and anti-inflammatory peprogramming in homeostasis and disease. Biomolecules 2020;10(9):1211.
- Jauhari A, Baranov SV, Suofu Y, et al. Melatonin inhibits cytosolic mitochondrial DNA-induced neuroinflammatory signaling in accelerated aging and neurodegeneration. Journal of Clin Invest 2020;130(6):3124-36.
- Левин О.С. Мемантин как препарат для базисной терапии деменции. Атмосфера. Нервные болезни 2007;4:10-7 [Levin OS. Memantine as a drug for the basic therapy of dementia. Atmosphere. Nervous diseases 2007;4:10-7 (in Russ.)].
