Экулизумаб в лечении атипичного гемолитико-уремического синдрома, связанного с беременностью: ретроспективное исследование у 85 пациенток
Изучение эффективности терапии экулизумабом и ее зависимости от сроков начала лечения у пациенток с атипичным гемолитикоуремическим синдромом (аГУС), связанным с беременностью.
В ретроспективное исследование были включены 85 пациенток в возрасте в среднем 29,3±6,6 лет с аГУС, развившимся в течение первых 8 дней после родов или, реже, во втором или третьем триместрах беременности. В зависимости от сроков назначения экулизумаба выделяли раннюю (в течение первых 7 дней после начала болезни), отсроченную (8-20 дней) и позднюю (21 день и более) терапию. Первичной комбинированной конечной точкой служили смерть от любых причин или развитие хронической почечной недостаточности, требующей лечения программным гемодиализом, вторичными – смерть от любых причин, частота нормализации количества тромбоцитов и активности ЛДГ (гематологический ответ) и динамика функции почек у выживших пациенток.
У всех пациенток наблюдались тромбоцитопения, микроангиопатическая гемолитическая анемия и острое почечное повреждение (ОПП), у 81 (95,3%) – внепочечные проявления. У 74 (87,1%) пациенток было начато лечение гемодиализом в течение от 1 до 5 дней после появления симптомов. Индукционная терапия экулизумабом, которую проводили в дополнение к плазмообмену и/или трансфузиям свежезамороженной плазмы у 56 пациенток, привела к быстрому восстановлению гематологических показателей и по сравнению с плазмотерапией вызывала значительное снижение риска первичной конечной точки (19,6% и 48,2%, соответственно; отношение шансов [ОШ] 0,26; 95% доверительный интервал [ДИ] 0,10-0,70) и смерти от любых причин (5,7% и 34,5%; ОШ 0,11, 95% ДИ 0,03-0,43). Наиболее эффективной была ранняя комплементблокирующая терапия. Среди 28 пациенток, которым экулизумаб был назначен в течение первой недели после начала болезни, не было зарегистрировано ни одного случая смерти или развития хронической почечной недостаточности в исходе неразрешившегося ОПП. Нежелательных реакций, потребовавших отмены экулизумаба, не наблюдали.
Исследование подтвердило высокую эффективность терапии экулизумабом, особенно ранней, у пациенток с аГУС, связанным с беременностью.
Атипичный гемолитико-уремический синдром (аГУС) – это редкое за болевание, проявляющееся тромбоцитопенией, микроангиопатической гемолитической анемией (МАГА) и ишемическим повреждением почек, манифестирующим, как правило, ОПП, которые развиваются в результате неконтролируемой активации альтернативного пути системы комплемента, обусловленной в большинстве случаев мутациями генов, регулирующих ее активность [1-3]. Морфологическим субстратом аГУС является тромботическая микроангиопатия (ТМА), характеризующаяся повреждением сосудистого эндотелия с последующим образованием тромбов в сосудах микроциркуляторного русла и развитием ишемии органов [4]. У части пациентов развитие аГУС провоцируют различные факторы, инициирующие активацию системы комплемента (комплементактивирующие состояния), в частности беременность и ее осложнения. По данным международного регистра, беременность была триггером аГУС у 6% из 464 взрослых пациентов, а у женщин доля аГУС, связанного с беременностью (или акушерского аГУС), в структуре заболевания составила 9% [5].
Беременность сопровождается умеренной активацией системы комплемента, которая является одним из компонентов врожденного иммунитета, а также необходима для нормального развития процесса гестации [6]. Чрезмерному увеличению активности системы комплемента препятствуют регуляторные белки, в том числе DAF (CD55), CD59 и MCP (CD46), которые экспрессируются на поверхности трофобласта и блокируют образование конвертаз C3, C5 и мембраноатакующего комплекса на поверхности мембран клеток. Некон тролируемая активация системы комплемента может быть следствием различных осложнений беременности, таких как преэклампсия, хирургические вмешательства или кровотечение [7], особенно у пациенток, имеющих мутации генов системы комплемента, которые определяются в 40-60% случаев аГУС, связанного с беременностью [8]. Преимущественному развитию аГУС в послеродовом периоде способствует также удаление плаценты с экспрессированными на ней белками системы комплемента, что нарушает естественную антикомплементарную защиту. В отличие от других вариантов ТМА, наблюдающихся при беременности, в частности преэклампсии или HELLP-синдрома (гемолиз, повышение активностии аминотрансфераз и тромбоцитопения), при аГУС ее проявления не разрешаются после родов, а, напротив, прогрессируют, нередко приводя к полиорганному поражению. Поэ тому неудивительно, что аГУС, связанный с беременностью, сопровождается высокими перинатальной и материнской заболеваемостью и смертностью и частым развитием диализзависимой хронической почечной недостаточности в исходе неразрешившегося ОПП [9].
На протяжении последних 10 лет для лечения аГУС, помимо плазмообмена, применяют экулизумаб – моноклональное антитело, которое предотвращает дальнейшее повреждение эндотелия сосудов и микротромбообразование в результате блокады С5 компонента комплемента. Включение этого препарата в схему терапии аГУС приводит к значительному увеличению выживаемости и снижению потребности в гемодиализе или трансплантации почки, в том числе у пациентов, уже начавших заместительную почечную терапию [4]. Опыт применения экулизумаба при аГУС, в том числе связанном с беременностью, остается ограниченным, хотя высокая эффективность препарата подтверждается описаниями отдельных случаев или серий наблюдений.
Целью ретроспективного исследования было изучение эффективности комплементблокирующей терапии экулизумабом и ее зависимости от сроков начала лечения у пациенток с аГУС, связанным с беременностью.
Материал и методы
В ретроспективное исследование включали пациенток с аГУС, развившимся во время беременности или после родов за период с 2013 по 2023 г. Исследование было одобрено локальным этическим комитетом Первого МГМУ им. И.М. Сеченова (№ 09-23 от 18.05.23).
ОПП, сочетавшегося с тромбоцитопенией (<150000 в мм3) и МАГА (снижение содержания гемоглобина <120 г/л и повышение активности ЛДГ, а также снижение уровня гаптоглобина, наличие шизоцитов в мазке периферической крови, отрицательная проба Кумбса), при отсутствии других возможных причин ТМА. Критериями исключения преэклампсии и HELLP-синдрома служило отсутствие спонтанной положительной динамики ТМА в течение 72 ч после родоразрешения. Критерием отсутствия тромботической тромбоцитопенической пурпуры считали активность ADAMTS 13 (a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13)>10%. Активность ADAMTS13 определяли методом FRET (fluorescence resonance energy transfer) с использованием флюорогенного субстрата FRETS-VWF73 (PeptaNova GmbH, Германия). Для исключения катастрофического антифосфолипидного синдрома и системной красной волчанки определяли наличие волчаночного антикоагулянта, антител к кардиолипину и β2-гликопротеину, антинуклеарного фактора и антител к двуспиральной ДНК.
Генетический анализ проводился в лаборатории ООО “Генотек" методом секвенирования следующего поколения с использованием наборов для обогащения экзома Genotek Clinical Exome (Illumina Inc., США) и секвенирования ДНК (Illumina Inc., США). Данные анализировали в соответствии с рекомендациями Американской коллегии медицинских генетиков. Проводился поиск мутаций в панели генов “Атипичный гемолитико-уремический синдром" (CD46, CFB, CFH, CFHR1, CFHR2, CFHR3, CFHR4, CFHR5, CFI, DGKE, PIGA, THBD, C3, ADAMTS13, CAPG, C2, MMACHC).
Для индукционной терапии экулизумаб вводили в дозе 900 мг один раз в неделю в течение 4 недель, для поддерживающей терапии – в дозе 1200 мг каждые две недели, начиная с 5-й недели. В зависимости от сроков назначения экулизумаба выделяли раннюю (в течение первых 7 дней после начала болезни), отсроченную (в течение 8-20 дней) и позднюю (21 день и более) терапию. С 2013 по 2019 г. применяли оригинальный препарат экулизумаба – Солирис (Alexion), с апреля 2019 г. – биоаналог экулизумаба – Элизария (АО Генериум). Для профилактики менингококковой инфекции проводили антибактериальную терапию препаратами, проникающими через гематоэнцефалический барьер (карбапенемы, цефалоспорины 3-4 поколения, фторхинолоны). После стабилизации состояния пациенток выполняли вакцинацию от менингококковой инфекции вакциной Менактра. Антибиотики отменяли не ранее, чем через 2 недели после введения вакцины.
Первичной комбинированной конечной точкой исследования служили смерть от любых причин или развитие терминальной хронической почечной недостаточности, требующей лечения программным гемодиализом (соответственно, проведение гемодиализа только в острую фазу заболевания не рассматривали как первичную конечную точку). Кроме того, анализировали смертность от любых причин, частоту восстановления количества тромбоцитов и нормализации активности ЛДГ (гематологический ответ), а также динамику функции почек у выживших пациенток. Безопасность комплементблокирующей терапии оценивали на основании нежелательных реакций, потребовавших отмены экулизумаба.
Выживаемость больных анализировали с помощью кривых Каплана-Мейера. Значимость различий между кривыми определяли с помощью критерии Гехана-Вилкоксона. Отношения шансов (ОШ) и 95% доверительные интервалы (ДИ) для первичной и вторичных конечных точек рассчитывали с помощью логистического регрессионного анализа. Статистически значимыми считали различия при p<0,05.
Результаты
Демографическая и клиническая характеристика пациенток. В исследование были включены 85 пациенток в возрасте в среднем 29,3±6,6 лет (от 16 до 44 лет) с аГУС, связанным с беременностью, у которых не было эпизодов ТМА в анамнезе (табл. 1). У повторнородящих женщин предыдущие беременности протекали без осложнений. Во время настоящей беременности у всех без исключения пациенток развитию ТМА предшествовали различные осложнения беременности и/или инфекции, которые сопровождаются активацией комплемента. Самыми частыми комплементактивирующими состояниями были преэклампсия (74,1%), кесарево сечение (78,8%) и кровотечение (71,7%). В большинстве случаев (81,2%) ТМА развилась в течение первых 8 дней после родов (преимущественно в первые сутки).
| Показатель | Значение |
|---|---|
| Примечание: *Инфекции мочевых путей (n=12), кишечная инфекция (n=11), острая респираторно-вирусная инфекция, включая COVID-19 (n=5), внутриутробная инфекция (n=8) | |
| Возраст, лет | 29,3±6,6 |
| Повторная беременность, n (%) | 53 (62,4) |
| Сроки развития аГУС, n (%) | |
| Первый триместр | 0 |
| Второй триместр | 6 (7,0) |
| Третий триместр | 10 (11,8) |
| После родов | 69 (81,2) |
| Комплементактивирующие состояния, n (%) | 63 (74,1) |
| Преэклампсия | 67 (78,8) |
| Кесарево сечение | 67 (78,8) |
| Кровотечение | 61 (71,7) |
| Отслойка плаценты | 29 (34,1) |
| Антенатальная гибель плода | 21 (31,7) |
| Внутриматочные манипуляции | 10 (11,7) |
| Релапаротомия | 19 (22,3) |
| Гистерэктомия | 19 (22,3) |
| Инфекции* | 36 (42,3) |
| Число комплементактивирующих состояний, n (%) | |
| 1 | 5 (5,9) |
| 2 | 18 (21,2) |
| 3 и более | 62 (72,9) |
| Медиана | 3,0 (2,0;4,0) |
У всех пациенток наблюдался полный симптомокомплекс ТМА, в том числе ОПП, тромбоцитопения и МАГА (табл. 2). У 74 (87,1%) пациенток отмечались олигурия или анурия и быстрое нарастание сывороточного уровня креатинина, что потребовало начала лечения гемодиализом в течение от 1 до 5 дней после начала болезни. Практически у всех пациенток (95,3%) наблюдались различные внепочечные проявления, в том числе острый респираторный дистресс-синдром, потребовавший искусственной вентиляции легких, кома, заторможенность, судороги, острая сердечная недостаточность, повреждение печени, проявлявшееся увеличением активности аминотрансфераз, и др. (табл. 2).
| Показатель | Значение |
|---|---|
| Примечание: *повышение активности аминотрансфераз: медиана активности АСТ – 205,0 ед/л (68,0;372,0), АЛТ – 144,0 ед/л (48,0;251,0). ТЭЛА – тромбоэмболия легочной артерии, ОРДС–острый респираторный дистресс-синдром | |
| ОПП, n (%) | 85 (100) |
| Сывороточный креатинин, мкмоль/л | 444,0 (325,0;610,0) |
| Протеинурия, г/л | 1,6 (1,0;3,6) |
| Артериальная гипертония, n (%) | 76 (89,4) |
| Гемодиализ, n (%) | 74 (87,1) |
| МАГА, n (%) | 85 (100) |
| Гемоглобин, г/л | 62,5 (53,0;76,0) |
| Гаптоглобин, г/л | 0,10 (0,04;0,28) |
| Шизоциты, % | 1,0 (1,0;2,0) |
| ЛДГ, ед/л | 2487,5 (1319,0;3900,0) |
| Тромбоцитопения, n (%) | 85 (100) |
| Количество тромбоцитов, 109/л | 49,0 (28,0;76,0) |
| Внепочечные проявления, n (%) | 81 (95,3) |
| Повреждение печени* | 69 (81,2) |
| Поражение легких | 62 (72,9) |
| ОРДС | 46 (54,1) |
| Гидроторакс | 15 (17,6) |
| ТЭЛА | |
| Искусственная вентиляция легких | |
| Поражение ЦНС | 47 (55,3) |
| Кома | 17 (20,0) |
| Инсульт | 5 (5,9) |
| Заторможенность | 21 (24,7) |
| Судороги | 14 (16,5) |
| Поражение сердца | 21 (24,7) |
| Острый инфаркт миокарда | 1 (1,2) |
| Острая сердечная недостаточность | 10 (11,8) |
| Нарушение ритма | 3 (3,5) |
| Гидроперикард | 7 (8,2) |
| Полиорганная недостаточность, n (%) | 76 (89,4) |
| Количество пораженных органов | 4,0 (3,0;4,0) |
При молекулярно-генетическом исследовании у 16 пациенток с аГУС патогенные мутации генов системы комплемента были выявлены в 8 случаях: варианты гена фактора I (с1217G>A и c.719C>G) у 2, варианты гена фактора Н (c.1548T>A, c.7C>G, c766G>A, c.1067G>A) у 4, вариант гена тромбомодулина (c.683C>T) у 1, вариант гена С3 (g6718128G>A) у 1. В остальных случаях определялись различные варианты с неясным клиническим значением, в том числе мутации гена фактора Н (c.2016A>G, c.2808G>T, c.1067G>A, c.1419G>A, c.184G>A, c1204C>T), тромбомодулина (c.1418C>T), ADAMTS 13 (c2699C>T, c.1342C>G, c.19C>T, c.1852C>G), С3 (c.2203C>T, c.941C>T, с.304C>G) в различных комбинациях.
Диагноз ТМА был подтвержден гистологически в 9 случаях: в 5 — при биопсии почек, в 4 — при аутопсии. У 1 из 5 пациенток в нефробиоптате выявлена картина острой ТМА, у 3 (через месяц после начала болезни) – сочетание признаков острой и хронической ТМА, у 1 – хронической ТМА. У 4 пациенток диагноз генерализованной ТМА был подтвержден на вскрытии (множественные тромбы в мелких сосудах почек, сердца, головного мозга, легких и печени).
Индукционная терапия экулизумабом. Восемьдесят три (97,6%) пациентки получали терапию свежезамороженной плазмой в режиме трансфузий (у 34), плазмообмена (у 17) или их сочетания (у 32), 68 (80,0%) – низкомолекулярные гепарины (в случае отсутвия выраженной тромбоцитопении или после повышения числа тромбоцитов более 80×109/л), 69 (81,2%) – антибиотики. Индукционная терапия экулизумабом проводилась у 56 (65,8%) из 85 пациенток с аГУС. Характеристика пациенток, получавших и не получавших экулизумаб, приведена в табл. 3. У 28 пациенток лечение было начато в течение первых 7 дней после начала заболевания (ранняя терапия), у 15 – через 8-20 дней (отсроченная терапия), у 13 – через 21 день и более (от 23 до 120 дней; поздняя терапия). Полный индукционный курс (4-5 инфузий экулизамаба) получила 51 пациентка, только одну инфузию – 5.
| Показатель | Получавшие экулизумаб (n=56) | Не получавшие экулизумаб (n=29) | p |
|---|---|---|---|
| Возраст, лет | 28,5 (24,5;33,0) | 29,0 (25,0;36,0) | 0,549 |
| ОПП, n (%) | 56 (100) | 29 (100) | 0,996 |
| Анурия, n (%) | 52 (92,9) | 22 (75,9) | 0,028 |
| Гемодиализ, n (%) | 53 (94,6) | 22 (75,9) | 0,028 |
| Креатинин, мкмоль/л | 499,0 (366,5;640,5) | 393,0 (260,0;490,0) | 0,011 |
| Гемоглобин, г/л | 62,0 (53,0;72,0) | 67,0 (55,0;78,0) | 0,501 |
| Тромбоциты, 109/л | 47,0 (27,0;65,0) | 56,0 (36,0;89,0) | 0,177 |
| Полиорганная недостаточность, n (%) | 50 (89,3) | 26 (89,7) | 0,965 |
| Внепочечные проявления, n (%) | 52 (92,9) | 29 (100) | 0,146 |
| Внепочечные проявления, n (%) | 52 (92,9) | 29 (100) | 0,146 |
| ОРДС | 27 (48,2) | 17 (58,6) | 0,368 |
| Искусственная вентиляция легких | 27 (48,2) | 17 (58,6) | 0,368 |
| Кома/инсульт | 14 (25) | 11 (37,9) | 0,096 |
| Судороги | 8 (14,3) | 6 (20,7) | 0,457 |
| Острая сердечная недостаточность | 8 (14,3) | 4 (13,8) | 0,935 |
| Повреждение печени | 44 (78,6) | 25 (86,2) | 0,399 |
Через 28 дней после начала лечения экулизумабом гематологический ответ (купирование гемолиза и нормализация числа тромбоцитов) был достигнут у всех выживших пациенток. Восстановление количества тромбоцитов происходило быстрее снижения активности ЛДГ. Так, через 3 дня после введения экулизумаба нормализация количества тромбоцитов и активности ЛДГ была отмечена у 87,3% (48/55) и 14,5% (8/55) пациенток, соответственно, через 7 дней – у 90,9% (50/55) и 56,4% (31/55), через 28 дней – у 100% (53/53) и 100% (53/53).
Первичная конечная точка (смерть или хроническая почечная недостаточность, требующая лечения программным гемодиализом) была отмечена у 11 (19,6%) из 56 пациенток, получавших экулизумаб, и 14 (48,2%) из 29 пациенток, которым не проводилась комплементблокирующая терапия (ОШ 0,26; 95% ДИ 0,10-0,70; р=0,011) (рис. 1). При ранней комплементблокирующей терапии частота первичной конечной точки составила 0% (0/28), отсроченной – 26,7% (4/15), поздней – 53,8% (7/13). ОШ первичной конечной точки при отсроченной комплементблокирующей терапии по сравнению с отсутствием лечения составило 0,39 (95% ДИ 0,10-1,51, р=0,208), при поздней – 1,25 (95%ДИ 0,34-4,64, р=0,669).
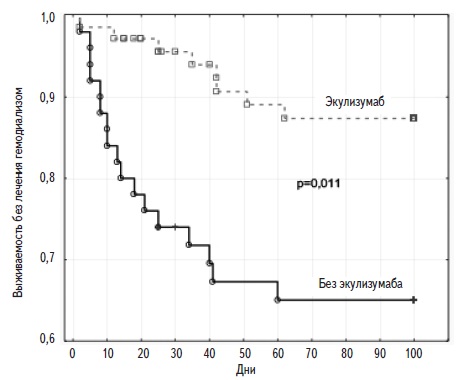
Тринадцать (12,9%) из 85 пациенток с аГУС умерли от прогрессирующей полиорганной недостаточности в течение от 2 до 40 дней после появления симптомов, в том числе 3 (5,7%) из 53 пациенток, получавших экулизумаб, и 10 (34,5%) из 29 пациенток, которым не проводилась комплементблокирующая терапия (ОШ 0,11, 95% ДИ 0,03-0,43, р=0,0008). Среди пациенток, получавших раннюю терапию экулизумабом, смертность составила 0% (0/28), отсроченную – 6,7% (1/15) и позднюю – 15,4% (2/13). ОШ смерти при отсроченной комплементблокирующей терапии по сравнению с отсутствием лечения составило 0,14 (95% ДИ 0,02-1,19, р=0,670), при поздней – 0,35 (95% ДИ 0,06-1,87, р=0,281).
Среди 72 выживших пациенток с аГУС полное восстановление функции почек наблюдалось в 48 (66,6%) случаях, формирование хронической болезни почек поздних стадией в исходе ОПП (СКФ от 15 до 60 мл/мин/1,73 м2) – в 12 (12,7%) и диализзависимая хроническая почечная недостаточность – в 12 (12,7%). Частота полного восстановления функции почек в группах выживших женщин, получавших и не получавших экулизумаб, составила 71,7% (38/53) и 52,6% (10/19) (p=0,392), а частота диализзависимой хронической почечной недостаточности – 15,1% (8/53) и 21,1% (4/19) (р=0,035), соответственно. Среди пациенток, получавших раннюю, отсроченную и позднюю терапию экулизумабом, частота полного восстановления функции почек составила 100% (28/28), 78,6% (11/14) и 54,5% (6/11), соответственно, а частота диализзависимой хронической почечной недостаточности – 0% (0/28), 21,4% (3/14) и 45,5% (5/11).
Поддерживающая терапия экулизумабом. У 12 из 53 выживших пациенток после купирования ТМА экулизумаб был отменен, в то время как у 41 пациентки проводилась поддерживающая терапия экулизумабом в течение от 1,5 мес до 8 лет (медиана 12,0 мес [6,0; 18,0]). Восемнадцать пациенток, которым исходно проводилась терапия оригинальным экулизумабом, в 2019 г. были переведены на лечение биоаналогом. У 22 из 41 пациентки поддерживающая терапия была прекращена в сроки от 1 до 48 мес (медиана 6,0 [1,5; 12,0]) Медиана длительности наблюдения после завершения комплементблокирующей терапии составила 6,0 (4,0; 7,0) лет. Девятнадцать пациенток (у 4 выявлены патогенные мутации генов комплемента) продолжают поддерживающую терапию по настоящее время в течение от 2 до 9 лет (медиана 4,0 лет [3,0; 5,0]). Ни у одной пациентки не было зарегистрировано рецидивов аГУС после отмены препарата. У одной пациентки через 6 мес после отмены экулизумаба наступила повторная беременность, на 34-й неделе которой комплементблокирующая терапия была возобновлена с целью профилактики рецидива аГУС. Через 3 месяца после родов препарат снова отменили. В течение 2 лет после отмены препарата сохраняется ремиссия аГУС.
Безопасность. Нежелательных реакций (в том числе инфекционных осложнений), потребовавших отмены экулизумаба, мы не наблюдали.
Обсуждение
Результаты нашего исследования подтверждают тяжесть течения аГУС, связанного с беременностью. У всех обследованных нами пациенток наблюдались выраженные тромбоцитопения и МАГА, сочетавшиеся с тяжелым ОПП, которое в 87% случаев потребовало лечения гемодиализом уже в первые дни после начала болезни. Более того, у 95% пациенток отмечались различные внепочечные проявления, в том числе поражение печени, легких, центральной нервной системы и реже сердца. Наиболее тяжелые системные проявления аГУС включали в себя острый респираторный дистресс-синдром (54%), кому (20%), острую сердечную недостаточность (12%), инсульт (6%) и инфаркт миокарда (1%). У большинства пациенток аГУС развивался после родов и значительно реже в третьем или втором триместрах беременности, что согласуется с опубликованными ранее данными [10,11]. Развитию аГУС предшествовали различные комплементактивирующие состояния, прежде всего преэклампсия, кесарево сечение, кровотечения, а также другие акушерские осложнения и инфекции, причем у трех четвертей пациенток количество потенциальных триггеров активации комплементов составляло 3 и более.
Эффективность плазмотерапии у пациенток с аГУС, связанным с беременностью, была низкой. Несмотря на плазмообмен и/или трансфузии свежезамороженной плазмы, около половины женщин, не получавших экулизумаб, умерли или остались на лечении программным гемодиализом в связи с развитием хронической почечной недостаточности в исходе неразрешившегося ОПП. По мнению экспертов Американского общества афереза, плазмотерапию у пациентов с аГУС следует рассматривать как метод лечения второй линии в связи с отсутствием убедительных доказательств его пользы при отсутствии антител к фактору комплемента Н [12]. Тем не менее, плазмообмен остается основой лечения в дебюте любой ТМА, а при тромботической тромбоцитопенической пурпуре (ТТП), которая является одной из возможных причин ТМА у беременных женщин, служит методом патогенетической терапии [13]. Для исключения ТТП необходимо измерять активность ADAMTS 13, которая при этом заболевании снижается менее 10%. Учитывая сложность быстрой дифференциальной диагностики аГУС и других форм ТМА и потенциальную эффективность плазмотерапии у части пациенток с аГУС, всем женщинам, у которых признаки ТМА сохраняются после родоразрешения, необходимо немедленн начинать лечение плазмообменом или трансфузиями свежезамороженной плазмы (последний метод менее эффективен).
Индукционная терапия экулизумабом у 56 пациенток с аГУС, связанным с беременностью, привела к снижению риска первичной конечной точки, включавшей в себя смерть и терминальную хроническую почечную недостаточность, требующую лечения программным гемодиализом, на 74% (ОШ 0,26; 95% ДИ 0,10-0,70) и риска смерти от любых причин на 89% (ОШ 0,11; 95% ДИ 0,03-0,43). Среди выживших пациенток при лечении экулизумабом были отмечены недостоверно увеличение частоты полного восстановления функция почек и статистически значимое снижение частоты диализзависимой хронической почечной недостаточности, развившейся в исходе неразрешившегося ОПП. Гематологические показатели после введения экулизумаба нормализовались в течение 28 дней у всех пациенток. Первым признаком ответа на комплементблокирующую терапию служило увеличение количества тромбоцитов, которое в большинстве случаев нормализовалось в течение первых 3 дней после начала лечения, в то время как снижение активности ЛДГ, отражавшее подавление гемолиза, отмечалось в более поздние сроки.
Наиболее эффективной комплементблокирующая терапия была у 28 пациенток, которым первую инфузию экулизумаба проводили в течение первой недели после появления признаков ТМА. При ранней терапии препаратом мы не зарегистрировали ни одного случая смерти, а функция почек во всех случаях полностью восстановилась, что позволило прекратить начатое ранее лечение гемодиализом. Тем не менее, при остроченной и поздней терапии экулизумабом смертность от любых причин (6,7% и 14,5%, соответственно) была ниже, чем в контрольной группе (34,5%), хотя разница между группами не достигла статистической значимости из-за малого числа наблюдений. Важное значение для своевременного назначения комплементблокирующей терапии имеют не только настороженность врачей и быстрое выполнение всех диагностических тестов, необходимых для исключения других причин ТМА, но и доступность экулизумаба. Чтобы ускорить инициацию комплементблокирующей терапии у пациенток с аГУС, связанным с беременностью, в крупных перинатальных центрах желательно иметь запас экулизумаба, достаточный для по крайней мере одного курса индукционной терапии.
Необходимо подчеркнуть, что биопсия почки не требуется для подтверждения диагноза аГУС, хотя она может быть выполнена, если причина ОПП вызывает сомнение или комплементблокирующая терапия оказывается неэффективной. В нашем исследовании биопсия почки была проведена 5 пациенткам с аГУС в сроки от одной недели до 4 мес от дебюта заболевания. Хотя гистологическая картина ТМА была обнаружена у всех пациенток, острая ТМА наблюдалась лишь у одной из них. В трех случаях определялись признаки как острой, так и хронической ТМА, а в одном – только хронической ТМА, что свидетельствует о быстром темпе прогрессирования ишемического повреждения почек.
Эффективность экулизумаба у пациенток с аГУС, связанным с беременностью, была ранее показана и в других исследованиях. F. Fakhouri и соавт. проанализировали результаты лечения 51 пациентки, включенной в Международный регистр аГУС [11]. Терапия экулизумабом, которая проводилось у 27 из них, привела к увеличению вероятности почечной выживаемости на 92% по сравнению с таковой у женщин, не получавших комплементблокирующую терапию (скорректированное отношение шансов 0,08; p=0,019). Расчетная скорость клубочковой фильтрации при лечении экулизумабом увеличилась в среднем на 56,2±39,8 мл/мин/1,73 м2. M. Gupta и соавт. на основании систематизированного обзора проанализировали 54 случая аГУС, развившегося во время беременности или через несколько дней после родов [10]. Среди 17 пациенток, получавших экулизумаб в связи с неэффективностью плазмообмена и внутривенных глюкокортикостероидов, не было зарегистрировано ни одного случая сохранения почечной недостаточности, диализа или смерти, в то время как эти неблагоприятные исходы наблюдались у 24% из 37 пациенток, которым не проводилась комплементблокирующая терапия.
Мы не наблюдали рецидивов аГУС у пациенток, получавших экулизумаб, в том числе после перехода с оригинального препарата на его биоаналог. У пациенток с аГУС, связанным с беременностью, необходимая длительность поддерживающей терапии экулизумабом специально не изучалась. В нашем исследовании экулизумаб был отменен у 34 (64,2%) из 53 выживших пациенток, в том числе у 12 – сразу после купирования ТМА, а у 22 – в различные сроки после перехода на поддерживающую терапию (медиана 12,0 мес). Прекращение комплементблокирующей терапии было часто обусловлено немедицинскими причинами, включая отказ пациенток от продолжения лечения или недоступность экулизумаба. Случаев рецидива аГУС у пациенток, прекративших терапию экулизумабом, независимо от причины отмены препарата (медиана длительности наблюдения 6,0 лет), мы не наблюдали. Приведенные данные свидетельствуют о том, что в акушерской практике действие дополнительных триггеров, хотя и достаточно мощное, чтобы вызвать неконтролируемую активацию системы комплемента, является слишком коротким для ее длительного поддержания даже у женщин с патогенными мутациями генов комплемента, а редуцированный до периода индукции курс лечения экулизумабом позволяет быстро и эффективно блокировать разрушительное действие комплемента [4]. аГУС, связанный с беременностью, не следует считать вариантом вторичной ТМА, развивающейся под действием различных факторов, таких как лекарственные средства, злокачественные опухоли, трансплантация органов, инфекции и др. [3]. По данным международного регистра, частота патогенных мутаций генов системы комплемента и антител к фактору Н была сходной у женщин с аГУС, связанным и не связанным с беременностью (43% и 45%, соответственно) [11]. Мы также выявили патогенные варианты генов факторов комплемента у половины обследованных нами пациенток, однако даже у них отмена терапии не привела к рецидиву аГУС при дальнейшем наблюдении.
Наше исследование подтверждает благоприятный профиль безопасности экулизумаба у пациенток с аГУС. Мы не наблюдали серьезных нежелательных реакций, которые потребовали бы прекращения комплементблокирующей терапии, в первую очередь, менингококковой инфекции. Для профилактики последней все женщины получали антибиотики, а после стабилизации их состояния проходили вакцинацию против менингококковой инфекции.
Наше исследование имеет ограничения, прежде всего отсутствие рандомизации и ретроспективный дизайн, который не позволял учесть влияние всех возможных различий между группами на результаты лечения. Тем не менее, группы женщин, получавших и не получавших экулизумаб, были сопоставимы по возрасту и основным клиническим показателям, а частота анурии, потребовавшей проведения гемодиализа уже в первые дни после появления симптомов аГУС, была выше среди пациенток, которым назначали экулизумаб, что указывало на более тяжелое течение заболевания в этой группе. Количество обследованных пациенток было относительно небольшим, однако оно превышало таковое в опубликованных ранее исследованиях, как и длительность периода наблюдения. У части женщин для индукционной и/или поддерживающей комплементблокирующей терапии применяли не оригинальный экулизумаб, а его биоаналог, зарегистрированный в Российской Федерации. Их сопоставимость по фармакокинетике, фармакодинамике, эффективности и безопасности установлены в рандомизированных и наблюдательных клинических исследованиях [16-19]. Также опубликованы данные об эффективности применения первого биоаналога экулизумаба в реальной клинической практике [20-22].
Заключение
Применение экулизумаба у пациенток с аГУС, связанным с беременностью, привело к быстрому восстановлению гематологических признаков ТМА и значительному снижению (на 74%) риска смерти или развития хронической почечной недостаточности, требующей заместительной почечной терапии, в исходе неразрешившегося ОПП. Наиболее эффективным оказалось раннее введение экулизумаба (в течение первой недели после появления симптомов), позволившее избежать летальных исходов и вызывавшее полное восстановление функции почек даже у пациенток с тяжелым ОПП, нуждавшихся в лечении гемодиализом.
Используемые источники
- Козловская Н.Л., Прокопенко Е.И., Эмирова Х.М., Серикова С.Ю. Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома. Нефрология и диализ 2015;17(3):242-64 [Kozlovskaya NL, Prokopenko EI, Emirova KhM, Serikova SYu. Clinical guidelines for diagnosis and treatment of atypical hemolytic uremic syndrome. Nephrology and Dialysis 2015;17(3):242-64 (In Russ.)].
- Коротчаева Ю.В., Козловская Н.Л., Демьянова К.А. и др. Атипичный гемолитико-уремический синдром: клиническая картина, диагностика и лечение. Клин фармакол тер 2022;31(2):43-50 [Korotchaeva Yu, Kozlovskaya N, Demyanova K, et al. Atypical hemolytic-uremic syndrome: clinical presentation, diagnosis and treatment. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022; 31(2):43-50 (In Russ.)].
- Michael M, Bagga A, Sartain SE, Smith RJH. Haemolytic uraemic syndrome. Lancet 2022;400(10364):1722-40.
- Коротчаева Ю.В., Козловская Н.Л., Моисеев С.В. Комплемент блокирующая терапия у пациентов с атипичным гемолитико-уремическим синдромом и вторичной тромботической микроангиопатией. Клин фармакол тер 2023;22(2):7-14 [Korotchaeva Yu, Kozlovskaya N, Moiseev S. Complement inhibition therapy in patients with atypical hemolytic uremic syndrome and secondary microangiopathies. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2023;32(2):7-14 (In Russ.)].
- Schaefer F, Ardissino G, Ariceta G, et al; Global aHUS Registry. Clinical and genetic predictors of atypical hemolytic uremic syndrome phenotype and outcome. Kidney Int 2018;94(2):408-18.
- Smith-Jackson K, Harrison RA. Alternative pathway activation in pregnancy, a measured amount "complements" a successful pregnancy, too much results in adverse events. Immunol Rev 2023;313(1):298-319.
- Korotchaeva Y, Kozlovskaya N, Shifman E, et al. Complement-activating conditions as potential triggers of pregnancy-related atypical haemolytic uraemic syndrome. Clin Kidney J 2021;14(12):2620-2.
- Fakhouri F, FrОmeaux-Bacchi V. Thrombotic microangiopathy in aHUS and beyond: clinical clues from complement genetics. Nat Rev Nephrol 2021;17(8):543-53.
- Kozlovskaya NL, Korotchaeva YV, Bobrova LA. Adverse outcomes in obstetricatypical haemolytic uraemic syndrome: a case series analysis. J Matern Fetal Neonat Med 2019;32(17):2853-9.
- Gupta M, Govindappagari S, Burwick RM. Pregnancy-associated atypical hemolytic uremic syndrome: A systematic review. Obstet Gynecol 2020;135:46-58.
- Fakhouri F, Scully M, Ardissino G, et al.·Pregnancy-triggered atypical hemolytic uremic syndrome (aHUS): a Global aHUS Registry analysis. J Nephrol 2021;34:1581–90.
- Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice – evidence-based approach from the Writing Committee of the American Society for Apheresis: the eighth special issue. J Clin Apher 2019;34(3):171-354.
- Zheng XL, Vesely SK, Cataland SR, et al. ISTH guidelines for treatment of thrombotic thrombocytopenic purpura. J Thromb Haemost 2020;18(10):2496-502
- Ariceta G, Fakhouri F, Sartz L, et al. Eculizumab discontinuation in atypical haemolytic uraemic syndrome: TMA recurrence risk and renal outcomes. Clin Kidney J 2021;14(9):2075-84.
- Fakhouri F, Fila M, Hummel A, et al. Eculizumab discontinuation in children and adults with atypical hemolytic-uremic syndrome: a prospective multicentric study. Blood 2021;137(18):2438-49.
- Птушкин В.В., Кулагин А.Д., Лукина Е.А. и др. Результаты открытого многоцентрового клинического исследования Ib фазы по оценке безопасности, фармакокинетики и фармакодинамики первого биоаналога экулизумаба у нелеченных пациентов с пароксизмальной ночной гемоглобинурией в фазе индукции терапии. Терапевтический архив 2020;92(7):77-84 [Ptushkin VV, Kulagin AD, Lukina EA, et al. Results of phase Ib open multicenter clinical trial of the safety, pharmacokineticsand pharmacodynamics of first biosimilar of eculizumab in untreated patients with paroxysmal nocturnal hemoglobinuria during induction of therapy. Therapeutic Archive 2020;92(7):77–84 (In Russ.)].
- Kulagin A, Ptushkin V, Lukina E, et al. Randomized multicenter noninferiority phase III clinical trial of the first biosimilar of eculizumab. Ann Hematol 2021;100(11):2689–98.
- Kulagin A, Ptushkin V, Lukina E, et al. Phase III clinical trial of Elizaria® and Soliris® in adult patients with paroxysmal nocturnal hemoglobinuria: results of comparative analysis of efficacy, safety, and pharmacological data. Blood 2019;134 (Suppl 1):3748.
- Коротчаева Ю.В., Козловская Н.Л., Шифман Е.М. Сравнительный анализ эффективности препаратов экулизумаба в лечении акушерского атипичного гемолитико-уремического синдрома. Клин фармакол тер 2021;30(3):25-30 [Korotchaeva YV, Kozlovskaya NL, Shifman EM. Comparative efficacy of the original and biosimilar eculizumab in the treatment of obstetric atypical hemolytic-uremic syndrome. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(3):25-30 (In Russ.)].
- Эмирова Х.М., Орлова О.М., Музуров А.Л. и др. Опыт применения Элизарии® при атипичном гемолитико-уремическом синдроме. Педиатрия. Журнал им. Г.Н. Сперанского 2019;98(5):225-9 [Emirova KhM, Orlova OM, Мuzurov AL. The experience of using Elizaria® for atypical hemolytic uremic syndrome. Pediatria n.a. G.N. Speransky 2019;98(5):225-9 [In Russ.)].
- Lavrishcheva IV, Jakovenko AA, Kudlay DA. A case report of atypical hemolyticuremic syndrome treatment with the first Russian eculizumab in adult patient. Urol Nephrol 2020;8(2):37-40.
- Лаврищева Ю.В., Яковенко А.А., Кудлай Д.А. Опыт применения российского биоаналога оригинального препарата экулизумаба для лечения больных атипичным гемолитико-уремическим синдромом. Терапевтический архив 2020;92(6):5-9 [Lavrishcheva IuV, Jakovenko AA, Kudlay DA. The experience of using the Russian biosimilar of the original drug eculizumab for the treatment of patients with atypical hemolytic-uremic syndrome. Therapeutic Archive 2020;92 (6):76–80 (In Russ.)]..
