Изучение фармакокинетических параметров лекарственного препарата Дуоника® в исследовании биоэквивалентности
Изучение фармакокинетики, оценка безопасности и подтверждение биоэквивалентности лекарственных препаратов Дуоника® (МНН: доксиламин + пиридоксин), таблетки кишечнорастворимые, покрытые пленочной оболочкой, 10 мг + 10 мг (АО “Валента Фарм”, Россия), и Диклектин®, таблетки с отсроченным высвобождением, 10 мг + 10 мг (Duchesnay Inc, Канада).
Проведено открытое рандомизированное двухпериодное перекрестное исследование сравнительной фармакокинетики препарата Дуоника® и референтного препарата Диклектин® после однократного приема натощак у 28 здоровых добровольцев женского пола, которые были рандомизированы на группы по 14 человек в зависимости от последовательности приема изучаемых препаратов в периодах исследования 1 и 2. В течение 72 ч после приема двух таблеток исследуемого или референтного препарата определяли концентрации доксиламина и пиридоксаль-5-фосфата (активного метаболита пиридоксина) в плазме крови методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Проводили фармакокинетический и статистический анализы с расчетом доверительных интервалов (ДИ) для фармакокинетических параметров Сmax и AUC(0-t). Безопасность исследуемых препаратов оценивали на основании частоты и тяжести нежелательных явлений (НЯ).
Значения 90% ДИ доксиламина для отношений показателей AUC(0-t) и Сmax составили 95,06–106,03% и 92,90–106,11%, соответственно. Для пиридоксаль-5-фосфата 90% значения ДИ для отношений показателей AUC(0-72 ч) и Сmax составили 94,74–111,81% и 98,53–109,80%, соответственно. Рассчитанные 90% ДИ находились в пределах критериев, установленных протоколом исследования (80,00–125,00%), что подтверждает биоэквивалентность исследуемых препаратов. Во время исследования ни у одного из добровольцев не было зафиксировано НЯ, что свидетельствует о благоприятном профиле безопасности.
Исследование подтвердило биоэквивалентность препарата Дуоника® и референтного препарата Диклектин®.
Во время беременности женщин нередко беспокоят тошнота и рвота, частота развития которых достигает 80% и 50%, соответственно. При этом вероятность возникновения повторных эпизодов тошноты и рвоты при последующих беременностях варьирует от 15 до 81%. Этиология тошноты и рвоты беременных (ТРБ) до конца не изучена. Предложены различные теории их развития, в частности предлагается рассматривать данное состояние как результат воздействия гормонов или в качестве эволюционного приспособления для защиты матери и плода от отравления пищей (предложенная теория схожим образом объясняет изменение вкуса и обоняния во время беременности), а также как следствие психологической предрасположенности, характерной для части женщин [1].
Чрезмерная рвота беременных представляет собой редкую форму ТРБ, которая развивается в 0,3–3,6% случаев беременности (в среднем 1,1%). Она приводит к выраженному снижению массы тела пациентки (по крайней мере на 5% от исходной массы тела до беременности) и может сопровождаться дегидратацией и электролитными нарушениями [2]. Для оценки тяжести тошноты и рвоты в I триместре беременности используют индекс PUQE (Pregnancy-Unique Quanti fi cation of Emesis and Nausea), величина которого ассоциируется с качеством жизни пациентки. В проведенных исследованиях было показано, что раннее лечение ТРБ может предотвратить появление чрезмерной рвоты беременных [1].
Согласно рекомендациям Американской коллегии акушеров и гинекологов (American College of Obstetricians and Gynecologists, ACOG) в качестве терапии первой линии ТРБ применяют комбинированные препараты, содержащие пиридоксин (витамин B6) и доксиламин [1]. Общество по акушерской медицине Австралии и Новой Зеландии отмечает, что при величине индекса PUQE<13 баллов лечение ТРБ возможно в амбулаторных условиях, в то время как при более высоком его значении следует рассмотреть лечение пациентки в стационаре или палате интенсивной терапии [2].
Безопасность и эффективность применения комбинации доксиламина и пиридоксина у беременных женщин подтверждены в многочисленных клинических исследованиях [3–10]. Общество акушеров и гинекологов Канады (Society of Obstetricians and Gynaecologists of Canada, SOGC) в руководстве по лечению ТРБ предлагает рассматривать эту комбинацию в качестве стандарта терапии [11].
Лекарственные препараты, содержащие комбинацию доксиламина и пиридоксина, на момент написания статьи в Российской Федерации (РФ) не зареги стрированы. Для регистрации воспроизведенного комбинированного препарата Дуоника®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 10 мг + 10 мг (АО "Валента Фарм", Россия), было проведено исследование с целью изучения его безопасности, фармакокинетики и подтверждения биоэквивалентности референтному препарату Диклектин®, таблетки с отсроченным высвобождением, 10 мг + 10 мг (Duchesnay Inc, Канада), у здоровых добровольцев при приеме натощак.
Материал и методы
Исследование было проведено в соответствии с протоколом клинического исследования, принципами Хельсинкской Декларации Всемирной Медицинской Ассоциации, стандартами по Надлежащей Клинической Практике (ICH E6 GCP), а также в соответствии с действующим законодательством РФ и Евразийского экономического союза (ЕАЭС). До начала исследования было получено разрешение Министерства здравоохранения РФ на проведение клинического исследования №437 от 11 июля 2022 г., одобрение Совета по этике при Минздраве РФ (выписка из протокола заседания №308 от 19 апреля 2022 г.), а также одобрение локального этического комитета исследовательского центра (выписка из протокола №63 от 16 августа 2022 г.). Участие в исследовании было добровольным. Доброволец подписывал информированное согласие и имел право отказаться от участия в исследовании в любой момент. Согласие добровольца было получено до проведения каких-либо процедур исследования.
В исследование включали здоровых добровольцев женского пола в возрасте от 18 до 49 лет, которые соответствовали следующим критериям: наличие подписанного информированного согласия, систолическое артериальное давление (САД) в диапазоне от 100 до 139 мм рт. ст., диастолическое артериальное давление (ДАД) от 60 до 89 мм рт. ст., частота сердечных сокращений (ЧСС) от 60 до 90 в минуту, частота дыхательных движений (ЧДД) от 12 до 18 в минуту, температура тела от 36,0° до 36,9°C, индекс массы тела (ИМТ) от 18,5 до 30 кг/м2 при массе тела не менее 45 кг, согласие женщины использовать адекватные методы контрацепции на протяжении всего исследования и в течение 30 дней после его завершения, отрицательный тест на беременность.
Основными критериями невключения были отягощенный аллергологический анамнез, непереносимость действующих и/или вспомогательных веществ, наличие хронических заболеваний, отклонения от нормальных значений инструментальных и лабораторных показателей на скрининге, хирургические вмешательства на органах брюшной полости (за исключением аппендэктомии) в течение 1 года до скрининга), наличие заболеваний или состояний, которые могли оказать влияние на фармакокинетику препаратов, острые инфекционные заболевания в течение 4 недель до скрининга, прием лекарственных препаратов, оказывающих влияние на системную гемодинамику или функцию печени, за 1 месяц до скрининга, регулярный прием лекарственных препаратов в течение 2 недель или разовый прием лекарственных препаратов в течение 7 дней до скрининга, применение депо-инъекций или донорство крови в течение 3 мес до скрининга, беременность или период лактации, курение, регулярный прием алкоголя.
Проведено открытое рандомизированное двухпериодное перекрестное исследование сравнительной фармакокинетики (биоэквивалентности) препаратов Дуоника®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 10 мг + 10 мг (АО "Валента Фарм", Россия), и Диклектин®, таблетки с отсроченным высвобождением, 10 мг + 10 мг (Duchesnay Inc, Канада). Исследование включало следующие периоды и визиты: период скрининга, периоды 1 и 2, отмывочный период и визит завершения исследования. Длительность периода скрининга составляла 1–14 суток. Длительность каждого периода исследования фармакокинетики составляла 3,5 суток, отмывочный период между ними продолжался 21 сутки.
В зависимости от последовательности приема исследуемого и референтного препаратов (RT или TR, где R – референтный препарат Диклектин®, а T – исследуемый препарат Дуоника®) добровольцев рандомизировали на две равные группы. В первом периоде исследования добровольцы из 1-й группы (последовательность RT) принимали референтный препарат, а во втором – исследуемый. Добровольцы, рандомизированные во 2-ю группу (последовательность TR), принимали в первом периоде исследуемый препарат, а во втором – референтный. В каждом из двух периодов добровольцы принимали по 2 таблетки исследуемого или референтного препарата однократно внутрь, запивая их негазированной водой после 12-часового голодания.
В ходе исследования у каждого добровольца были отобраны 72 образца крови (по 36 проб в каждом периоде, в том числе 16 образцов для определения концентрации доксиламина и 20 образцов для определения концентрации пиридоксаль-5-фосфата).
Для определения концентрации доксиламина в каждом периоде исследования образцы крови отбирались непосредственно до приема и через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 16, 24, 48 и 72 ч после приема изучаемых препаратов. Для определения концентрации пиридоксаль-5-фосфата производили отбор крови за 60 мин, 30 мин и непосредственно до приема, а также через 1, 3, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 24, 48 и 72 ч после приема изучаемых препаратов.
Количественное определение доксиламина и пиридоксаль-5-фосфата в плазме крови проводилось специально разработанными аналитическими методиками на основе высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием. Линей ный диапазон определяемых концентраций для доксиламина составил 0,25—120 нг/мл, для пиридоксаль-5фосфата — 0,2—100 нг/мл. Аналитические методики были валидированы по следующим параметрам: селективность, прецизионность, правильность, калибровочный диапазон, нижний и верхний пределы количественного определения, калибровочное уравнение и коэффициент корреляции, стабильность, степень экстракции, матричный эффект и эффект переноса. Так как пиридоксаль-5-фосфат относится к группе витаминов и принимает участие во многих биохимических процессах, протекающих внутри клеток, необходимо было учитывать фоновый уровень данного вещества в плазме крови. В связи с этим полученные значения пиридоксаль-5-фосфата были скорректированы с учетом среднего уровня вещества в 3 образцах, взятых в каждом из периодов за 60, 30 мин и непосредственно перед приемом препаратов. Для коррекции фонового уровня использовали метод стандартного вычитания.
Рассчитывали следующие показатели: AUC(0-t) – площадь под кривой плазменная концентрация – время с момента приема лекарственного препарата до последней определяемой концентрации во временной точке t; AUC(0-∞) – площадь под кривой плазменная концентрация – время с момента приема лекарственного препарата до бесконечности; Cmax – максимальная плазменная концентрация; CL/F – общий плазменный клиренс после перорального приема препарата; λz – константа скорости терминальной элиминации; tmax – время достижения максимальной плазменной концентрации; t1/2(z) – терминальный период полувыведения из плазмы крови; Vd/F – кажущийся объем распределения после перорального приема препарата; MRT(0-∞) – среднее время удержания действующего вещества в плазме крови с момента приема препарата до бесконечности.
Статистический анализ проводился при помощи специального программного обеспечения – языка статистического программирования R (версия 4.1.1) с использованием функции CVfromCI из пакета PowerTOST (версия 1.5–3). Для оценки биоэквивалентности были использованы основные фармакокинетические параметры: AUC(0-t) и Сmax. Препараты признавались биоэквивалентными, если границы 90% доверительных интервалов (ДИ) для отношений средних геометрических значений фармакокинетических параметров AUC(0-t) и Сmax в исходных единицах находились в установленных пределах 80,00–125,00%.
Оценка безопасности исследуемых препаратов прово дилась на основании частоты и тяжести нежелательных явлений (НЯ), мониторинга основных параметров жизнедеятельности (АД, ЧСС, ЧДД), изменения лабораторных показателей (клинический анализ крови, биохимический анализ крови, общий анализ мочи) и показателей ЭКГ.
Результаты
Всего было скринировано 36 добровольцев, из которых 28 женщин были рандомизированы на 2 группы по 14 человек. Две группы не отличались по антропометрическим параметрам. В популяцию для анализа безопасности и фармакокинетики вошли данные 28 добровольцев, в популяцию для оценки биоэквивалентности – 27 добровольцев (одна женщина отозвала информированное согласие после периода 1).
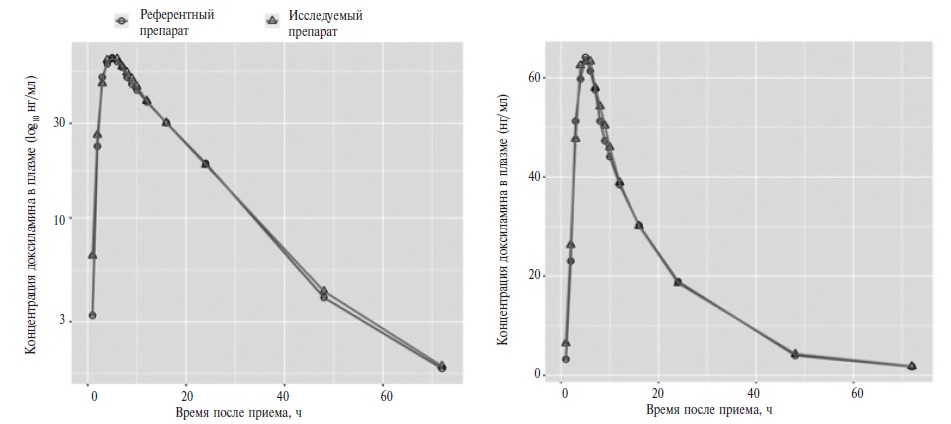
Усредненные фармакокинетические профили доксиламина в линейной и полулогарифмической шкалах после приема исследуемого и референтного препаратов представлены на рис. 1. Кривые зависимости плазменной концентрации от времени для исследуемых препаратов практически не отличались.
Фармакокинетические показатели доксиламина в составе исследуемого и референтного препаратов приведены в табл. 1.
| Параметр | Исследуемый препарат Дуоника® (n=27) | Референтный препарат Диклектин® (n=27) |
|---|---|---|
| AUC(0-t), нг×ч/мл | 1165,440±366,426 | 1141,637±275,860 |
| AUC(0-∞), нг×ч/мл | 1201,238±380,824 | 1175,610±288,113 |
| Cmax, нг/мл | 71,908±21,709 | 71,439±18,348 |
| CL/F, л/ч | 18,245±5,559 | 17,991±4,383 |
| λz, ч-1 | 0,056±0,009 | 0,055±0,008 |
| tmax, ч | 4,556±1,625 | 4,519±1,282 |
| t1/2(z), ч | 12,791±2,145 | 12,840±1,935 |
| Vd/F, л | 332,844±105,867 | 332,451±95,624 |
| MRT(0-∞), ч | 19,848±3,430 | 19,895±2,807 |
В ходе статистического анализа оценивали относительную биодоступность (f') и относительную скорость всасывания (f'') доксиламина. Среднее арифметическое значение (± стандартное отклонение) отношения параметров f' доксиламина (AUC(0-t) (T)/ AUC(0-t) (R)), характеризующего относительную биодоступность исследуемого препарата по сравнению с референтным препаратом, составило 101,7±18,2%. Среднее арифметическое значение (± стандартное отклонение) отношения параметров f'' доксиламина (Cmax (T)/Cmax (R)), характеризующего относительную скорость всасывания действующего вещества из исследуемого препарата по сравнению с референтным препаратом, составило 101,4±21,6%.
Усредненные фармакокинетические профили пиридоксаль-5-фосфата в линейной и полулогарифмической шкалах после приема исследуемого и референтного препаратов представлены на рис. 2. Характер зависимости плазменной концентрации от времени для сравниваемых препаратов практически не отличался.
Согласно п. 47 Решения Совета Евразийской экономической комиссии №85 от 03 ноября 2016 г., если отбор образцов продолжается в течение 72 ч и в точке 72 ч концентрация все еще поддается определению, то описывать AUC(0-t) и остаточную площадь нет необходимости. Достаточно документировать сведения о площади под кривой "плазменная концентрация – время" (AUC), усеченной в точке 72 ч (AUC(0-72 ч)). Поскольку длительность отбора образцов крови в исследовании составляла 72 ч, а у некоторых участников исследования в точке 72 ч концентрация пиридоксаль-5-фосфата все еще поддавалась определению, в соответствии с требованиями п. 47 вместо AUC(0-t) для пиридоксаль-5фосфата определяли значения AUC(0-72 ч). Сведения о фармакокинетических показателях пиридоксаль-5-фосфата в составе исследуемого и референтного препаратов обобщены в табл. 2.
| Параметр | Исследуемый препарат Дуоника® (n=27) | Референтный препарат Диклектин® (n=27) |
|---|---|---|
| AUC(0-t), нг×ч/мл | 549,958±237,628 | 537,032±253,058 |
| AUC(0-∞), нг×ч/мл | 736,964±391,772 | 683,935±307,122 |
| Cmax, нг/мл | 22,648±8,686 | 22,070±9,144 |
| CL/F, л/ч | 33,477±16,476 | 34,555±13,442 |
| λz, ч-1 | 0,025±0,011 | 0,026±0,012 |
| tmax, ч | 10,296±2,614 | 11,259±3,033 |
| t1/2(z), ч | 32,277±13,164 | 33,101±15,191 |
| Vd/F, л | 1411,439±566,668 | 1558,084±725,566 |
| MRT(0-∞), ч | 49,867±19,278 | 48,339±18,746 |
Среднее арифметическое значение (± стандартное отклонение) отношения параметров f' пиридоксаль-5 фосфата (AUC(0-72 ч) (T)/ AUC(0-72 ч) (R)), характеризую щего относительную биодоступность исследуемого препарата по сравнению с референтным препаратом, составило 106,0±27,6%. Среднее арифметическое значе ние (± стандартное отклонение) отношения параметров f'' пиридоксаль-5-фосфата (Cmax (T)/Cmax (R)), характе ризующего относительную скорость всасывания дей ствующего вещества из исследуемого препарата по сравнению с референтным препаратом, составило 105,2±16,9%.
Для доксиламина точечные оценки и 90% ДИ для отношений значений AUC(0-t) и Сmax составили 100,39% (95,06–106,03%) и 99,32% (90% ДИ 92,90–106,11%), соответственно (табл. 3). Для пиридоксаль-5-фосфата точечные оценки и 90% ДИ для отношений значений AUC(0-72 ч) и Сmax составили 102,93% (90% ДИ 94,74– 111,81%) и 104,01% (90% ДИ 98,53–109,80%) соответственно (табл. 3). Полученные 90% ДИ для доксиламина и пиридоксаль-5-фосфата находились в пределах критериев, установленных протоколом исследования (80,00–125,00%), что свидетельствовало о биоэквивалентности исследуемого и референтного препаратов.
Во время исследования не было зарегистрировано ни одного НЯ. Таким образом, профиль безопасности у исследуемого и референтного препаратов был благоприятным и сопоставимым.
Обсуждение
Комбинация действующих веществ доксиламина сукцината 10 мг, пиридоксина 10 мг и дицикломина гидрохлорида 10 мг впервые была зарегистрирована в 1956 г. под торговым названием Бендектин®. За период с 1956 по 1983 г. препарат по приблизительным оценкам приняли около 33 млн женщин.
Проведенные в последующем исследования показали отсутствие антиэметического эффекта дицикломина, вследствие чего в 1976 г. данный компонент был исключен из состава лекарственного препарата. В Канаде двухкомпонентный препарат доксиламина и пиридоксина был зарегистрирован под торговым название Диклектин® в 1978 г. Несмотря на то, что с 1983 г. производство препарата Бендектин® в США было остановлено по решению производителя Merrell Dow Pharmaceuticals из финансовых соображений, применение препарата Диклектин® в Канаде продолжалось [12, 13]. В 2013 г. канадский производитель (Duchesnay Inc) зарегистрировал в США описываемую комбинацию веществ под брендом Diclegis® [13].
Несмотря на длительный опыт применения, подтвержденную в многочисленных исследованиях эффективность и безопасность комбинации доксиламина и пиридоксина, первое исследование по изучению фармакокинетики комбинированного препарата Диклек тин® в виде лекарственной формы таблетки с отсроченным высвобождением было проведено в 2009 г. В данном исследовании при приеме препарата Диклектин® Tmax доксиламина, пиридоксина и пиридоксаля оказались в 3, 6 и 4 раза, соответственно, выше значений Tmax после перорального приема раствора, содержащего комбинацию действующих веществ в аналогичных дозировках. Таким образом, исследуемая лекарственная форма препарата значительно замедляла абсорбцию препарата, тем самым продлевая время его действия [14].
В проведенном АО "Валента Фарм" исследовании воспроизведенный препарат Дуоника®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 10 мг + 10 мг, по основным фармакокинетическим параметрам был эквивалентен референтному препарату Диклектин®, таблетки с отсроченным высвобождением, 10 мг + 10 мг. Согласно решению Совета Евразийской экономической комиссии от 3 ноября 2016 г. №85, установление фармакокинетической эквивалентности позволяет экстраполировать данные доклинических и клинических исследований референтного препарата на воспроизведенный препарат и подтвердить его безопасность и эффективность по зарегистрированным показаниям.
Заключение
Воспроизведенный комбинированный препарат Дуоника®, таблетки кишечнорастворимые, покрытые пленочной оболочкой, 10 мг + 10 мг (АО "Валента Фарм", Россия), и референтный препарат Диклектин®, таблетки с отсроченным высвобождением, 10 мг + 10 мг (Duchesnay Inc, Канада), являются биоэквивалентными, поскольку границы 90% ДИ для отношений средних геометрических значений AUC(0-t) и Сmax доксиламина и AUC(0-72 ч) и Сmax пиридоксаль-5-фосфата в исходных единицах не выходили за границы, установленные протоколом исследования (80,00–125,00%). Во время исследования не было зарегистрировано ни одного НЯ, что подтверждает сопоставимый и благоприятный профиль безопасности воспроизведенного препарата.
Используемые источники
- ACOG Practice Bulletin No. 189: Nausea And Vomiting Of Pregnancy. Obstet Gynecol 2018;131(1):e15.
- Lowe SA, Armstrong G, Beech A, et al. SOMANZ position paper on the management of nausea and vomiting in pregnancy and hyperemesis gravidarum. Aust N Z J Obstet Gynaecol 2020;60(1):34-43.
- Persaud N, Meaney C, El-Emam K, et al. Doxylamine-pyridoxine for nausea and vomiting of pregnancy randomized placebo controlled trial: Prespecified analyses and reanalysis. PLoS One 2018;13(1):e0189978.
- Zhang R, Persaud N. 8-way randomized controlled trial of doxylamine, pyridoxine and dicyclomine for nausea and vomiting during pregnancy: restoration of unpublished information. PLoS One 2017;12(1):e0167609.
- Koren G, Clark S, Hankins GDV, et al. Effectiveness of delayed-release doxylamine and pyridoxine for nausea and vomiting of pregnancy: a randomized placebo controlled trial. Am J Obstet Gynecol 2010;203(6):571.e1-7.
- Koren G, Clark S, Hankins GDV, et al. Demonstration of early efficacy results of the delayed-release combination of doxylamine-pyridoxine for the treatment of nausea and vomiting of pregnancy. BMC Pregnancy Childbirth 2016;16(1):371.
- Koren G, Clark S, Hankins GDV, et al. Maternal safety of the delayed-release doxylamine and pyridoxine combination for nausea and vomiting of pregnancy; a randomized placebo controlled trial. BMC Pregnancy Childbirth 2015;15:59.
- Koren G, Maltepe C, Madjunkova S. Ondansetron compared with doxylamine and pyridoxine for treatment of nausea in pregnancy: a randomized controlled trial. Obstet Gynecol 2015;125(2):490.
- Pope E, Maltepe C, Koren G. Comparing pyridoxine and doxylamine succinatepyridoxine HCl for nausea and vomiting of pregnancy: A matched, controlled cohort study. J Clin Pharmacol 2015;55(7):809-14.
- Oliveira LG, Capp SM, You WB, et al. Ondansetron compared with doxylamine and pyridoxine for treatment of nausea in pregnancy: a randomized controlled trial. Obstet Gynecol 2014;124(4):735-42.
- Arsenault M, Lane C, MacKinnon C, et al. The management of nausea and vomiting of pregnancy. J Obstet Gynaecol Canada 2002;24(10):817-31.
- Jane E. Brody Shadow of doubt wipes out Bendectin. The New York Times. June 19, 1983, Section 4, Page 7. https://www.nytimes.com/1983/06/19/weekinreview/shadow-of-doubt-wipes-out-bendectin.html?sec=health
- Madjunkova S, Maltepe C, Koren G. The delayed-release combination of doxylamine and pyridoxine (Diclegis®/Diclektin®) for the treatment of nausea and vomiting of pregnancy. Pediatr Drugs 2014;16(3):199-211.
- Nulman I, Koren G. Pharmacokinetic comparison of a delayed-release combination of doxylamine succinate and pyridoxine hydrocholoride (Diclektin) and oral solutions of these drugs in healthy women of childbearing age. Can J Clin Pharmacol 2009;16(3):29.
