Клиническое значение антител к рецептору фосфолипазы А2 М-типа у пациентов с первичной мембранозной нефропатией
Изучить значение циркулирующих антител к рецептору фосфолипазы А2 М-типа (анти-PLA2R) в диагностике первичной мембранозной нефропатии (МН) и определении особенностей клинической картины заболевания.
В исследование были включены 155 взрослых пациентов с первичной МН (112 мужчин и 43 женщины, медиана возраста 51 [36; 58] год). Контрольную группу составили 16 пациентов с другими морфологическими вариантами нефропатии. Уровни антиPLA2R в сыворотке крови определяли методом непрямой иммунофлуоресценции. Титры антиPLA2R <1:10 рассматривали как референсные значения. Риск прогрессирования первичной МН оценивали на основании выраженности протеинурии, степени нарушения функции почек, наличия жизнеугрожающих осложнений нефротического синдрома (НС) и титра антиPLA2R.
Серологическое тестирование пациентов с НС на анти-PLA2R проводилось в среднем через 10 мес после выявления высокой протеинурии. Анти-PLA2R определялись у 94 (60,6%) пациентов с первичной МН в различных титрах: 1:20 (n=13), 1:40 (n=16), 1:80 (n=28), 1:160 (n=20), 1:320 (n=12) и 1:640 (n=5). В контрольной группе анти-PLA2R не обнаружены. У анти-PLA2R-позитивных пациентов наблюдалась более высокая протеинурия и чаще встречались НС и нарушение функции почек, соответствующее хронической болезни почек (ХБП) 3 стадии и выше. У пациентов со средними и высокими титрами антиPLA2R (≥1:160) суточная экскреция белка с мочой и уровень креатинина были статистически значимо выше, а альбуминемия ниже, чем у пациентов с низкими титрами анти-PLA2R. Среди анти-PLA2R-позитивных пациентов была выше доля лиц с высоким и очень высоким риском прогрессирования первичной МН (р=0,002).
Позднее тестирование пациентов с НС на анти-PLA2R может объяснить невысокую частоту их выявления по сравнению с таковой в зарубежных исследованиях. Полученные результаты подтверждают информативность определения сывороточных антиPLA2R для диагностики, оценки активности первичной МН и оптимизации тактики лечения и указывают на целесообразность более широкого внедрения этого теста в клиническую практику.
Мембранозная нефропатия (МН) занимает ведущее место среди причин нефротического синдрома (НС) у взрослых и представляет собой гломерулярное заболевание, характеризующееся повреждением подоцитов в результате отложения в субэпителиальном пространстве иммунных комплексов, что приводит к активации системы комплемента и развитию протеинурии [1]. В состав иммунных комплексов могут входить как собственные аутоантигены подоцитов, так и экзогенные антигены. Приблизительно в 20-25% случаев МН является вторичной и обусловлена злокачественными новообразованиями, системными заболеваниями соединительной ткани, инфекциями, а также применением некоторых лекарственных препаратов. Клиничес кие проявления МН не отличаются многообразием (типичны изолированная протеинурия или НС без нарушения функции почек), течение заболевания неоднородно: описаны как случаи самопроизвольных ремиссий (примерно у 1/3 пациентов), так и прогрессирующего снижения функция почек с развитием терминальной хронической почечной недостаточности, требующей заместительной почечной терапии [2-4].
Хотя исследования патогенеза МН начались еще в конце 1950-х годов и уже первые работы на животных моделях продемонстрировали возможность формирования иммунных комплексов in situ путем связывания циркулирующих антител с аутоантигенами, расположенными на подоцитах [5-7], подобные антигены у человека в течение многих лет оставались неустановленными. Оказалось, что мегалин – подоцитарный антиген, обнаруженный в 1982 г. у крыс (против него направлены антитела в модели хеймановского нефрита), не экспрессируется подоцитами человека, не содержится в клубочках и депозитах иммунных комплексов у пациентов с МН и, следовательно, не может участвовать в ее развитии [8]. Дальнейший прогресс в понимании механизмов развития МН был достигнут только в 2009 г., когда L. Beck и соавт. с помощью метода Вестерн-блот и последующей масс-спектрометрии идентифицировали первый подоцитарный аутоантиген человека – трансмембранный рецептор фосфолипазы А2 М-типа (PLA2R) [9]. Авторы выявили антитела к PLA2R (антиPLA2R) у 26 (70%) из 37 пациентов с МН, не связанной с какими-либо другими заболеваниями, в то время как при вторичной МН, иных морфологических вариантах хронического гломерулонефрита и у здоровых добровольцев данные антитела отсутствовали [9]. В последующем сходные результаты были получены в работах других исследователей [10,11], что позволило рассматривать анти-PLA2R-ассоциированную МН как вариант первичной (идиопатической) МН.
К настоящему времени идентифицированы и другие подоцитарные антигены, которые могут быть мишенями для антител при МН, в том числе домен тромбоспондина 1 типа, содержащий 7A (THSD7A), экзостозин 1/экзостозин 2 (EXT1/EXT2), невральный протеин 1, подобный эпидермальному фактору роста (NELL-1), семафорин 3B (SEMA3B), протокадерин 7 (PCDH7), протокадерин FAT1 (FAT1), молекула адгезии нервных клеток 1 (NCAM-1), рецептор 3 трансформирующего фактора роста β (TGFBR3), высокотемпературный рекомбинантный белок A1 (HTRA1), контактин-1 (CNTN1) и нетрин G1 (NTNG1), однако PLA2R попрежнему остается наиболее значимым среди них с клинической точки зрения [12].
Впервые взаимосвязь между титрами анти-PLA2R и активностью первичной МН продемонстрировали L. Beck и соавт. На фоне иммуносупрессивной терапии у пациента наблюдалось исчезновение анти-PLA2R, которое предшествовало снижению протеинурии и повышению уровня альбумина в крови [9]. К настоящему времени в разных популяциях пациентов доказано, что при первичной МН уровни анти-PLA2R могут ассоциироваться с выраженностью протеинурии [13-16], ответом на лечение [13,17-19] и прогнозом [20]. В России такие исследования пока единичные и проводились они еще до широкого внедрения в клиническую практику и стандартизации методов анализа антиPLA2R.
Целью исследования было изучить в отечественной популяции пациентов значение циркулирующих антиPLA2R в диагностике первичной МН и определении особенностей клинической картины заболевания.
Материалы и методы
В исследование включали взрослых (в возрасте ≥18 лет) пациентов с морфологически подтвержденной МН (антиPLA2R позитивной и анти-PLA2R негативной) и пациентов с МН, подтвержденной только серологически (положительные анти-PLA2R), наблюдавшихся в Клинике им. Е.М. Та реева. Всем пациентам проведено обследование, исключившее вторичный характер нефропатии. Контрольную группу составили 16 пациентов с другими морфологическими вариантами нефропатии, у которых до проведения биопсии в связи с наличием НС исследовали в сыворотке крови анти-PLA2R на этапе обследования: фокально-сегментарный гломерулосклероз (n=9), болезнь минимальных изменений (n=2), IgA-нефропатия (n=1), фибриллярный гломерулонефрит (n=1), диабетическая нефропатия (n=2), амилоидоз (n=1).
Уровни анти-PLA2R в сыворотке крови определяли методом непрямой иммунофлуоресценции (НИФ) с помо щью коммерческой тест-системы компании Euroimmum (Германия). Титры анти-PLA2R<1:10 рассматривали как референсные значения. Низкими считали титры анти PLA2R в пределах от 1:20 до 1:80, средними/высокими – ≥1:160.
Риск прогрессирования первичной МН оценивали на основании выраженности протеинурии, степени нарушения функции почек, наличия жизнеугрожающих осложнений НС и титра анти-PLA2R в соответствии со следующими критериями:- низкий – скорость клубочковой фильтрации, рассчитанная по формуле CKD-EPI (рСКФ), >60 мл/мин/1,73 м2, протеинурия <3,5 г/сут, альбумин в крови >30 г/л и низкий титр анти-PLA2R;
- средний – рСКФ >60 мл/мин/1,73 м2 и/или протеинурия >4,0 г/сут и отсутствие ее снижения более чем на 50% на фоне терапии блокаторами ренин-ангиотензиновой системы в течение 6 мес и/или низкий титр антиPLA2R;
- высокий – рСКФ <60 мл/мин/1,73 м2 и/или протеинурия >8,0 г/сут, сохраняющаяся более 6 мес, и/или высокий титр анти-PLA2R;
- очень высокий – угрожающие жизни осложнения НС и/или быстрое снижение рСКФ, не объяснимое другими причинами.
Количественные переменные в зависимости от соответствия данных нормальному распределению представлены как среднее значение и стандартное отклонение или медиана и межквартильный размах, качественные – как частота (доли, проценты). Значимость межгрупповых различий оценивали с помощью t-критерия Стьюдента или U-критерия Манна-Уитни в зависимости от характера распределения. Для проверки статистической значимости различий частотных показателей применяли критерий X2 Пирсона, а при ожидаемой частоте явления менее 5 – точный критерий Фишера. При значении р<0,05 различия считали статистически значимыми.
Результаты
В исследование включены 155 пациентов с первичной МН (112 мужчин и 43 женщины, медиана возраста 51 [36; 58] год). Длительность МН до определения уровней анти-PLA2R (момент включения в исследование) составила 10 (4; 33) мес. Анти-PLA2R были выявлены у 94 (60,6%) пациентов в различных титрах: 1:20 (n=13), 1:40 (n=16), 1:80 (n=28), 1:160 (n=20), 1:320 (n=12) и 1:640 (n=5). Диагноз МН морфологически подтвержден у 140 пациентов, у 79 (84%) из них выявлены анти-PLA2R. У 15 пациентов диагноз МН установлен только серологически, а биопсия почек не проводилась в связи наличием противопоказаний (венозные тромботические осложнения, требующие лечения антикоагулянтами, у 13 пациентов, множественные кисты почек у 1) или отказом от процедуры (1 пациент). НС наблюдался у 111 (74,5%) пациентов (у 29 из них протеинурия превышала 8 г/сут), артериальная гипертония – у 96 (61,9%), снижение рСКФ <60 мл/мин/1,73 м2– у 35 (22,6%). У половины пациентов с артериальной гипертонией повышение АД задолго предшествовало развитию клинических проявления первичной МН.
В контрольной группе у всех 16 пациентов с другими морфологическими вариантами нефропатии антиPLA2R обнаружены не были.
Демографические и клинико-лабораторные характеристики пациентов с первичной МН, у которых определялись и не определялись анти-PLA2R, приведены в табл. 1. В обеих группах преобладали мужчины. Пациенты с положительными анти-PLA2R были статистически значимо старше пациентов, у которых эти антитела отсутствовали. В группе анти-PLA2R-позитивных пациентов НС встречался чаще, уровни протеинурии и креатинина были выше, а альбумина и рСКФ ниже, чем у анти-PLA2R-негативных пациентов, что указывало на большую выраженность НС. Эти различия могли объясняться более высокой активностью заболевания у анти-PLA2R-позитивных пациентов.
| Показатель | Анти-PLA2R–(n=61) | Анти-PLA2R+ (n=94) | p |
|---|---|---|---|
| Мужчины, n (%) | 40 (65,6) | 72 (76,6) | 0,134 |
| Возраст на момент определения анти-PLA2R, лет | 47,0 (31,0; 55,0) | 52,0 (39,0; 60,0) | 0,028 |
| Длительность МН на момент определения анти-PLA2R, мес | 12,0 (6,0; 38,0) | 7,0 (3,0; 25,5) | 0,005 |
| НС, n (%) | 34 (55,7) | 77 (81,9) | 0,001 |
| Протеинурия, г/сут | 3,0 (0,8; 6,3) | 4,5 (2,7; 7,6) | 0,003 |
| Сывороточный альбумин, г/л | 34,2 (25,5; 38,7) | 28,0 (24,2; 31,0) | 0,001 |
| Холестерин, ммоль/л | 6,5 (5,5; 7,2) | 7,1 (5,8; 9,4) | 0,051 |
| Артериальная гипертония, n (%) | 39 (63,9) | 65 (69,1) | 0,599 |
| Креатинин, мкмоль/л | 85,2 (71,0; 97,1) | 95,0 (76,8; 113,9) | 0,019 |
| рСКФ, мл/мин/1,73 м2 | 89,0 (69,0; 106,0) | 76,0 (56,5; 101,3) | 0,038 |
| Стадия ХБП на момент обследования, n (%) | 0,066 | ||
| 1-2 | 53 (86,7) | 62 (65,8) | |
| 3-5 | 8 (13,3) | 32 (34,2) |
Для подтверждения ассоциации между уровнями анти-PLA2R и активностью МН мы сопоставили подгруппы пациентов с низкими (1:20–1:80) и средними/высокими (≥1:160) титрами данных антител (табл. 2). У пациентов с титрами анти-PLA2R ≥1:160 медианы суточной потери белка с мочой и сывороточного уровня креатинина были статистически значимо ниже, а медиана содержания альбумина в сыворотке – выше, чем у пациентов с низкими титрами антител. Таким образом, различия выраженности НС и признаков активности гломерулонефрита между группами анти-PLA2R-позитивных и негативных пациентов формировались за счет пациентов с высокими титрами анти-PLA2R.
| Показатель | 1:20–1:80 (n=57) | ≥1:160 (n=37) | p |
|---|---|---|---|
| Мужчины, n (%) | 46 (82,1) | 26 (70,3) | 0,180 |
| Возраст на момент определения анти-PLA2R, лет | 55 (36,5; 60,0) | 51 (2,0; 59,0) | 0,980 |
| Длительность МН на момент определения анти-PLA2R, мес | 7,0 (3,1; 25,0) | 7,0 (3,0; 32,0) | 0,911 |
| Протеинурия, г/сут | 4,5 (2,5; 7,9) | 6,1 (3,4; 10,9) | 0,047 |
| Сывороточный альбумин, г/л | 28,0 (24,2; 30,5) | 22,5 (20,4; 30,1) | 0,003 |
| Холестерин, ммоль/л | 6,6 (5,9; 8,8) | 8,1 (5,7; 10,3) | 0,050 |
| Артериальная гипертония, n (%) | 38 (62,3) | 26 (70,3) | 0,822 |
| Креатинин, мкмоль/л | 91,0 (76,6; 111,8) | 102,0 (81,8; 121,8) | 0,030 |
| рСКФ, мл/мин/1,73 м2 | 79,0 (56,0; 103,0) | 61,0 (44,8; 76,8) | 0,356 |
| Стадия ХБП на момент обследования, n (%) | 0,479 | ||
| С1-2 | 41 (71,9) | 21 (56,8) | |
| С3-5 | 16 (28,1) | 16 (43,2) |
Среди анти-PLAR-позитивных пациентов была достоверно выше доля лиц с высоким и очень высоким риском прогрессирования МН, которые нуждались в проведении активной иммуносупрессивной терапии, тогда как среди анти-PLAR-негативных пациентов преобладали лица, относившиеся к группам низкого и среднего риска (р=0,002; рис. 1).
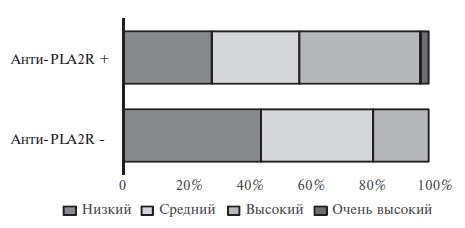
Обсуждение
В нашей работе частота выявления анти-PLA2R составила 60,6%. Этот показатель согласуется с результатами других исследований, хотя и был несколько ниже средних значений в европейских популяциях [911,13,18,19,21]. Вероятно, это обусловлено особенностями серологической диагностики первичной МН у российских пациентов, поскольку в нашей выборке во многих случаях анти-PLA2R исследовали уже при продолжительном течении заболевания (медиана длительности первичной МН к моменту определения антител составила в среднем 10 мес), когда циркулирующие антитела могли депонироваться в ткани почек. Кроме того, у части пациентов анти-PLA2R определяли в период ремиссии, в том числе медикаментозной. В двух третях случаев были обнаружены невысокие (1:20-1:80) титры анти-PLA2R, что также свидетельствует в пользу предположения о поздней серологической диагностике первичной МН в исследуемой популяции пациентов по причине недостаточной доступности метода. В контрольной группе у пациентов с другими морфологическими вариантами поражения почек, среди которых преобладали подоцитопатии, протекающие с высокой протеинурией, анти-PLA2R обнаружены не были, что подтверждает продемонстрированную ранее высокую специфичность этих антител при первичной МН [22].
Установленная связь анти-PLA2R с первичной МН открывает перспективы для неивазивной диагностики заболевания, позволяющей избежать возможных осложнений биопсии почки (частота которых достигает 16,6%, в том числе серьезных – 1,5% [23]) и снизить стоимость обследования больных. В то же время существование анти-PLA2R-негативных вариантов МН, зависимость частоты выявления анти-PLA2R от используемого метода (НИФ или твердофазный иммуноферментный анализ [ELISA]), стадии заболевания, проводимой иммуносупрессивной терапии, а также возможность сочетания МН с другими вариантами поражения почек (например, диабетической нефропатией, острым интерстициальным нефритом, острым канальцевым некрозом и т.п.) ограничивают информативность диагностики первичной МН, основанной только на определении анти-PLA2R [24]. Результаты исследований последних лет позволили отчасти решить эту проблему. Так, НИФ характеризуется большей специфичностью по сравнению с ELISA у пациентов с низкими титрами анти-PLA2R, поэтому первый метод следует использовать для верификации серопозитивности и исключения ложноположительных результатов при титрах анти-PLA2R в пределах 2-30 RU/мл, полученных с помощью ELISA [22,25].
В отношении возможности сочетания МН с другими вариантами поражения почек решающее значение имеет возможность изменения тактики лечения. По данным S.A. Bobart и соавт. [26], у 60 серопозитивных по анти-PLA2R пациентов с МН, у которых рСКФ превышала 60 мл/мин/1,73 м2 и отсутствовали данные в пользу вторичного характера нефропатии, выявленные при нефробиопсии сопутствующие изменения (фокально-сегментарный гломерулосклероз у 1 и диабетическая нефропатия у 1) не повлияли на тактику лечения и, следовательно, нефробиопсия в такой ситуации не позволила получить новую информацию, способную изменить подход к терапии. Позднее авторы подтвердили эти результаты в более крупной выборке [27]. Все это, вместе взятое, нашло отражение в обновленных рекомендациях KDIGO 2021, согласно которым у пациентов с НС и положительными уровнями анти-PLA2R для подтверждения диагноза МН биопсия почки не требуется [28].
В то же время отсутствие анти-PLA2R не исключает анти-PLA2R-ассоциированный вариант МН, поскольку в ряде случаев, например, на ранней стадии заболевания, когда антитела образуются в небольшом количестве и, связываясь с антигеном, полностью "оседают" в клубочках, их концентрация в крови остается ниже порога определения. В этой ситуации обнаружение PLA2R в ткани почки позволяет диагностировать первичную МН [29]. Аналогичная картина может наблюдаться в период ремиссии нефропатии. По данным B. Svo bodova и соавт. [30], в период ремиссии первичной МН анти-PLA2R определялись в сыворотки крови только в 22% случаев, а в ткани почки – в 59%.
Хотя наличие анти-PLA2R характеризуется высокой специфичностью в диагностике первичной МН, оно все же полностью не исключает ассоциацию МН с другими заболеваниями. В литературе описаны единичные случаи анти-PLAR-позитивной МН, ассоциированной с саркоидозом, гепатитом В и злокачественными опухолями [31]. Мы также наблюдали 5 анти-PLA2R-позитивных пациентов с МН, у которых имелись онкологические заболевания (рак слепой кишки у 1, мочевого пузыря у 1 и желудка у 1), диагностированные в течение первого года после развития нефропатии, или хронический вирусный гепатит С (у 2). Данные пациенты были исключены из исследования ввиду высокой вероятности вторичной природы МН, для лечения которой требовалось, прежде всего, устранение возможного этиологического фактора.
Полученные в нашей работе данные о связи титров анти-PLA2R с активностью первичной МН (в частности высокой протеинурией и более низкой альбуминемией) согласуются с результатами других исследований [13-15,34-37]. Примечательно, что у пациентов со средними и высокими титрами анти-PLA2R наблюдались более выраженные признаки активности заболевания, что также отмечали и другие авторы [13,14,21,34,37]. В качестве возможного механизма может обсуждаться наличие у этих пациентов более тяжелого повреждения подоцитов вследствие более активной выработки антиPLA2R с последующим образованием большего количества иммунных комплексов и активацией системы комплемента [36].
До обнаружения анти-PLA2R тактику ведения пациентов с первичной МН определяли на основании традиционных показателей, таких как выраженность протеинурии и гипоальбуминемии и степень нарушения функция почек. К настоящему времени установлено, что анти-PLA2R не просто отражают активность заболевания и могут использоваться для диагностики МН и дифференциальной диагностики между первичной и вторичной формами заболеваниями, но и служат полезным серологическим маркером для мониторирования иммунологической активности заболевания (в том числе, вероятности развития ремиссии), а также могут быть использованы для оценки риска прогрессирования и прогноза заболевания [19,22,34,38,39]. В нашем исследовании доля пациентов с высоким и очень высоким риском прогрессирования оказалась выше среди анти-PLA2R-серопозитивных больных. Кроме того, эти пациенты ожидаемо чаще нуждались в проведении активной иммуносупрессивной терапии. Похожие результаты ранее были получены E.J. Song и соавт. [36], в работе которых за период наблюдения иммуносупрессивную терапию получали 76% антиPLA2R-позитивных пациентов и только 17% больных, у которых анти-PLA2R отсутствовали.
Заключение
Результаты нашего исследования продемонстрировали более низкую частоту выявления анти-PLA2R в исследуемой выборке по сравнению с таковой в работах зарубежных авторов, что, по-видимому, объясняется поздним тестированием пациентов с НС на антиPLA2R в отечественной практике. Отсутствие антиPLA2R в контрольной группе подтверждает ранее продемонстрированную другими исследователями высокую специфичность этих антител при первичной МН и позволяет обсуждать применение этого теста для неинвазивной диагностики МН. В то же время серонегативность не исключает возможность анти-PLA2Rассоциированной МН, в связи с чем требуется активное внедрение в клиническую практику более информативного исследования анти-PLA2R в ткани почки. Кроме того, у всех пациентов с МН независимо от результатов серологической диагностики необходимо исключать ассоциированные состояния (новообразования, инфекции, системные заболевания и т.д.). Особенно тщательно следует обследовать анти-PLA2R-негативных пациентов с МН. Анти-PLA2R-позитивность ассоциирована с активностью первичной МН (в частности высокой протеинурией и более низкой альбуминемией), причем у пациентов со средними и высокими титрами анти-PLA2R наблюдаются более выраженные признаки активности заболевания. Полученные результаты подтверждают информативность определения сывороточных анти-PLA2R для диагностики, оценки активности первичной МН и оптимизации тактики лечения и указывают на целесообразность более широкого внедрения этого теста в клиническую практику.
Используемые источники
- Alsharhan L, Beck LH Jr. Membranous nephropathy: core curriculum 2021. Am J Kidney Dis 2021;77(3):440-53.
- Polanco N, GutiОrrez E, CovarsТ A, et al. Spontaneous remission of nephrotic syndrome in idiopathic membranous nephropathy. J Am SocNephrol 2010;21(4):697-704.
- Donadio JV Jr, Torres VE, Velosa JA, et al. Idiopathic membranous nephropathy: the natural history of untreated patients. Kidney Int 1988;33(3):708-15.
- Schieppati A, Mosconi L, Perna A, et al. Prognosis of untreated patients with idiopathic membranous nephropathy. N Engl J Med. 1993;329(2):85-9.
- Heymann W, Hackel DB, Harwood S, et al. Production of nephrotic syndrome in rats by Freund's adjuvants and rat kidney suspensions. Proc Soc Exp Biol Med 1959;100(4):660-4.
- Van Damme BJ, Fleuren GJ, Bakker WW, et al. Experimental glomerulonephritis in the rat induced by antibodies directed against tubular antigens. V. Fixed glomerular antigens in the pathogenesis of heterologous immune complex glomerulonephritis. Lab Invest 1978;38(4):502-10.
- Couser WG, Steinmuller DR, Stilmant MM, et al. Experimental glomerulonephritis in the isolated perfused rat kidney. J Clin Invest 1978;62(6):1275-87.
- Kerjaschki D, Farquhar MG. The pathogenic antigen of Heymann nephritis is a membrane glycoprotein of the renal proximal tubule brush border. Proc Natl Acad Sci U S A. 1982;79(18):5557-61.
- Beck L, Bonegio R, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361(1):11-21.
- Bobart SA, De Vriese AS, Pawar AS, et al. Noninvasive diagnosis of primary membranous nephropathy using phospholipase A2 receptor antibodies. Kidney Int 2019;95:429-38.
- Wiech T, Stahl RAK, Hoxha E. Diagnostic role of renal biopsy in PLA2R-antibody-positive patients with nephrotic syndrome. Mod Pathol 2019;32:1320-28.
- Caravaca-FontЗn F, Yandian F, Fervenza FC. Future landscape for the management of membranous nephropathy. Clin Kidney J 2023;16(8):1228-38.
- Hofstra JM, Beck LH, Beck DM, et al. Antiphospholipase A 2 receptor antibodies correlate with clinical status in idiopathic membranous nephropathy. Clin J Am Soc Nephrol 2011;6:1286–91.
- Li X, Wei D, Zhou Z, et al. Anti-PLA2R antibodies in Chinese patients with membranous nephropathy. Med Sci Monit 2016;22:1630–6.
- Pang L, Zhang AM, Li HX, et al. Serum anti-PLA2R antibody and glomerular PLA2R deposition in Chinese patients with membranous nephropathy: a crosssectional study. Medicine (Baltimore) 2017;96:e7218.
- Добронравов В.А., Лапин С.В., Лазарева Н.М. и др. Циркулирующие антитела к рецептору фосфолипазы А2 при первичной мембранозной нефропатии. Нефрология. 2012;16(4):39-44 [Dobronravov VA, Lapin SV, Lazareva NM, et al. Circulating phospholipase A2 receptor antibodies in primary membranous nephropathy. Nephrology (Saint-Petersburg) 2012;16(4):39-44 (In Russ.)].
- Bech AP, Hofstra JM, Brenchley PE, Wetzels JF. Association of anti-PLA₂R antibodies with outcomes after immunosuppressive therapy in idiopathic membranous nephropathy. Clin J Am Soc Nephrol 2014;9(8):1386-92.
- Ruggenenti P, Debiec H, Ruggiero B, et al. Anti-phospholipase A2 receptor antibody titer predicts post-rituximab outcome of membranous nephropathy. J Am Soc Nephrol 2015;26(10):2545–58.
- De Vriese AS, Glassock RJ, Nath KA, et al. A proposal for a serology-based approach to membranous nephropathy. J Am Soc Nephrol 2017;28:421–30.
- Beck LH Jr, Fervenza FC, Beck DM, et al. Rituximab-induced depletion of antiPLA2R autoantibodies predicts response in membranous nephropathy. J Am Soc Nephrol 2011;22(8):1543-50.
- Kanigicherla D, Gummadova J, McKenzie EA, et al. Anti-PLA2R antibodies measured by ELISA predict long-term outcome in a prevalent population of patients with idiopathic membranous nephropathy. Kidney Int 2013;83:940–8.
- Du Y, Li J, He F, et al. The diagnosis accuracy of PLA2R-AB in the diagnosis of idiopathic membranous nephropathy: a meta-analysis. PLoS One 2014;9(8):e104936.
- Pombas B, Rodríguez E, Sánchez J, et al. Risk factors associated with major complications after ultrasound-guided percutaneous renal biopsy of native kidneys. Kidney Blood Press Res 2020;45(1):122-30.
- McDonnell T, Wu HHL, Sinha S, Chinnadurai R. The role of PLA2R in primary membranous nephropathy: do we still need a kidney biopsy? Genes (Basel) 2023;14(7):1343.
- Behnert A, Schiffer M, Müller-Deile J, et al. Antiphospholipase A₂ receptor autoantibodies: a comparison of three different immunoassays for the diagnosis of idiopathic membranous nephropathy. J Immunol Res 2014;2014:143274.
- Bobart SA, De Vriese AS, Pawar AS, et al. Noninvasive diagnosis of primary membranous nephropathy using phospholipase A2 receptor antibodies. Kidney Int 2019;95(2):429-38.
- Bobart SA, Han H, Tehranian S, et al. Noninvasive diagnosis of PLA2R-associated membranous nephropathy: A validation study. Clin J Am Soc Nephrol 2021;16(12):1833-9.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021;100(4S):S1-276.
- van de Logt AE, Hofstra JM, Wetzels JF. Serum anti-PLA2R antibodies can be initially absent in idiopathic membranous nephropathy: seroconversion after prolonged follow-up. Kidney Int 2015;87(6):1263-4.
- Svobodova B, Honsova E, Ronco P, et al. Kidney biopsy is a sensitive tool for retrospective diagnosis of PLA2R-related membranous nephropathy. Nephrol Dial Transplant 2013;28(7):1839-44.
- Hoxha E, Beck LH Jr, Wiech T, et al. An indirect immunofluorescence method facilitates detection of thrombospondin type 1 domain-containing 7A-specific antibodies in membranous nephropathy. J Am Soc Nephrol 2017;28(2):520-31.
- Бобылева И.А., Кахсуруева П.А., Камышова Е.С. и др. Клинико-генетические особенности идиопатической мембранозной нефропатии у российских пациентов. Клиническая нефрология 2019;3:31-6 [Bobyleva IA, Kakhsurueva PA, Kamyshova ES, et al. Variants of M-type phospholipase a2 receptor (PLA2R1) gene associated with susceptibility to idiopathic membranous nephropathy (IMN). Klinicheskaya nephrologia 2019;3:31-36 (In Russ.)].
- Добронравов В.А., Майер Д.А., Бережная О.В. и др. Мембранозная нефропатия в российской популяции. Терапевтический архив. 2017;6:21-29 [Dobronravov VA, Mayer DA, Berezhnaya OV, et al. Membranous nephropathy in the Russian population. Terapevticheskii Arkhiv 2017;89(6):21-9 (In Russ.)].
- Hofstra JM, Debiec H, Short CD, et al. Antiphospholipase A2 receptor antibody titer and subclass in idiopathic membranous nephropathy. J Am Soc Nephrol 2012;23(10):1735-43.
- Oh YJ, Yang SH, Kim DK, et al. Autoantibodies against phospholipase A2 receptor in Korean patients with membranous nephropathy. PLoS One 2013;8(4):e62151.
- Song EJ, Jeong KH, Yang YA, et al. Anti-phospholipase A2 receptor antibody as a prognostic marker in patients with primary membranous nephropathy. Kidney Res Clin Pract. 2018;37(3):248-56.
- Kim YG, Choi YW, Kim SY, et al. Anti-phospholipase A2 receptor antibody as prognostic indicator in idiopathic membranous nephropathy. Am J Nephrol 2015;42(3):250-7.
- Radice A, Pieruzzi F, Trezzi B, et al. Diagnostic specificity of autoantibodies to M-type phospholipase A2 receptor (PLA2R) in differentiating idiopathic membranous nephropathy (IMN) from secondary forms and other glomerular diseases. J Nephrol 2018;31(2):271-8.
- Zhang Q, Huang B, Liu X, et al. Ultrasensitive quantitation of anti-phospholipase A2 receptor antibody as a diagnostic and prognostic indicator of idiopathic membranous nephropathy. Sci Rep 2017; 7(1):12049.
