Особенности инфаркта миокарда с подъемом сегмента ST при неалкогольном стеатозе печени и стеатогепатите
Оценка особенностей инфаркта миокарда с подъемом сегмента ST (ИМпST) у больных с метаболическим синдромом при наличии различных форм метаболически-ассоциированной жировой болезни печени (МАЖБП) – стеатоза печени и стеатогепатита.
В исследование был включен 71 пациент (медиана возраста 62,9 [59,9;66,0] лет) с ИМпST в сочетании с МАЖБП, поступивший для выполнения первичной коронароангиографии и чрескожного вмешательства на коронарных артериях. У 27 пациентов диагностирован стеатогепатит, у 44 – стеатоз печени. Всем пациентам проводили эластометрию печени, определяли кардиоспецифичный тропонин I при поступлении (cTnI-1) и через 24 ч (cTnI-24), средний размер тромбоцитов (MPV), активность аминотрансфераз, гамма-глутамилтрансферазы (ГГТ) и концентрацию фрагментов цитокератина-18 (ФЦК-18).
Наличие стеатогепатита у пациентов с ИМпST сопровождалось увеличением частоты значительного тромбоза (ТТG⩾3), необходимости в двухэтапном чрескожном вмешательстве на коронарных артериях, снижением степени разрешения элевации ST после первичного вмешательства, более значительным увеличением активности аминотрансфераз и ГГТ, а также увеличением риска неблагоприятных сердечно-сосудистых событий в течение 18 мес после острого коронарного синдрома (ОКС) по сравнению с таковыми у пациентов с ИМпST и стеатозом печени. Для диагностики МАЖБП у пациентов с ИМпST целесообразно проводить эластометрию печени, которую по возможности следует дополнять измерением концентрации ФЦК-18. Включение в многомерную модель концентрации ФЦК-18 привело к улучшению точности прогноза последующих коронарных событий.
ИМпST, сочетающийся со стеатогепатитом, характеризуется большей тромботической нагрузкой, выраженностью некроза, сложностью выполнения первичного чрескожного вмешательства и неблагоприятным прогнозом в ближайшие 18 мес после ОКС.
Проблема взаимосвязи сердечно-сосудистой патологии и патологии печени с наибольшей наглядностью реализуется на финальных стадиях поражения этих органов и обусловлена в основном гемодинамическими нарушениями. Чаще всего первичным является поражение сердца, которое, например, приводит к развитию застойного варианта цирроза печени при сердечной недостаточности. Более редким примером обратной последовательности может служить портопульмональная гипертензия при циррозе печени, которая сопровождается недостаточностью правого желудочка. Другие возможные сердечнососудистые расстройства у пациентов с первичными заболеваниями печени изучены недостаточно.
Метаболически-ассоциированная жировая болезнь печени (МАЖБП, старое название – неалкогольная жировая болезнь печени), развивающаяся в рамках метаболической дисфункции организма, рассматривается как фактор риска острого коронарного синдрома (ОКС) и может оказывать влияние на течение инфаркта миокарда (ИМ) [1]. В ряде исследований доказано, что у пациентов с МАЖБП наблюдается более тяжелое поражение коронарных артерий [2-4]. Тем не менее, связь между стеатозом печени и стеатогепатитом, т.е. основными проявлениями МАЖБП, и развитием и течением ОКС раскрыта далеко не полностью.
Материл и методы
В проспективное исследование включали пациентов с ИМпST в сочетании с МАЖБП, поступивших для выполнения первичной коронароангиографии и чрескожного вмешательства на коронарных артериях. МАЖБП диагностировали на основании критериев Американской ассоциации по изучению болезней печени и Европейской ассоциации по изучению печени: (1) наличие стеатоза печени, подтвержденного с помощью фиброэластометрии или гистологического исследования; (2) отсутствие значительного потребления алкоголя (30 г/сут этанола для мужчин и 20 г/сут для женщин); (3) отсутствие конкурирующих причин стеатоза печени и сопутствующих хронических заболеваний печени [5,6]. Критериями исключения были асцит, отечный синдром на фоне хронической сердечной недостаточности, терминальная стадиая хронической почечной недостаточности и злокачественные новообразования.
Инфаркт-ответственной считали артерию с острой тромботической (полной или субтотальной) окклюзией. Для описания сосудистых поражений использовали шкалу SYNTAX, классификацию морфологии коронарного стеноза (Stenosis morphology classification, ACC и AHA) и извитости артерии [7,8]. Ангиографическая оценка коронарного тромбоза проводилась по шкале TIMI trombus grade (ТТG), где ТТG 0 – нет ангиографических признаков тромбоза, ТТG 1 – вероятно наличие тромба, нарушение пристеночного контрастирования, неровность контуров сосуда, ТТG 2 – тромб размером не более половины диаметра инфарктответственной артерии, ТТG 3 – продольный размер тромба более половины, но менее двух диаметров инфаркт-ответственной артерии, ТТG 4 – продольный размер тромба более двух диаметров инфаркт-ответственной артерии и ТТG 5 – массивный тромбоз инфаркт-ответственной артерии [9].
Рассчитывали степень (%) разрешения подъема сегмента ST как отношение разницы суммарного значения подъема точки J во всех отведениях с элевацией сегмента ST до и через 90 мин после чрескожного коронарного вмешательства к сумме исходной величины ее подъема в этих отведениях ×100. Всем больным проводили эхокардиографию (GE Logiq F6) и фиброэластометрию печени (Fibroscan FS502 Touch, Echosens, Франция) с функцией САР (Controlled Attenuation Parameter). Показатель плотности печени в килопаскалях (кПа) определяли как среднее значение всех измерений. Фиброз устанавливали при увеличении плотности печени более 5,9 кПа, стадию фиброза определяли по шкале METAVIR: Ф1 (начальный фиброз) – 5,9–7,2 кПа; Ф2 (умеренный фиброз) – 7,3–9,5 кПа; Ф3 (выраженный фиброз) – 9,6–12,5 кПа; Ф4 (цирроз печени) – ≥12,6 кПа. Для оценки выраженности стеатоза применяли параметр затухания ультразвуковой волны, измеряемый в децибелах/метр (дБ/м): С0 (нет стеатоза) – <215 дБ/м; С1 (минимальный стеатоз; ≤5% гепатоцитов со стеатозом) – 215–251 дБ/м; С2 (умеренный стеатоз; 6–32% гепатоцитов со стеатозом) – 252–295 дБ/м; С3 (выраженный стеатоз; 33–100% гепатоцитов со стеатозом) – ≥296 дБ/м. При наличии острой сердечной недостаточности (Killip ≥II) плотность печени измеряли через 72 ч после ее купирования.
Стеатогепатит диагностировали на основании критериев M. Koneman и соавт.: увеличение плотности печени >8,5 кПа в сочетании с увеличением активности АсАТ >40 Ед/л, наличием сахарного диабета, артериальной гипертонии и возрастом старше 50 лет [10]. Повышение активности АсАТ часто наблюдается при ИМ, поэтому указанные критерии рекомендуется дополнять измерением концентрации фрагментов цитокератина-18 (ФЦК-18), увеличение которой (особенно M30) определяется не некрозом миокарда при острой ишемии, а апоптотической гибелью гепатоцитов и холангиоцитов вследствие хронического воспаления в печеночной паренхиме [11]. Концентрацию ФЦК-18 измеряли методом ELISA (Biotech, Швеция).
ИМпST диагностировали на основании общепринятых критериев [12-16].
Кардиоспецифичный тропонин I определяли методом ELISA при поступлении (cTnI-1) и через 24 ч (cTnI-24). Кроме того, измеряли активность аспартатаминотрансферазы (АсАТ), аланинаминотрансферазы (АлАТ), гамма-глутамилтрансферазы (ГГТ), содержание холестерина липопротеинов низкой плотности (ХС-ЛНП), холестерина липопртеинов высокой плотности (ХС-ЛВП), триглицеридов (ТГ), глюкозы натощак, общего билирубина и креатинина. Скорость клубочковой фильтрации (СКФ) рассчитывали по Кокрофту-Голту. В общем анализе крови определяли количество тромбоцитов и их средний объем (MPV).
В течение 18 месяцев после ОКС оценивали сердечнососудистые события, включая повторный ИМ, повторное чрескожное вмешательство на коронарных артериях, рецидив стенокардии и/или необходимость в возобновлении антиангинальной терапии.
Различия между двумя группами для непрерывных переменных, представленных в виде медианы, 25 и 75 квартилей, рассчитывали с помощью U-критерия Манна-Уитни. При сравнении трех групп использовали критерий Н (Крускала-Уоллиса). Категориальные переменные сравнивали с использованием критерия X2. В связи с выполнением чрескожных вмешательств несколькими операторами рассчитывали значения κ Коэна для всех ангиографических показателей. Для оценки влияния набора факторов на вероятность наступления неблагоприятных событий в течение 18 месяцев после ОКС с коррекцией на исходное наличие стеатогепатита использованы регрессионная модель Кокса (результаты выражались в виде отношения рисков [ОР] c 95% доверительным интервалом [ДИ]) и логистический анализ (результаты выражены в виде отношения шансов [ОШ] с 95% ДИ). Регрессионную модель пропорциональных рисков Кокса применяли для проверки влияния переменных на развитие неблагоприятных коронарных событий с учетом фактора времени. Переменные с p<0,150 в однофакторном анализе вводили как ковариаты в многофакторный анализ. Логистическую регрессию использовали для решения трех задач: (1) для оценки пороговых значений концентрации ФЦК-18, влияющих на прогноз без учета фактора времени; (2) для оценки результативности прогнозирования неблагоприятного течения ИМ без учета фактора времени при наличии стеатогепатита с учетом клинических данных, возраста, концентрации АсАТ (непрерывные переменные) и плотности печени >8,5 или ≤8,5 кПа (категориальная переменная); (3) для проверки гипотезы об улучшении качества прогноза неблагоприятного исхода при включении в модель дополнительной характеристики — концентрации ФЦК-18 в крови (непрерывная переменная). Площади под ROC-кривой исходной и улучшенной модели сравнивали с применением теста DeLong. Оптимальное пороговое значение во всех случаях задано с условием баланса между чувствительностью (Se) и специфичностью (Sp). Статистический анализ выполнен с помощью программного обеспечения RStudio 4.3.1 и Statistica 12.0 для Windows.
Результаты
В исследование был включен 71 больной с ИМпST в сочетании с МАЖБП (56 мужчин; медиана возраста 62,9 [59,9; 66,0] лет), поступивший для выполнения первичной коронароангиографии через лучевой доступ и чрескожного вмешательства на коронарных артериях. До поступления в стационар все пациенты получали ацетилсалициловую кислоту 300 мг, клопидогрел 600 мг, нефракционированный гепарин (60-70 Ед/кг) и анальгетики. У 62 пациентов выполнено экстренное стентирование (стент "Калипсо"). У 9 больных с массивным тромбозом и высокой вероятностью развития феномена "no-reflow" выполнено первичное двухэтапное чрескожное вмешательство. Первоначально кровоток восстанавливали путем механической реканализации проводником и баллонной дилатации в сочетании с аспирацией тромба. Затем назначали инфузию блокаторов IIb/IIIa гликопротеиновых рецепторов. При сохранении гемодинамически значимого (≥75%) стеноза инфаркт-ответственной артерии через 5 суток имплантировали стент.
| Тяжесть стеатоза | С0 | С1 | С2 | С3 |
|---|---|---|---|---|
| n | - | 7 | 17 | 47 |
| Женщины | - | 4 | - | 11 |
| Мужчины | - | 3 | 17 | 36 |
| Тяжесть фиброза | Ф0 | Ф1 | Ф2 | Ф3 |
| n | 1 | 32 | 27 | 11 |
| Женщины | - | 7 | 6 | 2 |
| Мужчины | 1 | 25 | 21 | 9 |
| Стеатоз печени | 1 | 32 | 11 | - |
| Стеатогепатит | - | - | 16 | 11 |
У 27 из 71 пациента диагностировали стеатогепатит (1-я группа), у 44 – стеатоз печени (2-я группа). Структура тяжести стеатоза и фиброза по данным эластометрии печени представлена в табл. 1, клиническая и демографическая характеристика пациентов со стеатогепатитом и стеатозом печени – в табл. 2.
| Показатели | Стеатогепатит (n=27) |
Стеатоз печени (n=44) |
p |
|---|---|---|---|
| Примечание: ФВ ЛЖ — фракция выброса левого желудочка, ФП — фибрилляция предсердий, ИМТ — индекс массы тела, ЧКВ — чрескожное вмешательство на коронарных артериях | |||
| Возраст, лет | 63,2 (59,6;67,1) | 62,3 (59,2;66,4) | 0,453 |
| Мужчины, n (%) | 25 (92,6) | 31 (70,5) | 0,568 |
| ИМТ, кг/м2 | 27,7 (24,9;32,4) | 26,9 (24,1;31,8) | 0,816 |
| Окр. талии, см | 95 (82;98) | 94 (81;98) | 0,950 |
| Гипертония, n (%) | 16 (59,3) | 26 (59,1) | 0,847 |
| Сах. диабет, n (%) | 9 (33,3) | 5 (11,4) | 0,128 |
| Глюкоза, ммоль/л | 5,2 (4,9;5,9) | 5,1 (4,9;5,2) | 0,048 |
| ФЦК-18, Ед/л | 397,1 (316,0;441,3) | 179,4 (64,6;241,8) | <0,001< /td> |
| ХС ЛВП, ммоль/л | 0,93 (0,88;1,01) | 0,98 (0,93;1,13) | 0,117 |
| ТГ, ммоль/л | 1,59 (1,22;1,81) | 1,26 (1,21;1,72) | 0,178 |
| СКФ, мл/мин | 84,9 (77,2;89,3) | 85,3 (76,5;90,1) | 0,897 |
| сТnI-1, нг/мл | 4,10 (4,01;5,07) | 3,61 (1,02;4,01) | 0,003 |
| сТnI-24 ч, нг/мл | 27,90 (24,10;32,11) | 23,8 (20,35;28,95) | 0,008 |
| Тромбоциты, ×103/мкл | 276 (272;331) | 273 (269;276) | 0,061 |
| MPV, фл | 10,4 (9,8;11,8) | 9,9 (9,3;10,7) | <0,001< /td> |
| АлАТ, Ед/л | 77,5 (73,4;81,5) | 69,1 (54,9;73,6) | <0,001< /td> |
| АсАТ, Ед/л | 60,5 (53,7;63,8) | 53,6 (45,9;61,3) | <0,001< /td> |
| ГГТ, Ед/л | 43,2 (38,8;49,0) | 29,2 (18,2;41,4) | <0,001< /td> |
| Билирубин, мкмоль/л | 10,1 (9,2-11,6) | 9,4 (8,8-11,6) | 0,260 |
| Класс по Killip, n (%) | |||
| I | 23 (85,2) | 43 (97,7) | 0,835 |
| II | 3 (11,1) | 1 (2,3) | 0,345 |
| III | 1 (3,7) | - | 0,815 |
| Подъем ST, n (%) | |||
| V2,3-6 | 9 (33,3) | 14 (31,8) | 0,879 |
| I, aVL | 2 (7,4) | 7 (15,9) | 0,875 |
| II, III, aVF | 13 (48,1) | 18 (40,9) | 0,879 |
| ФП в дебюте, n (%) | 1 (3,7) | 4 (9,1) | 0,547 |
| ФВ ЛЖ, % | 52 (50;56) | 54 (50;56) | 0,317 |
| Инфаркт-ответственная артерия, n (%) |
|||
| левая нисходящая | 12 (44,4) | 22 (50,0) | 0,956 |
| огибающая | 2 (7,4) | 4 (9,1) | 0,822 |
| правая | 13 (48,1) | 18 (40,9) | 0,880 |
| Пораженный участок, n (%) |
|||
| проксимальный | 18 (66,7) | 17 (38,6) | 0,270 |
| средний | 8 (29,6) | 22 (50,0) | 0,356 |
| дистальный | 1 (3,7) | 5 (11,4) | 0,547 |
| Исх. TIMI, n (%) | |||
| 0 | 25 (80,3) | 32 (72,7) | 0,712 |
| I | 1 (9,7) | 6 (13,6) | 0,402 |
| II | 1 (9,7) | 6 (13,6) | 0,402 |
| TTG, n (%) | |||
| 1 | 1 (3,7) | 18 (40,9) | 0,014 |
| 2 | 4 (14,8) | 19 (43,2) | 0,115 |
| 3 | 8 (29,6) | 3 (6,8) | 0,066 |
| 4 | 6 (22,2) | 4 (9,1) | 0,327 |
| 5 | 8 (29,6) | - | 0,003 |
| Извитость коронарных артерий, n (%) |
|||
| минимальная | 4 (14,8) | 10 (22,7) | 0,712 |
| умеренная | 1 (3,7) | 8 (18,2) | 0,221 |
| выраженная | - | 2 (4,5) | 0,722 |
| Кальциноз, n (%) | |||
| минимальный | 2 (7,4) | 5 (11,4) | 0,933 |
| умеренный | 1 (3,7) | 3 (6,8) | 0,944 |
| выраженный | 5 (18,5) | 6 (13,6) | 0,890 |
| SYNTAX, балл, | 16,25 (12,5;19,5) | 15,5 (10;18,5) | 0,150 |
Основным клиническим проявлением ИМ в двух группах был ангинозный синдром (88,9% и 88,6% пациентов, соответственно), реже причинами вызова бригады скорой медицинской помощи служили сердцебиение, изменение АД или слабость. Тактика терапии ИМ на догоспитальном этапе была сопоставимой в двух группах. ИМ чаще всего локализовался в области передней стенки левого желудочка (у 51,8% и 65,9% пациентов двух групп, соответственно).
Медиана содержания сТnI, который является маркером степени распространенности некроза миокарда, в 1-й группе была достоверно выше, чем 2-й группе, как при поступлении, так и через 24 ч, причем разница этого показателя между группами в течение суток увеличилась с 11,9% до 14,7% (р<0,05).
В связи с выполнением чрескожных вмешательств на коронарных артериях несколькими операторами рассчитывали значения κ Cohen, которые для всех ангиографических показателей составляли от 0,66 до 0,81. В обеих группах чаще всего встречалось поражение сосудов в бассейне левой коронарной артерии (у 51,9% и 59,1% пациентов, соответственно). Неполная окклюзия (TIMI I или 2) наблюдалась у 7,4% пациентов 1-й группы и 27,3% пациентов 2-й группы (р=0,160). При сравнении характеристик бляшки и других изменений сосудов (извитость, кальциноз, признаки коллатерального кровотока) существенные различия между двумя группа не выявили. Итоговые значения шкалы SYNTAX также не достоверно не отличались.
У пациентов со стеатогепатитом чаще встречались клинические ситуации, требовавшие отсроченного стентирования для профилактики развития феномена "no-reflow" вследствие высокой тромботической нагрузки (TTG ≥3; р<0,05). По данным логистического регрессионного анализа, стеатоз печени ассоциировался с менее выраженным тромбозом (TTG 1: однофакторное ОШ 18,0, 95% ДИ 2,15-150,42, р=0,008; TTG 2: ОШ 4,37, 95% ДИ 1,26-15,09, р=0,02), в то время как при стеатогепатите выявлено увеличение вероятности высокой тромботической нагрузкой (TTG ≥3: ОШ 2,04, 95% ДИ 1,17-10,11, р=0,01) и повышения MPV более 10,2 фл (ОШ 3,61, 95% ДИ 1,92-7,01, р=0,038).
Результативность чрескожного вмешательства при ИМпST, которую оценивали на основании восстановления кровотока в инфаркт-ответственной артерии, у пациентов со стеатогепатитом оказалась ниже, а количество случаев отсроченной имплантацией стента было выше. По этой причине степень разрешения подъема сегмента ST в этой группе была ниже (р=0,009).
Активность аминотрансфераз у пациентов со стеатогепатитом была ожидаемо выше, чем у пациентов со стеатозом печени (табл. 2). Еще большая разница между группами была выявлена при анализе активности ГГТ.
В 1-й группе концентрация ФЦК-18 была более, чем в 2 раза выше, чем во 2-й группе. По данным ROC-анализа, оптимальное значение этого показателя, позволявшее судить о высокой вероятности стеатогепатита при ИМпST, составило 427 Ед/л: чувствительность (Se) – 81,7% (95% ДИ 79,0-96,3), специфичность (Sp) – 44,2% (95% ДИ 41,9-95,1), положительная прогностическая ценность – 86,0% (95% ДИ 79,1-98,1), отрицательная прогностическая ценность – 95,0% (95% ДИ 88,3-100), точность (аccuracy) – 91,0% (95% ДИ 87,0-98,0), площадь под ROC-кривой – 94,5 (95% ДИ 88,7-99,5).
| Показатели | Однофакторный анализ | Многофакторный анализ | ||||
|---|---|---|---|---|---|---|
| ОР | 95% ДИ | р | ОР | 95% ДИ | p | |
| Возраст >65 лет | 0,91 | 0,88-1,01 | 0,144 | - | - | - |
| Курение | 1,02 | 0,79-1,11 | 0,136 | - | - | - |
| Синдром апноэ во сне | 0,94 | 0,73-1,01 | 0,117 | - | - | - |
| Плотность печени >8,5 кПа | 1,87 | 1,41-2,26 | 0,005 | 1,31 | 1,01-1,62 | 0,02 |
| ФЦК-18 >427 Ед/л | 15,0 | 6,81-33,12 | 0,0004 | 4,81 | 2,08-6,17 | 0,01 |
| SYNTAX 23 балл | 1,11 | 0,91-1,23 | 0,130 | - | - | - |
| TTG ≥3 | 1,26 | 0,98-1,33 | 0,027 | - | - | - |
| Сахарный диабет | 1,13 | 1,06-1,21 | 0,001 | - | - | - |
| Персистирующая фибрилляция предсердий | 0,98 | 0,97-1,00 | 0,063 | - | - | - |
С помощью модели регрессии Кокса у пациентов со стеатогепатитом выявлено увеличение риска наступления сердечно-сосудистых событий в течение 18 мес в 8,52 раза (95% ДИ 5,77-11,04) по сравнению с таковым у пациентов со стеатозом печени. По данным однофакторного анализа, факторами риска неблагоприятных исходов были возраст >65 лет, курение, синдром апноэ во сне, балл SYNTAX ≥23, персистирующая форма фибрилляции предсердий в намнезе (табл. 3). При многофакторном анализе было показано, что независимыми предикторами сердечно-сосудистых событий являются плотность печени >8,5 кПа и содержание ФЦК-18 >427 Ед/л.
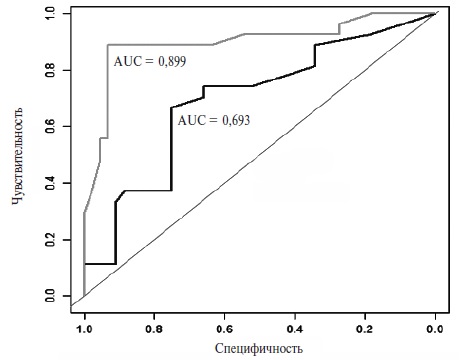
Для прогнозирования вероятности неблагоприятных сердечно-сосудистых событий в ближайшие 18 мес у пациентов с ИМ, сочетающегося с МАЖБП, предложена модель логистической регрессии, включающая в качестве факторов либо только значения возраста, активности АсАТ и плотности печени, либо еще и значения уровня ФЦК-18 (рис. 1). Включение в модель концентрации ФЦК-18 существенно улучшило дискриминационные значения прогнозирования, в частности привело к увеличению площади под ROC-кривой с 69,3 (95% ДИ 56,2–82,0) до 89,9 (95% ДИ 81,0–98,3). Значение z-показателя DeLong составило -3,4 (p=0,0007).
Обсуждение
МАЖБП в настоящее время рассматривается в качестве самостоятельного фактора риска сердечно-сосудистых заболеваний при метаболическом синдроме [1,17-19]. Точным методом диагностики МАЖБП является биопсия печени, однако это инвазивное исследование проводится далеко не всегда, особенно при ОКС. К информативным неинвазивным методам диагностики относятся эластометрия печени и магнитно-резонансная томография (МРТ), причем первый метод более доступен в неотложной кардиологии. На основании плотности печени и содержания различных биомаркеров в крови можно дифференцировать проявления МАЖБП – стеатоз печени и стеатогепатит. Однако рекомендуемые диагностические шкалы, такие как BARD score (Вody mass index, Аspartate aminotrans fera se/Аlanine aminotransferase Ratio, Diabetes), NAFLD fibrosis score, SteatoTest, предполагают оценку активности аминотрансфераз [20,21], трактовка которой затруднена при ИМ. Более специфичным биомаркером стеатогепатита является ФЦК-18 (фракция М30), который поступает в кровь лишь при разрушении клеток печени (гепатоцитов и холангиоцитов) и эпителиальных тканей, а не миокарда. Цитокератин 18 – это белок цитоскелета и основной представитель семейства промежуточных филаментов I типа. На него приходится 5% от общего белка, содержащегося в гепатоцитах и холангиоцитах [22,23]. Полноразмерная форма протеина высвобождается из некротических клеток, тогда как фрагменты выделяются при активизации каспазы – одного из ключевых ферментов апоптоза, который усиливается при стеатогепатите под действием эффекторных воспалительных клеток [24]. В нашем исследовании концентрация ФЦК-18 у пациентов со стеатогепатитом более чем в 2 раза превышала таковую у пациентов со стеатозом печени, а оптимальное пороговое значение этого показателя составило 427 Ед/л. В другом исследовании пороговые значения суммарной концентрации ФЦК-18 (М65) и фракции М30, позволявшие подтвердить наличие стеатогепатита, составили 400 и 200 МЕ/л, соответственно [25].
сТnI – это маркер распространенности некроза миокарда. При ИМпST, сочетавшимся со стеатогепатитом, рост тропонинемии был более выраженным, чем при стеатозе печени. Более высокие концентрации сТnI-24 у пациентов со стеатогепатитом могли частично объясняться более частым отказом от выполнения стентирования в первые сутки ИМпST по причине массивного коронарного тромбоза, однако более значительное повышение содержания сТnI-1 в этой группе требует анализа возможных механизмов исходной высокой тромботической нагрузки. Одним из них может быть повышенная реактивность тромбоцитов. Так, у пациентов со стеатогепатитом средний объем тромбоцитов (MPV) был достоверно выше, чем у пациентов со стеатозом печени, что указывало на большую активность этих клеток. Доказано, что MPV положительно коррелирует с баллом по шкале SYNTAX и относится к числу предикторов неблагоприятного прогноза при ИМ [26,27]. Другими причинами повышенного тромбообразования при МАЖБП могут служить системная гипекоагуляция и нарушение фибринолиза [28,29].
Мы не выявили различий других ангиографических показателей между группами пациентов ИМпST, сочетавшимся со стеатогепатитом или стеатозом печени. В некоторых предыдущих исследованиях у пациентов с МАЖБП было отмечено увеличение частоты многососудистого поражения коронарного русла и кальцификации коронарных артерий [3,30], хотя другие авторы, наоборот, наблюдали корреляцию MAЖБП с наличием некальцифицированных и смешанных бляшек, а количество пораженных сосудов было сопоставимым с таковым у пациентов с ОКС, не страдавших заболеванием печени [2,31]. Противоречивость полученных данных, вероятно, обусловлена тем, что в этих исследованиях пациентов с МАЖБП объединяли в одну группу и не выделяли варианты этого заболевания – стеатогепатит и стеатоз печени. Кроме того, для оценки кальциноза использовали традиционную коронароангиографию, которая по точности диагностики уступает ангиографии с мультиспиральной компьютерной томографией.
Данные о роли других заболеваний печени, прежде всего хронического вирусного гепатита В и С, в развитии коронарного атеросклероза и ОКС неоднозначны. Некоторые авторы не выявили повышенного риска развития ИМ у пациентов с HCV-инфекцией [32,33], однако в другом исследовании HCV-инфекция сопровождалась значительным увеличением риска ИМ 2 типа (скорректированное отношение рисков 1,46, 95% ДИ 1,09-1,97), но не ИМ 1 типа [34]. По данным анализа 686 HCV-позитивных пациентов, вирусная инфекция оказалась независимым предиктором ангиографически подтвержденного поражения коронарных артерий (скорректированное ОШ 4,2; 95% ДИ 1,4–13,0) [35]. Кроме того, HCV-инфекция ассоциировалась с увеличением отдаленной смертности пациентов с ИМ, особенно у мужчин и пациентов с артериальной гипертонией (ОШ 1,12; 95% ДИ 1,06-1,18) [36]. Похожие разногласия касаются и хронического гепатита В. Одни исследователи указывают на низкий риск развития ИМ у пациентов с HBV-инфекцией (скорректированное ОШ 0,49; 95% ДИ 0,42-0,56), тогда как в последних популяционных исследованиях доказан существенный рост тяжести и частоты осложнений ИМ и снижение выживаемости пациентов с ОКС при наличии хронического гепатита В [37-42]. Имеются сообщения о связи активности хронического вирусного и/или алкогольного гепатита и выраженности фиброза печени с развитием коронарного атеросклероза и острых коронарных событий. Так, у пациентов с ОКС, перенесших чрескожное вмешательство на коронарных артериях, наличие фиброза, подтвержденного с помощью теста FIB-4 (>3,25), сочеталось в острый период с более высокими лейкоцитозом и содержанием сTnT и было независимым предиктором госпитальных осложнений ИМ [43].
Количество похожих исследований, в которых изучалось значение стеатогепатита в развитии ОКС, меньше, однако они свидетельствуют о самостоятельной патогенетической роли МАЖБП. При неалкогольном стеатогепатите наблюдается увеличение количества факторов риска атеросклероза и ИМ [44], а дестабилизация атеросклеротической бляшки может быть следствием высокой концентрации медиаторов воспаления и повышенной активности эффекторных клеток врожденного иммунитета. Гибель гепатоцитов, перегруженных триглицеридами, вызывает высвобождение молекулярных фрагментов, ассоциированных с повреждением (DAMP), которые запускают активацию макрофагов. Увеличение количества последних, включая купфферовские клетки, приводит к росту концентрации циркулирующих медиаторов воспаления, в том числе интерлейкинов-1, -6 и -20, которые усиливают атерогенез [45,46]. Клиническим итогом могут быть развитие осложнений в острый период ИМ и увеличение внутригоспитальной летальности [47].
Следует подчеркнуть важность выделения двух вариантов МАЖБП у пациентов ИМ, так как результаты нашего исследования свидетельствуют об увеличении риска неблагоприятных событий в течение 18 мес у пациентов со стеатогепатитом. С целью повышения точности его диагностики целесообразно учитывать не только высокие значения плотности печени (>8,5 кПа) и активности АсАТ, но и по возможности определять содержание ФЦК-18. Это позволит повысить и точность оценки прогноза у пациентов с ИМпST и метаболическим синдромом, сопровождающимся МАЖБП. Активность аминотрансфераз в крови сопряжена с повреждением кардиомиоцитов и является фактором риска сердечно-сосудистых осложнений [48,49]. При наличии стеатогепатита она увеличивается еще в большей степени.
Заключение
Наличие стеатогепатита у пациентов с ИМпST сопровождалось увеличением частоты значительного тромбоза (ТТG≥3), необходимости в двухэтапном чрескожном вмешательстве на коронарных артериях, снижением степени разрешения элевации ST после первичного вмешательства, закономерным более значительным увеличением активности аминотрансфераз и ГГТ, а также увеличением риска неблагоприятных сердечно-сосудистых событий в течение 18 мес после ОКС по сравнению с таковыми у пациентов с ИМпST и стеатозом печени. Для диагностики МАЖБП у пациентов с ИМпST целесообразно проводить эластометрию печени, которую по возможности следует дополнять измерением концентрации ФЦК-18.
Используемые источники
- Olubamwo OO, Virtanen JK, Voutilainen A, et al. Association of fatty liver index with the risk of incident cardiovascular disease and acute myocardial infarction. Europ J Gastroenterol Hepatol 2018;30(9):1047-54.
- Noda T, Kamiya K, Hamazaki N, et al. The prevalence of metabolic dysfunctionassociated fatty liver disease and its association with physical function and prognosis in patients with acute coronary syndrome. J Clin Med 2022;11(7):1847.
- Ismaiel A, Popa SL, Dumitrascu DL. Acute coronary syndromes and nonalcoholic fatty liver disease: “Un Affaire de Coeur”. Can J Gastroenterol Hepatol 2020:8825615.
- Soares Sturzeneker MC, Montemezzo M, Precoma DB, et al. The relationship between non-alcoholic fatty liver disease and acute coronary syndrome severity: is non-alcoholic fatty liver disease a risk marker of coronary atherosclerotic disease? Europ Heart J 2021;42(1):ehab724-1449.
- Mohammed E, Arun JS, Jacob G. MAFLD: A consensus-driven proposed nomenclature for metabolic associated fatty liver disease. Gastroenterology 2020;158(7):1999-2014.
- 6.Cusi K, Isaacs S., Barb D, et al. American Association of Clinical Endocrinology clinical practice guideline for the diagnosis and management of nonalcoholic fatty liver disease in primary care and endocrinology clinical settings: co-sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocrine Pract. 2022;28(5):528-62.
- Eleid MF, Guddeti RR, Tweet MS, et al. Coronary artery tortuosity in spontaneous coronary artery dissection angiographic characteristics and clinical implications. Circ Cardiovasc Interv 2014;7:656–62.
- Rentrop KP, Cohen M, Blanke H, Phillips RA. Changes in collateral channel filling immediately after controlled coronary artery occlusion by an angioplasty balloon in human subjects. J Amer Coll Cardiol 1985;5(3):587-92.
- Gibson CM, de Lemos JA, Murphy SA, et al. Combination therapy with abciximab reduces angiographically evident thrombus in acute myocardial infarction. A TIMI 14 Substudy. Circulation 2001;103(21):2550–4.
- Konerman MA, Jones JC, Harrison SA. Pharmacotherapy for NASH: Current and emerging. J Hepatol 2018;68(2):362–75.
- Pagano S, Bakker SJL, Juillard C, et al. Serum level of cytokeratin 18 (M65) as a prognostic marker of high cardiovascular disease risk in individuals with non-alcoholic fatty liver disease. Biomolecules 2023;13(7):1128.
- Sgarbossa EB, Pinski SL, Barbagelata A, et al. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundle-branch block. N Engl J Med 1996; 334(8):481-7.
- 13.Smith SW, Dodd KW, Henry TD, et al. Diagnosis of ST-elevation myocardial infarction in the presence of left bundle branch block with the ST-elevation to Swave ratio in a modified Sgarbossa rule. Ann Emerg Medi 2012;60(6):766-76.
- Hands ME, Cook EF, Stone PH, et al. Electrocardiographic diagnosis of myocardial infarction in the presence of complete left bundle branch block. Amer Heart J 1988;116(1):23-31.
- de Winter RJ, Verouden NJ, Wellens HJ, et al. A new ECG sign of proximal LAD occlusion. N Engl J Med 2008;359(19):2071-3.
- Aslanger E, YхldхrхmtЯrk Е, Şimşek B, et al. A new electrocardiographic pattern indicating inferior myocardial infarction. J Electrocard 2020;61:41-6.
- Labenz C, Huber Y, Michel M, et al. Impact of NAFLD on the incidence of cardiovascular diseases in a primary care population in Germany. Dig Dis Sci 2020;65:2112-9.
- Kim JH, Moon JS, Byun SJ, et al. Fatty liver index and development of cardiovascular disease in Koreans without pre-existing myocardial infarction and ischemic stroke: a large population-based study. Cardiovasc Diabetol 2020;19(1):1-9.
- Tsutsumi T, Eslam M, Kawaguchi T, et al. MAFLD better predicts the progression of atherosclerotic cardiovascular risk than NAFLD: generalized estimating equation approach. Hepatol Res 2021;51(11):1115-28.
- Kechagias S, Ekstedt M, Simonsson C, et al. Non-invasive diagnosis and staging of non-alcoholic fatty liver disease. Hormones 2022;21:349–68.
- Ruffillo G, Fassio E, Alvarez E, et al. Comparison of NAFLD fibrosis score and BARD score in predicting fibrosis in nonalcoholic fatty liver disease. J Hepatol 2011;54(1):160-3.
- Tada T, Saibara T, Ono M, et al. Predictive value of cytokeratin-18 fragment levels for diagnosing steatohepatitis in patients with nonalcoholic fatty liver disease. Europ J Gastroenterol Hepatol 2020;33(11):1451-8.
- Wu G, Li H, Fang Q, et al. Complementary role of fibroblast growth factor 21 and cytokeratin 18 in monitoring the different stages of nonalcoholic fatty liver disease. Sci Rep 2017;7:5095.
- Toi UM, Linder S. Detection of epithelial cell death in the body by cytokeratin 18 measurement. Biomedi Pharmacother 2005;59(2):S359-62.
- Pagano S, Bakker SJL, Juillard C, et al. Serum level of cytokeratin 18 (M65) as a prognostic marker of high cardiovascular disease risk in individuals with non-alcoholic fatty liver disease. Biomolecules 2023;13(7):1128.
- Martin JF, Bath PMW, Burr ML. Influence of platelet size on outcome after myocardial infarction. Lancet 1991;338(8780):1409-11.
- Waleed KB, Tse G, Wang L, et al. Relationship of mean platelet volume to severity of coronary atherosclerosis in non-ST-segment myocardial infarction. Europ Heart J 2022;43(1):ehab849.087.
- Tripodi A, Lombardi R, Primignani M, et al. Hypercoagulability in patients with non-alcoholic fatty liver disease (NAFLD): causes and consequences. Biomed 2022;10(2):249.
- Eriksen PL, Thomsen KL, Sørensen M, et al. Impaired fibrinolysis without hypercoagulability characterises patients with non-alcoholic fatty liver disease. Thromb Res 2022;213:9-15.
- Park HE, Kwak MS, Kim D, et al. Nonalcoholic fatty liver disease is associated with coronary artery calcification development: a longitudinal study. J Clin Endocrinol Metab 2016;101(8):3134-43.
- Zhang Z, Zheng M, Lei H, et al. A clinical study of the correlation between metabolic-associated fatty liver disease and coronary plaque pattern. Sci Rep 2023;13(1):7224.
- Forde KA, Haynes K, Troxel AB, et al. Risk of myocardial infarction associated with chronic hepatitis c virus infection: a population-based cohort study. J Viral Hep 2012;19(4):271-7.
- Wu A, Burrowes S, Zisman E, et al. Association of hepatitis C infection and acute coronary syndrome: A case-control study. Medicine 2021;100(21):e26033.
- Williams-Nguyen J, Hawes SE, Nance RM, et al. Association between chronic hepatitis c virus infection an d myocardial infarction among people living with hiv in the United States. Amer J Epid 2020;189(6):554-63.
- Vassalle C, Masini S, Bianchi F, et al. Evidence for association between hepatitis C virus seropositivity and coronary artery disease. Heart 2004;90(5):565–6.
- Kuo S-H, Hung W-T, Tang P-L, et al. Impact of hepatitis C virus infection on long-term mortality after acute myocardial infarction: a nationwide populationbased, propensity-matched cohort study in Taiwan. BMJ Open 2018;8:e017412.
- Kuo C, Chen Y, Hsu C, et al The impact of chronic hepatitis B infection on major adverse cardiovascular events and all-cause mortality in patients with diabetes: a nationwide population-based study from Taiwan. BMJ Open 2017;7:e016179.
- Sung J, Song Y-M, Choi Y-H, et al. Hepatitis B virus seropositivity and the risk of stroke and myocardial infarction. Stroke 2007;38:1436–41.
- Clemens MM, McGill MR, Apte U. Mechanisms and biomarkers of liver regeneration after drug-induced liver injury. Adv Pharmacol 2019;85:241–62.
- Eguchi A, Iwasa M, Yamada M, et al. A new detection system for serum fragmented cytokeratin 18 as a biomarker reflecting histologic activities of human nonalcoholic steatohepatitis. Hepat Comm 2022;6(8):1987-99.
- Balakrishna AM, Ismay M, Butt DN, et al. Trends, outcomes, and management of acute myocardial infarction in patients with chronic viral hepatitis. Hosp Pract 2022;50(3):236-43.
- 42.Kuo PL, Lin KC, Tang PL, et al. Contribution of hepatitis B to long-term outcome among patients with acute myocardial infarction: A nationwide study. Medicine (Baltimore) 2016;95(5):e2678.
- Biccir FG, Barill F, Sammartini E, et al. Relationship between non-invasively detected liver fibrosis and in-hospital outcomes in patients with acute coronary syndrome undergoing PCI. Clin Res Cardiol 2023;112:236–46.
- Lin SY, Lin CL, Lin CC, et al. Risk of acute coronary syndrome and peripheral arterial disease in chronic liver disease and cirrhosis: a nationwide populationbased study. Atherosclerosis 2018;270:154-9.
- Zhang Z, Zheng M, Lei H, et al. A clinical study of the correlation between metabolic-associated fatty liver disease and coronary plaque pattern. Sci Rep 2023;13:7224.
- Alisi A, Carsetti R, Nobili V. Pathogen-or damage-associated molecular patterns during nonalcoholic fatty liver disease development. Hepatology 2011;54:1500-2.
- Khokhlov L, Thapa U, Hussain F, et al. Patients admitted with acute coronary syndrome and a history of non-alcoholic fatty liver disease have greater risk of mortality and worse clinical outcomes. J Am Coll Cardiol 2023;81(8):1238.
- Targher G, Byrne CD. Circulating markers of liver function and cardiovascular disease risk. Arterioscl Thromb Vasc Biol 2015;35:2290–6.
- Yamakado M, Tanaka T, Nagao K, et al. Plasma amino acid profile associated with fatty liver disease and co-occurrence of metabolic risk factors. Sci Rep 2017;7:14485.
