Прогностическое значение различных критериев дефицита железа у пациентов с декомпенсацией сердечной недостаточности
Оценить прогноз госпитализированных пациентов с декомпенсацией сердечной недостаточности (СН) и дефицитом железа (ДЖ) и динамику частоты ДЖ в результате оптимальной медикаментозной терапии СН без препаратов железа.
В исследование были включены 223 пациента с декомпенсаций СН (медиана возраста 73 [65; 82] года). У всех пациентов определяли показатели феррокинетики (сывороточное железо, трансферрин, ферритин, коэффициент насыщения трансферрина железом — КНТЖ) и NT-proBNP. Наличие ДЖ оценивали на основании двух критериев: (1) ферритин <100 нг/мл или 100-299 нг/мл при КНТЖ<20%; (2) КНТЖ<20% и сывороточное железо <13 мкмоль/л. Первичной комбинированной конечной точкой служили повторная госпитализация и смерть от любых причин в течение 12 мес после госпитализации, вторичными – отдельные компоненты первичной конечной точки.
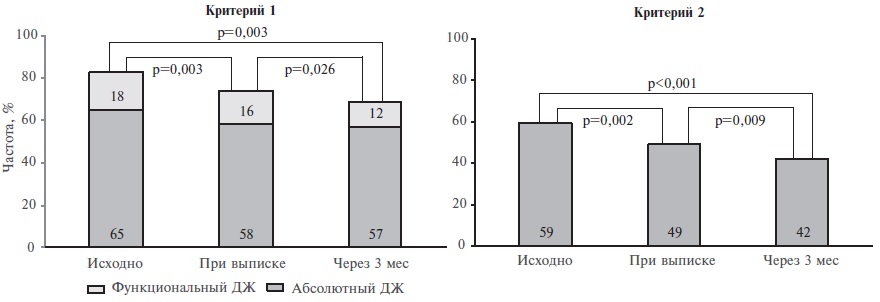
По критериям 1 и 2 ДЖ был выявлен у 199 (89%) и 156 (70%) пациентов, соответственно. Наличие ДЖ по критерию 2 сопровождалось увеличением риска комбинированной первичной конечной точки (отношение рисков [ОР] 2,38; 95% доверительный интервал [ДИ] 1,52-7,49, р=0,003) и госпитализации по любой причиной (ОР 2,40; 95% ДИ 1,01-5,69, p=0,047). Наличие ДЖ по критерию 1 не оказывало значимого влияния на прогноз. Увеличение риска смерти от любых причин было отмечено при снижении КНТЖ (ОР 0,91;95% ДИ 0,87-0,96, p<0,001) и повышении содержания ферритина (ОР 1,01; 95% ДИ 1,00-1,01, p<0,001). Частота ДЖ у пациентов с декомпенсацией СН снизилась от момента госпитализации до выписки (на 9% по критерию ДЖ 1 и на 10% по критерию ДЖ 2) и через 3 месяца (на 14% и 17%, соответственно). Значимые предикторы разрешения ДЖ без назначения препаратов железа не были установлены.
Критерий 2 ДЖ имеет прогностическую значимость, в отличие от критерия 1. О неблагоприятном прогнозе свидетельствует снижение КНТЖ, а не уровня ферритина. На фоне оптимальной терапии СН через 3 мес отмечено снижение частоты ДЖ.
Дефицит железа (ДЖ) у пациентов с сердечной недостаточностью (СН) сопровождается снижением качества жизни, толерантности к физической нагрузке, повышением частоты повторных госпитализаций и смертноcти независимо от наличия анемии [1]. Данные наблюдательных исследований свидетельствуют о высокой частоте ДЖ среди пациентов со стабильной СН и еще более высокой при декомпенсированной СН [2,3]. Для диагностики ДЖ традиционно определяют содержание железа и ферритина в сыворотке и коэффициент насыщения трансферрина железом (КНТЖ). Следует учитывать, что ферритин не только отражает запасы железа в организме, но может повышаться как белок острой фазы, что затрудняет диагностику ДЖ [4,5]. Немногочисленные работы свидетельствуют о том, что частота ДЖ у пациентов с СН зависит от компенсации СН [6]. Учитывая высокую стоимость внут ривенных препаратов железа, важным с фармакоэкономической точки зрения представляется проблема оптимального времени назначения таких препаратов [7].
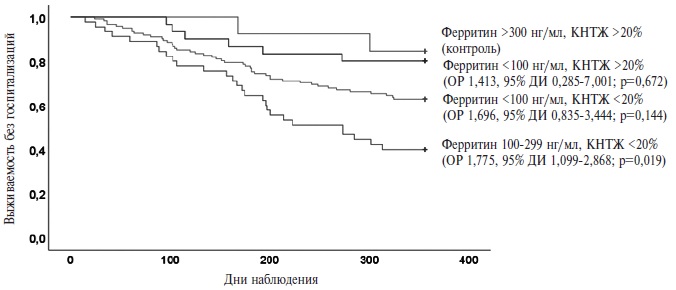
В соответствии с рекомендациями Евро пейского общества кардиологов и Российского кардиологического общества ДЖ может быть установлен при снижении содержания ферритина <100 нг/мл (абсолютный ДЖ) или при его содержании 100– 299 нг/мл в сочетании с КНТЖ <20% (функциональный ДЖ) [8,12]. Хотя этот критерий успешно использовали в ряде крупных рандомизированных контролируемых исследований [9-11], он не был валидирован при биопсии костного мозга. В результате валидации маркеров обмена железа с помощью биопсии костного мозга в качествее признаков ДЖ было предложено использовать КНТЖ <20% и содержание железа сыворотки <13 мкмоль/л [13].
Целью исследования было оценить прогноз госпитализированных пациентов с декомпенсацией СН и дефицитом железа (ДЖ) и динамику частоты ДЖ у пациентов в результате оптимальной медикаментозной терапии СН без препаратов железа.
Материл и методы
Популяция исследования. В проспективное исследование включали пациентов с декомпенсаций СН (независимо от фракции выброса левого желудочка – ФВ ЛЖ), госпитализированных с октября 2020 г. по апрель 2021 г. Наличие СН подтверждалось повышенным уровнем NT–proBNP >125 нг/мл у пациентов с синусовым ритмом и >600 нг/мл у пациентов с фибрилляцией или трепетанием предсердий. Критериями исключения были язвенная болезнь желудка и двенадцатиперстной кишки, острый коронарный синдром, онкологические заболевания, острый гепатит, лечение гемодиализом, беременность, пневмония любой этиологии, включая COVID-19, прием препаратов железа за 3 месяца до включения в настоящее исследование.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации. Протокол исследования был одобрен этическим комитетом Медицинского института РУДН.
Оцениваемые параметры. У всех пациентов исходно определяли содержание железа, трансферрина и ферритина в сыворотке и КНТЖ. У 100 пациентов содержание ферритина, КНТЖ и железа сыворотки измеряли также в день выписки и спустя 3 месяца после госпитализации. При этом пациенты не получали препараты железа. Наличие ДЖ оценивали на основании двух критериев: (1) ферритин <100 нг/мл или ферритин 100-299 нг/мл в сочетании с КНТЖ <20% (критерий 1) и (2) КНТЖ <20% и сывороточное содержание железа <13 мкмоль/л (критерий 2).
Фенотип СН определяли в соответствии в ФВ ЛЖ: ≤40% – низкая, 41–49% – умеренно сниженная и ≥50% – сохранная. Тяжесть состояния пациентов с СН определяли с помощью шкалы оценки клинического состояния (ШОКС). Функциональный класс (ФК) СН по NYHA оценивали в соответствие с пройденной в течение 6 минут дистанцией (6МТХ).
Конечные точки. Первичной конечной точкой исследования были повторная госпитализация по любым причинам и смерть от любых причин, вторичными – два компонента первичной конечной точки по отдельности. Исходы определяли посредством телефонных контактов через 3, 6 и 12 мес после выписки.
Статистический анализ. Для статистической обработки данных использовали программу IBM SPSS Statistics 26.0. Проверка на нормальность распределения выполнялась с помощью W-теста Шапиро-Уилка. Данные представлены как Me (IQR) при ненормальном распределении и как M±SE при нормальном распределении. Прогностические модели были построены с помощью бинарной логистической регрессии с пошаговым исключением на основании статистики Вальда. Анализ выживаемости выполнен путем построения кривых Каплана-Мейера и оценкой разницы лог-ранк критерием с расчетом относительного риска. Влияние независимых предикторов на исход оценивали с помощью регрессионного анализа Кокса. Значение p<0,05 считали статистически достоверным.
Результаты
Характеристика пациентов. В исследование были включены 223 пациента с декомпенсаций СН (медиана возраста 73 [65; 82] года). Клинико-демографическая и лабораторная характеристика пациентов представлена в табл. 1.
| Параметр | Значение |
|---|---|
| Мужчины, n (%) | 129 (58) |
| Возраст, лет | 73 (65; 82) |
| Курение, n (%) | 36 (16) |
| ФВ ЛЖ, % | 44 (30; 55) |
| ФВ ЛЖ, n (%) | |
| ≤40% | 99 (44) |
| 41-49% | 40 (18) |
| ≥50% | 84 (38) |
| Функциональный класс по NYHA, n (%) | |
| II | 37 (25) |
| III | 77 (53) |
| IV | 32 (22) |
| Госпитализации за последние 6 мес, n (%) | 64 (29) |
| ШОКС, баллы | 7 (5; 8) |
| Сопутствующие заболевания, n (%) | |
| Артериальная гипертония | 196 (88) |
| Ишемическая болезнь сердца | 121 (54) |
| Перенесенный инфаркт миокарда | 89 (40) |
| Инсульт в анамнезе | 25 (11) |
| Фибрилляция предсердий | 136 (61) |
| Сахарный диабет | 71 (32) |
| Анемия | 102 (46) |
| ХОБЛ или бронхиальная астма | 36 (16) |
| ХБП | 82 (37) |
| Лабораторные показатели | |
| Эритроциты, млн/мкл | 4,4 (3,9; 4,7) |
| Гемоглобин, г/л | 126 (113; 138) |
| Ферритин, нг/мл | 60,6 (35,7; 115,7) |
| КНТЖ, % | 12,5 (7,2; 18,6) |
| Сывороточное железо, мкмоль/л | 8,8 (5,7; 13,2) |
| Трансферрин, г/л | 2,8 (2,4; 3,2) |
| СКФ, мл/мин/1,73 м2 | 53,5 (40,0; 68,3) |
| NT–proBNP, пг/мл | 4076 (1911; 9651) |
По критерию 1 ДЖ был выявлен у 199 (89%) пациентов, в том числе абсолютный у 153 (69%) и функциональный у 46 (20%). По критерию 2 ДЖ имелся у 156 (70%) пациентов. При использовании критерия 1 ДЖ без анемии выявили у 106 (47%) пациентов, ДЖ с анемией – у 93 (42%), анемию без ДЖ – у 9 (4%). У 15 (7%) пациентов содержание гемоглобина и сывороточных маркеров обмена железа было нормальным. При анализе критерия 2 ДЖ без анемии определялся у 77 (35%) пациентов, ДЖ с анемией – у 79 (35%), анемия без ДЖ – у 24 (11%). У 43 (19%) пациентов отклонений содержания гемоглобина и сывороточных маркеров обмена железа от нормы не выявили.
Конечные точки. За время 12-месячного наблюдения 48 (21,5%) пациентов были повторно госпитализированы по любым причинам и 57 (25,6%) пациентов умерли от любых причин.
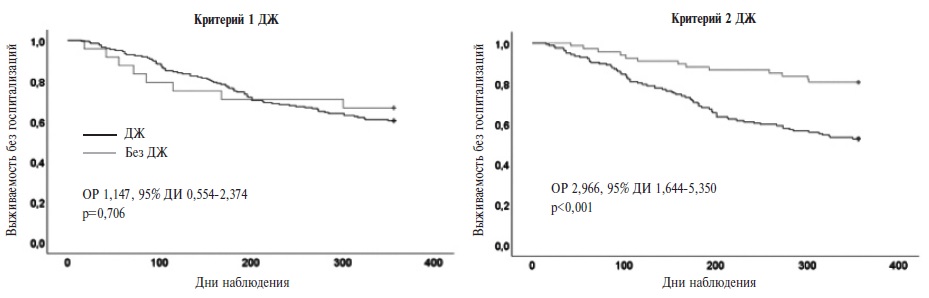
По данным многофакторного регрессионного анализа Кокса (табл. 2), наличие ДЖ по критерию 2 сопровождалось увеличением риска первичной конечной точки в 3,4 раза (отношение рисков [ОР] 3,378; 95% доверительный интервал [ДИ] 1,524-7,488) и госпитализации по любым причинам в 2,4 раза (ОР 2,397; 95% ДИ 1,010-5,691), но не влияло на риск смерти от любых причин. В то же время наличие ДЖ по критерию 1 не сопровождалось увеличением риска как первичной, так и вторичной конечных точек (рис. 1). Другие предикторы конечных точек указаны в таблице. Данные о выживаемости пациентов в зависимости от фенотипа ДЖ приведены на рис. 2.
| Предиктор | Коэффициент регрессии |
Стандартная ошибка |
p | Exp(B) | 95% ДИ |
|---|---|---|---|---|---|
| В модель включены: пол, анемия, ДЖ по критериям 1 и 2, ФВ ЛЖ, %, ФВ ЛЖ ≤40%, ФВ ЛЖ <50%, ИБС, инфаркт миокарда в анамнезе, фибрилляция предсердий (ФП), артериальная гипертония, ХБП, ХОБЛ, курение, ожирение, повышение объема циркулирующей крови более 5 л, возраст, уровни гемоглобина, ферритина, КНТЖ, трансферрина, сывороточного железа, гемоглобина | |||||
| Повторные госпитализации по любым причинам | |||||
| ФВ ЛЖ ≤40% | 0,840 | 0,318 | 0,008 | 2,315 | 1,241-4,318 |
| ДЖ критерий 2 | 0,874 | 0,441 | 0,047 | 2,397 | 1,010-5,691 |
| Смерть от любых причин | |||||
| ФП | 1,047 | 0,363 | 0,004 | 2,850 | 1,398-5,81) |
| КНТЖ | -0,092 | 0,025 | <0,001 | 0,912 | 0,869-0,957 |
| Ферритин | 0,005 | 0,001 | <0,001 | 1,005 | 1,003-1,006 |
| Повторные госпитализации или смерть | |||||
| Гемоглобин | -0,016 | 0,006 | 0,005 | 0,984 | 0,973-0,995 |
| ДЖ критерий 2 | 1,217 | 0,406 | 0,003 | 3,378 | 1,524-7,488 |
| ФВ ЛЖ ≤40% | 0,911 | 0,251 | <0,001 | 2,486 | 1,520-4,067 |
| Ферритин | 0,003 | 0,001 | <0,001 | 1,003 | 1,001-1,004 |
Динамика частоты ДЖ. Показатели обмена железа определяли в динамике у 100 пациентов. По критерию 1 частота ДЖ снизилась с 83% (65% – абсолютный, 18% – функциональный) до 74% к моменту выписки (58% – абсолютный, 16% – функциональный) и до 69% через 3 мес (57% – абсолютный, 12% – функциональный). По критерию 2 частота ДЖ снизилась с 59% до 49% к моменту выписки и до 42% через 3 мес (рис. 3). Значимые предикторы разрешения ДЖ без назначения препаратов железа по критериям 1 и 2 не были установлены.
Обсуждение
Мы выявили значительное снижение частоты ДЖ по критериям 1 и 2 у пациентов с декомпенсацией СН, не принимавших препараты железа, во время короткой госпитализации. Сходные данные были получены и другими исследователями [6]. Можно предположить, что декомпенсация СН является триггером развития ДЖ, а ее лечение приводит к разрешению ДЖ у части пациентов [14]. При декомпенсации СН усиливается застой крови по большому кругу кровообращения [15], что приводит к ухудшению кровотока по венам кишечника, отеку слизистой оболочки кишки и ее гипоперфузии, развитию ишемии, нарушению проницаемости сосудов и дисбактериозу [16]. Это влияет на всасывание различных веществ, в том числе железа [17].
Возможность разрешения ДЖ у пациентов с СН без лечения дорогостоящими препаратами железа позволяет обсуждать вопрос об их применении с учетом стадии компенсации СН [7]. Хотя в исследовании AFFIRM-AHF внутривенное введение карбоксимальтозата железа привело к снижению риска повторных госпитализаций у пациентов с острой декомпенсацией СН [11], вероятно, не всем пациентам целесообразно назначать этот препарат во время декомпенсации, когда частота ДЖ самая высокая.
Пациентам с СН рекомендуют назначать препараты железа внутривенно, учитывая нарушение его всасывания в желудочно-кишечном тракте вследствие возможного застоя в венах кишечника и блокады ферропортина гепсидином. Повышение содержания гепсидина у пациентов с СН объясняется высоким воспалительным фоном, выражающемся в повышении уровней провоспалительных маркеров, таких как интерлейкины-1 и -6 и фактор некроза опухоли альфа. При парентеральном применении карбоксимальтозат железа минует энтероциты кишечника. Комплекс карбоксимальтозы и гидроксида железа поглощается клетками ретикуло-эндотелиальной системы, в частности макрофагами. В них создается значительный запас железа, которое должно высвобождаться по мере необходимости. Однако, высвобождение железа из клеток ретикулоэндотелиальной системы также может нарушиться вследствие связи гепсидина с ферропортином макрофагов [18]. Чтобы снять гепсидиновый блок, необходимо в первую очередь лечить основное заболевание, которое его вызвало – СН.
По данным многофакторного регрессионного анализа, снижение содержания гемоглобина в крови на 1 г/л сопровождалось увеличением риска комбинированной первичной конечной точки на 1,6%. Эти данные свидетельствуют о необходимости своевременного лечения анемии, которая часто встречается у пациентов с СН и нередко обусловлена ДЖ [19].
Наличие ДЖ по критерию 2 сопровождалось увеличением риска первичной конечной точки в 3,4 раза и госпитализации по любым причинам в 2,4 раза, в то время как наличие ДЖ по критерию 1 не влияло на риск как первичной, так и вторичной конечных точек. Сходные результаты были получены в исследовании F. Graham и соавт. [20].
Снижение КНТЖ на 1% ассоциировалось с увеличением риска смерти от любых причин в течение 1 года на 8,8%. Это также согласуется с данными литературы последних лет, которые свидетельствуют о том, что именно КНТЖ, а не ферритин имеет более значимую прогностическую ценность в отношение неблагоприятных исходов [21]. В нашем исследовании увеличение содержания ферритина (а не снижение, характерное для ДЖ) на 1 нг/мл сопровождалось увеличением риска первичной конечной точки на 0,3% и риска смерти от любых причин на 0,5%, т.е. неблагоприятное прогностическое значение ферритина было связано с его ролью как маркера общего воспаления, а не ДЖ.
Подобная закономерность ранее была описана другими авторами [22]. Кроме того, мы выявили ухудшение прогноза у пациентов с функциональным ДЖ, т.е. с высокими уровнями ферритина.
Недавно были опубликованы результаты мета-анализа крупных рандомизированных контролируемых исследований (CONFIRM-HF, AFFIRM-AHF, HEARTFID и IRONMAN), в которых изучалась эффективность карбоксимальтозата железа у пациентов с СН [9,11,23, 24]. Внутривенное введение препарата железа привело к достоверному снижению риска повторных госпитализаций по поводу сердечно-сосудистого заболевания и смерти от сердечно-сосудистых причин (ОР 0,86, 95% ДИ 0,75-0,98, p=0,029). Наибольшее снижение риска этой конечной точки было выявлено у пациентов с КНТЖ <15% (ОР 0,72, 95% ДИ 0,57–0,69, p=0,006), в то время как у пациентов с КНТЖ ≥24% он не изменился (ОР 1,17, 95% ДИ 0,91–1,50, p=0,213) [25]. Эти данные могут стать основанием для пересмотра показаний к внутривенному введению препаратов железа у пациентов с СН.
Заключение
Результаты исследования показали, что критерий 2 ДЖ (КНТЖ <20% и сывороточное железо <13 мкмоль/л), в отличие от критерия 1 (ферритин <100 нг/мл или 100299 нг/мл при КНТЖ <20%), позволяет предсказать увеличение риска комбинированной первичной конечной точки и госпитализации по любой причине у пациентов с декомпенсацией СН. На ухудшение прогноза указывало также наличие анемии и снижение КНТЖ, а не содержания ферритина. Во время госпитализации и в течение 3 мес после выписки у части пациентов наблюдалось разрешение ДЖ, хотя препараты железа им не назначали.
Ограничения настоящего исследования
Нами не были установлены предикторы спонтанного разрешения ДЖ. Вывление таких предикторов позволило бы уточнить показания к внутривенному введению препаратов железа у пациентов с СН.
Используемые источники
- Jankowska EA, Rozentryt P, Witkowska A, et al. Iron deficiency predicts impaired exercise capacity in patients with systolic chronic heart failure. J Card Fail. 2011;17(11):899-906.
- Cohen-Solal A, Damy T, Terbah M, et al. High prevalence of iron deficiency in patients with acute decompensated heart failure. Eur J Heart Fail 2014;16:984-91.
- Okonko DO, Mandal AK, Missouris CG, et al. Disordered iron homeostasis in chronic heart failure: prevalence, predictors, and relation to anemia, exercise capacity, and survival. J Am Coll Cardiol 2011;58(12):1241-51.
- Gentil JRS, Fabricio CG, Tanaka DM, et al. Should we use ferritin in the diagnostic criteria of iron deficiency in heart failure patients?. Clin Nutr ESPEN 2020;39:119-123.
- Kalantar-Zadeh K, Kalantar-Zadeh K, Lee GH. The fascinating but deceptive ferritin: to measure it or not to measure it in chronic kidney disease? Clin J Am Soc Nephrol 2006;1 Suppl 1:S9-S18.
- van Dalen DH, Kragten JA, Emans ME, et al. Acute heart failure and iron deficiency: a prospective, multicentre, observational study. ESC Heart Fail 2022;9(1):398-407.
- Недогода С.В., Саласюк А.С., Барыкина И.Н. и др. Фармакоэкономический анализ применения лекарственного препарата карбоксимальтозата железа у пациентов с хронической сердечной недостаточностью и дефицитом железа в Российской Федерации. Главврач 2022;6:30-43 [Nedogoda SV, Salasyuk AS, Barykina IN, et al. Pharmacoeconomic analysis of the use of ferric carboxymaltose in patients with chronic heart failure and iron deficiency in Russian Federation. Chief Physician 2022;6:30-43 (In Russ.)].
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42(36):3599-726.
- Anker SD, Comin Colet J, Filippatos G, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med 2009;361(25):2436-48.
- Ponikowski P, van Veldhuisen DJ, Comin-Colet J, et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency†. Eur Heart J 2015;36(11):657-68.
- Ponikowski P, Kirwan BA, Anker SD, et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet 2020;396(10266):1895-1904.
- Przybylowski P, Wasilewski G, Golabek K, et al. Absolute and functional iron deficiency is a common finding in patients with heart failure and after heart transplantation. Transplant Proc 2016;48(1):173-6.
- Grote Beverborg N, Klip IT, Meijers WC, et al. Definition of iron deficiency based on the gold standard of bone marrow iron staining in heart failure patients. Circ Heart Fail 2018;11(2):e004519.
- Стуклов Н.И. Дефицит железа и анемия у больных хронической сердечной недостаточностью. Рациональная фармакотерапия в кардиологии 2017;13(5):651-60 [Stuklov NI. Iron deficiency and anemia in patients with chronic heart failure. Rational pharmacotherapy in cardiology 2017;13(5):651-60 (In Russ.)]..
- Jian J, Yang Q, Dai J, et al. Effects of iron deficiency and iron overload on angiogenesis and oxidative stress-a potential dual role for iron in breast cancer. Free Radic Biol Med 2011;50(7):841-7.
- Sandek A, Bauditz J, Swidsinski A, et al. Altered intestinal function in patients with chronic heart failure. J Am Coll Cardiol 2007;50(16):1561-9.
- von Haehling S, Doehner W, Anker SD. Nutrition, metabolism, and the complex pathophysiology of cachexia in chronic heart failure. Cardiovasc Res 2007;73(2):298-309.
- Toblli JE, Angerosa M. Optimizing iron delivery in the management of anemia: patient considerations and the role of ferric carboxymaltose. Drug Des Devel Ther 2014;8:2475-91.
- Xia H, Shen H, Cha W, Lu Q. The prognostic significance of anemia in patients with heart failure: A meta-analysis of studies from the last decade. Front Cardiovasc Med 2021;8:632318.
- Graham FJ, Masini G, Pellicori P, et al. Natural history and prognostic significance of iron deficiency and anaemia in ambulatory patients with chronic heart failure. Eur J Heart Fail 2022;24(5):807-17.
- Campodonico J, Nicoli F, Motta I, et al. Prognostic role of transferrin saturation in heart failure patients. Eur J Prev Cardiol 2021;28(15):1639-46.
- Masini G, Graham FJ, Pellicori P, et al. Criteria for iron deficiency in patients with heart failure. J Am Coll Cardiol 2022;79(4):341-51.
- Mentz RJ, Garg J, Rockhold FW, et al. Ferric carboxymaltose in heart failure with iron deficiency. N Engl J Med 2023;389(11):975-86.
- Kalra PR, Cleland JGF, Petrie MC, et al. Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet 2022;400:2199-209.
- Ponikowski P, Mentz RJ, Hernandez AF, et al. Efficacy of Ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis. Eur Heart J 2023;ehad586.
