АНЦА-ассоциированные интерстициальные заболевания легких и интерстициальная пневмония с аутоиммунными признаками
Интерстициальное заболевание легких (ИЗЛ) – возможное проявление васкулитов, ассоциированных с антителами к цитоплазме нейтрофилов (АНЦА), однако известны случаи идиопатической интерстициальной пневмонии, сочетавшейся с циркуляцией АНЦА, но без признаков системного васкулита (АНЦА-ИЗЛ).
Определение доли АНЦА-ИЗЛ в когорте пациентов с интерстициальной пневмонией с аутоиммунными признаками (ИПАП) и изучение особенностей их течения.
В ретроспективное исследование включали взрослых пациентов с АНЦА-ИЗЛ или ИПАП. Всем пациентам были выполнены клиническое обследование, компьютерная томография (КТ) легких, иммунологические исследования и спирометрия, в части случаев – биопсия легкого.
В исследование были включены 49 пациентов (37 женщин, медиана возраста 57,0 лет) с ИПАП и 4 пациента (3 женщины, возраст от 42 до 67 лет) с АНЦА-ИЗЛ. У 30 (61,2%) из 49 пациентов с ИПАП при КТ определялась неспецифическая интерстициальная пневмония (НСИП), у 7 (14,3%) – обычная интерстициальная пневмония (ОИП), у 6 (12,2%) – недифференцированная интерстициальная пневмония, у 6 (12,2%) – организующаяся пневмония. Клинические критерии ИПАП наблюдались у 25 (51,0%) пациентов, серологические – у 45 (91,8%). Медиана форсированной жизненной емкости легких (ФЖЕЛ) составила 85,0% (62,9;100,7), а медиана DLCO – 56,0% (41,5;67,5). У 2 из 4 пациентов с АНЦА-ИЗЛ по КТ установлена НСИП, у 1 – ОИП, у 1 – недифференцированная интерстициальная пневмония. Антитела к протеиназе-3 определялись у 3 пациентов, к миелопероксидазе – у 1. Медиана ФЖЕЛ составила 58% (52,0;63,0), а медиана DLCO – 59% (47,0;60,5). Иммуносупрессивная терапия проводилась у 44 (89,8%) из 49 пациентов с ИПАП и всех 4 пациентов с АНЦА-ИЗЛ, антифибротическая терапия нинтеданибом – у 5 (10,2%) пациентов с ИПАП.
У пациентов с идиопатической интерстициальной пневмонией могут быть обнаружены АНЦА. Иммуносуп рессивная терапия в ряде случаев АНЦА-ИЗЛ позволяла добиться стабилизации болезни. При прогрессировании легочного фиброза возможно назначение антифибротической терапии.
Антинейтрофильные цитоплазматические антитела (АНЦА) – это группа антител к различным антигенам, содержащимся в цитоплазме нейтрофилов, таким как протеиназа-3 (ПР3) и миелопероксидаза (МПО). Наличие АНЦА в сыворотке имеет важное значение в диагностике и классификации АНЦА-ассоциированных васкулитов, хотя аутоантитела не являются специфичными для них и могут определяться при различных заболеваниях, в том числе других иммуновоспалительных ревматических заболеваниях, аутоиммунных заболеваниях печени, воспалительных заболеваниях кишечника, инфекционном эндокардите и злокачественных опухолях [1].
АНЦА-ассоциированные васкулиты, характеризующиеся поражением преимущественно мелких сосудов, включают в себя три нозологических формы: гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА) [2,3]. Антитела к МПО чаще обнаруживают при МПА и ЭГПА, а антитела к ПР3 – при ГПА [4-6]. АНЦА определяются практически у всех пациентов с МПА, однако они нередко отсутствуют при ЭГПА и локальной форме ГПА, характеризующейся поражением верхних дыхательных путей или орбиты [1,7-13]. Поражение паренхимы легких часто развивается при МПА и ГПА и варьирует от бессимптомных очаговых изменений до крайне тяжелых форм, таких как образование обширных зон деструкции или диффузное альвеолярное кровотечение [14-16]. При ЭГПА поражение легких чаще всего проявляется бронхиальной астмой, реже встречается эозинофильная пневмония [17].
Интерстициальные заболеваниях легких (ИЗЛ) представляют собой неоднородную группу патологических состояний, которые могут как первичными (идиопатические интерстициальные пневмонии), так и проявлением системного заболевания, прежде всего системной склеродермии, реже ревматоидного артрита, идиопатических воспалительных миопатий, системной красной волчанки и др. [18,19]. Впервые ИЗЛ при АНЦА-ассоциированных васкулитах описали японские авторы в 1994 г. В этом исследовании частота поражения интерстициальной ткани легких у пациентов с МПА составила 58,7% [20]. В последующем были опубликованы результаты других исследований, подтверждавших возможность развития ИЗЛ у пациентов с ААВ, особенно при наличии антител к МПО [21,22]. Распро стра нен ность подобного варианта поражения легких у пациентов с ААВ варьировала в широких пределах (от 1 до 30%) и была выше в японской популяции [23-25]. Кроме того, описаны случаи идиопатической интерстициальной пневмонии, сочетавшейся с циркуляцией АНЦА (чаще к МПО), но без признаков системного васкулита (АНЦА-ИЗЛ).
У части пациентов с идиопатической интерстициальной пневмонией могут быть выявлены различные аутоантитела (антинуклеарный фактор, ревматоидный фактор, антитела к циклическому цитруллинированному пептиду, двуспиральной ДНК, рибонуклеопротеину, SS-A, SS-B, антигену Smith и др.), характерные для иммуновоспалительных ревматических заболеваний, несмотря на отсутствие клинических проявлений последних [26]. Этот вариант ИЗЛ предложено называть интерстициальной пневмонией с аутоиммунными признаками (ИПАП; interstitial pneumonia with autoimmune features). В соответствии с рекомендациями рабочей группы Европейского респираторного общества (ERS) и Американского торакального общества (ATS) 2015 г., ИПАП следует диагностировать у пациентов с признаками интерстициальной пневмонии при КТ высокого разрешения (неспецифическая интерстициальная пневмония [НСИП], организующаяся пневмония [ОП] и лимфоцитарная интерстициальная пневмония [ЛИП]), у которых имеются различные клинические проявления (артрит, "рука механика", синдром Рейно, кожные явзы дистальных фаланг пальцев и др.) и/или выявляются указанные выше аутоантитела, однако не может быть установлен диагноз определенного системного заболевания соединительной ткани в связи с тем, что они не удовлетворяют необходимым классификационным критериям [27]. АНЦА не были включены в серологический домен критериев ИПАП, так как, по мнению экспертов, васкулиты не относятся к системным заболеваниям соединительной ткани и должны рассматриваться отдельно [18,27], хотя эта точка зрения представляется спорной [28].
Целью настоящего исследования было определение доли АНЦА-ИЗЛ в структуре ИПАП и изучение особенностей их течения.
Материалы и методы
В ретроспективное наблюдательное исследование включали взрослых пациентов с ИПАП или АНЦА-ИЗЛ, обследованных в клинике им. Е.М. Тареева с 01.01.2018 по 01.10.2023. Протокол исследования был одобрен Локальным этическим комитетом Первого МГМУ имени И.М. Сеченова (Сеченовского Университета) 17.11.2022 (протокол №2322).
Всем пациентам проводили КТ органов грудной клетки, определение функции внешнего дыхания и диффузионной способности легких по монооксиду углерода (DLCO) и серологические исследования, включая антинуклеарный фактор (АНФ) на культуре клеток НЕр-2, ревматоидный фактор (РФ), антитела к циклическому цитруллинированному пептиду (АЦЦП), АНЦА, панель антинуклеарных и антисинтетазных антител. Антитела к ПР3 и МПО определяли количественно методом иммуноферментного анализа. Классифи кацию КТ-паттернов ИЗЛ проводили в соответствии с рекомендациями ATS/ERS 2013 г.
ИПАП диагностировали на основании клинических, серологических и рентгенологических/морфологических критериев, распределенных по соответствующим доменам, в соответствии с рекомендациями ERS и ATS 2015 г. [26]. Все пациенты c ИПАП были консультированы ревматологом для исключения системных заболеваний соединительной ткани (системной склеродермии, ревматоидного артрита, синдрома Шегрена и идиопатических воспалительных миопатий). Диагноз АНЦА-ИЗЛ устанавливали на основании наличия КТ-признаков ИЗЛ и антител к МПО или ПР3 в сыворотке при отсутствии других клинических проявлений АНЦА-ассоциированного васкулита.
Статистический анализ. Нормальность распределения количественных переменных проверяли при помощи критерия Шапиро-Уилка. Для количественных переменных с распределением, отличным от нормального, результаты представлены в виде медианы и межквартильного размаха (IQR), для качественных переменных – в виде абсолютных значений и доли в процентах. Статистическую обработку полученных данных проводили с помощью программы Jamovi версия 2.3.28.
Результаты
В исследование были включены 53 пациента, у 49 из которых была диагностирована ИПАП, а у 4 – АНЦАИЗЛ. Большинство пациентов с ИПАП были женщинами (75,5%), медиана возраста составила 57,0 (50,5;63,5) лет (табл. 1). Основным КТ-паттерном поражения легких в этой группе была НСИП, которая наблюдалась у 30 (61,2%) пациентов. Реже встречались недифференцированная интерстициальная пневмония и ОП – по 6 (12,2%), в то время как случаев ЛИП нами выявлено не было. У 7 (14,3%) пациентов была диагностирована обычная интерстициальная пневмония (ОИП). У 12 пациентов была выполнена биопсия легких. Наиболее частым морфологическим паттерном была НСИП, выявленная у 7 пациентов. Клинические критерии ИПАП ("рука механика", дигитальные язвы, артриты, телеангиэктазии, феномен Рейно, отек пальцев, симптом Готтрона) наблюдались у 25 (51,0%) пациентов, серологические критерии (АНФ, РФ, АЦЦП, антитела к экстрагируемым антигенам ядра клеток, антитела к тРНК-синтетазе и др.) – у 45 (91,8%). Среди клинических критериев чаще всего встречался артрит, а среди серологических – повышение титра АНФ, РФ и антитела к SS-A (Ro).
| Показатели | Значения |
|---|---|
| Примечание: АНФ – антинуклеарный фактор, АЦЦП – антитела кциклическому цитруллинированному пептиду, РФ – ревматоидный фактор | |
| Возраст, лет | 57,0 (50,5;63,5) |
| Женщины, n (%) | 37 (75,5) |
| ФЖЕЛ, % | 85,0 (62,9;100,7) |
| DLCO, % | 56,0 (41,5;67,5) |
| Статус курения, n (%) | |
| Курильщик | 2 (4,1) |
| Бывший курильщик | 7 (14,3) |
| Никогда не курил | 40 (81,6) |
| КТ-паттерн, n (%) | |
| ОИП | 7 (14,3) |
| НСИП | 30 (61,2) |
| ОП | 6 (12,2) |
| Недифф. интерстициальная пневмония | 6 (12,2) |
| Биопсия легкого, n (%) | 12 (24,5) |
| ОИП | 1 (2,0) |
| НСИП | 7 (14,3) |
| ОП | 2 (4,1) |
| Недифф. интерстициальная пневмони | 2 (4,1) |
| Клинические критерии ИПАП, n (%) | 25 (51,0) |
| "Рука механика" | 6 (12,2) |
| Артрит | 16 (32,7) |
| Феномен Рейно | 5 (10,2) |
| Симптом Готтрона | 1 (2,0) |
| Язвы кончиков пальцев кистей | 0 |
| Телеангиоэктазии на ладонях | 0 |
| Беспричинный отек пальцев | 0 |
| Серологические критерии ИПАП, n (%) | 45 (91,8) |
| АНФ | 32 (65,3) |
| РФ | 13 (26,5) |
| Антитела к двуцепочечной ДНК | 2 (4,1) |
| Антитела к Sm-антигену | 5 (10,2) |
| Антитела к SS-A (Ro) | 13 (26,5) |
| Антитела к SS-B (La) | 4 (8,1) |
| Антитела к tРНК-синтетазе | 7 (14,3) |
| Антитела к топоизомеразе (Scl-70) | 2 (4,1) |
| АЦЦП | 0 |
| Антитела к рибонуклеопротеину | 0 |
| Антитела к MDA-5 | 0 |
Медиана форсированной жизненной емкости легких (ФЖЕЛ) составила 85,0% (62,9;100,7) от должной, а медиана DLCO – 56,0% (41,5;67,5). Снижение ФЖЕЛ ниже 80% от должной наблюдалось у 14 (28,6%) пациентов, снижение DLCO – у 36 (73,5%).
| № | Возраст дебюта, пол |
Титр (ед/мл) и тип АНЦА |
Другие антитела |
Паттерн КТ | Биопсия | ФЖЕЛ/DLCO, % | Лечение | Исход |
|---|---|---|---|---|---|---|---|---|
| Примечание: ГП – гиперсенситивный пневмонит, АНФ – антинуклеарный фактор, РФ – ревматоидный фактор, N – верхняя граница референсного интервала, ГКС – глюкокортикостероиды, ЦФА – циклофосфамид, АЗА – азатиоприн, МТ – метотрексат, ММФ – микофенолата мофетил, ГХХ – гидроксихлорохин, РТМ – ритуксимаб. Референсные значения АНЦА 0-5 ед/мл | ||||||||
| 1 | 67, жен. | ПР3, 47,5 | - | НСИП | - | 60/- | ГКС, ЦФА, АЗА, МТ | Стабилизация |
| 2 | 67, жен. | МПО, 17,0 | РФ | Недиф. ИП | Недиф. ИЗЛ | 56/62 | ГКС, ММФ, ГХХ, РТМ | Стабилизация |
| 3 | 42, муж | ПР3, 2N | АНФ | НСИП | ГП | 40/35 | ГКС, AЗA, MMФ, MT | Смерть |
| 4 | 67, жен | ПР3, 50,5 | - | ОИП | - | 72/59 | ММФ | Стабилизация |
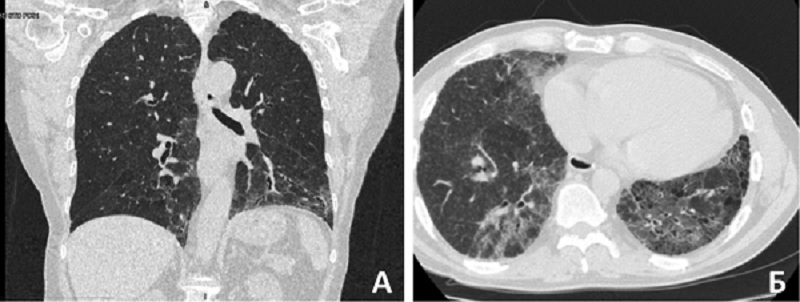
Характеристика 4 пациентов с АНЦА-ИЗЛ (3 женщины, возраст от 42 до 67 лет) представлена в табл. 2. У двух из них КТ-паттерн поражения легких соответствовал НСИП, у одного – ОИП, у одного – недифференцированной интерстициальной пневмонии (рис. 1). При гистологическом исследовании биоптата легких у одного пациента выявлена картина фиброзной стадии гиперсенситивного пневмонита, у второго – картина недифференцированной интерстициальной пневмонии. У трех пациентов определялись антитела к ПР3, а у одного – к МПО. В динамике на фоне проводимой иммуносупрессивной терапии уровни АНЦА нормализовались у всех 4 пациентов. Медиана ФЖЕЛ составила 58% (52,0;63,0) от должной, а медиана DLCO – 59% (47,0;60,5).
Медиана длительности наблюдения пациентов с ИПАП после установления диагноза составила 40,0 (27,0;50,0) мес. Иммуносупрессивная терапия проводилась у 44 (89,8%) из 49 пациентов, в том числе глюкокортикостероидами – у 40 (81,6%), азатиоприном, метотрексатом, циклофосфамидом, циклоспорином или микофенолата мофетилом – у 26 (53,1%). У 5 (10,2%) пациентов проводилась антифибротическая терапия (нинтеданиб у 4, пирфенидон у 1), которую назначали в связи с прогрессированием легочного фиброза, несмотря на иммуносупрессивную терапию. Развитие системных заболеваний соединительной ткани во время периода наблюдения наблюдали у 6 (12,5%) пациентов, в том числе у 3 – ревматоидного артрита, у 2 – дерматомиозита и у 1 – болезни Шегрена. Прогрессирование легочного фиброза на фоне лечения отмечалось у 8 (18,2%) из 45 пациентов. Умерли 12 (24,5%) пациентов. В 8 случаях причиной смерти было прогрессирование ИЗЛ и дыхательной недостаточности, в 4 – сердечно-сосудистые причины.
Обсуждение
Результаты ретроспективного исследования подтверждают, что у части пациентов с идиопатической интерстициальной пневмонией могут определяться не только аутоантитела, характерные для системных заболеваний соединительной ткани, но и АНЦА (как к МПО, так и ПР3) несмотря на отсутствие других клинических проявлений АНЦА-ассоциированного васкулита. Наши данные не позволяют судить о частоте АНЦА-ассоциированной интерстициальной пневмонии в структуре ИЗЛ. В других исследованиях частота выявления антител к МПО у пациентов с интерстициальной пневмонией составляла 4-36%, а антител к ПР3 – 2-4% [29]. Частота АНЦА у пациентов с ИЗЛ была выше в азиатских странах, в частности в Японии и Китае, что может объясняться более высокой распространенностью МПА и позитивности по МПО-АНЦА в этой популяции [30]. Полагают, что антитела к МПО могут принимать непосредственное участие в патогенезе легочного фиброза за счет активации нейтрофилов и выделения ими различных оксидантов, вызывающих пролиферацию фибробластов и отложение внеклеточного матрикса в паренхиме легких [23]. К другим возможным механизмам повреждения легких относят выделение нейтрофилами, активированными под действием АНЦА, протеолитических ферментов, таких как эластаза, или нейтрофильных внеклеточных ловушек (neutrophil extracellular traps – NETs) [31]. Антитела к ПР3 также вызывают активацию нейтрофилов и, соответственно, могут играть роль в патогенезе интерстициальной пневмонии за счет тех же или похожих механизмов. В американском исследовании G. Liu и соавт. проанализировали частоту АНЦА в двух независимых когортах пациентов с диагнозом идиопатического легочного фиброза [25]. АНЦА были выявлены у 4,0% из 353 пациентов и 5,1% из 392 пациентов, соответственно. В первой когорте антитела к ПР3 определялись чаще антител к МПО, в то время как во второй когорте наблюдалась обратная картина. В нашей серии случаев антитела к ПР3 были выявлены у 3 пациентов, а антитела к МПО – у 1.
Хорошо известно, что ИПАП может предшествовать развитию развернутой клинической картины системного аутоиммунного заболевания. В течение нескольких лет после установления диагноза поражения легких мы наблюдали развитие системного заболевания соединительной ткани у 6 (12,5%) из 49 пациентов с ИПАП. В то же время у 4 пациентов с АНЦА-ИЗЛ в течение около 5 лет не было отмечено появления признаков системного васкулита. Следует отметить, что все они получали терапию глюкокортикостероидами и/или иммуносупрессивными препаратами, которая гипотетически могла препятствовать генерализации патологического процесса. Тем не менее, результаты других исследований свидетельствуют о том, что у части пациентов с АНЦА-ИЗЛ возможно развитие АНЦА-ассоциированного васкулита. В упоминавшемся выше исследовании C. Liu и соавт. АНЦА-ассоциированный васкулит в течение более года после начала наблюдения в двух когортах развился у 25-33% пациентов с ИЗЛ, у которых исходно определялись антитела к МПО, в то время как при наличии антител к ПРЗ таких случаев не было [25]. Сходные данные приводят и другие авторы. H. Hozumi и соавт. при обследовании более 300 пациентов с идиопатической интерстициальной пневмонией выявили антитела к МПО и ПР-3 в 8,5% и 4,4% случаев, соответственно [32,33]. В течение 5 лет частота развития АНЦА-ассоциированного васкулита составила 24,3% при наличии антител к МПО и 0% при наличии антител к ПР3. Отсутствие терапии по поводу интерстициальной пневмонии у МПО-АНЦА-позитивных пациентов сопровождалось более чем трехкратным увеличением риска развития АНЦА-ассоциированного васкулита. Таким образом, результаты исследований свидетельствуют о том, что наличие антител к МПО у пациентов с интерстициальной пневмонией, особенно не получающих лечение, примерно в четверти случаев сопровождалось развитием системного васкулита в течение ближайших нескольких лет, в то время как при наличии антител к ПР3 такая угроза отсутствовала. Причины возможной зависимости риска развития системного васкулита от серологического профиля у пациентов с АНЦА-ИЗЛ остаются неясными.
Клинические проявления идиопатической интерсти-циальной пневмонии любой природы сходные и вклю-чают в себя одышку, сухой кашель, крепитацию влегких и вентиляционные нарушения рестриктивноготипа – снижение ФЖЕЛ, а также снижение DLCO.Основной метод диагностики – КТ высокого разреше-ния, которая позволяет выявить уплотнение по типу"матового стекла", ретикулярные изменения, утолще-ние междолькового интерстиция, зоны консолидации и"сотового легкого". В большинстве случаев эти измене-ния являются симметричными. Особенность ИПАП –возможное наличие системных проявлений, которые,однако, недостаточны для установления диагноза опре-деленного системного заболевания соединительнойткани. В нашей когорте они (чаще всего артрит илисиндром Рейно) наблюдались примерно у половиныпациентов, в то время как в остальных случаях диагнозИПАП был установлен на основании рентгенологиче-ской картины и наличия аутоантител (РФ, АНФ и др.).Если у пациента с интерстициальной пневмонией опре-деляются АНЦА, то необходимо проводить обследова-ние с целью исключения АНЦА-ассоциированноговаскулита, прежде всего МПА. Проявлениями систем-ного васкулита могут быть поражение кожи (пальпируе-мая пурпура, язвы), почек (острый нефритическийсиндром, снижение скорости клубочковой фильтра-ции), нервной системы (мононеврит, полиневропатия),верхних дыхательных путей (язвенно-некротическийринит, поражение околоносовых пазух), лихорадка,похудание, лабораторные признаки воспаления.Следует учитывать, что указанные симптомы могутпоявиться в различные сроки после установления диаг-ноза АНЦА-ИЗЛ.
При прогрессировании фиброза легких, в том числе несмотря на иммуносупрессивную терапию, целесообразно назначение антифибротических препаратов, которые в нашем исследовании применялись у 5 (10,2%) из 49 пациентов с ИПАП. Хотя эффективность нинтеданиба у пациентов с АНЦА-ИЗЛ не установлена, она продемонстрирована при идиопатическом легочном фиброзе и прогрессирующем легочном фиброзе другой природы, в том числе в рамках системных заболеваний соединительной ткани [41,42].
Заключение
АНЦА не относят к классификационным критериям ИПАП, хотя такой подход представляется спорным, учитывая сходство механизмов развития и методов лечения системных заболеваний соединительной тканей и АНЦА-ассоциированных васкулитов. У всех пациентов с идиопатической интерстициальной пневмонией следует определять АНЦА, в том числе к МПО и ПР3, методом иммуноферментного анализа. У пациентов с АНЦА-ИЗЛ, прежде всего при наличии антител к МПО, возможно развитие системного васкулита в течение нескольких лет после установления диагноза поражения легких. Хотя эффективность иммуносупрессивной терапии у пациентов с АНЦА-ИЗЛ остается недоказанной, она представляется оправданной независимо от КТ-паттерна. При прогрессировании легочного фиброза целесообразно применение нинтеданиба.
Используемые источники
- Moiseev S, Cohen Tervaert JW, Arimura Y, et al. 2020 international consensus on ANCA testing beyond systemic vasculitis. Autoimmun Rev 2020;19(9):102618.
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum 2013;65(1):1-11.
- Leavitt RY, Fauci AS, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener’s granulomatosis. Arthritis Rheum 1990;33(8):1101-7.
- Grayson PC, Ponte C, Suppiah R, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for eosinophilic granulomatosis with polyangiitis. Ann Rheum Dis 2022;81(3):309-14.
- Robson JC, Grayson PC, Ponte C, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis 2022;81(3):315-20.
- Suppiah R, Robson JC, Grayson PC, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. Ann Rheum Dis 2022;81(3):321-6.
- Kallenberg CGM. Pathogenesis of ANCA-associated vasculitides. Ann Rheum Dis 2011;70 Suppl 1:i59-63.
- Novikov P, Smitienko I, Bulanov N, et al. Testing for antineutrophil cytoplasmic antibodies (ANCAs) in patients with systemic vasculitides and other diseases. Ann Rheum Dis 2017;76(8):e23.
- Jennette JC, Wilkman AS, Falk RJ. Anti-neutrophil cytoplasmic autoantibodyassociated glomerulonephritis and vasculitis. Am J Pathol 1989;135(5):921-30.
- Bosch X, Mirapeix E, Font J, et al. Anti-myeloperoxidase autoantibodies in patients with necrotizing glomerular and alveolar capillaritis. Am J Kidney Dis 1992;20(3):231-9.
- van der Woude FJ, Rasmussen N, Lobatto S, et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener’s granulomatosis. Lancet 1985;1(8426):425-9.
- Kallenberg CG, Brouwer E, Weening JJ, Tervaert JW. Anti-neutrophil cytoplasmic antibodies: current diagnostic and pathophysiological potential. Kidney Int 1994;46(1):1-15.
- Bossuyt X, Cohen Tervaert JW, Arimura Y, et al. Position paper: Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nat Rev Rheumatol 2017;13(11):683-92.
- Schirmer JH, Wright MN, Vonthein R, et al. Clinical presentation and long-term outcome of 144 patients with microscopic polyangiitis in a monocentric German cohort. Rheumatology 2016;55(1):71-9.
- Puéchal X, Pagnoux C, Perrodeau Г, et al. Long-term outcomes among participants in the WEGENT trial of remission-maintenance therapy for granulomatosis with polyangiitis (Wegener’s) or microscopic polyangiitis. Arthritis Rheumatol 2016;68(3):690-701.
- Solans-LaquО R, Fraile G, Rodriguez-Carballeira M, et al. Clinical characteristics and outcome of Spanish patients with ANCA-associated vasculitides: Impact of the vasculitis type, ANCA specificity, and treatment on mortality and morbidity. Medicine (Baltimore) 2017;96(8).
- Watanabe R, Hashimoto M. Eosinophilic granulomatosis with polyangiitis: latest findings and updated treatment recommendations. J Clin Med. 2023;12(18):5996.
- Travis WD, Costabel U, Hansell DM, et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013;188(6):733-48.
- Vij R, Strek ME. Diagnosis and treatment of connective tissue disease-associated interstitial lung disease. Chest 2013;143(3):814-24.
- Arimura Y, Minoshima S, Tanaka U, et al. [Pulmonary involvement in patients with myeloperoxidase specific-antineutrophil cytoplasmic antibody]. Ryumachi Rheum.1995;35(1):46-55.
- Bahmer T, Romagnoli M, Girelli F, et al. The use of auto-antibody testing in the evaluation of interstitial lung disease (ILD) – A practical approach for the pulmonologist. Respir Med 2016;113:80-92.
- Borie R, Crestani B. Antineutrophil cytoplasmic antibody-associated lung fibrosis. Semin Respir Crit Care Med. 2018;39(4):465-470.
- Sebastiani M, Manfredi A, Vacchi C, et al. Epidemiology and management of interstitial lung disease in ANCA-associated vasculitis. Clin Exp Rheumatol 2020;38(2):221-31.
- Alba MA, Flores-Suárez LF, Henderson AG, et al. Interstital lung disease in ANCA vasculitis. Autoimmun Rev 2017;16(7):722.
- Liu GY, Ventura IB, Achtar-Zadeh N, et al. Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in North American patients with idiopathic pulmonary fibrosis. Chest 2019;156(4):715-23.
- Акулкина Л.А., Щепалина А.А., Моисеев А.С. и др. Интерстициальная пневмония с аутоиммунными признаками: одноцентровое проспективное исследование. Терапевтический архив 2023;95(3):224–229. [Akulkina LA, Shchepalina AA, Moiseev AS, et al. Interstitial pneumonia with autoimmune features: monocentric prospective study. Terapevticheskii Arkhiv 2023;95(3):224–9 (In Russ.)].
- Fischer A, Antoniou KM, Brown KK, et al. An official European Respiratory Society/American Thoracic Society research statement: interstitial pneumonia with autoimmune features. Eur Respir J 2015;46(4):976-87.
- Novikov P, Shchegoleva E, Akulkina L, et al. Diagnostic pitfalls and treatment challenges in interstitial pneumonia with autoimmune features. Arthritis Rheumatol 2019;71(4):651-2.
- Kadura S, Raghu G. Antineutrophil cytoplasmic antibody-associated interstitial lung disease: a review. Eur Respir Rev 2021;30(162):210123.
- Furuta S, Chaudhry AN, Hamano Y, et al. Comparison of phenotype and outcome in microscopic polyangiitis between Europe and Japan. J Rheumatol 2014;41(2):325-33.
- Negreros M, Flores-SuЗrez LF. A proposed role of neutrophil extracellular traps and their interplay with fibroblasts in ANCA-associated vasculitis lung fibrosis. Autoimmun Rev 2021;20(4):102781.
- Hozumi H, Enomoto N, Oyama Y, et al. Clinical implication of proteinase-3-antineutrophil cytoplasmic antibody in patients with idiopathic interstitial pneumonias. Lung 2016;194(2):235-42.
- Hozumi H, Oyama Y, Yasui H, et al. Clinical significance of myeloperoxidaseanti-neutrophil cytoplasmic antibody in idiopathic interstitial pneumonias. PloS One 2018;13(6):e0199659.
- Brovko M, Akulkina L, Sholomova V, et al. Usual interstitial pneumonia: A distinct group within interstitial pneumonia with autoimmune features? Respirology 2018;23(10):958.
- Kelly BT, Moua T. Overlap of interstitial pneumonia with autoimmune features with undifferentiated connective tissue disease and contribution of UIP to mortality. Respirology 2018;23(6):600-5.
- Sambataro G, Sambataro D, Torrisi SE, et al. State of the art in interstitial pneumonia with autoimmune features: a systematic review on retrospective studies and suggestions for further advances. Eur Respir Rev 2018;27(148):170139.
- Maillet T, Goletto T, Beltramo G, et al. Usual interstitial pneumonia in ANCAassociated vasculitis: A poor prognostic factor. J Autoimmun 2020;106:102338.
- Comarmond C, Crestani B, Tazi A, et al. Pulmonary fibrosis in antineutrophil cytoplasmic antibodies (ANCA)-associated vasculitis: a series of 49 patients and review of the literature. Medicine (Baltimore) 2014;93(24):340-9.
- Акулкина Л.А., Бровко М.Ю., Шоломова В.И. и др. АНЦА-ассоциированные интерстициальные заболевания легких: актуальные вопросы диагностики и лечения. Клин фармакол тер 2019;28(4):76-82 [Akulkina L, Brovko M, Sholomova V, et al. Diagnosis and treatment of ANCA-associated interstitial lung disease. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019; 28(4):76-82 (In Russ.)]
- Thompson GE, Specks U. Update on the management of respiratory manifestations of the antineutrophil cytoplasmic antibodies-associated vasculitides. Clin Chest Med 2019;40(3):573-82.
- Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in progressive fibrosing interstitial lung diseases. N Engl J Med 2019;381(18):1718-27.
- Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in progressive interstitial lung diseases: data from the whole INBUILD trial. Eur Respir J 2022;59(3):2004538.
