Диагностическое и прогностическое значение NT-proBNP у пациентов с неалкогольной жировой болезнью печени и декомпенсированной сердечной недостаточностью
Изучить содержание N-терминального пропептида натрийуретического гормона (NT-proBNP) у пациентов с неалкогольной жировой болезнью печени (НАЖБП) и острой декомпенсацией сердечной недостаточности (ОДСН) при поступлении и при выписке и оценить его влияние на клинические исходы.
В исследование были включены 566 пациентов, госпитализированных с ОДСН II–IV функционального класса (ФК) по NYHA (49,3% мужчин, средний возраст 72,4±11,4 лет). Всем пациентам при поступлении и выписке измеряли содержание NT-proBNP. Степень стеатоза печени определяли с помощью фиброэластометрии на аппарате Fibroscan 502 touch (Echosens, Франция) с использованием ультразвуковой опции CAP. Значения CAP анализировали следующим образом: менее 294 дБ/м – стеатоз 0 степени (S0), 295-309 дБ/м – 1 степени (S1), 310-330 дБ/м – 2 степени (S2), 331 дБ/м и выше – 3 степени (S3). Во время периода наблюдения оценивали смертность от любых причин и частоту повторных госпитализаций.
НАЖБП диагностирована у 168 (29,7%) из 566 пациентов с ОДСН. Частота ее у пациентов с сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) была выше (43%), чем у пациентов со сниженной ФВ (25%). У пациентов с выраженным стеатозом (S3) медиана содержания NT-proBNP была достоверно ниже, чем у пациентов с умеренным стеатозом (S1, S2) и без стеатоза (S0) как при поступлении (926, 1246 и 1850 пг/мл, соответственно, p<0,001), так и при выписке (480, 1077 и 1685 пг/мл, p<0,001). По данным многофакторного регрессионного анализа Кокса, содержание NT-proBNP>1593 пг/мл при выписке и ФВ<40% независимо ассоциировались с более высоким риском смерти от любых причин в течение периода наблюдения (отношения шансов 3,14; 95% доверительный интервал 1,52–6,43; р<0,001, и 2,90; 1,46–5,76; р=0,002, соответственно).
У пациентов с ОДСН, сочетавшейся с НАЖБП, выявлено более низкое содержание NT-proBNP при поступлении и при выписке, однако уровни его и ФВ ЛЖ при выписке имели важное значение для оценки риска смерти от любой причины.
У значительной части пациентов, госпитализированных с острой декомпенсацией хронической сердечной недостаточности (ОДСН), при выписке из стационара сохраняются клинические и лабораторно-инструментальные признаки застоя, что приводит к повышению риска смерти и повторных госпитализаций [1-3]. Повышение содержания N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP), отражающее тяжесть застоя крови, является одним из основных критериев диагностики сердечной недостаточности (СН) и неблагоприятным прогностическим фактором [4]. Значимое влияние на содержание NT-proBNP могут оказывать пол, возраст, масса тела, этническая принадлежность и сопутствующие заболевания, такие как ишемическая болезнь сердца, артериальная гипертония, острый коронарный синдром, фибрилляция предсердий, почечная недостаточность. Известно, что содержание NT-proBNP снижается у людей с ожирением [5-8].
Уровни NT-proBNP могут быть снижены у пациентов с неалкогольной жировой болезнью печени (НАЖБП) [9-12], которая во всем мире является ведущей причиной хронических заболеваний печени. Распространенность НАЖБП увеличивается параллельно с пандемией метаболического синдрома и сахарного диабета и в настоящее время достигает 25–30% [13,14]. Согласно последним исследованиям, НАЖБП рассматривается как независимый фактор риска и прогрессирования СН [15-17].
Исследование уровней NT-proBNP у пациентов с НАЖБП и ОДСН ранее не проводилось. Целью исследования было изучить содержание NT-proBNP при поступлении и при выписке и оценить его пороговые значения и прогностическое значение у пациентов с ОДСН и НАЖБП.
Материалы и методы
В исследование включали госпитализированных пациентов с ОДСН, которую диагностировали в соответствии с действующими рекомендациями: быстрое возникновение или нарастание симптомов и признаков СН в сочетании со структурно-функциональными изменениями сердца и повышенным уровнем NT-proBNP [4]. Диагноз НАЖБП устанавливался в соответствии с клиническими рекомендациями Российского научного медицинского общества терапевтов и гастроэнтерологов по диагностике и лечению НАЖБП [14].
Критериями исключения были острый коронарный синдром (ОКС) или инсульт давностью менее месяца, хроническая болезнь почек (ХБП) в терминальной стадии, употребление алкоголя в анамнезе (>210 мл этанола в неделю для мужчин и >140 мл в неделю для женщин) и/или алкогольный эксцесс перед госпитализацией, клиниколабораторные стигмы хронической алкогольной интоксикации, злокачественные новообразования, отечный синдром другой этиологии, напряженный асцит, правосторонний гидроторакс, другие хронические заболевания печени (аутоиммунные заболевания печени, вирусные гепатиты и др.), прием препаратов, способствующих развитию стеатоза (химиотерапия, тамоксифен, глюкокортикостероиды и др.), выраженные когнитивные нарушения и иммобилизация. Все пациенты подписали информированное согласие на участие в исследовании, которое было одобрено этическим комитетом Медицинского института РУДН.
Содержание NT-proBNP в плазме крови определяли с помощью иммуноферментного анализа при поступлении и при выписке.
Стандартную эхокардиографию, измерение диаметра нижней полой вены и ультразвуковое исследование легких проводили с помощью аппарата VIVID-E90 (General Electric Healthcare, США). СН с низкой фракцией выброса левого желудочка (СНнФВ) диагностировали при ФВ≤40%, СН с умеренной ФВ (СНуФВ) – при ФВ 41-49% и СН с сохраненной ФВ (СНсФВ) – при ФВ ≥50%.
Степень стеатоза печени определяли с помощью фиброэластометрии на аппарате Fibroscan 502 Touch (Echosens, Франция) c использованием ультразвуковой опции CAP (Controlled Attenuation Parameter – контролируемый параметр затухания). Использовали стандартный датчик (M) и датчик для тучных пациентов (XL). Пациент находился в положении лежа на спине с отведенной за голову правой рукой. Измерения проводились в области VIII–IX межреберных промежутков справа от задней до передней аксиллярной линии с выполнением не менее 10 достоверных измерений в ходе одного обследования по стандартной методике. Результаты считали достоверными, если успешными были не менее 60% измерений с интерквартильным соотношением менее 30%. Для верификации степени стеатоза при НАЖБП использовали следующие пороговые значения CAP: менее 294 дБ/м – стеатоз 0 степени (S0), 295-309 дБ/м – 1 степени (S1), 310-330 дБ/м – 2 степени (S2), 331 дБ/м и выше –3 степени (S3) [18].
Неблагоприятные исходы оценивали во время госпитализации (смерть от любых причин) и в течение 2 лет после выписки (повторные госпитализации по поводу ОДСН, смерть от прогрессирующей СН и от любых причин) по данным системы ЕМИАС, а также методом структурированного опроса при повторном визите или при телефонных контактах с пациентами или их родственниками.
Статистическая обработка результатов выполнялась с помощью программ Statistica (версия 10.0; StatSoft) и SPSS (версия 26.0). Для описания количественных переменных использовали среднее арифметическое (М) и стандартное отклонение (SD) (для нормального распределения) или медиану (Ме) и интерквартильный размах (IQR) (для распределения, отличавшегося от нормального). Качественные переменные описывали абсолютными (n) и относительными (%) значениями. Взаимосвязь между двумя признаками определяли методом корреляции Спирмена. Различия между двумя группами оценивали с помощью U-критерия Манна-Уитни для количественных переменных и критерия хи-квадрата Пирсона (χ2) для качественных переменных. Оценку достоверности различий в одной группе в разных точках проводили по W-критерию Уилкоксона. Для множественных сравнений использовали однофакторный дисперсионный анализ ANOVA, а при ненормальном распределении – тест Краскела-Уоллиса. Выживаемость оценивали методом Каплана–Мейера с использованием критерия log-rank.
Для оценки влияния различных показателей (в качестве непрерывной и дискретной величины) на риск наступления интересующей переменной использовали однофакторные и многофакторные модели регрессионного анализа Кокса. Переменные, включенные в модель, были выбраны в соответствии с их клинической значимостью. Для определения пороговых значений выживаемости проводили ROC-анализ с использованием индекса Юдена. Достоверными считали результаты при значении p<0,05.
Результаты
С января 2020 г. по январь 2023 г. в ГКБ им. В.В. Ви но градова были экстренно госпитализированы 1187 пациентов с ОДСН. В одноцентровое проспективное исследование были включены 566 пациентов, соответствовавших критериям включения и исключения из исследования (49,3% мужчин, средний возраст 72,4±11,4 лет). У большинства пациентов имелась артериальная гипертония (91,3%), более чем у половины – ожирение (57,1%), хроническая болезнь почек (52,3%) и ишемическая болезнь сердца (51,1%), примерно у трети – сахарный диабет 2 типа (33,3%) и перенесенный инфаркт миокарда (36,4%). Характеристика пациентов представлена в табл. 1.
| Параметр | Значение |
|---|---|
| Примечание: СН – сердечная недостаточность | |
| Мужчины, n (%) | 279 (49,3) |
| Возраст, годы | 72,4±11,4 |
| Длительность СН, годы | 2,0 (1;5) |
| Индекс массы тела, кг/м2 | 30,9 (26,8;35,6) |
| Курение, n (%) | 121 (21,4) |
| Функциональный класс СН по NYHA, n (%) | |
| II | 31 (5,5) |
| III | 304 (53,7) |
| IV | 231 (40,8) |
| Фракция выброса левого желудочка, % | 45 (35;55) |
| Фракция выброса левого желудочка, n (%) | |
| <40 | 183 (32,3) |
| 40–49 | 150 (26,5) |
| ≥50% | 233 (41,2) |
| Артериальная гипертония, n (%) | 517 (91,3) |
| Ишемическая болезнь сердца, n (%) | 289 (51,1) |
| Инфаркт миокарда в анамнезе, n (%) | 206 (36,4) |
| Сахарный диабет, n (%) | 189 (33,3) |
| Ожирение, n (%) | 323 (57,1) |
| Неалкогольная жировая болезнь печени, n (%) | 168 (29,7) |
| Фибрилляция предсердий, n (%) | 368 (64,9) |
| Инсульт в анамнезе, n (%) | 90 (15,9) |
| Хроническая болезнь почек, n (%) | 296 (52,3) |
| Шкала Чарлсон, баллы | 6,0 (4,0;8,0) |
| NT-proBNP, пг/мл | 1755 (753;3261) |
НАЖБП была диагностирована у 168 (29,7%) из 566 пациентов с ОДСН. Среди пациентов с сохраненной ФВ частота ее была выше (43%), чем среди пациентов с низкой ФВ (25%). Группы пациентов, страдавших и не страдавших НАЖБП, были сопоставимы по полу, но отличались по среднему возрасту (табл. 2). В первой группе была значительно выше доля пациентов с артериальной гипертонией, сахарным диабетом 2 типа, ожирением и хроническими обструктивными заболеваниями легкими, а также с сохраненной ФВ. Медиана ФВ у пациентов с НАЖБП была статистически значимо выше, чем у пациентов без НАЖБП.
| Показатель | НАЖБП (n=168) |
Без НАЖБП (n=398) |
p |
|---|---|---|---|
| Примечание: ХОБЛ – хроническая обструктивная болезнь легких, БА – бронхиальная астма, САД – систолическое АД, ДАД – диастолическое АД, ФК – функциональный класс | |||
| Мужчины, n (%) | 83 (49,4) | 196 (49,2) | 0,953 |
| Возраст, годы | 69,9±10,2 | 73,5±11,8 | <0,001 |
| Длительность СН, годы | 2 (1;5) | 2 (0,5;5) | 0,327 |
| Койко-день, дни | 8 (7;9) | 8 (7;10) | 0,318 |
| ФК СН по NYHA, n (%) | |||
| II | 64 (38,1) | 127 (31,9) | 72 (42,9) |
| III | 72 (42,9) | 187 (47,0) | |
| IV | 32(19,0) | 84 (21,1) | |
| ФВ ЛЖ, % | 48 (38;56) | 45 (35;55) | 0,028 |
| Сохраненная ФВ ЛЖ, n (%) | 75 (44,6) | 140 (35,2) | 0,030 |
| Артериальная гипертония, n (%) | 160 (95,2) | 358 (89,9) | 0,041 |
| ИБС, n (%) | 80 (47,6) | 209 (52,5) | 0,245 |
| Фибрилляция предсердий, n (%) | 105 (62,4) | 263 (66,0) | 0,470 |
| Периф. атеросклероз, n (%) | 27 (16,1) | 52 (13,1) | 0,327 |
| Сахарный диабет 2 типа, n (%) | 72 (42,9) | 112 (28,1) | <0,001 |
| Ожирение, n (%) | 142 (84,5) | 181 (45,5) | <0,001 |
| ХОБЛ/БА, n (%) | 42 (25,0) | 60 (15,1) | 0,004 |
| Хрон. болезнь почек, n (%) | 75 (44,6) | 221 (55,5) | 0,027 |
| Хроническая анемия, n (%) | 24 (14,3) | 81 (20,3) | 0,098 |
| Курение, n (%) | 38 (22,6) | 83 (20,8) | 0,166 |
| Шкала Чарлсон, баллы | 6,0 (4,0;7,0) | 6,0 (4,0;8,0) | 0,113 |
| САД, мм рт. ст. | 136 (121;153) | 123 (108;140) | <0,001 |
| ДАД, мм рт. ст. | 75 (67;83) | 70 (63;79) | 0,012 |
| NT-proBNP пг/мл | |||
| при поступлении | 1070 (268;2127) | 1850 (798;3515) | <0,001 |
| при выписке | 808 (158;1574) | 1685 (628;2733) | <0,001 |
Медиана содержания NT-proBNP в группе пациентов с НАЖБП была значительно ниже, чем в группе сравнения как при поступлении [1070 (268;2127) пг/мл и 1850 (798;3515) пг/мл, соответственно, р<0,001], так и при выписке из стационара [808 (158;1574) пг/мл и 1685 (628;2733) пг/мл, р<0,001]. Кроме того, содержание NT-proBNP при поступлении и выписке зависело от выраженности стеатоза печени. У пациентов с выраженным стеатозом (S3) оно было достоверно ниже, чем с умеренным стеатозом (S1, S2) и без стеатоза (S0) (табл. 3).
| Показатель | S0 | S1, S2 | S3 | p |
|---|---|---|---|---|
| NT-proBNP | ||||
| поступление | 1850 | 1246 | 926 | <0,001 |
| (798;3515) | (298;2000) | (256;1870) | ||
| выписка | 1685 | 1077 | 480 | <0,001 |
| (628;2733) | (250;1649) | (107;1406) | ||
Во время периода наблюдения (от 3 дней до 2,8 лет; в среднем 1,2 года) конечные точки были зарегистрированы у 327 (57,8%) пациентов. В группе пациентов с НАЖБП общая смертность и смертность от ОДСН были достоверно ниже, чем в группе пациентов без НАЖБП, в то время как разница госпитальной смертности и частоты повторных госпитализаций по поводу ОДСН между группами не достигла статистической значимости (табл. 4). Кривые выживаемости (Каплана–Майера) в завимости от наличия НАЖБП представлены на рис. 1.
| Показатели | НАЖБПБ (n=168) |
Без НАЖБП (n=398) |
ОШ (95% ДИ), p |
|---|---|---|---|
| Госпитальная смертность |
5 (3,0) | 24 (6,7) | 2,14 (0,82-5,58), р=0,090 |
| Cмертность от любых причин |
34 (20,2) | 117 (29,4) | 1,58 (1,08-2,31), р=0,019 |
| Смертность от ОДСН |
7 (4,2) | 41 (10,3) | 2,66 (1,19-5,93), р=0,017 |
| Повторная госпитализация |
48 (28,6) | 128 (32,2) | 1,32 (0,94-1,85), р=0,093 |
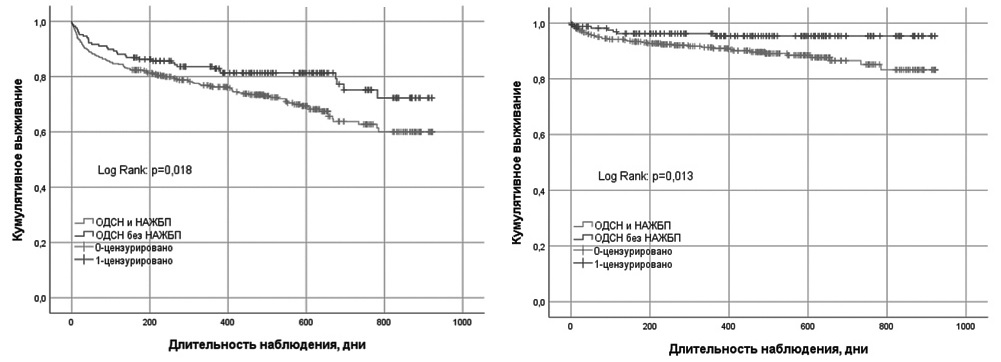
По данным ROC-анализа, пороговое значение уровня NT-proBNP при выписке, позволявшее прогнозировать смерть от любых причин, составило >1593 пг/мл у пациентов с НАЖБП (чувствительность 62,5; специфичность 68,1; р=0,025; AUC 0,634; индекс Юдена 0,3057) и >2332 пг/мл у пациентов без НАЖБП (чувствительность 88,0; специфичность 45,5; р=0,001; AUC 0,652; индекс Юдена 0,3057). Кривые Каплана–Мейера кумулятивной вероятности выживания (общая смертность) у пациентов с НАЖБП, у которых содержание NTproBNP было выше или ниже указанного порогового значения (1593 нг/мл), представлены на рис. 2.
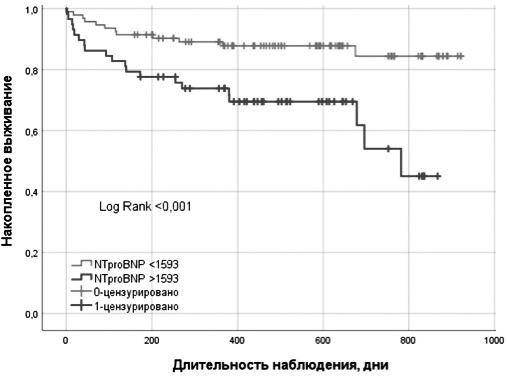
По данным одногофакторного регрессионного анализа Кокса, наиболее значимыми факторами риска смерти от любых причин у пациентов с НАЖБП были увеличение содержания NTproBNP при выписке >1593 пг/мл и снижение ФВ ЛЖ<40% (табл. 5). Независимое прогностическое значение этих факторов было подтверждено в многофакторной модели, в которую включали переменные, увеличивающие риск наступления неблагоприятного исхода по данным однофакторного анализа и литературы (возраст, ИМТ, ФВ ЛЖ, III-IV функциональный класс СН, индекс Чарлсона, NTproBNP>1593 нг/мл, ФВ ЛЖ<40). Отношение шансов смерти (ОШ) от любых причин для содержания NTproBNP при выписке>1593 пг/мл составило 3,06 (95% ДИ 1,42–6,58; р=0,004), для ФВ ЛЖ<40% – 3,89 (95% ДИ 1,71–8,21; р=0,001).
| Однофакторный анализ | Многофакторный анализ | |||||
|---|---|---|---|---|---|---|
| ОШ | 95% ДИ | р | ОШ | 95% ДИ | р | |
| Примечание: многофакторный анализ проводили с поправкой на пол, возраст, ИМТ, ФК СН (III–IV), баллы ШОКС, индекса Чарлсона | ||||||
| Возраст | 1,01 | 0,98-1,05 | 0,323 | 1,92 | 0,59-6,20 | 0,275 |
| Артериальная гипертония | 0,57 | 0,17-1,90 | 0,366 | 0,34 | 0,95-1,25 | 0,105 |
| Индекс Чарлсона | 1,15 | 0,99-1,33 | 0,901 | 1,81 | 0,65-5,03 | 0,253 |
| ШОКС, баллы | 1,08 | 0,93-1,25 | 0,075 | 1,50 | 0,68-3,31 | 0,311 |
| ФК СН (III–IV) NYHA | 1,26 | 0,84-1,89 | 0,255 | 0,32 | 0,09-1,08 | 0,057 |
| NT-proBNP >1593 пг/мл | 3,14 | 1,52-6,43 | 0,002 | 3,06 | 1,42-6,58 | 0,004 |
| ФВ ЛЖ <40% | 2,90 | 2,90 | 0,002 | 3,89 | 1,71-8,21 | 0,001 |
Обсуждение
Предыдущие клинические исследования показали, что НАЖБП ассоциирована с изменениями энергетического метаболизма миокарда, развитием субклинического ремоделирования, систолической и диастолической дисфункцией миокарда на ранних стадиях заболевания, независимо от установленных факторов риска СН, что позволяет предположить, что НАЖБП может быть независимым фактором риска развития и прогрессирования СН [15-17,19]. Диастолическая дисфункция ЛЖ является сильным предиктором сердечно-сосудистых заболеваний, в частности СНсФВ [20]. В последнее время накапливается все больше данных, свидетельствующих о том, что НАЖБП играет важную роль в патогенезе СНсФВ [21,22].
В нашем исследовании частота НАЖБП у пациентов с СНсФВ была выше (42%), чем у пациентов с СНнФВ (25%). Полученные нами данные согласуются с результатами недавнего проспективного исследования, которое показало, что распространенность НАЖБП среди амбулаторных пациентов с СНсФВ достигает 50% и превышает таковую в общей популяции [23]. В другом ретроспективном исследовании было выявлено увеличение риска развития СН у пациентов с НАЖБП, причем риск СНсФВ был выше такового СНнФВ [24].
В литературе мы не нашли исследования, в которых изучались уровни NT-proBNP у пациентов с ОДСН и НАЖБП. Таким образом, мы впервые показали связь между выраженностью стеатоза печени и содержанием NT-proBNP у таких пациентов. В нескольких публикациях сообщалось о существовании обратной взаимосвязи между уровнем NT-proBNP и наличием НАЖБП. В исследовании MESA у 4529 участников, не страдавших сердечно-сосудистыми заболеваниями, более низкие уровни NT-proBNP были связаны с большей распространенностью НАЖБП [9]. В другом исследовании у 351 пациента с подтвержденной при биопсии НАЖБП, у которых отсутствовали сердечно-сосудистые заболевания в анамнезе, низкие уровни NT-proBNP тесно ассоциировались с более высокой распространенностью неалкогольного стеатогепатита [10]. А. Metwaly и соавт. выявили тенденцию к снижению содержания NTproBNP у больных НАЖБП и его достоверное повышение у пациентов с циррозом печени после перенесенного вирусного гепатита С [11]. У пациентов с сахарным диабетом 2 типа и НАЖБП снижение уровня NT-proBNP в плазме крови независимо ассоциировалось с высоким содержанием жира в печени, которое измеряли с помощью магнитно-резонансной спектроскопии [12].
Во многих исследованиях жировая дистрофия печени рассматривается как проявление висцерального ожирения [25,26]. Во Фрамингемском исследовании была выявлена обратная связь между уровнями NTproBNP в плазме и накоплением внутрибрюшного висцерального жира даже после поправки на ИМТ, в то время как связь уровней NT-proBNP с содержанием подкожного жира отсутствовала [27]. В другом исследовании показана значимая связь между более высокими уровнями NT-proBNP и меньшим количеством внутрипеченочного жира, измеренного с помощью магнитнорезонансной спектроскопии [25]. У 608 пациентов с сахарным диабетом 2 типа была продемонстрирована обратная корреляция между содержанием BNP и ИМТ, причем связь между BNP и массой висцерального жира была более сильной по сравнению с другими показателями ожирения [28]. Более высокие уровни натрийуретических пептидов независимо ассоциировались с "благоприятным" профилем ожирения, характеризующимся меньшим количеством висцерального жира и жира в печени и более высоким содержанием жира в нижней части тела [29].
Снижение уровня NT-proBNP при наличии НАЖБП может быть связано с увеличением резистентности печеночных синусоидов, которое приводит к снижению преднагрузки сердца и, следовательно, внутрисердечного давления наполнения [30]. По мере прогрессирования НАЖБП увеличивается чреспеченочная обструкция кровотока, вызванная повышенным сопротивлением в синусоидальной области, что приводит к дальнейшему снижению содержания NT-proBNP [31].
Также было показано, что метаболический синдром связан со снижением содержания натрийуретических пептидов (ANP, BNP и CNP) и измененной экспрессией их рецепторов (NPR-A, NPR-B и NPR-C) [32]. Натрийуретические пептиды выводятся из кровообращения с помощью натрийуретического пептидного рецептора-С (NPR-C) [33]. Рецепторы натрийуретического пептида обнаружены в жировой ткани, сердечной и скелетных мышцах, почках и печени. Увеличение уровня инсулина в организме вызывает снижение экспрессии NPR-A и NPR-B в жировой ткани и увеличивает экспрессию NPR-C, тогда как голодание дает противоположный эффект [34]. Таким образом, повышение уровня инсулина приводит к уменьшению содержания натрийуретических пептидов за счет увеличения их клиренса. При этом снижается способность натрий уретических пептидов оказывать клеточное действие из-за уменьшения количества рецепторов NPR-A и NPR-B [35].
Уровень BNP оставался важным прогностическим фактором позволявшим предсказать ухудшение симптомов СН, нарастание гемодинамических нарушений и повышенную смертность независимо от уровня ИМТ несмотря на его более низкие значения в исследовании у 316 пациентов с ожирением и СН [36]. В нашем исследовании в многофакторной регрессионной модели повышение содержания NT-proBNP >1593 пг/мл при выписке у пациентов с ОДСН и НАЖБП также ассоциировалось с повышенным риском смертии.
Заключение
Группа пациентов с ОДСН и НАЖБП характеризовалась более высокими значениями ФВ ЛЖ и более низким содержанием NT-proBNP, которое обратно коррелировало со степенью стеатоза, что может затруднять своевременную диагностику СН и назначение адекватной терапии. При этом увеличение содержания NT-proBNP выше порогового значения и низкая ФВ ЛЖ были связаны примерно с трехкратным увеличением риска смерти пациентов с НАЖБП после выписки из стационара.
Используемые источники
- Кобалава Ж.Д., Сафарова А.Ф., Соловьева А.E. и др. Легочный застой по данным ультразвукового исследования у пациентов с декомпенсацией сердечной недостаточности. Кардиология 2019;59(8):5-14 [Kobalava ZhD, Safarova AF, Soloveva AE, et al. Pulmonary congestion by lung ultrasound in decompensated heart failure: associations, in-hospital changes, prognostic value. Kardiologiia 2019;59(8):5-14 (In Russ.)].
- Кобалава Ж.Д., Толкачева В.В., Сарлыков Б.К. и др. Интегральная оценка застоя у пациентов с острой декомпенсацией хронической сердечной недостаточности. Российский кардиологический журнал 2022;27(2):4799 [Kobalava ZhD, Tolkacheva VV, Sarlykov BK, et al. Integral assessment of congestion in patients with acute decompensated heart failure. Russian Journal of Cardiology 2022;27(2):4799 (In Russ.)].
- Rubio-Gracia J, Demissei BG, ter Maaten JM, et al. Prevalence, predictors, and clinical outcome of residual congestion in acute decompensated heart failure. Int J Cardiol 2018;258:185-91.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42(36):3599-726.
- Richards AM. The relationship of plasma NT-proBNP to age and outcomes in heart failure. JACC Heart Fail 2016;4(9):746-8.
- Suthahar N, Meems LMG, Ho JE, de Boer RA. Sex-related differences in contemporary biomarkers for heart failure: a review. Eur J Heart Fail 2020;22:775-88.
- Bajaj NS, GutiОrrez OM, Arora G, et al. Racial differences in plasma levels of Nterminal pro-B-type natriuretic peptide and outcomes: The Reasons for Geographic and Racial Differences in Stroke (REGARDS) Study. JAMA Cardiol 2018;3(1):11-7.
- Goetze JP, Bruneau BG, Ramos HR, et al. Cardiac natriuretic peptides. Nat Rev Cardiol 2020;17(11):698-717.
- Sanchez OA, Lazo-Elizondo M, Zeb I, et al. Computerized tomography measured liver fat is associated with low levels of N-terminal pro-brain natriuretic protein (NT-proBNP). Multi-Ethnic Study of Atherosclerosis. Metabolism 2016;65(5):728-35.
- Qiao ZP, Zheng KI, Zhu PW, et al. Lower levels of plasma NT-proBNP are associated with higher prevalence of NASH in patients with biopsy-proven NAFLD. Nutr Metab Cardiovasc Di. 2020;30(10):1820-5.
- Metwaly A, Khalik AA, Nasr FM, et al. Brain natriuretic peptide in liver cirrhosis and fatty liver: correlation with cardiac performance. Electron Physician 2016;8(2):1984-93.
- Johansen ML, Schou M, Rasmussen J, et al. Low N-terminal pro-brain natriuretic peptide levels are associated with non-alcoholic fatty liver disease in patients with type 2 diabetes. Diabetes Metab 2019;45(5):429-35.
- Younossi Z, Anstee QM, Marietti M, et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol 2018;15(1):11-20.
- Лазебник Л.Б., Голованова Е.В., Туркина С.В. и др. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология 2021;185(1):4–52 [Lazebnik LB, Golovanova EV, Turkina SV, et al. Non-alcoholic fatty liver disease in adults: clinic, diagnostics, treatment. Guidelines for therapists, third version. Experimental and Clinical Gastroenterology 2021;1(1):4-52 (In Russ.)].
- Chiu LS, Pedley A, Massaro JM, et al. The association of non-alcoholic fatty liver disease and cardiac structure and function - Framingham Heart Study. Liver Int 2020;40(10):2445-54.
- Lee YH, Kim KJ, Yoo ME, et al. Association of non-alcoholic steatohepatitis with subclinical myocardial dysfunction in non-cirrhotic patients. J Hepatol 2018;68(4):764-72.
- Simon TG, Bamira DG, Chung RT, et al. Nonalcoholic steatohepatitis is associated with cardiac remodeling and dysfunction. Obesity (Silver Spring) 2017;25:1313–6.
- Petroff D, Blank V, Newsome PN, et al. Assessment of hepatic steatosis by controlled attenuation parameter using the M and XL probes: an individual patient data meta-analysis. Lancet Gastroenterol Hepatol 2021;6(3):185-98.
- VanWagner LB, Wilcox JE, Colangelo LA, et al. Association of nonalcoholic fatty liver disease with subclinical myocardial remodeling and dysfunction: A population-based study. Hepatology. 2015;62(3):773-783.
- Obokata M, Reddy YNV, Borlaug BA. Diastolic dysfunction and heart failure with preserved ejection fraction: understanding mechanisms by using noninvasive methods. JACC Cardiovasc Imaging 2020;13(1 Pt 2):245-57.
- Wang A, Li Z, Sun Z, et al. Heart failure with preserved ejection fraction and non-alcoholic fatty liver disease: new insights from bioinformatics. ESC Heart Fail 2023;10(1):416-31.
- Itier R, Guillaume M, Ricci JE, et al. Non-alcoholic fatty liver disease and heart failure with preserved ejection fraction: from pathophysiology to practical issues. ESC Heart Fail 2021;8(2):789-98.
- Miller A, McNamara J, Hummel SL, et al. Prevalence and staging of non-alcoholic fatty liver disease among patients with heart failure with preserved ejection fraction. Sci Rep 2020;10(1):12440.
- Fudim M, Zhong L, Patel KV, et al. Nonalcoholic fatty liver disease and risk of heart failure among Medicare beneficiaries. J Am Heart Assoc 2021;10(22):e021654.
- Westerbacka J, Corner A, Tiikkainen M, et al. Women and men have similar amounts of liver and intra-abdominal fat, despite more subcutaneous fat in women: implications for sex differences in markers of cardiovascular risk. Diabetologia 2004;47:1360–9.
- Pietilainen KH, Rissanen A, Kaprio J, et al. Acquired obesity is associated with increased liver fat, intra-abdominal fat, and insulin resistance in young adult monozygotic twins. Am J Physiol Endocrinol Metab 2005;288:768–74.
- Cheng S, Fox CS, Larson MG, et al. Relation of visceral adiposity to circulating natriuretic peptides in ambulatory individuals. Am J Cardiol 2011;108(7):979-84.
- Sugisawa T, Kishimoto I, Kokubo Y, et al. Visceral fat is negatively associated with B-type natriuretic peptide levels in patients with advanced type 2 diabetes. Diabetes Res Clin Pract 2010;89:174–80.
- Neeland IJ, Winders BR, Ayers CR, et al. Higher Natriuretic peptide levels associate with a favorable adipose tissue distribution profile. J Am Coll Cardiol 2013;62:752–60.
- Salah HM, Pandey A, Soloveva A, et al. Relationship of nonalcoholic fatty liver disease and heart failure with preserved ejection fraction. JACC Basic Transl Sci 2021;6(11):918-32.
- Hirooka M, Koizumi Y, Miyake T, et al. Nonalcoholic fatty liver disease: portal hypertension due to outflow block in patients without cirrhosis. Radiology 2015;274(2):597-604.
- Moro C, Lafontan M. Natriuretic peptides and cGMP signaling control of energy homeostasis. Am J Physiol Heart Circ Physiol 2013;304:358-68.
- Mangiafico S, Costello-Boerrigter LC, Andersen IA, et al. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics. Eur Heart J 2013;34:886–93.
- Nakatsuji H, Maeda N, Hibuse T, et al. Reciprocal regulation of natriuretic peptide receptors by insulin in adipose cells. Biochem Biophys Res Commun 2010;392:100–5.
- Gentili A, Frangione MR, Albini E, et al. Modulation of natriuretic peptide receptors in human adipose tissue: Molecular mechanisms behind the “natriuretic handicap” in morbidly obese patients. Transl Res 2017;186:52–61.
- Horwich MD, Hamilton MD, Fonarow GC. B-Type natriuretic peptide levels in obese patients with advanced heart failure. J Am Coll Cardiol 2006; 47:85–90.
