Эффективность применения левилимаба на амбулаторном этапе для снижения тяжести COVID-19 и профилактики госпитализаций
Оценка эффективности амбулаторного применения левилимаба у пациентов с COVID19 для снижения риска тяжелого течения заболевания и госпитализации.
В исследовании приняли участие 120 пациентов с COVID-19, получавших стандартную терапию. В исследуемую группу больных, получивших 2 инъекции левилимаба, были включены 47 мужчин и 29 женщин (средний возраст 46,7 года), контрольную группу составили 21 мужчина и 23 женщины (средний возраст 46,3±2 года), не получавшие ингибитор рецепторов интерлейкина-6 (ИЛ-6).
В основной группе была отмечена более быстрая динамика температуры тела, насыщения крови кислородом, объема поражения легких при компьютерной томографии и лабораторных показателей активности воспаления, в том числе содержания С-реактивного белка (СРБ) и фибриногена. Факторами риска госпитализации были артериальная гипертония (отношение рисков [ОР] 1,49; 95% доверительный интервал [ДИ] 0,8-2,8; p=0,123); индекс массы тела (ИМТ) более 30 кг/м2 (1,96; 1,52-3,2; p=0,007) и распространенность поражения легких 25-50% (8,37; 2,37-29,3; p=0,0009). В группе левилимаба частота госпитализаций была достоверно ниже, чем в контрольной группе (17,1% и 36,4%, соответственно; ОР 0,47; 95% ДИ 0,25-0,88; p=0,019), в том числе среди пациентов с факторами риска более тяжелого течения COVID-19 (23,8% и 50,0%; ОР 0,47; 95% ДИ 0,24-0,94; p=0,033).
Применение левилимаба в амбулаторных условиях у пациентов с COVID19 способствует снижению тяжести заболевания и риска госпитализации.
Левилимаб (Илсира®, АО "БИОКАД", Россия) – это отечественный ингибитор как растворимых, так и мембранных рецепторов интерлейкина (ИЛ)-6, который разрешен к медицинскому применению при COVID-19. Молекула левилимаба содержит вариабельные фрагменты легких и тяжелых цепей и константные домены с полностью человеческой последовательностью.
К настоящему времени накоплены данные о пользе противовоспалительной иммуномодулирующей терапии препаратами моноклональных антител к ИЛ-6 и его рецепторам у пациентов с тяжелым течением COVID-19. Наиболее крупными исследованиями, в которых проводилась оценка эффективности и безопасности тоцилизумаба при COVID-19, были RECOVERY (n = 4116) и REMAP-CAP (n = 803) [1,2]. В исследовании RECOVERY пациенты с COVID-19 и дыхательной недостаточностью различной степени тяжести (от кислородотерапии до механической вентиляции легких, что соответствует 5-9 категории по классификации ВОЗ) при наличии признаков воспаления (содержание С-реактивного белка более 75 мг/л) были рандомизированы на группы тоцилизумаба 400-800 мг/сут внутривенно и стандартной терапии. Показатель 28-дневной летальности составил 31% в группе тоцилизумаба и 35% в группе стандартной терапии (p=0,0028). Статистические значимые различия данного показателя сохранялись в различных подгруппах пациентов, в частности получавших терапию системными глюкокортикостероидами. В подгруппе пациентов, которым не требовалось проведение механической вентиляции легких на момент включения в исследование, назначение тоцилизумаба привело к статистически значимому снижению частоты достижения комбинированной конечной точки, включавшей в себя смерть или необходимость в интубации. Ингибиторы рецепторов ИЛ-6 (тоцилизумаб, сарилумаб и левилимаб) и ИЛ-6 (олокизумаб) широко используются у пациентов с COVID-19 для патогенетической терапии "цитокинового шторма", который лежит в основе тяжелого течения заболевания.
У пациентов с COVID-19 тяжелого течения не было выявлено достоверной разницы в эффективности тоцилизумаба, левилимаба и олокизумаба [3]. В многоцентровом открытом обсервационном клиническом исследовании было показано, что включение левилимаба в стандартную схему терапии у больных с тяжелым течением COVID-19 оказывает значимое противовоспалительное действие и снижает вероятность прогрессирования поражения легочной ткани. При этом левилимаб и другие ингибиторы ИЛ-6 не влияют на эффективность противовирусного ответа и клиренс SARS-CoV-2 и не повышают риск более тяжелого течения инфекционного процесса [4].
Применение ингибиторов ИЛ-6, в том числе левилимаба, предусмотрено во временных методических рекомендациях по профилактике, диагностике и лечению новой коронаровирусной инфекции, однако эффективность их раннего применения не изучена.
Целью исследования была оценка эффективности амбулаторного применения левилимаба у пациентов с COVID-19 для снижения риска тяжелого течения заболевания и госпитализации.
Материалы и методы
В открытое проспективное исследование, проводившееся в одном центре, включали амбулаторных пациентов в возрасте от 18 до 65 лет с COVID-19 легкой или средней степени тяжести, подтвержденным методом полимеразной цепной реакции. Исследование проводилось с ноября 2021 года по февраль 2022 года. Критериями невключения были противопоказания к введению левилимаба, другие клинически значимые активные инфекции, беременность и период грудного вскармливания.
Все пациенты подписали информированное согласие на участие в исследовании, которое проводилось в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации "Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей" (1964 г., с последующими дополнениями) и отраженных в ГОСТ Р 52379-2005 "Надлежащая клиническая практика", правилами IСН GСР и действующими нормативными требованиями.
Все пациенты получали стандартную терапию согласно временным методическим рекомендациям "Профилак тика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (07.05.2021)", действовавшим на момент проведения исследования [5]. Пациентам основной группы вводили подкожно левилимаб в дозе 162,0 мг в день включения в исследование и на 7-й день наблюдения. Распределение пациентов на исследуемую (левилимаб + стандартная терапия) и контрольную (только стандартная терапия) группу проводилось методом "конвертов".
Всем пациентам проводили медицинский осмотр, измерение температуры тела и степени насыщения крови кислородом (SpO2), компьютерную томографию легких (КТ), общий анализ крови, определение уровня C-реактивного белка (СРБ), ферритина (ФР), фибриногена, D-димера, ИЛ-6 и проадреномедуллина в крови (про-АДМ). Кон центрацию про-АДМ измеряли методом иммуноферментного анализа с помощью коммерческого набора Human MR pro-ADM ELISA Kit (FineTest, Китай).
Клиническое наблюдение осуществлялось ежедневно дистанционно. Больные ежедневно в одно и то же время утром проводили термометрию, оценивали по предлагаемым опросникам выраженность кашля, слабости и давали общую оценку своему состоянию. Осмотр больных с регистрацией температуры тела медицинским персоналом и пульсоксиметрией проводили на 7-й день, а повторные лабораторные исследования – на 14-й день от начала лечения.
Конечной точкой исследования была госпитализация пациента в случае ухудшения тяжести течения заболевания. В случае госпитализации наблюдение за пациентом прекращали.
Статистическая обработка результатов проводилась с использованием программы Medcalс®, версия 19.8. Для проверки гипотезы о нормальности распределения использовали критерий Колмогорова-Смирнова. При нормальном распределении результаты представляли в виде среднего значения (М) и среднего квадратичного отклонения (s). При наличии нормального распределения использовали критерий Стьюдента (t) или парный критерий (t) для парных выборок. При отсутствии нормального распределения использовали U тест Манна—Уитни и для парных выборок. Достоверность разницы по распределению качественных признаков в группах оценивали по критерию χ2. Для оценки риска конечных точек проводили однофакторный регрессионный анализ.
Результаты
В исследование были включены 120 пациентов с подтвержденным COVID-19, которые были распределены на две группы: основную – 76 пациентов (47 мужчин, средний возраст 46,7 лет), которые получали левилимаб на фоне стандартной терапии, и контрольную – 44 пациента (21 мужчина, средний возраст 46,3 лет), которым проводили только стандартную терапию. По возрасту, половому составу, частоте сопутствующих заболеваний, которые могут способствовать более тяжелому течению COVID-19, распространенности поражения легких по данным КТ, длительности заболевания пациенты двух групп статистически значимо не отличались (табл. 1). Также не было обнаружено значимых отличий в стандартной фармакотерапии. Как в основной, так и в контрольной группе пациенты получали противовоспалительную терапию (нестероидные противовоспалительные препараты, парацетамол), противовирусные средства (фавипиравир, триазаверин), антикоагулянты (ривароксабан, апиксабан) и антибиотики (табл. 1).
| Показатели | Основная группа (n=76) |
Контрольная группа (n=44) |
|---|---|---|
| Средний возраст, лет | 46,7±10,8 | 46,3±11,2 |
| Мужчины, n (%) | 47 (61,8) | 21 (47,7) |
| Дни от появления первых симптомов заболевания |
6,4±2,0 | 6,4±2,9 |
| Сопутствующие заболевания, n (%) | ||
| Артериальная гипертония | 18 (23,7) | 10 (22,7) |
| Сахарный диабет | 2 (2,6) | 0 |
| Ожирение (ИМТ >30 кг/м2) | 22 (28,9) | 16 (36,4) |
| Инфаркт миокарда в анамнезе | 2 (2,6) | 2 (4,5) |
| Стабильная стенокардия | 2 (2,6) | 2 (4,5) |
| Инсульт в анамнезе | 3 (3,9) | 3 (6,8) |
| Курение, n (%) | 8 (10,5) | 2 (4,5) |
| КТ легких, n (%) | ||
| Без изменений | 4 (5,3) | 1 (2,3) |
| КТ 1 (от 0 до 25%) | 65 (85,5) | 39 (88,6) |
| КТ 2 (от 25 до 50%) | 7 (9,2) | 4 (9,1) |
| Стандартная терапия, n (%) | ||
| Парацетамол | 21 (27,6) | 11 (25,0) |
| НПВП | 55 (72,4) | 33 (75,0) |
| Противовирусные препараты | ||
| Фавипиравир | 56 (73,7) | 32 (72,7) |
| Триазаверин | 20 (26,3) | 12 (27,3) |
| Антикоагулянты | ||
| Ривароксабан 10 мг | 61 (80,3) | 38 (86,4) |
| Апиксабан 2,5 мг | 11 (14,5) | 6 (13,6) |
| Не принимали | 4 (5,2) | 0 |
| Антибиотики | ||
| Ко-амоксициллин 875/125 мг | 25 (32,9) | 20 (45,5) |
| Азитромицин 250 мг/сут | 13 (17,1) | 4 (9,1) |
| Левофлоксацин 500 мг/сут | 34 (44,7) | 16 (36,4) |
| Не принимали | 4 (5,3) | 4 (9,1) |
| Вакцинация от COVID-19, n (%) | 28 (36,8) | 10 (22,7) |
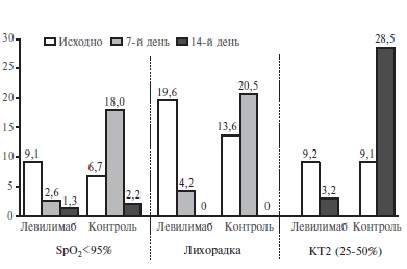
До начала исследования не выявлено статистически значимых различий между основной и контрольной группами по частоте лихорадки (>38,0оС), снижения SpO2 <95% и распространенности поражения легких по данным КТ (рис. 1). На 7-й день после включения в исследование частота лихорадки в основной группе (без учета госпитализированных больных, которые выбывали из исследования) была достоверно ниже, чем в контрольной (3,9% и 20,5%, соответственно; р<0,05), а на 14-й день температура тела у всех пациентов, остававшихся под наблюдением, нормализовалось. На 7-й день доля пациентов с SpO2 <95% в основной группе группе также была достоверно ниже, чем в контрольной (2,6% и 18,0%; р<0,05), а через 14 дней частота гипоксемии достоверно не отличалась между группами. В течение 14 дней доля пациентов с распространенностью поражения легких, соответствовавшей КТ2, в основной группе уменьшилась с 9,2% до 3,2%, а в контрольной группе увеличилась с 9,1 до 28,5% (p<0,05).
При анализе лабораторных показателей в начале исследования не было обнаружено существенных различий между основной и контрольной группами (табл. 2). На 14-й день наблюдения в обеих группах пациентов наблюдалось статистически значимое увеличение количества лейкоцитов, которое было значительно выше в контрольной группе. Кроме того, в контрольной группе наблюдалось увеличение количества нейтрофилов, в то время как в исследуемой группе оно снизилось и на 14-й день было статистически значимо ниже, чем у пациентов, не получавших левилимаб. В обеих группах наблюдалось статистически значимое повышение количества эозинофилов и лимфоцитов, которое на 14-й день было сопоставимым в двух группах.
| Основная группа | Контрольная группа | р для разницы между группами | ||||
|---|---|---|---|---|---|---|
| Исходно (n=76) | 14-й день (n=63) | Исходно (n=44) | 14-й день (n=28) | Исходно | 14-й день | |
| Примечание: * достоверность разницы в группе между исходным показателем и показателем на 14-й день (р<0,05). 1критерий t Стьюдента, 2парный критерий t Стьюдента, 3критерий Манна-Уитни, 4критерий Уилкоксона | ||||||
| Гемоглобин, г/л | 149,1±13,7 | 148,8±14,9 | 147,5±12,5 | 142,1±13,8*2 | 0,525 | 0,046 |
| Интерлейкин-6, пг/мл | 23,7±20,7 | 30,1±18,1 | 27,6±28,8 | 7,8±10,4*4 | 0,143 | <0,0001 |
| Лейкоциты, 109/л | 5,1±1,7 | 5,8±1,6*2 | 5,8±2,4 | 7,1±2,8*2 | 0,082 | 0,008 |
| Нейтрофилы, 109/л | 3,3±1,4 | 2,9±1,5 | 3,8±2,1 | 4,1±2,3 | 0,154 | 0,007 |
| Эозинофилы, 109/л | 0,1±0,2 | 0,2±0,1*4 | 0,1±0,1 | 0,2±0,1*4 | 0,421 | 0,387 |
| Лимфоциты, 109/л | 1,4±0,5 | 2,0±0,6*2 | 1,4±0,6 | 2,0±0,6*2 | 0,525 | 0,562 |
| Моноциты, 109/л | 0,4±0,2 | 0,5±0,5 | 0,6±1,0 | 0,7±0,9 | 0,151 | 0,112 |
| Тромбоциты, 109/л | 188,8±57,4 | 281,4±90,8*2 | 202,2±59,2 | 326,7±93,6*2 | 0,225 | 0,032 |
| СОЭ, мм/ч | 28,5±20,9 | 14,7 ±14,3*2 | 30,0 ±17,8 | 36,8±28,8 | 0,541 | <0,0001 |
| Д-димер, FEU/мл | 0,47±0,20 | 0,51±0,32 | 0,57±0,50 | 0,51±0,49 | 0,127 | 0,957 |
| Фибриноген, г/л | 4,48±1,00 | 2,87±0,74*2 | 4,70±0,90 | 4,57±1,47 | 0,231 | <0,0001 |
| СРБ, мг/л | 26,2±28,5 | 1,8±3,0*4 | 31,5±37,0 | 16,2±28,0*4 | 0,363 | <0,0001 |
| Ферритин, мкг/л | 357,8±285,6 | 342,5±236,5 | 379,7±330,3 | 357,6±363,4 | 0,732 | 0,791 |
| про-АДМ, нмоль/л | 0,55±0,33 | 0,54±0,26 | 0,53±0,27 | 0,57±0,22 | 0,332 | 0,571 |
Снижение содержания СРБ в течение 14 дней в исследуемой группе было более выраженным (с 26,2 до 1,8 мг/л), чем в контрольной (с 31,5 до 16,2 мг/л). Через 14 дней уровень СРБ в группе левивимаба был статистически значимо ниже, чем в контрольной группе. Аналогичная динамика выявлена и при анализе содержания фибриногена в двух группах. Уровень ИЛ-6 у больных контрольной группы статистически значимо снизился, а в группе левимимаба не изменился. Содержание ферритина и про-АДМ не изменилось в обеих группах.
За время наблюдения из-под наблюдения выбыли в связи с госпитализацией 29 (24%) больных. Причинами госпитализации были сохраняющаяся лихорадка (>38,0оС) к 7-му дню заболевания у 12 (41,2%) пациентов, снижение SpO2<95% у 10 (34,5%), увеличение распространенности поражения легких по данным КТ у 6 (21,3%), желудочно-кишечное кровотечение у 1 (3,5%). Факторами риска госпитализации служили артериальная гипертония (ОР 1,49; 95% ДИ 0,8-2,8; p=0,123), индекс массы тела (ИМТ) более 30 кг/м2 (1,96; 1,52-3,2; p=0,007) и распространенность поражения легких 2550% на момент включения в исследование (8,37; 2,3729,3; p=0,0009). Хотя бы один фактор риска из перечисленных выше имелся у 64 из 120 пациентов. Среди пациентов с факторами риска были госпитализированы 21 (32,8%) из 64, а среди пациентов без факторов риска – 8 (14,3%) из 56. Относительный риск (ОР) госпитализации при наличии хотя бы одного фактора риска составил 2,26 (95% ДИ 1,08-4,68; р=0,03).
В основной и контрольной группах были госпитализированы 13 (17,1%) из 76 пациентов и 16 (36,4%) из 44 пациентов (р=0,018). Таким образом, применение левилимаба привело практически к двукратному снижению риска госпитализации (ОР 0,47; 95% ДИ 0,25-0,88; р=0,019). Сходные результаты были получены среди пациентов с факторами риска. Среди них были госпитализированы 10 (23,8%) из 42 пациентов группы левилимаба и 11 (50,0%) из 22 пациентов контрольной группы (ОР 0,47; 05% ДИ 0,24-0,94; р=0,033).
Тенденция к снижению риска госпитализации была также отмечена у 38 пациентов, которые были ранее вакцинированы от COVID-19. Среди вакцинированных были госпитализированы 5 (13,2%) из 38 пациентов, а среди невакцинированных – 24 (29,3%) из 82 пациентов (ОР 0,45; 95% ДИ 0,19-1,10; р=0,076).
Обсуждение
Результаты исследования подтверждают клиническую эффективность левилимаба в лечении пациентов с COVID-19 на амбулаторном этапе. Эти результаты согласуются с данными рандомизированного двойного слепого плацебо-контролируемого исследования CORONA [6]. У пациентов, получавших левилимаб, наблюдался более быстрый регресс симптомов инфекции, таких как повышение температуры тела, снижение степени насыщения крови кислородом и патологические изменения в легких. Важным результатом исследования является снижение снижение частоты тяжелых форм инфекции, требующих госпитализации, при лечении левилимабом на амбулаторном этапе, которое отмечалось также среди пациентов с факторами риска более тяжелого течения COVID-19, такими как ожирение, распространенность поражения легких и артериальная гипертония. Полученные результаты указывают на потенциальное снижение риска госпитализации среди вакцинированных больных.
Заключение
Применение левилимаба на ранней стадии COVID-19 значительно ускоряет регресс симптомов и снижает тяжесть воспалительной реакции и частоту госпитализации, в том числе у пациентов с факторами риска более тяжелого течения заболевания. Полученные результаты указывают на целесообразность раннего введения левилимаба для эффективного лечения COVID19 и предотвращения его тяжелого течения.
Используемые источники
- RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet 2021;397:1637–45.
- REMAP-CAP Investigators; Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with Covid-19. N Engl J Med 2021;384(16):1491-502.
- Бобкова С.С., Жуков А.А., Проценко Д.Н. и др. Сравнительная эффективность и безопасность применения препаратов моноклональных антител к ИЛ-6 у пациентов с новой коронавирусной инфекцией COVID-19 тяжелого течения. Ретроспективное когортное исследование. Вестник интенсивной терапии им. А.И. Салтанова. 2021;1:69–76 [Bobkova SS, Zhukov AA, Protsenko DN, et al. Comparative study of monoclonal anti-IL6 antibodies in severe new coronavirus disease COVID-19 patients. Retrospective cohort study. Annals of Critical Care 2021;1:69–76 (In Russ.)].
- Zhou Z, Price CC. Overview on the use of IL-6 agents in the treatment of patients with cytokine release syndrome (CRS) and pneumonitis related to COVID-19 disease. Expert Opin Investig Drugs 2020;29(12):1407-12.
- Минздрав России. Временные методические рекомендации “Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (07.05.2021)”.
- Lomakin NV, Bakirov BA, Protsenko DN, et al. The efficacy and safety of levilimab in severely ill COVID-19 patients not requiring mechanical ventilation: results of a multicenter randomized double-blind placebo-controlled phase III CORONA clinical study. Inflamm Res 2021;70(10-12):1233-46.
