Язвенная болезнь – кто виноват и что делать?
Первые успехи в лечении язвенной болезни (ЯБ), достигнутые при использовании антибиотиков в сочетании с блокаторами протонной помпы, способствовали возникновению гипотезы, что H. pylori является главной причиной ЯБ. Логичным продолжением данной точки зрения казалось предположение, что добившись эрадикации H. pylori, можно ликвидировать ЯБ. Спустя 40 лет после открытия H. pylori стало ясно, что эрадикационная терапия сокращает сроки рубцевания язвы, улучшает качество жизни и позволяет добиться более продолжительной ремиссии, однако не дает оснований надеяться на ликвидацию ЯБ. Тем не менее, в новых рекомендациях Маастрихт VI эрадикация H. pylori по-прежнему провозглашается главной целью терапии H. pylori-ассоциированных заболеваний. Широкое применение антибиотиков в практическом здравоохранении позволило спасти миллионы жизней. В то же время, устойчивость бактерий к существующим антибиотикам вследствие продолжающейся эскалация антибактериальной терапии названа Всемирной организацией здравоохранения одной из главных угроз человечеству в нынешнем веке. С учетом изложенного вопрос об инфекционной концепции патогенеза ЯБ и принципах ее коррекции нуждаются в уточнении.
В течение последних 40 лет развитие язвенной болезни (ЯБ) рассматривают как результат нарушения равновесия между действием факторов "агрессии", способствующих язвообразованию, и факторов "защиты", препятствующих этому процессу в желудке и двенадцатиперстной кишке [1]. Практически без возражений роль ключевого фактора агрессии была присвоена микробу H. pylori [2]. Основанием для быстрого и повсеместного признания данной версии послужил, прежде всего, тот факт, что на фоне использования антибиотиков в комбинации с блокаторами кислотной продукции удалось значительно сократить сроки рубцевания язв с 1,5-2 мес до 2-3 недель. При этом более чем в 90% случаев эпителизация язвы сопровождалось эрадикацией бактерий и продолжительной ремиссией, которая субъективно воспринималась как ликвидация ЯБ. В результате возникла, казавшаяся очень убедительной, версия о том, что, "победив" H. pylori, мы ликвидируем и ЯБ – "нет H. pylori – нет язвы" [3]. Однако к концу ХХ столетия в широкомасштабных исследованиях, проводившихся в разных странах мира, было установлено, что на долю ЯБ, не связанной с инфекцией H. pylori, приходилось 38% дуоденальных язв и 56% язв желудка [4]. В сообщениях первого десятилетия ХХI века отмечалось, что только у 45% пациентов старше 80 лет ЯБ ассоциирована с геликобактерной инфекцией. В возрасте старше 60 лет частота выявления H. pylori-негативной язвы достигала 33–73% всех случаев ЯБ [5]. В связи с изложенным в представление о патогенезе внесено уточнение – "нет H. pylori – нет H. pylori-ассоциированной ЯБ" [6].
С учетом собственных результатов и данных литературы мы пришли к выводу, что выявляемое в динамике снижение соотношения H. pylori-позитивных и H. pylori-негативных вариантов ЯБ убедительно свидетельствует о вторичной роли H. pylori в патогенезе гастродуоденальных язв. Можно предположить, что будучи одним из ведущих модифицируемых факторов риска, возможно даже основным, микроб, все же не является главным. Важным доказательством вторичной роли H. pylori служит эксперимент, выполненный первооткрывателем микроорганизма B. Marshall. Чтобы доказать этиологическую роль H. pylori в развитии ЯБ и хронического гастрита, автор произвел опыт с самозаражением. Он ввел себе в желудок концентрированную суспензию чистой культуры H. pylori (109 микробных тел). Через 7 дней у него развилась типичная клиническая картина острого гастрита, которая в короткие сроки исчезла без каких-либо последствий. Известно, что у добровольцев, вводивших себе в желудок культуру Н. pylori, также ни разу не удалось воспроизвести ЯБ, а это третий неподтвержденный постулат Коха [7]. С учетом изложенного, вопрос об инфекционной концепции патогенеза ЯБ следует признать спорным.
Чтобы понять, в каком альтернативном направлении можно продолжить поиск решения проблемы патогенеза ЯБ, приведем известный факт, установленный академиком В.Х. Василенко задолго до открытия H. pylori – "Язвы заживают при лечении, без лечения и вопреки лечению" [8]. Для подтверждения справедливости данного суждения можно привести общеизвестные факты: наличие наследственной предрасположенности, роль пола пациента, существование спонтанных обострений весной и осенью и ремиссий ЯБ в летние месяцы. Можно предположить, что патогенез ЯБ обусловлен, прежде всего, не внешними модифицируемыми, а внутренними немодифицируемыми причинами. Внешние факторы, к числу которых относится и H. pylori, вероятно, играют роль триггера, запускающего и поддерживающего генетически обусловленную программу. К числу основных немодифицируемых факторов риска также относится и возраст человека. Отмечая роль немодифицируемых факторов, мы столкнулись с проблемой поиска ответа на вопрос, в чем заключается принципиальное отличие ЯБ от симптоматических гастродуоденальных язв?
При анализе возраста 167 пациентов (114 мужчин и 53 женщины; язвы двенадцатиперстной кишки у 102 и желудка у 65), в котором впервые была выявлена язва в желудке или двенадцатиперстной кишке, нами установлено, что кривая распределения имеет два четких пика. Первый приходился на возраст 20-30 лет (65 случаев, 55 мужчин и 10 женщин), второй – на возраст 50 лет и старше (102 случая, 59 мужчин и 43 женщины) [9]. Принципиальное отличие двух групп заключалось в том, что язвы у больных первой группы всегда развивались вне связи с другими заболеваниями или воздействием каких-либо химических, физических или психических факторов. У больных же второй группы язвы всегда сочетались с каким-либо острым или обострением хронического заболевания, воздействием химических, физических или психических факторов. Тот факт, что язвы у пациентов первой группы возникали в молодом возрасте и не были связаны с какой-либо сопутствующей патологией, дает основание не только предполагать, но и утверждать, что заболевание имеет наследственно предрасположенный генез. Пред расположенность к язвообразованию, очевидно, может передаваться по наследству, но может иметь и спорадический, ненаследуемый характер. В целом, можно сделать вывод о том, что формирование язвы у пациентов первой группы программируется уже в момент оплодотворения яйцеклетки и в значительной степени зависит от пола пациента. В отличие от больных первой группы, в формировании язвы у пациентов второй группы основную роль играли пожилой возраст, сопутствующие заболевания или воздействие каких-то внешних факторов. Таким образом, можно констатировать, что язвы в первой группе являются преимущественно генетически детерминированными, а во второй – "приобретенными". Полученные результаты дают основание сделать вывод: пациенты первой группы могут считаться страдающими ЯБ, а второй – симптоматическими гастродуоденальными язвами [9].
Подтверждением существования генетической предрасположенности к развитию ЯБ служит тот факт, что от 20% до 70% детей с ЯБ двенадцатиперстной кишки имеют родителей или ближайших родственников, страдающих этим же заболеванием. Установлено также, что ЯБ у близких родственников встречается в 5-10 раз чаще, чем в популяции. Наследственные язвы чаще обостряются и чаще сопровождаются кровотечением. Предрасположенность к дуоденальной язве передается по мужской линии [10]. Эстрогены играют роль мощного защитного фактора, но с наступлением менопаузы их продукция критически падает, в связи с чем соотношение мужчин и женщин с ЯБ снижается с 5,5:1 в молодом возрасте до 1,4:1 в пожилом [9].
О ведущей роли немодифицируемых факторов риска свидетельствует и тот факт, что наличие или отсутствие немодифицируемого фактора кратно увеличивает или, наоборот, снижает риск возникновения заболеваний, в то время как нейтрализация модифицируемых факторов влияет на результат лечения значительно в меньшей степени.
Понять конкретный механизм реализации немодифицируемых факторов риска в развитии гастродуоденальных язв можно лишь с учетом того обстоятельства, что представление о патогенезе должно строго соответствовать морфологическому субстрату обсуждаемого заболевания. Морфологический субстрат гастродуоденальных язв хорошо известен – это локальный дефект слизистой и подслизистой оболочек желудка и/или двенадцатиперстной кишки, иногда язва может перфорировать все слои органа. С учетом данного обстоятельства есть основание считать, что формирование локальной язвы возможно лишь в случае существования локальной ишемии. Ни одна из других известных причин, включая и H. pylori, не может претендовать на роль фактора, способного вызвать образование локального язвенного дефекта.
Версия существования локальной ишемии представляется самой очевидной, потому она и возникла в числе одной из первых гипотез. Р. Вирхов (R. Virchow, 1853) считал, что образование язвенного дефекта в желудке или двенадцатиперстной кишке – это местный патологический процесс, обусловленный расстройством кровообращения в их стенке вследствие тромбоза или эмболии ("сосудистая теория Р. Вирхова"). Острый тромбоз и/или эмболия чревной или верхней брыжеечной артерии или их ветвей действительно возможны, но при этом развивается не локальная, а обширная ишемия и некроз не одного, а двух и более органов. Таким образом, версия о сосудистом генезе ЯБ была быстро отвергнута и в настоящее время имеет лишь исторический интерес.
В нашем исследовании 82 из 167 пациентов с ЯБ были оперированы по поводу различных осложнений (кровотечения, перфорация, пенетрация или их сочетания), возникших на фоне консервативного лечения. При морфометрическом исследовании сосудов было показано, что в области краев язвы артериолы, венулы и капилляры развиты фактически в той же степени, что и в пределах непораженной слизистой оболочки. При этом в перивенулярном и перикапиллярном пространствах многих сосудов краев язв отмечалась выраженная лимфоплазмоцитарная инфильтрация. Некоторые отдельно располагающиеся очаги имели сходство с лимфоидными фолликулами. В области же дна язв артериолы и венулы практически отсутствовали, а сеть капилляров была в 6-9 раз гуще, чем в пределах интактных тканей. Капилляры в области дна язв были окружены фиброзно-склеротической стромой и имели вид неспадающихся продольных трубок, реже были изогнуты в форме спирали или имели вид синусоидов. При этом было выявлено большое число капилляров, лишенных эритроцитов и содержащих одну плазму ("плазматические" капилляры). При осложненном течении в периульцерозных тканях многих язв, прежде всего, в области дна, выявлялись очаги кровоизлияний, иногда довольно обширные, с диффузным пропитыванием оболочек стенки органа форменными элементами крови [9].
Таким образом, результаты исследования подтвердили наличие локальной ишемии в периульцерозной области, которая и определяет локальный характер повреждения слизистой желудка и/или двенадцатиперстной кишки. При этом ишемия, обусловленная физиологической неравномерностью развития сосудов, была дополнительно усилена локальной гипоплазией сосудов мелкого и среднего калибра желудка или двенадцатиперстной кишки врожденного (при язвенной болезни) или приобретенного генеза (преимущественно атеросклеротического – при симптоматических язвах). Результаты исследования позволяют сделать вывод о том, что постоянно существующая ишемия, обусловленная гипоплазией сосудов врожденного или приобретенного генеза, ассоциированной с возрастными инволютивными изменениями, в покое не является критической. Для формирования локального язвенного некроза в желудке или двенадцатиперстной кишке ишемия должна быть дополнительно усилена до определенной пороговой величины.
Усилению постоянно существующей стойкой локальной ишемии слизистой оболочки желудка или луковицы двенадцатиперстной кишки способствуют:- гастродуоденальная дисмоторика различного генеза;
- прямое повреждающее действие экзотоксинов H. py lori на дегенеративно измененные цитоплазматические мембраны клеток, располагающихся в области ишемии;
- изменение силы электрического и магнитного полей
Земли – сезонное, суточное, обусловленное перемещением на большие расстояния с севера на юг, с запада на восток и обратно, степенью солнечной, лунной активности и другими обстоятельствами.
Электромагнитные поля составляют естественнуюэлектромагнитную биосферу нашей планеты. Напря женность магнитного поля Земли определяется главным образом ее электрическим и магнитнымквазистатическими полями, атмосферным электричеством, радиоизлучением Солнца и галактик. Эти факторы изменчивы, а их колебания зависят от многихпричин. Когда проходят атмосферные фронты, изменение давления и электрического поля тесно связанымежду собой. Влияние же Солнца на Землю ярко проявляется возмущением магнитного поля Земли.Мощность последнего определяется количеством солнечных пятен и мощностью процессов на нем (вспышки, выброс веществ). В 80% случаев ростугеомагнитного индекса соответствует увеличение числабольных [11]. Высокая частота весенне-осенних обострений язвенной болезни отмечается в период пика солнечной активности. С изменением силы электрическогои магнитного полей меняется и интенсивность реакцийсвободнорадикального и перекисного окисления липидов всех типов клеточных мембран, располагающихся вмагнитном поле [12]. Таким образом, изменение магнитного поля Земли может оказывать стабилизирующееили дестабилизирующее действие на все типы клеточных мембран в организме. При язвообразовании наиболее значимо повышение интенсивности реакцийсвободнорадикального и перекисного окисления липидов в тканях желудка и двенадцатиперстной кишки(эпителий слизистой оболочки, эндотелий сосудов,форменные элементы крови в сосудах, гладкая мускулатура стенок сосудов).
Кроме отмеченных, перечень модифицируемых факторов риска, способных усилить локальную ишемию, может включать десятки других причин. В конечном счете, дефицит поступления в зону ишемии энергетических, пластических субстратов, витаминов, антиоксидантов, микроэлементов, гормональный дисбаланс (прежде всего снижение продукции эстрогенов) ведут к выраженному усилению интенсивности реакций свободно-радикального и перекисного окисления липидов клеточных мембран. Следствием этого является нарушение структуры клеточных мембран, активности мембраносвязанных ферментов, нарушение исходного осмотического и онкотического давления в клетках эпителия и эндотелия в зоне ишемии, в конечном счете – гибель клеток с обнажением подэпителиального слоя слизистой оболочки желудка и/или двенадцатиперстной кишки. Сопутствующее локальное нарушение процессов свертывания, фибринолиза, кининогенеза в области ишемии ведет к нарушению реологических свойств крови, способствуя дополнительному усилению локальной ишемии.
При различных вариантах симптоматических гастродуоденальных язв на первый план могут выходить и иные причины. Однако локальный характер язвенного дефекта служит убедительным доказательством того, что в большинстве случаев именно локальная ишемия играет главную роль в формировании язвенного дефекта в желудке или двенадцатиперстной кишке, остальные же факторы различным образом способствуют лишь ее усилению [9].
В августе 2022 г. опубликованы новые рекомендации Маастрихт VI с очередными изменениями положений эрадикационной терапии H. pylori [13]. В новых положениях уже не идет речь о необходимости достижения полной ликвидации H. pylori-ассоциированных заболеваний, но эрадикация H. pylori по-прежнему провозглашается главной целью терапии ЯБ, хронического гастрита, профилактики возникновения таких заболеваний, как аденокарцинома и MALT-лимфома желудка. При этом, если в предыдущих рекомендациях для достижения эрадикации предусматривалась возможность проведения терапии первой, второй, третьей линии, теперь к ней добавилась рекомендация о возможности терапии четвертой линии [13].
Безальтернативное требование о необходимости обязательного достижения эрадикации, сформулированное 40 лет назад, целиком базируется на консервативной позиции, согласно которой Н. pylori относится к категории патогенных микробов и является главной причиной возникновения ЯБ. Однако обоснованность данной версии представляется сомнительной, поскольку в ней демонстративно игнорируется тот факт, что уже на протяжении как минимум десятков тысячелетий Н. pylori сохраняется в организме не менее, чем у половины населения планеты. При этом в абсолютном большинстве случаев инфекция протекает бессимптомно или малосимптомно. С учетом изложенного, микроб может быть отнесен к категории резидентной (постоянно присутствующей в организме) микрофлоры. Это означает, что находиться в организме человека постоянно, не причиняя ему вреда, может лишь та микрофлора, которая не имеет антагонистических отношений с хозяином. Данное обстоятельство дает основания отнести Н. pylori к категории не более, чем условно-патогенных микробов. В литературе отмечается, что резидентная микробиота у взрослых имеет значительную степень стабильности и стремится к восстановлению после любых дисбиотических нарушений [14]. Поэтому даже после достижения эрадикации, Н. pylori, вполне ожидаемо, может вновь вернуться к хозяину. Подтвер ждением справедливости данного вывода служат результаты исследования А.П. Осокиной и соавт. После успешной эрадикации H. pylori у 100 пациентов с ЯБ двенадцатиперстной кишки, находившихся под наблюдением в течение 11 лет, повторное инфицирование установлено в 45 случаях, в том числе в течение первых 5 лет в 27 и последующих 6 лет в 18. У 32 пациентов реинфицирование сопровождалось обострением ЯБ [15]. Приведенные результаты свидетельствуют о том, что если после эрадикации H. pylori и формируется какой-то постинфекционный иммунитет, то сохраняется он очень недолго, но главный вывод состоит в том, что роль H. pylori в патогенезе ЯБ необоснованно завышена. Это подтверждается и тем, что за прошедшие десятилетия в ряде регионов H. pylori при ЯБ и ее обострениях выявляли даже реже, чем в общей популяции [4,5]. Приведенные данные позволяют сделать вывод о том, что не всякий рецидив дуоденальной язвы сочетается с инфицированием H. pylori, и не всякое инфицирование ведет к рецидиву заболевания. Эрадикационная терапия, сокращая в большинстве случаев сроки рубцевания язвы и улучшая качество жизни, позволяет добиться более продолжительной ремиссии. Однако она не является гарантированной защитой от рецидива заболевания и, тем более, не дает оснований надеяться на ликвидацию ЯБ. Если эрадикация H. pylori не ведет к ликвидации ЯБ, попытка избавиться от микроба становится похожей на войну Дон Кихота с ветряными мельницами. В этой войне пострадать могут сам Дон Кихот или мельницы, в случае же необоснованно агрессивной эрадикации H. pylori количество пострадавших будет исчисляться многими миллионами пациентов.
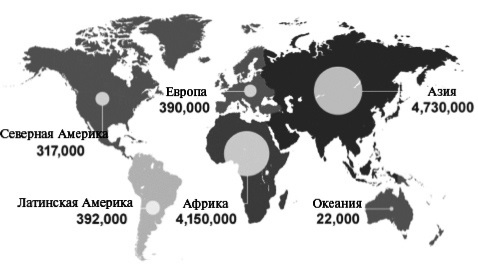
Когда в ранних рекомендациях Маастрихтского консенсуса появилось предложение о возможности и условиях проведения терапии третьей линии, впервые возникло чувство, что мы свернули с большой дороги, вошли в лес и заблудились. В настоящее же время, когда было предложено добиваться эрадикации с помощью терапии четвертой линии, появилось ощущение, что мы по-прежнему находимся в лесу, но идем уже не по твердой земле, а с трудом делаем шаги по зыбкому болоту, где каждый следующий шаг может стать последним. В вероятности подобного сценария убеждают и выводы Всемирной организации здравоохранения (ВОЗ). Широкое применение антибиотиков в практическом здравоохранении, особенно современных высокоэффективных их представителей, позволило спасти миллионы жизней. В то же время устойчивость бактерий к существующим антибиотикам названа ВОЗ одной из главных угроз человечеству в нынешнем веке [16]. Проблема устойчивости микроорганизмов к противомикробным препаратам, включая антибиотики, сегодня имеет глобальный масштаб и ставит под угрозу столетний прогресс в области здравоохранения. В обзоре, подготовленном по заказу правительства Великобри тании, утверждалось, что инфекции, вызванные резистентными микроорганизмами, в 2014 г. стали причиной около 700 000 случаев смерти на планете, а по оценкам экспертов, к 2050 г. этот показатель может увеличиться до 10 миллионов, прежде всего за счет стран Африки и Азии (более 4 миллионов в каждом регионе). Тем не менее, в Европе количество случаев смерти от инфекций, вызванных резистентными возбудителями, может составить почти 400 000 (рис. 1) [17].
По некоторым прогнозам, уже в ближайшие годы мы можем оказаться практически без эффективных антимикробных препаратов, так как с конца 1980-х гг. в мире не появилось ни одного принципиально нового класса антибиотиков [18]. Резистентные возбудители появились не вчера, но сегодня темпы роста их количества увеличиваются в геометрической прогрессии. Антибиотикорезистентность бактерий делает лекарства, которые мы используем, гораздо менее эффективными. Самостоятельной очень важной проблемой является потребление антибиотиков животными. В США 70% важных с медицинской точки зрения антибиотиков назначают животным, а не людям. Исследования показывают, что существует связь между использованием антибиотиков в сельском хозяйстве и резистентностью к ним микрофлоры человека.
Инфекции, вызванные бактериями, устойчивыми к антибиотикам, являются одной из ведущих причин смерти людей всех возрастов. Прошедшие годы показали, что прогноз роста антимикробной резистентности и связанной с ней смертности пациентов подтверждается. Согласно анализу, опубликованному в журнале Lancet, в 2019 году 4,95 млн человек умерли от болезней, в возникновении которых принимали участие бактерии с антимикробной резистентностью. Из них 1,27 млн случаев смерти были прямым результатом устойчивости к противомикробным препаратам, а это означает, что лекарственноустойчивые инфекции унесли жизни бόльшего числа людей, чем ВИЧ/СПИД (864 000 случаев смерти) или малярия (643 000 случаев смерти) [19].
Считаем, что разделение факторов риска на модифицируемые и немодифицируемые позволяет, во-первых, понять главную причину возникновения ЯБ, а, во-вторых, сделать вывод, что если немодифицируемые факторы риска и обусловленные ими заболевания невозможно ликвидировать, то их относительно корректно можно контролировать путем нейтрализации модифицируемых факторов риска. Поскольку эрадикация H. pylori позволяет сократить сроки рубцевания язвы, улучшить качество жизни и добиться более продолжительной ремиссии, следует признать, что антигеликобактерная терапия в сочетании с блокаторами протонной помпы будет и дальше сохранять лидирующую роль в лечении ЯБ. Однако с учетом того, что ЯБ невозможно победить, следует понять, к какой цели мы должны стремиться? Эрадикационная терапия является адекватной, когда речь идет об инфекционном заболевании, обусловленном патогенным возбудителем. Но если H. pylori относится к категории условно-патогенных микробов, принципы лечения должны существенно отличаться. Причисляя H. pylori к категории патогенных микробов, мы должны лечить подобных больных в инфекционных стационарах, в реальной же практике лечением подобных пациентов занимаются не инфекционисты, а гастроэнтерологи.
Если сравнивать различные заболевания, ассоциированные с условно-патогенной флорой, то ЯБ имеет ряд сходных признаков с внебольничной пневмонией (ВП). Во-первых, как и при ЯБ, в возникновении ВП в роли модифицируемых факторов выступает ряд условнопатогенных бактерий. Главным путем инфицирования респираторных отделов легких при ВП является аспирация содержимого ротоглотки. Во-вторых, достоверно установлено, что в полости рта и в желудке обнаруживаются одни и те же штаммы вида H. pylori [20]. Таким образом, ротоглотка является резервуаром не только для возбудителей ВП, но и резервуаром, из которого H. pylori проникает в желудок. Следует уточнить, что легочные инфекции у молодых людей обычно являются моноинфекцией, а у лиц старше 60 лет вызваны ассоциациями возбудителей, 3/4 которых представлены сочетанием грамположительной и грамотрицательной флоры [21].
По данным А.Г. Чучалина и соавт., 30-50% случаев ВП в Российской Федерации (РФ) вызваны Streptococcus pneumoniae, 8-30% – атипичными микроорганизмами (Chlamydophila pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila), 3-5% – Haemophilus influenzae, Staphylococcus aureus и Klebsiella pneumoniae [22]. Следующим важным элементом сходства ЯБ и ВП является сходная антибиотикочувствительность и антибиотикорезистентность. Для лечения обоих заболеваний используются одни и те же группы антибиотиков – аминопенициллины, макролиды, респираторные фторхинолоны, тетрациклины. В связи с этим, можно предположить, что одинаковые условия существования в ротоглотке сформировали и какое-то культуральное сходство, в том числе антибиотикочувствительность и антибиотикорезистентность. Подобно тому, как при ЯБ возможно возникновение H. pylori-негативных язв, при ВП не всегда удается выявить возбудителя инфекции. По данным Л.С. Страчунского и соавт., несмотря на имеющийся современный арсенал методов лабораторной диагностики, у 30-50% больных с легочными инфекциями в РФ не удается верифицировать этиологию инфекционного процесса [23].
Наличие сходных признаков возникновения заболеваний наталкивает на мысль о существовании определенного сходства и в принципах их лечения. При этом следует уточнить, что если вопросы лечения гастродуоденальных язв находятся на стадии поиска, проб и ошибок, то принципы лечения ВП к настоящему времени радикально уже не пересматриваются. В рекомендациях по диагностике и лечению ВП указывается, что перед началом антибактериальной терапии врач должен принять меры к установлению этиологического фактора, уточнить аллергологический анамнез, сведения о сопутствующих заболеваниях, применявшихся ранее антибактериальных препаратах и причинах их неэффективности [22]. Однако несмотря на расширение возможностей микробиологической диагностики, примерно у половины госпитализированных пациентов с ВП этиологический диагноз остается неустановленным [24,25]. Поэтому, в большинстве случаев лечение начинают с эмпирической антибактериальной терапии. Всем пациентам с определенным диагнозом ВП рекомендуется назначение антибактериальных препаратов системного действия в как можно более короткие сроки (не позднее 4 ч с момента установления диагноза, 1 ч – при тяжелой внебольничной пневмонии, осложненной септическим шоком).
Принципиальным различием терапии ЯБ и ВП является конечная цель лечения. При ВП конечная цель – достижение клинического выздоровления. В настоящее время дискуссии по поводу принципа минимальной достаточности при использовании антибактериальных препаратов практически завершены. Большинство исследований подтверждает эффективность короткого курса применения антибактериальных средств [26]. В большинстве случаев в результате лечения удается достичь и эрадикации агента, причастного к возникновению пневмонии. Однако при благоприятном течении заболевания подобная задача специально не ставится. Более того, прием антибиотиков прекращается еще до того, как ликвидируются основные клинические проявления и пневмоническая инфильтрация.
Продолжительность антибактериальной терапии ВП определяется индивидуально, рекомендуется руководствоваться критериями ее достаточности [27,28]:- стойкое снижение температуры тела <37,2°C в течение не менее 48 ч;
- отсутствие интоксикационного синдрома;
- частота дыхания <20 в минуту у пациентов без хронической дыхательной недостаточности;
- отсутствие гнойной мокроты (за исключением пациентов с ее постоянной продукцией);
- количество лейкоцитов в крови <10 × 109 /л, нейтрофилов <80%, юных форм <6%.
Оптимальная продолжительность применения антибактериальных препаратов системного действия при ВП до настоящего времени не определена и зависит от различных факторов – возраста, сопутствующих заболеваний, наличия осложнений, скорости ответа на стартовую антибактериальную терапию и др. В рандомизированном контролируемом исследовании, в котором оценивали исходы лечения у пациентов с нетяжелой ВП относительно коротким (≤7 дней) и более длительным (>7дней) курсом антибактериальной терапии, не выявлено существенных различий между группами [29]. В отдельных исследованиях при неосложненной ВП была продемонстрирована эффективность и более коротких курсов антибактериальной терапии [30,31]. При следовании критериям "достаточности" антибактериальной терапии длительность ее в большинстве случаев не превышает 5-7 дней. Продолжение или модификация антибактериальной терапии при ВП в случае соблюдения критериев "достаточности" не рекомендуется. Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самостоятельно или под влиянием симптоматической терапии. Длительно сохраняющийся субфебрилитет не является признаком бактериальной инфекции. Рентгенологические проявления ВП разрешаются медленнее клинических симптомов, поэтому контрольная рентгенография грудной клетки не может служить критерием для определения длительности антибактериальной терапии [27].
Несмотря на существование важных элементов сходства микрофлоры, выявляемой при ВП и ЯБ (наличие общего резервуара поддержания инфекции – ротоглотка; сходные классификационные признаки – условнопатогенная флора; сходный перечень используемых препаратов), подходы к лечению сравниваемых заболеваний имеют принципиальные различия. Подходы, которые расцениваются как "золотой стандарт" при терапии H. pylori-ассоциированных гастродуоденальных язв (эрадикация H. pylori), при лечении ВП считаются ошибочными. Завершение антибактериальной терапии при ВП считается допустимым через 5-7 дней при достижении критериев "достаточности", в то время как ликвидация рентгенологических проявления пневмонии может затянуться на 1-1,5 месяца. С наступлением клинического выздоровления пациента с ВП дальнейшая судьба инфекционного агента не анализируется. Это связано с тем, что, во-первых, идентифицировать возбудителя не всегда возможно даже до начала лечения, во-вторых, условно-патогенный возбудитель через какое-то время все равно может вернуться к хозяину и будет поддерживать цикл своего развития неопределенно долго, возможно всю жизнь, без ущерба для макроорганизма. При язвах же желудка и двенадцатиперстной кишки эрадикационная терапия второй, третьей, а теперь и четвертой линий проводится не в зависимости от того, зарубцевалась язва или нет, а от того, продолжает выявляться H. pylori или нет. Не вдаваясь в подробности, отметим, что лечение других заболеваний, ассоциированных с условно-патогенной флорой (инфекции желчевыводящих, мочевыводящих путей и др.), проводится по принципам, сходным с таковыми при лечении ВП. При этом вопрос о достижении эрадикации не является главным, основной целью лечения заболеваний, ассоциированных с условно-патогенной флорой, считают выздоровление или достижение клинической ремиссии.
В итоге можно констатировать, что с медикаментозной терапией гастродуоденальных язв сложилась абсурдная ситуация – возбудителя инфекции мы считаем патогенным, при этом пациента госпитализируем в соматическое отделение (как при условно-патогенной инфекции), а эрадикацию проводим по стандартам облигатно патогенной инфекции. Можно сделать вывод, что сохраняющееся требование добиваться эрадикации H. pylori является ошибочным. Объясняться оно может лишь тем, что по стойкой инерции мы продолжаем рассматривать геликобактера в качестве облигатно патогенного микроба. Считаем, что сегодня, спустя 40 лет с момента открытия H. pylori, накопилось достаточное количество информации, позволяющей пересесть с двух стульев на один – микроба признать условно-патогенным и перейти от стратегии эрадикационной терапии к стратегии, основанной на достижении критериев достаточности. С учетом того, что H. pylori может неоднократно возвращаться к человеку, а также в соответствии с существующими принципами лечения ЯБ, можно с уверенностью прогнозировать, что в дальнейшем появится предложение проводить терапию пятой и последующих линий. Это может повлечь за собой не только неблагоприятные, но даже катастрофические последствия. Многократно повторяющиеся попытки убить условно-патогенного микроба, способствуя росту антибиотикорезистентности, могут убить не только H. pylori, но и его хозяина. Остается выбрать ответ – а какое из двух зол меньшее? Наиболее приемлемым считаем вывод, что если мы хотим избежать худших последствий, вероятно, необходимо отказаться от стратегии эрадикации, главной же целью следует считать достижение критериев достаточности.
Поскольку большинство исследований подтверждает эффективность короткого курса применения антибактериальных средств, сформулировать кратко критерии достаточности можно следующим образом:- главной целью лечения следует считать рубцевание язвы с достижением клинической ремиссии заболевания;
- нормализация лабораторно-инструментальных показателей;
- сохранение H. pylori в желудке и/или двенадцатиперстной кишке не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации.
Продолжительность минимально достаточного короткого курса применения антибактериальных средств предстоит изучить в последующих исследованиях.
Используемые источники
- Shay H, Sun DCH. Etiology and pathology of gastric and duodenal ulcer. In: Bockus HL. Gastroenterology, Philadelphia-London: Saunders Elsevier. 1968:420–465.
- Warren JR, Marshall BJ. Unidentified curved bacilli in the stomach of patient with gas-tritis and peptic ulceration. Lancet 1983;1:1311–5.
- Graham DY. Campylobacter pylori and peptic ulcer disease. Gastroenterology. 1989;96(2):615-25.
- Профилактика и лечение хронических заболеваний верхних отделов желудочно-кишечного тракта. Под ред. В.Т. Ивашкина. М.: МЕДпресс-информ; 2013:75-8. [Prevention and treatment of chronic diseases of the upper gastrointestinal tract. Ivashkin VT (ed.). M.: MEDpress-inform; 2013:75-8 (In Russ.)]
- Teves PM, Ventura SS, Salgado EM. Characteristics of gastroduodenal ulcers in patients with negative biopsies for Helicobacter pylori. Acta Gastroenterologica Latinoamericana 2010;40 (1):40–45.
- Tytgat GN. Endoscoping transmission of Helicobacter pylori. Aliment Pharmacol Ther 1995;9(2):105-10.
- Marshall BJ, Armstrong JA, McGechie DB, Glancy RJ. Attempt to fulfil Koch’s postulates for pyloric Campylobacter. Med J Aust 1985;142(8):436-9.
- Василенко В.Х. Чего мы не знаем о язвенной болезни (пути изучения проблемы). Актуальные вопросы гастроэнтерологии 1970;3:3-17. [Vasilenko VKh. What we don't know about peptic ulcer disease (ways to study the problem). Aktualnie voprosi gastroenterologii 1970;3:3-17 (In Russ.)].
- Литовский И.А., Гордиенко А.В. Дискуссионные вопросы патогенеза гастродуо-денальных язв. Вестник российской военно-медицинской академии 2015;52(4):197–204 [Litovsky IA, Gordienko AV. Debatable issues of the pathogene-sis of gastroduodenal ulcers. Vestnik rossiiskoi voenno-medicinskoi akademii 2015;52(4):197–204 (In Russ.)].
- Руководство по гастроэнтерологии: в 3 т. Т. 1. Под ред. Комарова Ф.И., Гребeнева А.Л. М.: Медицина; 1995:456-534. [Guide to Gastroenterology: in 3 vols. Vol. 1. Komarov FI, Grebenev AL (eds). M.: Medicine; 1995:456-534. (In Russ.)].
- Аскаров У.А., Гонтмахер Н.Д., Пулатова С.С. и др. Особенности клинического течения и сезонных обострений язвенной болезни в климатических условиях Узбекистана. Терапевтический архив 1985;57(10):135-36. [Askarov UA, Gontmacher ND, Pulatova SS, et al. Features of the clinical course and seasonal exacerbations of peptic ulcer disease in the climatic conditions of Uzbekistan. Therapeutic Archive 1985;57(10):135-36. (In Russ.)].
- Портнов, Ф.Г. и др. Экспериментальное изучение влияния электрических полей на процессы перекисного окисления в организме. Свободнорадикальное окисление липидов в норме и патологии. М.: Наука, 1976;153-54. [Portnov, FG, et al. Experimental study of the effect of electric fields on the processes of peroxidation in the body. Free radical oxidation of lipids in norm and pathology: Moscow: Nauka, 1976;153-54 (In Russ.)].
- Malfertheiner P, Megraud F, Rokkas Тm et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence сonsensus report. Gut 2022;71:1724–62.
- Шендеров Б.А. Микробная экология человека и ее роль в поддержании здоровья. Метаморфозы 2014; 5: 72-80 [Shenderov BA. Microbial ecology of man and its role in maintaining health. Metamorphoses. 2014; 5: 72-80. (In Russ.)].
- Осокина А.П., Минушкин О.Н., Шиндина Т.С. Течение язвенной болезни двенадцатиперстной кишки после успешной эрадикации Helicobacter pylori. Эффективная фармакотерапия 2015;2:12-5 [Osokina AP, Minushkin ON, Shindina TS. The course of duodenal ulcer disease after successful eradication of Helicobacter pylori. Effective pharmacotherapy 2015;2:12-5. (In Russ.)].
- World Health Organization Antimicrobial resistance: global report on surveillance 2014; 234 р. http://apps.who.int/iris/bitstream/10665/112642/1/9789241564748_eng.pdf?ua=1.
- O’Neill J. Antimicrobial resistance: tackling a crisis for the health and wealth of nations. London: Review on Antimicrobial Resistance, 2014.
- Арепьева М.А., Колбин А.С., Курылев А.А. и др. Систематический обзор математических моделей, применяемых для прогнозирования развития резистентности бактерий к антибиотикам. Клиническая микробиология и антимикробная химиотерапия 2014;16(2):137-43 [Arepyeva MA, Kolbin AS, Kurylev AA, et al. A systematic review of mathematical models used to predict the development of bacterial resistance to antibiotics. Clinical Microbiology and Antimicrobial Chemotherapy 2014;16(2):137-43. (In Russ.)].
- Darboe S, Haller S, Dunachie S, et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet 2022;399:629-55.
- Tamassy K, Simon L, Francis M. Evolution of helicobacter positivity in infants bom from positive mothers. Orv Hetil 1995;136(26):1387-91.
- Ноников В.Е. Антибактериальная терапия пневмоний в стационаре. РМЖ 2001;9(21):923-29 [Nonikov VE. Antibacterial therapy of pneumonia in the hospital. RMJ 2001;9(21):923-29. (In Russ.)].
- Чучалин А.Г., Синопальников А.И., Страчунский Л.С. и др. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике. М., 2010. 82 с. [Chuchalin AG, Sinopalnikov AI, Strachunsky LS, et al. Community-acquired pneumonia in adults. Practical recommendations for diagnosis, treatment and prevention. M., 2010. 82 p. (In Russ.)].
- Страчунский Л.С., Белоусова Ю.Б., Козлов С.Н. Практическое руководство по антиинфекционной химиотерапии. Смоленск: МАКМАХ, 2007, 464 с.
- Jain S, Self WH, Wunderink RG, et al. Community-acquired pneumonia requiring hospitalization among U.S. adults. N Engl J Med 2015;373:415-27.
- Bartlett JG. 2005–6 Pocket Book of Infectious Disease Therapy. Lippincott Williams & Wilkins 2004; 349.
- Clinical Practice Guidelines for Antimicrobial Prophylaxis in Surgery ASHP Therapeutic Guidelines American Society of Health System Pharmacists 2013, 582-666.
- Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике (пособие для врачей). Клин микробиол антимикроб химиотер 2010;12:186-225 [Chuchalin AG, Sinopalnikov AI, Kozlov RS, et al. Community-acquired pneumonia in adults. Practical recommendations for diagnosis, treatment and preven-tion (manual for doctors). Klin microbiol antimicrobial chemother 2010;12:186-225. (In Russ.)].
- Athlin S, Lidman C, Lundqvist A, et al. Management of community-acquired pneumonia in immunocompetent adults: updated Swedish guidelines 2017. Infect Dis (Lond) 2018;50(4):247-72.
- Dimopoulos G, Matthaiou DK, Karageorgopoulos DE, et al. Short- versus longcourse antibacterial therapy for community-acquired pneumonia: a meta-analysis. Drugs 2008;68(13):1841–54.
- El Moussaoui R, de Borgie CA, van den Broek P, et al. Effectiveness of discontinuing antibiotic treatment after three days versus eight days in mild to moderatesevere com-munity acquired pneumonia: randomised, double blind study. BMJ 2006;332:1355.
- Dunbar LM, Wunderink RG, Habib MP, et al. High-dose, short-course levofloxacin for community-acquired pneumonia: a new treatment paradigm. Clin Infect Dis 2003;37:752-760.
