Анти-Ха активность у пациентов с неклапанной фибрилляцией предсердий на фоне приема апиксабана и ривароксабана
Проблема мониторирования терапии прямыми пероральными антикоагулянтами остается дискуссионной. Одним из перспективных методов, коррелирующих с прямым определением концентрации препарата в крови, считают оценку анти-Ха активности.
Оценить значения анти-Ха активности при приеме ривароксабана или апиксабана в различных дозировках в точках, соответствовавших минимальной и максимальной равновесной концентрации препарата в крови.
В исследование были включены 102 пациента с фибрилляцией предсердий, принимавших ривароксабан (n=56) или апиксабан (n=46) для профилактики тромбоэмболических осложнений. Уровни анти-Ха активности измеряли фотоколориметрическим методом в точках предполагаемых минимальной и максимальной равновесных концентраций.
При приеме апиксабана в дозах 5 и 10 мг/сут медианы минимальной анти-Ха активности составили 19,3 и 81,0 нг/мл, соответственно (р<0,05), максимальной – 369,8 и 403,0 нг/мл. При приеме ривароксабана в дозах 10, 15 и 20 мг/сут медианы минимальной анти-Ха активности равнялись 27,0, 55,1 и 108,0 нг/мл, соответственно (р<0,05), максимальной – 117,0, 238,0 и 266,7 нг/мл.
Значения анти-Ха активности у пациентов с фибрилляцией предсердий, получавших ривароксабан или апиксабан, характеризовались высокой вариабельностью. Минимальные ее значения статистически значимо отличались в зависимости от дозы антикоагулянта и были ниже максимальных уровней анти-Ха активности.
Еще во Фрамингемском исследовании было показано, что фибрилляция предсердий (ФП) примерно в 5 раз увеличивает риск инсульта [1]. Наиболее эффективная стратегия его профилактики у таких пациентов – постоянный прием пероральных антикоагулянтов [2–5]. Первые рандомизированные контролируемые исследования 3 фазы показали, что прямые пероральные антикоагулянты (ПОАК) по эффективности в профилакте инсульта, смертности от всех причин и серьезных кровотечений по крайней мере не уступают варфарину или превосходят его [6,7].
Похожие результаты были получены и в многочисленных обсервационных исследованиях, которые проводились в реальной клинической практике [8–12], хотя результаты некоторых из них расходились с данными рандомизированных клинических исследований. Например, в ретроспективном когортном исследовании D. Grahams и соавт. применение апиксабана и ривароксабана у пациентов с фибрилляцией предсердий привело к более значительному снижению риска тромбоэмболических осложнений и смерти от любых причин по сравнению с таковым в рандомизированных контролируемых исследованиях [13]. Если в контролируемом исследовании ROCKET-AF ривароксабан не уступал варфарину по эффективности в профилактике инсульта или системных эмболий, то в ретроспективном исследовании ARISTOPHANES ривароксабан вызывал значительное снижение риска тромбоэмболических осложнений, но увеличение риска больших кровотечений по сравнению с варфарином [9]. В Канадском ретроспективном исследовании применение ПОАК в стандартных дозах сопровождалось сопоставимым риском инсульта и более низким риском смерти по сравнению с таковыми при лечении варфарином [14]. Однако при лечении ривароксабаном в низкой дозе, в отличие от других ПОАК, риск инсульта и кровотечения оказался выше, чем в группе варфарина. Полагают, что на эффективность и безопасность применения ПОАК в клинической практике могут оказывать влияние различные факторы, такие как неадекватная оценка клинической ситуации и индивидуальных рисков, несовершенство шкал, низкая приверженность к терапии и др. [15,16].
Приведенные данные указывают на целесообразность терапевтического лекарственного мониторинга лечения ПОАК у пациентов с фибрилляцией предсердий, хотя этот вопрос остается спорным, а общепринятый метод оценки антикоагулянтного действия ПОАК отсутствует. Возможно, мониторирование результатов лечения у всех пациентов, получающих ПОАК, не имеет смысла, однако оно может быть оправданным в тех случаях, когда существует риск изменения фармакокинетики препаратов этой группы вследствие межлекарственных взаимодействий, хронической почечной недостаточности, ожирения или пожилого возраста [17–20].
Один из самых точных методов определения концентрации препарата в крови – высокочувствительная жидкостная хроматография, однако она имеет существенные ограничения, в том числе не только высокую стоимость, но и необходимость как специального оборудования, так и обученного персонала [21]. При лечении ПОАК более простым и менее дорогим методом может быть фотоколориметрическая оценка анти-Ха активности, которая в ряде исследований прямо коррелировала с концентрацией препаратов этой группы в крови [22–25].
Целью исследования было оценить значения анти-Ха активности при приеме ривароксабана или апиксабана в различных дозировках в точках, которые соответствовали минимальной и максимальной равновесной концентрации препаратов в крови.
Материал и методы
В проспективное исследование включали пациентов с фибрилляцией предсердий, получавших терапию ингибиторами фактора Xa ривароксабаном или апиксабаном. Иссле дование проводилось в соответствии с Хельсинской декларацией Всемирной медицинской ассоциации "Этические принципы проведения научных медицинских исследований с участием человека" с поправками 2013 г. и "Правилами надлежащей клинической практики в Российской Федерации", утвержденными приказом Минздрава РФ от 01.04.2016 г. 200н. Протокол исследования был одобрен ЛЭК при Первом МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет) протокол №01-20 от 22.01.2020 г.
Минимальную анти-Ха активность определяли до приема препаратов (в точке, соответствовавшей минимальной равновесной концентрации препарата), максимальную – через 2-4 часа после приема (в точке, соответствовавшей максимальной равновесной концентрации). Анти-Ха активность измеряли хромогенным методом на автоматическом анализаторе Chem Well 2900 (США) при помощи реактивов TECHNOCHROM® anti-Xa (Tecnoclone, Австрия). Мини мальная определяемая анти-Ха активность составляла 10 нг/мл для ривароксабана и 20 нг/мл для апиксабана, а диапазон измерений – 10-700 и 20-700 нг/мл, соответственно. Для калибровки и контроля качества анализов использовали калибраторы и контрольные образцы плазмы TECHOVIEW Rivaroxaban® и TECHOVIEW Aрixaban®.
Статистическая обработка результатов проводилась с использованием программы Medcalс®, версия 19.8.1.
Результаты
В исследование были включены 102 пациента с неклапанной фибрилляцией предсердий, 56 из которых получали терапию ингибитором Ха апиксабаном и 46 – риваро ксабаном (табл. 1). Две группы пациентов существенно не отличались по клиническим и демографическим показателям.
| Показатели | Апиксабан (n=46) |
Ривароксабан (n=56) |
|---|---|---|
| Средний возраст, лет | 77,7±9,4 | 78,2±8,1 |
| Мужчины, n (%) | 21 (45,7) | 29 (51,8) |
| Длительность приема, мес (мода и диапазон) | 26 (6-33) | 28 (6-34) |
| Суточная доза, n (%) | ||
| 5 мг | 28 (60,9) | - |
| 10 мг | 18 (39,1) | 9 (16,1) |
| 15 мг | - | 26 (46,4) |
| 20 мг | - | 21 (37,5) |
| Форма фибриляции предсердий, n (%) | ||
| Пароксизмальная | 21 (45,7) | 21 (37,5) |
| Постоянная | 25 (54,3) | 35 (44,6) |
| Сопутствующие заболевания, n (%) | ||
| Постинфарктный кардиосклероз | 6 (13,0) | 3 (5,0) |
| Стенокардия напряжения | 7 (15,0) | 5 (9,0) |
| Инсульт в анамнезе | 7 (15,0) | 4 (7,0) |
| Артериальная гипертония | 43 (93,0) | 53 (95,0) |
| Хрон. сердечная недостаточность | 34 (74,0) | 42 (75,0) |
| Сахарный диабет 2 типа | 13 (28,0) | 17 (30,4) |
| ХОБЛ | 4 (9,0) | 3 (5,0) |
| Бронхиальная астма | 1 (2,0) | - |
| Хроническая болезнь почек | 46 (100) | 56 (100) |
| 2 стадия | 18 (39,1) | 21 (37,5) |
| 3а стадия | 9 (19,6) | 20 (35,7) |
| 3б стадия | 19 (41,3) | 15 (26,8) |
Значения анти-Ха активности варьировались в широких пределах при приеме как апиксабана, так и ривароксабана (табл. 2). В группе апиксабана минимальная анти-Ха активность составляла от 8,6 до 194,7 нг/мл, а максимальная – от 123,6 до 574,6 нг/мл. При приеме сниженной дозы апиксабана (5 мг/сут) медиана минимальной анти-Ха активности была статистически значимо ниже, чем при приеме полной дозы (10 мг/сут): 19,3 и 81,0 нг/мл, соответственно (р<0,05). В то же время медианы максимальной анти-Ха активности при приеме апиксабана в двух дозах достоверно не отличались: 369,8 и 403,0 нг/мл, соответственно. Распределение анти-Ха активности в зависимости от дозы апиксабана представлено на рис. 1.
| Препарат, доза | Минимальная анти-Ха активность (нг/мл) | Максимальная анти-Ха активность (нг/мл) | ||||||
|---|---|---|---|---|---|---|---|---|
| Медиана | Min-Max | 25%-75% процентиль |
Критерий Шапиро-Уилка |
Медиана | Min-Max | 25%-75% процентиль |
Критерий Шапиро-Уилка |
|
| Примечание: 1достоверность разницы по критерию Манна-Уитни между апиксабаном 5 и 10 мг (р<0,05), 2между ривароксабаном 10 и 15 мг (р<0,05), 3между ривароксабаном 10 и 20 мг (р<0,05), 4между ривароксабаном 15 и 20 мг (р<0,05), *между минимальной и максимальной анти-Ха активностью | ||||||||
| Апиксабан 5 мг/сут (n=28) | 19,3 | 8,6-150,7 | 10,1-28,6 | <0,0001 | 369,8* | 123,6-562,0 | 209,3-440,3 | 0,181 |
| Апиксабан 10 мг/сут (n=18) | 81,01 | 34,0-194,7 | 38,2-112,3 | <0,0001 | 403,0* | 134,9-574,6 | 235,9-517,2 | 0,144 |
| Ривароксабан 10 мг/сут (n=9) | 27,6 | 27,0-32,0 | 27,4-30,4 | 0,124 | 117,0* | 100,4-297 | 111,4-280,3 | <0,001 |
| Ривароксабан 15 мг/сут (n=26) | 55,12 | 21,0-112,0 | 37,0-97,4 | 0,186 | 238,02* | 108,0-502,0 | 136,0-287,4 | 0,250 |
| Ривароксабан 20 мг/сут (n=21) | 108,03,4 | 21,1-198,0 | 51,9-142,2 | 0,153 | 266,73* | 242,0-286,0 | 245,0-285,0 | 0,132 |
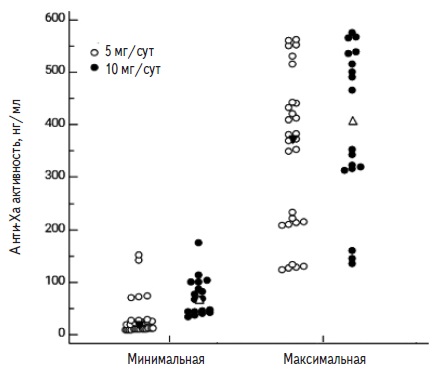
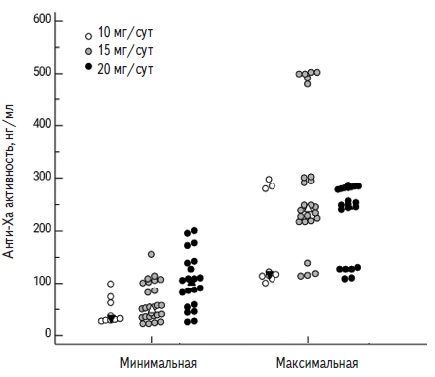
Сходные результаты были получены у пациентов, принимающих ривароксабан. Как для минимальной, так и для максимальной анти-Ха активности была характерна высокая вариабельность значений: от 27,0 до 198,0 нг/мл и от 100,4 до 285,0 нг/мл, соответственно. При увеличении дозы препарата с 10 до 15 и 20 мг/сут значения минимальной и максимальной анти-Ха активности увеличивались. Так, медианы минимальной анти-Ха активности при применении ривароксабана в дозах 10, 15 и 20 мг/сут составляли 27,0, 55,1 и 108 нг/мл, соответственно (р<0,05 во всех случаях), а медианы максимальной анти-Ха активности – 117,0, 238,0 и 266,7 нг/мл (разница была статистически значимой при увеличении дозы с 10 до 15 или 20 мг/сут, но недостоверной при увеличении дозы с 15 до 20 мг/сут). Распределение анти-Ха активности в зависимости от суточной дозы ривароксабана представлено на рис. 2.
| Минимальная анти-Ха активность |
Максимальная анти-Ха активность |
|||
|---|---|---|---|---|
| rp | p | rp | p | |
| Апиксабан | -0,274 | 0,142 | 0,216 | 0,181 |
| Ривароксабан | -0,378 | 0,009 | -0,581 | 0,0004 |
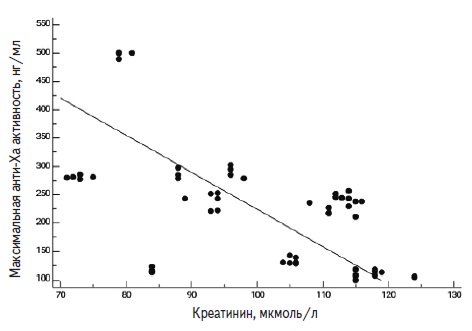
В обеих группах пациентов анти-Ха активность не зависела от возраста и пола. Повышение сывороточного уровня креатинина сопровождалось снижением максимальной анти-Ха активности у пациентов, принимавших ривароксабан (рис. 3), что, вероятно, было обусловлено коррекцией дозы препарата в зависимости от скорости клубочковой фильтрации. Статистически значимой корреляционной зависимости между значениями анти-Ха активности и сывороточным уровнем креатинина в группе пациентов, принимавших апиксабан, выявлено не было (табл. 3). В группе пациентов, принимавших ривароксабан, отмечалась статистически значимая обратная корреляционная взаимосвязь между этими показателями, которая была слабой (r=-0,378) для минимальной анти-Ха активности и средней (r= -0,581) для максимальной.
Обсуждение
Результаты нашего исследования показали высокую вариабельность минимальной и максимальной анти-Ха активности у пациентов с фибрилляцией предсердий, получавших как апиксабан, так и ривароксабан. Хотя полученные данные косвенно подтверждают целесообразность мониторирования анти-Ха активности при лечении ингибиторами Ха в клинической практике, для определения референтных значений этого показателя необходимы более крупные проспективные клинические исследования. Медианы максимальной анти-Ха активности были сопоставимыми при применении зарегистрированных для терапии фибрилляции предсердий доз апиксабана 5 и 10 мг/сут. Сходные результаты были получены при применении ривароксабана в дозах 15 и 20 мг/сут.
При лечении ривароксабаном в дозе 10 мг/сут медианы как минимальной, так и максимальной антиХа активности были значительно ниже таковых при применении препарата в официально рекомендованных дозах 15 и 20 мг/сут, что может указывать на недо статочную эффективность низкой дозы и служить дополнительным аргументом для повышения приверженности к лечению у пациентов, которые (как в нашем исследовании) самостоятельно снижают дозу ПОАК вопреки рекомендациям специалистов.
Наличие статистически значимой корреляционной связи между сывороточным уровнем креатинина и анти-Ха активностью в группе ривароксабана может свидетельствовать о целесообразности мониторирования последней у пациентов с более продвинутыми стадиями хронической болезни почек. Отсутствие подобной корреляции в группе пациентов, принимавших апиксабан, могло отражать недостаточную мощность исследования или более сложный режим дозирования препарата при нарушении функции почек. Для изучения подобных взаимосвязей требуются дальнейшие исследования. Возможными показаниями к мониторированию анти-Ха активности при лечении ингибиторами Ха могут быть также пожилой возраст, печеночная недостаточность, прием лекарственных препаратов, взаимодействующих с ПОАК, низкая приверженность к лечению и перенесенные кровотечения.
В работе T. Ahuja и соавт., которые изучали пиковые и пороговые уровни анти-Ха активности при лечении ингибиторами Ха по различным показаниям (фибрилляция предсердий, венозные тромбоэмболические осложнения и др.), также была выявлена высокая вариабельность этих показателей. Следует отметить, что исследование проводилось по сходной методике, но с использованием других реактивов. Более 60% анализов в исследовании T. Ahuja и соавт. были выполнены в связи с развитием нежелательных реакций. Как и в нашем исследования, анти-Ха активность не зависела от пола пациентов. Медианы минимальной и максимальной анти-Ха активности при применении ривароксабана в дозе 20 мг/сут составили 98 и 315 нг/мл, соответственно. При лечении апиксабаном в дозах 5 и 10 мг/сут медианы минимальной анти-Ха активности равнялись 91 и 105 нг/мл, максимальной – 259 и 255 нг/мл. Значения анти-Ха активности в нашем исследовании в основном находились в диапазоне референтных уровней показателя в исследовании T. Ahuja и соавт. [26].
Несколько исследований показали прогностическое значение повышения пиковых концентраций ривароксабана в крови при оценке риска кровотечения [27,28]. Сходные данные были получены при изучении уровней апиксабана, причем снижение его минимальной концентрации в крови ассоциировалось с риском инсульта [28,29]. В нашей работе у некоторых пациентов анти-Ха активность в значительной степени выходила за пределы межквартильного диапазона, что могло указывать на повышенный риск кровотечений, хотя данный вопрос требует дальнейшего изучения.
Т. Moner-Banet и соавт. на основании обзора исследований, в которых концентрации ингибиторов Ха измеряли преимущественно напрямую, предложили безопасные диапазоны минимальных концентраций ривароксабана (от 10 до 110 нг/мл) и апиксабана (от 20 до 130 нг/мл) [30]. При приеме ривароксабана, особенно в дозе 20 мг/сут, в отличие от апиксабана, значения минимальной анти-Ха активности нередко выходили за рамки безопасного диапазона. Это согласуется с данными реальной клинической практики, которые свидетельствуют о том, что апиксабан характеризуется лучшим профилем безопасности по сравнению с другими ПОАК. Однако для оценки корреляции между концентрациями ингибиторов Ха в крови и анти-Ха активностью, определения безопасного терапевтического диапазона последней и ее влияния на риск нежелательных явлений, анализа факторов, влияющих на уровень препарата в крови, требуются дополнительные исследования.
В настоящий момент отсутствуют рекомендации по интерпретации результатов анти-Ха активности и показаниям к ее измерению. При применении гепарина анти-Ха активность рекомендуют определять через 4 ч после введения препарата. Имеются данные о том, что при лечении ПОАК повышенные уровни анти-Ха активности могут сохраняться в крови в течение 63-98 ч, однако этот вопрос также требует уточнения [31-33].
Заключение
Значения анти-Ха активности у пациентов с фибрилляцией предсердий, получавших ингибиторы фактора Ха, характеризовались высокой вариабельностью. Мини мальные ее значения статистически значимо отличались в зависимости от дозы антикоагулянта и были ниже максимальных уровней анти-Ха активности. Теоретически мониторирование анти-Ха активности при лечении ингииторами Ха может быть полезным для оценки риска кровотечений у пожилых людей или пациентов с нарушением функции почек, а также при необходимости срочного оперативного вмешательства. Необходимы дальнейшие исследования для определения конкретных показаний к мониторированию антиХа активности при применении ингибиторов Ха.
Используемые источники
- Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991;22(8):983–8.
- Joglar JA, Chung MK, Armbruster AL, et al. 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2024;149(1):E1–156.
- Andrade JG, Aguilar M, Atzema C, et al. The 2020 Canadian Cardiovascular Society/Canadian Heart Rhythm Society Comprehensive Guidelines for the Management of Atrial Fibrillation. Can J Cardiol 2020;36(12):1847–948.
- Lip GYH, Banerjee A, Boriani G, et al. Antithrombotic therapy for atrial fibrillation: CHEST Guideline and Expert Panel Report. Chest 2018;154(5):1121–201.
- Hindricks G, Potpara T, Kirchhof P, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021;42(5):373–498.
- Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365(10):883–91.
- Granger CB, Alexander JH, McMurray JJV, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365(11):981–92.
- Staerk L, Gerds TA, Lip GYH, et al. Standard and reduced doses of dabigatran, rivaroxaban and apixaban for stroke prevention in atrial fibrillation: a nationwide cohort study. J Intern Med 2018;283(1):45–55.
- Lip GYH, Keshishian A, Li X, et al. Effectiveness and safety of oral anticoagulants among nonvalvular atrial fibrillation patients: The ARISTOPHANES study. Stroke 2018;49(12):2933–44.
- Lawal OD, Aronow HD, Shobayo F, et al. Comparative effectiveness and safety of direct oral anticoagulants and warfarin in patients with atrial fibrillation and chronic liver disease: A nationwide cohort study. Circulation 2023;147:782–94.
- Li G, Lip GYH, Holbrook A, et al. Direct comparative effectiveness and safety between non-vitamin K antagonist oral anticoagulants for stroke prevention in nonvalvular atrial fibrillation: a systematic review and meta-analysis of observational studies. Eur J Epidemiol 2019;34(2):173–90.
- Rutherford OW, Jonasson C, Ghanima W, et al. Comparison of dabigatran, rivaroxaban, and apixaban for effectiveness and safety in atrial fibrillation: a nationwide cohort study. Eur Heart J Cardiovasc Pharmacother 2020;6(2):75-85.
- Graham DJ, Baro E, Zhang R, et al. Comparative stroke, bleeding, and mortality risks in older Medicare patients treated with oral anticoagulants for nonvalvular atrial fibrillation. Am J Med 2019;132(5):596-604.
- Rahme E, Godin R, Nedjar H, et al. Dose specific effectiveness and safety of DOACs in patients with non-valvular atrial fibrillation: A Canadian retrospective cohort study. Thromb Res 2021;203:121–30.
- Giner-Soriano M, Prat-Vallverdú O, Ouchi D, et al. Sex and gender differences in the use of oral anticoagulants for non-valvular atrial fibrillation: A populationbased cohort study in primary health care in catalonia. Front Pharmacol 2023; 14:1110036.
- Rosa M, Llorca D, MartТn CA, et al. Oral anticoagulant adequacy in non-valvular atrial fibrillation in primary care: A cross-sectional study using real-world data (Fantas-TIC Study). Intern J Environm Res Publ Health 2021;18:2244.
- Akpan IJ, Cuker A. Laboratory assessment of the direct oral anticoagulants: who can benefit? Kardiol Pol 2021;79(6):622–30.
- Becattini C, Giustozzi M, Ranalli MG, et al. Variation of renal function over time is associated with major bleeding in patients treated with direct oral anticoagulants for atrial fibrillation. J Thromb Haemost 2018;16(5):833–41.
- Kailas SD, Thambuluru SR. Efficacy and safety of direct oral anticoagulants compared to warfarin in prevention of thromboembolic events among elderly patients with atrial fibrillation. Cureus 2016;8(10):e836.
- Bando S, Nishikado A, Hiura N, et al. Efficacy and safety of rivaroxaban in extreme elderly patients with atrial fibrillation: Analysis of the Shikoku Rivaroxaban Registry Trial (SRRT). J Cardiol 2018;71(2):197–201.
- Cini M, Legnani C, Padrini R, Cosmi B, et al. DOAC plasma levels measured by chromogenic anti-Xa assays and HPLC-UV in apixabanand rivaroxaban-treated patients from the START-Register. Int J Lab Hematol 2020;42(2):214–22.
- Douxfils J, Mani H, Minet V, et al. Non-VKA oral anticoagulants: cccurate measurement of plasma drug concentrations. Biomed Res Int 2015;2015: :345138.
- Douxfils J, Mullier F, Loosen C, et al. Assessment of the impact of rivaroxaban on coagulation assays: Laboratory recommendations for the monitoring of rivaroxaban and review of the literature. Thromb Res 2012 Dec 1;130(6):956–66.
- Gosselin RC, Adcock DM, Bates SM, et al. International Council for Standardization in Haematology (ICSH) Recommendations for Laboratory Measurement of Direct Oral Anticoagulants. Thromb Haemost 2018;118(3):437– 50.
- Gouin-Thibault I, Flaujac C, Delavenne X, et al. Assessment of apixaban plasma levels by laboratory tests: Suitability of three anti-Xa assays a multicentre French GEHT study. Thromb Haemost 2013;111(2):240–8.
- Ahuja T, Raco V, Bhardwaj S, Green D. To measure or not to measure: direct oral anticoagulant laboratory assay monitoring in clinical practice. Adv Hematol 2023;2023 :9511499.
- Sakaguchi T, Osanai H, Murase Y, et al. Monitoring of anti-Xa activity and factors related to bleeding events: A study in Japanese patients with nonvalvular atrial fibrillation receiving rivaroxaban. J Cardiol 2017;70(03):244–9.
- Wada S, Toyoda K, Sato S, et al. Anti-Xa activity and event risk in patients with direct factor Xa inhibitors initiated early after stroke. Circ J 2018;82(11):2872–9.
- Bhagirath VC, Eikelboom JW, Hirsh J, et al. Apixaban-calibrated anti-FXa activity in relation to outcome events and clinical characteristics in patients with atrial fibrillation: results from the AVERROES trial. TH Open 2017;1(02):e139–45.
- Moner-Banet T, Alberio L, Bart PA. Does one dose really fit all? on the monitoring of direct oral anticoagulants: A review of the literature. Hamostaseologie 2020; 40(2):184–200.
- Macedo KA, Tatarian P, Eugenio KR. Infl uence of direct oral anticoagulants on anti-factor Xa measurements utilized for monitoring heparin. Ann Pharmacother 2018;52(2):154–9.
- Wendte J, Voss G, Van Overschelde B. Influence of apixaban on antifactor Xa levels in a patient with acute kidney injury. Am J Health Syst Pharm 2016;73(8): 563–7.
- Faust AC, Kanyer D, Wittkowsky AK. Managing transitions from oral factor Xa inhibitors to unfractionated heparin infusions. Am J Health Syst Pharm 2016; 73(24):2037–41.
