Таргетная деплеция TRBV9+ Т-лимфоцитов в качестве иммунотерапии пациента с анкилозирующим спондилитом
Аутоиммунные заболевания обусловлены формированием долгоживущих клонов Ти/или Влимфоцитов, ошибочно распознающих собственные антигены. Такие клоны могут инициировать иммунный ответ против собственных тканей и клеток организма, вовлекающий те или иные иммунные клетки и механизмы атаки. Избирательная деплеция или подавление активности аутореактивных Т-лимфоцитов является заветной целью в терапии аутоиммунных заболеваний, однако идентификация ассоциированных с развитием заболевания Т-клеточных рецепторов (T-cell receptors, TCR) и распознаваемых ими антигенных эпитопов остается сложной задачей. Недавно был идентифицирован TRBV9-содержащий мотив TCR CD8+ Т-клеток, ассоциированный с патогенезом анкилозирующего спондилита, псориатического артрита и острого переднего увеита, а также пептидные антигены, распознаваемые такими TCR в HLA-B*27 контексте. После успешных доклинических исследований на нечеловекообразных обезьянах мы осуществили первую в мире деплецию TRBV9+ T-лимфоцитов у пациента с анкилозирующим спондилитом. За 3 месяца пациент достиг ремиссии и прекратил лечение ингибиторами фактора некроза опухоли, которые он ранее непрерывно получал в течение 5 лет. К настоящему времени полная ремиссия сохраняется в течение 4 лет на фоне поддерживающей терапии тремя дозами моноклонального антитела к TRBV9 в год. У пациента наблюдается значительное улучшение показателей подвижности позвоночника и индекса BASMI. Таким образом, таргетная деплеция TRBV9+ Т-лимфоцитов является потенциально излечивающей терапией HLA-B*27-ассоциированного спондилоартрита. Специфичное устранение основной причины заболевания без системной иммуносупрессии может стать основой для нового поколения безопасных и эффективных методов лечения аутоиммунных заболеваний
Анкилозирующий спондилит (АС), псориатический артрит и другие спондилоартриты связаны с носительством HLA-B*27:05, что указывает на общий антигенный путь развития этих заболеваний [1]. Две группы авторов описали характерный мотив TCRβ CDR3 CD8+ Т-клеток в периферической крови пациентов с АС по срав нению с HLA-B*27+ здоровыми донорами. У пациентов с AC данный мотив представлен в большем количестве в синовиальной жидкости, чем в периферической крови [2–4]. Концентрация этого CDR3 мотива также повышена в синовиальной жидкости HLA-B*27+ пациентов с реактивным артритом, который представляет собой воспалительный иммунный ответ, вызванный инфекцией, и может впоследствии приводить к развитию АС [5]. Кроме того, недавно мы описали аутопептиды и бактериальные пептиды, которые презентируются HLAB* 27:05 и распознаются соответствующими TCR, связанными с АС. Эти данные подтверждают теорию артритогенного пептида [1,6]. В совокупности полученные данные дают веские основания предполагать, что клоны TRBV9+ CD8+ Т-лимфоцитов, несущие характерный мотив CDR3, вовлечены в развитие аутоиммунитета при АС и других вариантах HLA-B*27-ассоциированных ауто иммунных спондилоартритов, включая острый передний увеит [6], псориатический артрит [7], ювенильный идиопатический артрит и болезнь Крона [8,9] (рис. 1a).
![HLA-B*27-ассоциированные спондилоартриты, а также механизм действия и эффекты анти-TRBV9-иммунотерапии. a. Концепция артритогенного пептида. CD8+ Т-лимфоциты, праймированные микробными пептидами, презентированными HLA-B*27, образуют популяции Т-клеток памяти, которые затем в результате перекрестной реактивности взаимодействуют с собственными пептидами, связанными с HLA-B*27 [22]. В зависимости от хоуминга Т-лимфоцитов и других факторов формируется клиническая картина HLA-B*27-ассоциированного спондилоартрита, характерная для этого аутоиммунного заболевания. b. Терапия цитотоксическими антителами к TRBV9 приводит к полной элиминации TRBV9+ Т-лимфоцитов посредством нескольких механизмов: антителозависимой клеточной цитотоксичности, осуществляемой естественными киллерными клетками (NK), белками комплемента, а также антителозависимого клеточного фагоцитоза макрофагами (MΦ), такими как купферовские клетки печени [23]. c. Анти-TRBV9-терапия направлена на уничтожение клонов TRBV9+ Т-лимфоцитов, в том числе аутоиммунных, но не приводит к системным изменениям ни одной из ветвей Т-клеточного иммунитета. Показаны только наиболее частые сегменты гена TRBV](/img/articles/2024.2/targetnaya-depleciya-trbv9-t-limfocitov-v-kachestve-immunoterapii-pacienta-s-ankiloziruyushchim-spondilitom_fig1.jpg)
Предшествующие исследования на моделях аутоиммунитета и рака у животных продемонстрировали эффективность и безопасность терапевтической деплеции подгруппы Т-лимфоцитов, несущих определенный сегмент гена TCR [10-13].
Мы предположили, что селективная деплеция TRBV9+ Т-лимфоцитов с помощью анти-TRBV9 цитотоксического антитела (рис. 1b) может обеспечить безопасную и эффективную терапию HLA-B*27-ассо ции рованных аутоиммунных заболеваний. Т-лимфоциты, TCR которых содержит бета-цепь семейства TRBV9, составляют приблизительно 4% от всех Т-клеток человека [14]. Таким образом, анти-TRBV9-терапия не подавляет системно какую-либо ветвь адаптивного Т-клеточного ответа (например, Th1, Th2, Th17, Th1-17, Th22, Treg, TFH или CD8+ Т-клетки; рис. 1c), а оставшиеся 96% репертуара наивных Т-клеток и Т-клеток памяти в значительной степени покрывают антигенные специфичности, необходимые для иммунной защиты. Соответственно, такая терапия не должна быть связана с риском системной иммуносупрессии.
Для подтверждения этой гипотезы сначала мы продемонстрировали эффективность и безопасность антитело-опосредованной деплеции TRBV9+ Т-лимфоцитов на нечеловекообразных приматах. Затем мы провели целенаправленную деплецию TRBV9-позитивных Т-лимфоцитов у HLA-B*27+ пациента с АС. Это вмешательство привело к глубокой деплеции целевой популяции клеток и сопровождалось резким улучшением показателей активности заболевания в течение 3 мес после введения препарата. Некоторые симптомы заболевания частично вернулись через 10 мес одновременно с повторным появлением патогенного мотива TCRβ CDR3 среди Т-лимфоцитов периферической крови, что подтверждает его ведущую роль в развитии АС. Пос ледующее проведение анти-TRBV9-терапии привело к устранению патологического мотива TCRβ CDR3 и наступлению полной ремиссии, которая на настоящий момент сохраняется в течение 4 лет на фоне поддерживающей анти-TRBV9-терапии каждые 4 месяца.
Мы надеемся, что развитие методов идентификации связанных с аутоиммунными заболеванием мотивов TCR в ассоциированных контекстах HLA [4,7,8,15-17] позволит разработать таргетные иммунотерапевтические стратегии в отношении как минимум части аутоиммунных заболеваний.
Доклинические исследования
Исследуемый препарат BCD-180, представляющий собой цитотоксическое гуманизированное моноклональное антитело к TRBV9, был произведен АО "БИОКАД" и изучен в доклинических исследованиях. Препарат BCD-180 вызывал выраженную дозозависимую деплецию TRBV9+ Т-лимфоцитов в периферической крови при однократном внутривенном введении макакам-резусам (Macaca mulatta). Это было подтверждено с помощью TRBV9-специфичной полимеразной цепной реакции (ПЦР) в реальном времени (дополнительные данные, рис. 1a–c) и анализа репертуаров TCR (дополнительные данные, рис. 1d–i). У животных, которым вводили препарат в высокой дозе (10 мг внутривенно), деплеция целевой популяции Т-лимфоцитов наблюдалась в течение приблизительно 90 дней, после чего происходило ее постепенное восстановление (дополнительные данные, рис. 1b). Более детальное исследование было проведено на Macaca fascicularis, которым вводили препарат BCD-180 в дозе 3, 10 или 30 мг/кг внутривенно каждые 2 недели в течение 6 недель с 20-недельным периодом наблюдения без введения препарата. Во всех случаях наблюдалась выраженная деплеция TRBV9+ T-лимфоцитов в периферической крови в течение 21 дня после введения первой дозы препарата (дополнительные данные, рис. 1j). Анализ фармакокинетики показал профиль, типичный для терапевтических моноклональных антител [18]. Макси мальная концентрация и площадь под кривой увеличивались пропорционально дозе, что свидетельствует о линейной фармакокинетике (дополнительные данные, рис. 1k). Препарат BCD-180 не вызывал побочных эффектов у M. fascicularis и раздражение в местах введения (дополнительное примечание 1).
Описание пациента с анкилозирующим спондилитом
Мужчина, 1963 года рождения. В детстве развивался нормально. Наследственность не отягощена. Первые симптомы АС появились в возрасте 20 лет после переохлаждения во время пешего похода (рис. 2a). Через некоторое время после незначительной травмы позвоночника отмечено нарастание общей скованности и боли в поясничном отделе в утренние часы, а также боли и ограничения подвижности в тазобедренных суставах. Постепенно появилось выраженное ограничение подвижности в шейном и поясничном отделах позвоночника. В 1986 г. был диагностирован АС. В 1999 г. при рентгенографии костей таза выявлен двусторонний сакроилиит III стадии (дополнительные данные, рис. 2), в это же время обнаружен HLA-B*27. С 1983 по 2004 г. пациент принимал индометацин, дозу которого постепенно увеличивал в связи со снижением эффективности. В этот период ограничение подвижности постепенно распространилось на все отделы позвоночника. С 2004 по 2009 г. проводилась терапия ингибитором фактора некроза опухоли альфа (ФНОα) инфликсимабом, который вызывал уменьшение боли и скованности в позвоночнике, однако после 5-летнего применения эффект препарат был утрачен. До 2009 г. активность заболевания оставалась высокой (рис. 2b, c). В мае 2009 г. пациенту проведена аутологичная трансплантация гемопоэтических стволовых клеток (ТГСК) [19,20], что привело к стабильной ремиссии АС длительностью около 2 лет. В этот период в периферической крови пациента наблюдалось снижение доли связанного с АС мотива CDR3 Т-клеток, что подтверждено данными глубокого анализа репертуаров TCRβ и таргетного анализа репертуаров TRBV9 (рис. 2m, показано стрелкой).
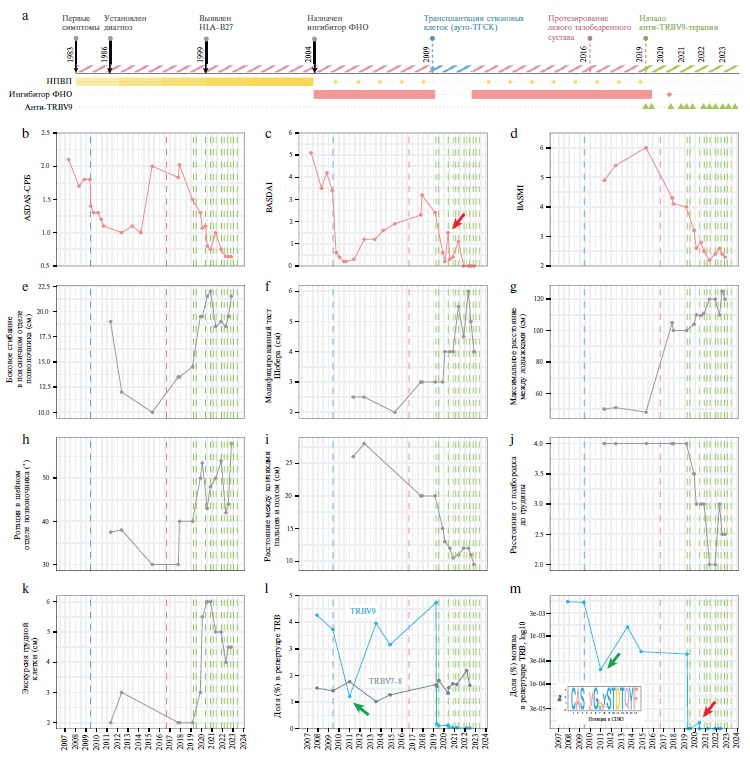
2013 г. активность заболевания повысилась. С 2013 по 2019 г. проводилась терапия различными ингибиторами ФНОα, в том числе инфликсимабом, адалимумабом, голимумабом и цертолизумаба пэголом. Эффект каждого из них сохранялся в течение 0,5–1 года, но после 1–2 лет терапии другим ингибитором ФНОα пациент возвращался к ранее применявшимся препаратам этой группы, которые снова демонстрировали достаточно высокую эффективность. По данным клинического обследования и рентгенографии тазобедренных суставов, у пациента был диагностирован двусторонний коксит. В 2016 г. после тотального эндопротезирования левого тазобедренного сустава было достигнуто значительное улучшение индекса BASMI за счет увеличения объема движений в тазобедренных суставах (рис. 2d, g). Несмотря на продолжающуюся терапию ингибиторами ФНОα, пациент попрежнему испытывал боль и скованность во всех отделах позвоночника, выраженное ограничение движений в шейном отделе и боль в правом тазобедренном суставе.
Лечение моноклональным антителом к TRBV9 в дозе 60 мг внутривенно было начато 27 марта 2019 г. после получения одобрения этическим комитетом Россий ского национального исследовательского медицинского университета имени Н.И. Пирогова и предоставления письменного информированного согласия. Премеди кация включала однократное введение преднизолона (120 мг внутривенно), ондансетрона (8 мг внутривенно), хлоропирамина (20 мг внутримышечно) и парацетамола (1000 мг внутрь). Во время инфузии у пациента наблюдались легкая усталость, тошнота и преходящая артериальная гипертония, что, вероятно, было связано с введением глюкокортикостероида. Нежелательных явлений 2–4-й степени тяжести зарегистрировано не было. Через 10 дней после начала лечения у пациента резко снизилась доля TRBV9+ T-лимфоцитов в периферической крови, что подтверждено результатами анализа репертуаров TCRβ в мононуклеарных клетках периферической крови (рис. 2l и дополнительные данные, рис. 3) и ПЦР в реальном времени (дополнительные данные, рис. 4). Из периферической крови исчез мотив CDR3, связанный с АС (рис. 2m). В то же время представленность Т-лимфоцитов, несущих TCR c TRBV других семейств, оставалась неизменной (дополнительные данные, рис. 3a), а общая клональность репертуара TCRβ не изменилась (дополнительные данные, рис. 3b).
В течение 3 мес после введения препарата самочувствие пациента постепенно улучшилось (рис. 2b–k). У него исчезли утренняя скованность в позвоночнике и боль в правом тазобедренном суставе, а физическая активность увеличилась. Эти положительные эффекты сохранялись. Пациент начал активно заниматься лечебной физкультурой с упором на дыхательные мышцы, мышцы передней брюшной стенки и конечностей. Ранее такая активность была ограничена из-за сильных болей в суставах и ухудшения самочувствия. В этот период пациент прекратил терапию ингибитором ФНОα.
С целью элиминации TRBV9+ Т-лимфоцитов, которые могли сохраниться в организме пациента, в июле 2019 г. была введена вторая доза (120 мг) анти-TRBV9терапии, несмотря на продолжающуюся ремиссию. В ходе введения второй (более высокой) дозы моноклонального антитела к TRBV9 у пациента не наблюдалось побочных эффектов. По-видимому, это было связано с тем, что после введения первой дозы препарата доля TRBV9+ Т-лимфоцитов в крови у него была крайне низкой (рис. 2l).
После периода устойчивой ремиссии в марте 2020 г. у пациента вновь начали появляться симптомы заболевания после физического перенапряжения: боль в верхней части грудной клетки и чувство стеснения и скованности в виде "кольца" в области грудной клетки. Пациент также сообщал о неприятных ощущениях и чувстве тяжести в нижних конечностях после нахождения в положении стоя в течение 5–10 минут. Отмечено также увеличение индекса BASDAI (рис. 2c, показано стрелкой). Хотя общая доля TRBV9+ Т-лимфоцитов в периферической крови оставалась чрезвычайно низкой (рис. 2l), глубокий таргетный анализ репертуаров TRBV9 TCR показал повторное появление мотивов CDR3, связанных с АС (рис. 2m, стрелка). На основании этих данных в мае 2020 г. пациенту была повторно проведена анти-TRBV9-терапия (в дозе 160 мг), при этом побочных эффектов не возникло. Клинические симптомы заболевания полностью исчезли в течение 10 дней после инфузии. Следует отметить, что одновременно мотив CDR3, связанный с АС, исчез из периферической крови и более не определялся (рис. 2m). В дальнейшем пациент получал инфузии моноклонального антитела к TRBV9 один раз в 4 месяца в дозе 320–500 мг (рис. 2а) без побочных эффектов.
На момент написания статьи у пациента наблюдается полная ремиссия (исходя из стандартных индексов активности заболевания) в течение 4 лет с момента начала анти-TRBV9-терапии (рис. 2b, c). Пациент больше не получает терапию ингибиторами ФНОα. Также отмечено улучшение показателей подвижности позвоночника и индекса BASMI (рис. 2d–k). Мы связываем эти улучшения со снижением выраженности мышечной боли и скованности.
С 2016 по 2019 г. у пациента наблюдалось рентгенологическое прогрессирование в шейном отделе позвоночника: увеличение модифицированного индекса mSASSS (modified Stoke Ankylosing Spondylitis Spine Score) с 21 до 25 баллов. По данным рентгенографии в 2022 г., этот показатель стабилизировался на уровне 26 баллов (дополнительные данные, рис. 5b). Рентгено грам мы правого тазобедренного сустава с 2020 по 2023 г. показали постепенное разрушение одного из остеофитов, который постоянно увеличивался в размерах на протяжении всего предшествующего периода наблюдения (дополнительные данные, рис. 6). Оценка синдесмофитов, энтезофитов и других остеофитов не показала прогрессирования заболевания.
Обсуждение
В данной статье описана таргетная иммунотерапия аутоиммунного заболевания с использованием моноклонального антитела, вызывающего избирательную деплецию узкой TRBV9-содержащей подгруппы Т-лимфоцитов, включающей клоны, связанные с развитием аутоиммунитета. Исследуемая терапия оказалась успешной и привела к долгосрочной полной ремиссии заболевания при недостаточной эффективности предшествующих методов лечения. Это продемонстрировало осуществимость, переносимость и эффективность антитело-опосредованной деплеции TRBV9+ Т-лимфоцитов для лечения АС.
В настоящее время анти-TRBV9-терапия изучается в клинических исследованиях II и III фазы у пациентов с АС (https://clinicaltrials.gov/ct2/show/NCT05445076). Потенциально она применима и к другим HLA-B*27-ассоциированным заболеваниям, таким как псориатический артрит, острый передний увеит, ювенильный идиопатический артрит и болезнь Крона, поскольку недавние исследования показали, что характерный мотив CDR3 TRBV9 широко представлен у HLA-B*27+ пациентов [6,7].
В будущем описанная выше стратегия специфичного устранения группы Т-клеток, включающей те, которые являются основной причиной заболевания, не сопровождающаяся системной иммуносупрессией, может быть использована и для лечения других аутоиммунных заболеваний (для которых будут выявлены семейства TCR, ассоциированные с болезнью), в том числе сахарного диабета 1-го типа [16], рассеянного склероза [21] и не-HLA-B*27-ассоциированной болезни Крона [17]. Возможно, когда-нибудь будет создана коллекция терапевтических моноклональных антител к различным сегментам TRBV и TRAV TCR. Это позволит каждому пациенту получать персонализированную иммунотерапию, основанную на идентификации клонов, участвующих в патогенезе заболевания, и выборе подходящего терапевтического моноклонального антитела или их комбинации.
Материал и методы
Одобрение этическим комитетом. Исследование было одобрено этическим комитетом РНИМУ им. Н.И. Пи ро гова (протокол № 221). Пациент предоставил письменное информированное согласие. Исследование было проведено в соответствии с рекомендациями CARE и принципами Хельсинкской декларации. Локальный этический комитет Научно-исследовательского института медицинской приматологии одобрил проведение экспериментов на животных.
Доклинические исследования. Для эксперимента были отобраны 12 самцов Macaca mulatta в возрасте 5–8 лет, прошедшие карантин. Образцы периферической крови для анализа репертуаров TCR с помощью секвенирования нового поколения (next generation sequencing, NGS) и ПЦР в реальном времени собирали непосредственно до и через 3, 6, 14, 22, 40, 90, 150 и 300 дней после однократного внутривенного введения препарата BCD-180 или иммуноглобулинов IgG человека. Животные были распределены на три группы: две экспериментальные и одну контрольную (по 4 в каждой). Животные в одной экспериментальной группе получали препарат BCD-180 в дозе 1 мг внутривенно, в другой – в дозе 10 мг внутривенно. Животные в контрольной группе получали человеческий иммуноглобулин IgG внутривенно (Мик роген). Животные были распределены по группам по результатам рандомизации для обеспечения равномерного распределения по массе тела в каждой группе.
В отдельном эксперименте 40 особей Macaca fascicularis (20 самцов и 20 самок) в возрасте 4–7 лет, прошедших карантин, были разделены на четыре группы (5 самцов и 5 самок в каждой группе). Животным различных групп вводили BCD-180 в дозах 3, 10, 30 мг/кг или плацебо один раз каждые 2 недели в течение 6 недель, после чего следовал 20-недельный период без лечения. Животных распределяли по группам по результатам рандомизации для обеспечения равномерного распределения по массе тела и пола в каждой группе. Животных содержали в соответствии с Европейской конвенцией по защите позвоночных животных, используемых в экспериментальных и других научных целях, с учетом видоспецифичных положений для нечеловекообразных приматов.
Исследование иммунотоксичности на Macaca fascicularis. Образцы периферической крови отбирали в пробирки Vacuette с гепарином (Greiner Bio-One) непосредственно перед введением препарата BCD-180 и через 3, 5, 7, 13, 18 и 25 недель после него. Образцы готовили в соответствии с методологией производителя (https://www.bdbiosciences.com/en-us/resources/protocols/ stain-lyse-no-wash). Образцы крови инкубировали со смесью меченных антител в течение 30 мин при температуре 37 °С и влажности 70–80%. Лизис эритроцитов проводили с использованием прибора для сортировки клеток, активируемой флуоресценцией (fluorescence-activated cell sorting, FACS) (Becton Dickinson). Субпо пуляционный состав лимфоцитов оценивали на проточном цитометре Guava easyCyte (Merck Millipore) с использованием реактивов меченных антител CD3PerCP-Cy5.5, клон SP34-2; CD4-FITC, клон L200; CD8PE, клон RPA-T8; CD20-FITC, клон 2H7, клон CD16-PE3G8 и клон CD56-PE MY31 (BD Biosciences). Была проведена количественная оценка следующих субпопуляций клеток: B-лимфоциты (CD20+), T-лимфоциты (CD3+), Th-лимфоциты (CD3+CD4+), цитотоксические CD8+ Т-лимфоциты (CD3+CD8+) и NK (CD3−CD16/56+). Данные обрабатывали с помощью программного обеспечения InCyte guavaSoft. Образцы периферической крови для анализа состава иммуноглобулинов отбирали с использованием пробирок Vacuette с активатором свертывания (Greiner Bio-One) для получения не менее 0,6 мл сыворотки непосредственно перед инъекцией препарата BCD-180 и через 6, 13 и 26 недель после нее. Уровень IgE в сыворотке крови определяли с помощью набора IgE обезьян для ИФА Monkey IgE ELISA kit (Life Diagnostics). IgA, IgG и IgM определяли в сыворотке крови на автоматическом биохимическом анализаторе HTI BioChem FC-360 (High Technology) с использованием стандартных наборов.
Анализ репертуаров TCRβ. Образцы периферической крови отбирали в пробирки Vacuette с ЭДТК. Мононуклеарные клетки выделяли из 6 мл периферической крови путем центрифугирования в градиенте плотности в растворе фиколла (Панэко). Клетки промывали буфером Хэнка; общую РНК экстрагировали с помощью набора RNeasy Mini (Qiagen) с обработкой ДНКазой. Подготовку библиотек кДНК TCRβ, меченных уникальным молекулярным идентификатором (unique molecular identifier, UMI), проводили с использованием набора Monkey TCR RNA (MiLaboratories) и набора Human TCR RNA Multiplex (MiLaboratories) в соответствии с инструкциями производителя. Для синтеза кДНК использовали 200 нг РНК мононуклеарных клеток периферической крови. Библиотеки кДНК TCRβ, ориентированные на TRBV9, готовили с использованием адаптированной версии набора Human TCR RNA Multiplex (MiLaboratories). Секвенирование проводили на Illumina MiSeq и NextSeq 550 с использованием парных прочтений длиной 150 + 150 нуклеотидов. Для группировки результатов на основе UMI и коррекции ошибок использовали MIGEC [24]. Экстракцию репертуаров TCRβ CDR3 проводили с помощью MiXCR [25]. Для последующего анализа использовали VDJtools [26].
Количественная оценка количества TRBV9 с помощью ПЦР в режиме реального времени. Образцы периферической крови отбирали у обезьян непосредственно перед первым введением анти-TRBV9 и через 21 день после него. Образцы периферической крови у пациента отбирали регулярно с помощью пробирок Vacuette. Мононуклеарные клетки периферической крови выделяли с использованием градиентного протокола в растворе фиколла (Панэко), промывали буфером Хэнка, а затем экстрагировали суммарную РНК с помощью набора RNeasy Mini (Qiagen) с обработкой ДНКазой. Синтез кДНК проводили с использованием обратной транскриптазы SmartScribe (Takara Bio) с короткими олигонуклеотидами BC4 в соответствии с протоколом производителя (структуры олигонуклеотидов приведены в дополнительной таблице 1). Для синтеза первой цепи кДНК использовали 300 нг РНК. ПЦР в реальном времени проводили в трех повторах с использованием набора qPCRmix-HS SYBR (Евроген) и следующих специфических олигонуклеотидов в конечной концентрации 0,2 мкМ каждого: для TRBV9 – прямой TRBV9-специфичный и обратный BCuni2; для TRBV7 – прямой TRBV7-специфичный и обратный BCuni2; а для TRBC – прямой BC_for_hum и обратный BC_rev_hum (только для образцов пациента). Для оценки различий в пороговых циклах между целевыми сегментами гена TRBV9 и эталонными сегментами гена TRBV7 (где TRBV7 представляет собой сумму сегментов гена TRBV7), а также между TRBV и эталонным сегментом TRBC до введения анти-TRBV9 терапии и в несколько моментов времени после этого применяли метод 2-ΔΔCT.
Статистический анализ. Для проверки равенства медиан распределения TRBV9/7 между моментами времени использовали тест Краскела – Уоллиса, а затем, при необ хо димости, тест Даннетта с уровнем значимости 95% с поправкой на эффект множественных сравнений. Статистический анализ и визуализацию проводили с использованием программной среды R v.3.14. (https:// www.R-project.org) и пакетов ggplot2 v3.4.3 [27] и ggseqlogo v0.1 [[28].
Доступность данных. Репертуары TCRβ CDR3 и метаданные представлены на ресурсе Figshare: https:// figshare.com/projects/TRBV9_depletion_TCR_repertoires/1713 69. Репертуары TCRβ CDR3 и метаданные Macaca mulatta доступны по ссылке: https://doi.org/ 10.6084/m9.figshare. 23609148.v2. Группа репертуаров TCR пациента представлена по ссылке: https://doi.org/10.6084/m9.figshare.23609970.v3. Репертуары TRBV9 TCR пациента доступны по ссылке: https://doi.org/10.6084/m9.figshare.23611209.v2.
Используемые источники
- Benjamin R, Parham P. Guilt by association: HLA-B*27 and ankylosing spondylitis. Immunol Today 1990;11:137–42.
- Faham M, Carlton V, Moorhead M, et al. Discovery of T cell receptor β motifs specific to HLA-B*27-positive ankylosing spondylitis by deep repertoire sequence analysis. Arthritis Rheumatol 2017;69(4):774–84.
- Komech EA, Pogorelyy MV, Egorov ES, et al. CD8+ T cells with characteristic T cell receptor beta motif are detected in blood and expanded in synovial fluid of ankylosing spondylitis patients. Rheumatology (Oxford) 2018;57(6):1097–104.
- Pogorelyy MV, Minervina AA, Shugay M, et al. Detecting T cell receptors involved in immune responses from single repertoire snapshots. PLoS Biol 2019; 17(6):e3000314.
- May E, Dulphy N, Frauendorf E, et al. Conserved TCR beta chain usage in reactive arthritis; evidence for selection by a putative HLA-B*27-associated autoantigen. Tissue Antigens 2002;60(4):299–308.
- Yang X, Garner LI, Zvyagin IV, et al. Autoimmunity-associated T cell receptors recognize HLA-B*27-bound peptides. Nature 2022;612(7941):771–7.
- Komech EA, Koltakova AD, Barinova AA, et al. TCR repertoire profiling revealed antigen-driven CD8+ T cell clonal groups shared in synovial fluid of patients with spondyloarthritis. Front Immunol 2022;13:973243.
- Garrido-Mesa J, Brown MA. T cell repertoire profiling and the mechanism by which HLA-B*27 causes ankylosing spondylitis. Curr Rheumatol Rep 2022; 24(12):398–410.
- Bowness P. HLA-B*27. Annu Rev Immunol 2015;33:29–48.
- Chiocchia G, Boissier MC, Fournier C. Therapy against murine collagen-induced arthritis with T cell receptor V beta-specific antibodies. Eur J Immunol 1991; 21:2899–905.
- Liu Z, Cort L, Eberwine R, et al. Prevention of type 1 diabetes in the rat with an allele-specific anti-T-cell receptor antibody: Vβ13 as a therapeutic target and biomarker. Diabetes 2012;61(5):1160–8.
- Paul S, Pearlman AH, Douglass J, et al. TCR β chain-directed bispecific antibodies for the treatment of T cell cancers. Sci Transl Med 2021;13(584):eabd3595.
- Maciocia PM, Wawrzyniecka PA, Philip B, et al. Targeting the T cell receptor βchain constant region for immunotherapy of T cell malignancies. Nat Med 2017; 23(12):1416–23.
- Putintseva EV, Britanova OV, Staroverov DB, et al. Mother and child T cell receptor repertoires: deep profiling study. Front Immunol 2013;4:463.
- Xue Z, Wu L, Tian R, et al. Disease associated human TCR characterization by deep-learning framework TCR-DeepInsight. Preprint at bioRxiv https://doi.org/ 10.1101/2023.05.22.541406 (2023).
- Nakayama M, Michels AW. Using the T cell receptor as a biomarker in type 1 diabetes. Front Immunol 2021;12:777788.
- Rosati E, Rios Martini G, Pogorelyy MV, et al. A novel unconventional T cell population enriched in Crohn's disease. Gut 2022;71(11):2194–204.
- Valente D, Mauriac C, Schmidt T, et al. Pharmacokinetics of novel Fc-engineered monoclonal and multispecific antibodies in cynomolgus monkeys and humanized FcRn transgenic mouse models. MAbs 2020;12(1):1829337.
- Mamedov IZ, Britanova OV, Bolotin DA, et al. Quantitative tracking of T cell clones after haematopoietic stem cell transplantation. EMBO Mol Med 2011; 3(4):201–7.
- Britanova OV, Bochkova AG, Staroverov DB, et al. First autologous hematopoietic SCT for ankylosing spondylitis: a case report and clues to understanding the therapy. Bone Marrow Transplant 2012;47(11):1479–81.
- Hayashi F, Isobe N, Glanville J, et al. A new clustering method identifies multiple sclerosis-specific T-cell receptors. Ann Clin Transl Neurol 2021;8(1):163–76.
- Sewell A. Why must T cells be cross-reactive? Nat Rev Immunol 2012;12:669–77.
- Montalvao F, Garcia Z, Celli S, et al. The mechanism of anti-CD20-mediated B cell depletion revealed by intravital imaging. J Clin Invest 2013;123(12):5098–103.
- Shugay M, Britanova OV, Merzlyak EM, et al. Towards error-free profiling of immune repertoires. Nat Methods 2014;11(6):653–5.
- Bolotin DA, Poslavsky S, Mitrophanov I, et al. MiXCR: software for comprehensive adaptive immunity profiling. Nat Methods 2015;12(5):380–1.
- Shugay M, Bagaev DV, Turchaninova MA, et al. VDJtools: Unifying Post-analysis of T Cell Receptor Repertoires. PLoS Comput Biol 2015;11(11):e1004503.
- Wickham H. ggplot2: Elegant Graphics for Data Analysis 1st edn (SpringerVerlag, 2009).
- Wagih O. ggseqlogo: a versatile R package for drawing sequence logos. Bioinformatics 2017;33:3645–7.
