Фармакоэкономическое исследование препаратов, применяемых при лечении псориаза среднетяжелой и тяжелой степени у пациентов с неэффективностью базовой системной терапии
Фармакоэкономический анализ использования генно-инженерных биологических препаратов (ГИБП) и апремиласта для лечения больных псориазом среднетяжелой и тяжелой степени с позиции российской системы здравоохранения.
Построена модель “древо принятия решений”, с помощью которой оценивали исходы лечения и затраты на него по схемам терапии. Каждая схема начиналась с одного из сравниваемых препаратов для лечения псориаза (1-я линия), в дальнейшем внутри каждой схемы было смоделировано переключение на препараты 2-й и 3-й линий. Выбор последних осуществлялся в соответствии с отраженной в литературе практикой. В качестве сравниваемых альтернатив выступали этанерцепт, адалимумаб, инфликсимаб (референтный и биоаналог), устекинумаб, секукинумаб, апремиласт. Продолжительность лечения каждым препаратом основывалась на данных международных регистров пациентов, эффективность – на данных мета-анализов. Горизонт моделирования составил три года. Это позволило сравнить затраты на каждую из схем с отражением длительности применения препаратов, основанной на реальной клинической практике. Были выполнены анализ “затраты-эффективность” и анализ чувствительности.
Наименьшей стоимостью 3-летнего лечения в расчете на одного пациента обладает схема, начинающаяся с этанерцепта. В то же время наилучшим показатель “затраты-эффективность” был у схемы терапии, начинающейся с секукинумаба. Анализ чувствительности продемонстрировал устойчивость полученных результатов при снижении цен на препараты сравнения до 5%.
В условиях российского здравоохранения с клинико-экономической точки зрения наиболее рациональным препаратом для инициации терапии псориаза среднетяжелой и тяжелой степени у пациентов с неэффективностью базовой системной терапии является секукинумаб.
Псориаз – это системное неинфекционное иммуноассоциированное заболевание, характеризующееся ускоренной пролиферацией кератоцитов и нарушением их дифференцировки, иммунными реакциями в дерме и синовиальных оболочках, дисбалансом между провоспалительными и противовоспалительными цитокинами, хемокинами [1]. Распространенность псориаза в разных странах варьируется от 0,09 до 11,4% у взрослых и от 0 до 1,4% у детей [2-6]. Средний возраст дебюта псориаза – 15-20 лет, второй пик приходится на 50-69 лет [7-10]. В 2015 г. в России было зарегистрировано 341 339 больных псориазом, а распространенность составила 233,4 на 100 тыс. населения [11]. Среди взрослых псориаз выявляют в 2 раза чаще, чем среди детей. Мужчины болеют несколько чаще, чем женщины [12,13].
Социальная значимость псориаза определяется дебютом в трудоспособном возрасте, неблагоприятным прогнозом заболевания в случае отсутствия адекватной терапии, более высоким риском развития сопутствующих заболеваний и смерти. Мужчины и женщины с тяжелым псориазом умирают на 3,5 и 4,4 года раньше, соответственно, чем люди без этого дерматоза [14]. Псориаз вызывает не только физические и эмоциональные страдания, но и снижает качество жизни, приводит к инвалидности, потере производительности [15].
Целями терапии псориаза являются уменьшение клинических проявлений и частоты рецидивов заболевания, устранение субъективных ощущений, улучшение качества жизни пациентов в целом, профилактика утраты трудоспособности и контроль над течением сопутствующих заболеваний [1,16-18]. Современная стратегия лечения псориаза получила название "лечение до достижения цели" (Treat-to-Target – Т2Т) [18]. Ее суть сводится к длительному применению высокоэффективных и безопасных лекарственных средств (методов) с целью достижения стойкой ремиссии либо минимальной активности патологического процесса [18]. Препараты, используемые для достижения целей стратегии Т2Т, должны оказывать таргетное действие, обеспечивать длительное сохранение терапевтического ответа и высокую приверженность к терапии, обладать благоприятным профилем безопасности и низкой иммуногенностью [1,18]. Современные генно-инженерные биологические препараты (ГИБП) в полной мере соответствуют терапевтической стратегии Т2Т и делают возможным достижение максимально высоких результатов терапии псориаза, позволяя пациентам жить полноценной жизнью [17-19]. ГИБП, применяющиеся для лечения псориаза (за исключением этанерцепта), представляют собой моноклональные антитела к патогенетически значимым факторам воспаления. Изби ра тельное влияние на ключевые звенья иммунопатогенеза псориаза приводит к быстрому началу действия, высокой и стойкой эффективности препаратов [1].
Для анализа эффективности лечения больных псориазом используется Индекс площади и тяжести псориаза (Psoriasis Area and Severity Index – PASI), который представляет собой систему оценки распространенности поражения кожи и тяжести заболевания [16,17]. Большинство больных псориазом отвечают на терапию ГИБП уже через 10-12 недель [20-26], в связи с чем, по мнению ряда авторов, в качестве нового стандарта эффективности терапии следует использовать снижение индекса PASI более чем на 90% (PASI 90) [27].
Лечение ГИБП при псориазе проводится в два этапа: индукционный период (до 12 недель), когда решается вопрос о дальнейшем продолжении терапии, и период поддерживающей терапии, длящийся от нескольких недель до нескольких лет [28]. В конце индукционного периода (3 мес) лечение должно быть изменено, если не достигнут "приемлемый ответ", т.е. имеется так называемая "первичная неэффективность", критериями которой являются площадь пораженной кожи (BSA) 1-3% или PASI <75 [17,29-31]. В таких случаях рекомендуется последовательное увеличение дозы, уменьшение интервалов между введениями, комбинированное применение ГИБП и низких доз метотрексата (10-15 мг в неделю), назначение ГИБП с другим механизмом действия [29-31]. В случае отказа от терапии или ее смены из-за развития нежелательных явлений (НЯ) также рекомендуется назначить ГИБП с иным механизмом действия [29-31].
Основной причиной прекращения поддерживающей терапии ГИБП является "эффект ускользания", т.е. развитие вторичной неэф фективности лечения (утрата первичного ответа на 50% и более), которая главным образом связана с появлением нейтрализующих антител к препарату [28]. При появлении "эффекта ускользания" на любом сроке терапии рекомендуют последовательное увеличение дозы ГИБП, уменьшение интервала между введениями, назначение низких доз метотрексата (либо циклоспорина или УФБ-терапии) на фоне продолжения терапии ГИБП либо замена препарата на другой с меньшей иммуногенностью [28].
В РФ для лечения больных псориазом в случае неэффективности стандартной системной терапии зарегистрированы следующие препараты:- ингибиторы фактора некроза опухоли-α (ФНО-α) – этанерцепт, адалимумаб, инфликсимаб (оригинальный и биоаналог);
- ингибитор интерлейкина (ИЛ)-12/23 устекинумаб;
- ингибитор ИЛ-17А секукинумаб;
- ингибитор фосфодиэстеразы (ФДЭ)-4 апремиласт.
Важно отметить, что апремиласт, в отличие от этанерцепта, адалимумаба, инфликсимаба, устекинумаба и секукинумаба, не является ГИБП и представляет собой "малую молекулу", действующую внутри клетки и вызывающую подавление воспалительной реакции за счет модуляции экспрессии ФНО-α, ИЛ-23, ИЛ-17.
Все перечисленные выше препараты включены в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), а также в перечень для обеспечения лекарственными препаратами льготных категорий граждан, что подразумевает закупки данных препаратов за счет государственного бюджета. В условиях ограниченного финансирования важную роль в оценке целесообразности затрат государственных средств на те или иные технологии здравоохранения играет их клинико-экономическая эффективность.
Целью данного исследования был сравнительный клинико-экономический анализ применения различных ГИБП и апремиласта в российской клинической практике для лечения больных обыкновенным псориазом среднетяжелой и тяжелой степени в рамках программы государственных гарантий (ПГГ) бесплатного оказания гражданам медицинской помощи.
Материал и методы
Клинико-экономический анализ был проведен согласно Методическим рекомендациям ФГБУ "ЦЭККМП" Мин здра ва России [32] с точки зрения системы здравоохранения РФ в рамках ПГГ бесплатного оказания гражданам медицинской помощи. Влияние на состояние пациентов и стоимость лечения среднетяжелого и тяжелого псориаза были рассчитаны с точки зрения лиц, участвующих в лечении псориаза или принимающих решение о возмещении затрат пациентам на препараты: дерматовенерологов, клинических фармакологов, главных специалистов, специалистов по экономике здравоохранения, членов формулярных комитетов, организаторов здравоохранения и других.
Целевой популяцией исследования были пациенты старше 18 лет с псориазом среднетяжелой и тяжелой степени, ранее не получавшие ГИБП и не отвечающие на стандартную системную терапию. Временной горизонт исследования составил 3 года (1096 дней). Количество анализируемых пациентов в каждой моделируемой альтернативной группе по 1000 человек.
В качестве показателя клинической эффективности была использована вероятность улучшения индекса PASI более чем на 90% по сравнению с исходным (PASI 90). Источ никами данных о клинической эффективности служили рандомизированные клинические исследования, мета-анализы, систематизированные обзоры, а также регистры пациентов с псориазом.
Были рассчитаны коэффициенты "затраты-эффективность" на основании сравнения отношений прямых медицинских затрат и эффективности, выраженной в вероятности достижения индекса PASI 90. Наиболее эффективной считали стратегию с самым низким значением данного показателя, что подразумевает меньшие затраты финансовых средств для достижения выбранной единицы эффективности.
Клинико-экономическое моделирование проводили путем построения модели по типу "древа принятия решений", представляющего схему развития заболевания после назначения одной из выбранных лекарственных альтернативы клинических исходов, происходящих с определенной вероятностью. Источником информации о частоте развития клинических состояний были опубликованные данные рандомизированных клинических исследований и регистров. На рис. 1 представлена ветвь модели для одной из альтернативных стратегий лечения.
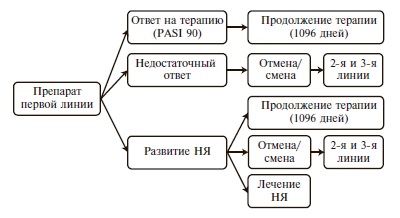
Прямые медицинские затраты учитывали расходы на 1-ю линия терапии, визиты пациентов в дневной стационар и амбулаторно-поликлинические учреждения для введения препаратов сравнения в рамках ПГГ, препараты 2-й и 3-й линий при смене терапии из-за недостаточного ответа, развития НЯ, отказа пациента от лечения данным препаратом и других причин, терапию НЯ. Дисконтирование прямых медицинских затрат и терапевтических исходов проводилось по ставке 5% в год [33]. Анализ затрат включал прямые медицинские затраты, связанные с использованием медикаментозной терапии, и медицинские услуги.
Затраты на лекарственные препараты. Согласно дизайну исследования, при терапии тем или иным препаратом у пациентов регистрировали показатели эффективности (PASI 90), безопасности (вероятность отмены/смены терапии из-за недостаточного ответа, НЯ, решения пациента и других причин), а также среднюю продолжительность терапии (drug survival), включая период индукции ремиссии и поддерживающего лечения вплоть до его отмены/смены. В разработанной фармакоэкономической модели использовали понятие "схемы терапии", обозначаемой по названию препарата, с которой ее начинали. Если пациент достигал приемлемого ответа на лечение этим пре паратом (PASI 90), то общая продолжительность рассматриваемой в модели терапии препаратом 1-й линии составляла 3 года (1096 дней). Если же у больного регистрировали недостаточный ответ на терапию, развитие НЯ, требующих отмены/смены терапии, или отмену терапии по решению самого пациента, то его переводили на другой препарат (2-й или 3-й линии), однако при этом все затраты все равно относили к исходной схеме.
Внутри каждой схемы терапии для каждой линии (1-й, 2-й, 3-й) регистрировали среднюю продолжительность терапии и рассчитывали стоимость поддерживающей терапии до ее отмены/смены. Стоимость индукционного лечения учитывали только в 1-й линии и не рассчитывали для 2-й и 3-й линии, поскольку смену ГИБП проводят без так называемого "периода отмывки" [1].
Дозы, схемы применения изучаемых препаратов и их стоимость указаны в табл. 1. Для расчетов стоимости препаратов сравнения использовали цены за 2018 г., взятые из Государственного реестра предельных отпускных цен с учетом НДС (10%) и средней оптовой надбавки (10%) [34].
| Препарат | Стоимость 1 флакона*, руб. | Путь введения | Дозы и схема применения | |
|---|---|---|---|---|
| Индукционный период | Поддерживающий период | |||
| Примечания: п/к – подкожно; в/в – внутривенно; п/о – перорально. *для апремиласта указана стоимость за 1 упаковку. Инструкции по медицинскому применению: https://grls.rosminzdrav.ru/grls.aspx. Предельные отпускные цены: https://grls.rosminzdrav.ru/pricelims.aspx | ||||
| Этанерцепт 50 мг/мл | 13 790,98 | п/к | нет | 50 мг в неделю |
| Адалимумаб 40 мг/0,8 мл | 35 302,31 | п/к | 80 мг в первую неделю | 40 мг 1 раз в 2 недели, начиная через неделю после индукционной дозы |
| Инфликсимаб 100 мг | 31 598,99 | в/в | 5 мг/кг 0, 2 и 6 недель | 5 мг/кг каждые 8 недель |
| Устекинумаб 45 мг/0,5 мл | 231 352,00 | п/к | 45 мг в первую и четвертую недели | 45 мг через 4 недели после индукционной дозы каждые 12 недель |
| Секукинумаб 150 мг/мл | 41 803,81 | п/к | 300 мг/нед в течение 4-х недель | 300 мг 1 раз в 4 недели |
| Апремиласт №27 | 21 056,88* | п/о | титрование 14 дней | - |
| Апремиласт 30 мг №56 | 43 668,92* | п/о | - | 30 мг 2 раза в день |
Затраты на медицинские услуги. В модели учитывался способ введения препарата, так как от этого зависят затраты медицинских организаций на ведение больных. Согласно использованной методологии, внутривенное введение производилось в условиях дневного стационара, подкожное – в амбулаторно-поликлинических учреждениях, пероральное – в домашних условиях самим пациентом. Стоимость медицинских услуг и посещений специалистов рассчитывали на основе территориальной ПГГ бесплатного оказания медицинской помощи в г. Москве на 2017 г. [35]. Согласно этой программе, стоимость тарифа лечения в условиях дневных стационаров за счет средств обязательного медицинского страхования составляет 719,29 руб., стоимость посещения амбулаторно-поликлинических медицинских организаций для подкожного введения ГИБП составляет 450,50 руб. и складывается из стоимости подкожной инъекции (38,54 руб.) и приема врача-дерматовенеролога (411,96 руб. = 274,64 руб. × 1,5 УЕТ1) [35].
Результаты
Эффективность препаратов сравнения и продолжительность терапии.В ходе информационного поиска было найдено 5 систематизированных обзоров и мета-анализов, сравнивающих эффективность препаратов при лечении псориаза среднетяжелой и тяжелой степени [36,40]. А. Nast и соавт. (2015 г.) сопоставили эффективность ГИБП и апремиласта на основании 25 рандо мизированных клинических исследований в целом у 11 279 пациентов, которым назначали этанерцепт, адалимумаб, инфликсимаб, устекинумаб, секукинумаб и апремиласт [37]. Полученные данные послужили основой для сравнительной оценки эффективности препаратов сравнения в настоящем фармакоэкономическом исследовании. Как было указано выше, эффективность определяли с помощью относительного риска достижения PASI 90 по сравнению с плацебо на момент оценки конечной точки в рандомизированном клиническом исследовании (24-28 недели). Наилучшие результаты при непрямом сравнении эффективности были получены для секукинумаба и устекинумаба, за которыми следовали инфликсимаб, адалимумаб, этанерцепт и апремиласт. Относительный риск был переведен в вероятность достижения индекса PASI, используя средний ответ на плацебо, который составлял 1,68% для PASI 90 (табл. 2) [37]. Формула для расчета вероятности достижения PASI 90: 1,68% × относительный риск PASI 90 при применении ГИБП и апремиласта.
| Препараты | Отн. риск достижения PASI 90 |
Эффективность PASI 90, % |
Вероятность достижения PASI 90 |
|---|---|---|---|
| Этанерцепт | 19,14 | 32,2 | 0,3216 |
| Адалимумаб | 23,17 | 38,9 | 0,3893 |
| Инфликсимаб | 31,00 | 52,1 | 0,5208 |
| Устекинумаб | 31,63 | 53,1 | 0,5314 |
| Секукинумаб | 40,15 | 67,5 | 0,6745 |
| Апремиласт | 13,00 | 21,8 | 0,2184 |
В качестве "суррогатного" показателя, характеризующего сочетание положительных качеств препарата при его применении в реальной клинической практике, часто используется продолжительность лечения до отмены/смены препарата (drug survival, time to discontinuation). Этот комплексный параметр зависит от соче тания возможности длительного сохранения эффективности и безопасности терапии, а также благоприятных потребительских свойств, определяющих удобство применения, например, путь введения. Последний имеет немаловажное значение. Так, в целом все больные, находящиеся на парентеральной терапии, предпочитают подкожное введение препарата по сравнению с внутривенным [41]. Данные о продолжительности лечения и НЯ можно получить в регистрах пациентов, которые в отличие от рандомизированных клинических исследований, содержат информацию, полученную в реальной клинической практике [42].
В международном регистре пациентов с псориазом PSOLAR (PSOriasis Longitudinal Assessment and Registry) были проанализированы данные более 12 000 пациентов, находящихся на лечении этанерцептом, адалимумабом, инфликсимабом и устекинумабом [43]. Авторы показали, что ГИБП являются эффективными на начальной стадии лечения заболевания, однако клинический ответ со временем уменьшается, в том числе при модификации терапии, что в конечном итоге приводит к приостановке терапии или переключению на другой ГИБП как внутри одного класса препаратов, так и между ними [43]. По данным регистра PSOLAR, продолжительность 1-й линии терапии составила для этанерцепта в среднем 215 дней, адалимумаба – 258 дней, инфликсимаба – 305 дней, устекинумаба – 316 дней [44]. Средняя продолжительности применения секукинумаба в качества препарата 1-й линии в исследовании J. Georgakopoulos и соавт. (2017 г.) равнялась 280 дней [45], а апремиласта в исследовании I. Vujic и соавт. (2018 г.) – 87 дней [46].
Модель данного исследования предполагала, что при недостаточном ответе на ГИБП 1-й линии, развитии НЯ, требующих отмены/смены терапии, или ее прекращении по решению самих пациентов, их переводили на другой ГИБП (2-я и 3-я линия). Для этанерцепта, адалимумаба, инфликсимаба и устекинумаба эти данные были получены из регистра PSOLAR [44], для секукинумаба ввиду его отсутствия в PSOLAR – из регистра DERMBIO [47]. Данные по апремиласту, не включенному ни в первый, ни во второй регистр, были взяты из исследований ESTEEM [48]. После перехода на 2-ю и 3-ю линии терапии использовали данные из регистра PSOLAR [44].
Вероятность развития нежелательных явлений. В дополнение к затратам на препараты и стоимость их введения учитывали и стоимость лечения самых частых НЯ, в том числе инфекций, злокачественных новообразований и сердечно-сосудистых событий. Источником информации служили данные регистра PSOLAR, а также мета-анализов и клинических исследований [4852]. Стоимость лечения НЯ была рассчитана по тарифам МГФОМС за 2017 г. (табл. 3) [35].
| Нежелательные явления | Этанерцепт | Адалимумаб | Инфликсимаб | Устекинумаб | Секукинумаб | Апремиласт |
|---|---|---|---|---|---|---|
| Примечания: MACE – основные сердечно-сосудистые события (инфаркт миокарда, инсульт, сердечно-сосудистая смерть); НЯ – нежелательные явления. | ||||||
| Серьезные инфекции | 30 970,79 | 41 827,61 | 52 324,49 | 17 794,04 | 9 293,62 | 7 319,08 |
| Злокачественные новообразования | 338,60 | 338,60 | 338,60 | 338,60 | 338,60 | 74,64 |
| MACE | 297,26 | 297,26 | 279,77 | 244,80 | 367,20 | 4,37 |
| ИТОГО | 31 606,64 | 42 463,47 | 52 942,86 | 18 377,43 | 9 999,42 | 7 398,09 |
Анализ прямых медицинских затрат. Как было указано ранее, в модели анализируются затраты на "схемы терапии". Внутри схемы возможен переход на лечение другим препаратом с учетом эффективности терапии и ее длительности по данным регистров пациентов. Общая продолжительность терапии составляет три года. Вероятность перевода на другой ГИБП (2-я и 3-я линия) внутри каждой схемы терапии была рассчитана на основе регистров. При этом учитывали стоимость препаратов (табл. 1), необходимое количество препаратов 2-й и 3-й линии, среднюю продолжительность лечения ГИБП до его смены/отмены по той или иной причине. В качестве препарата 2-й линии терапии для этанерцепта, адалимумаба и инфликсимаба был выбран устекинумаб, обладающий другим механизмом действия, для секукинумаба и устекинумаба – инфликсимаб, для апремиласта – устекинумаб. При неэффективности 2-й линии терапии пациентов переводили на препарат 3-й линии, который также подбирали с учетом механизма действия. Модель учитывала количество больных, оставшихся на 1-й линии терапии и закончивших 3-летний период лечения (временной горизонт в данной модели), количество больных, получавших препараты 2-й и 3-й линии, а также количество посещений дневного стационара для внутривенного введения препарата или амбулаторно-поликлинического учреждения для подкожного введения ГИБП, стоимость лечения НЯ (табл. 3).
Результаты расчета прямых медицинских затрат за 3 года терапии показали, что наименьшими затратами характеризуется схема терапии, начинающаяся с этанерцепта, – 2 685 087 руб. Затраты на каждую схему терапии приведены в табл. 4.
| Схема терапии | Этанерцепт | Адалимумаб | Инфликсимаб | Инфликсимаб биоаналог | Устекинумаб | Секукинумаб | Апремиласт |
|---|---|---|---|---|---|---|---|
| Затраты на 1 пациента за 3 года | 2 685 087 | 3 082 637 | 2 964 248 | 2 715 389 | 3 404 441 | 3 271 009 | 2 991 373 |
Анализ "затраты-эффективность". Анализ "затратыэффективность" основывался на 3-летней стоимости каждой схемы терапии (табл. 4) и эффективности препарата, с которого начинается лечение в каждой из рассматриваемых схем, с учетом дисконтирования (табл. 2). Результаты анализа (табл. 5) показали, что у больных со среднетяжелым и тяжелым псориазом наиболее экономически целесообразной является схема терапии, которую начинают с секукинумаба. Коэффициент "затраты-эффективность" для этой схемы составил 4 849 388 руб. при 3-летнем горизонте моделирования и 1 616 463 руб. при однолетнем, что является минимальным значением по сравнению со всеми остальными схемами. За ней следовала схема терапии, начинающаяся с биоаналога инфликсимаба – 5 213 881 руб. за 3 года и 1 737 960 руб. за 1 год. Таким образом, схема терапии, начинающаяся с секукинумаба, потребует наименьших затрат на одного пациента, достигшего PASI 90.
| Показатели | Этанерцепт | Адалимумаб | Инфликсимаб | Инфликсимаб биоаналог | Устекинумаб | Секукинумаб | Апремиласт |
|---|---|---|---|---|---|---|---|
| Дисконтированные затраты за 3 года, руб. | 2 319 479 | 2 662 898 | 2 560 629 | 2 345 655 | 2 940 884 | 2 825 621 | 2 584 060 |
| Эффективность, PASI 90 | 0,2778 | 0,3363 | 0,4499 | 0,4499 | 0,4590 | 0,5827 | 0,1887 |
| "Затраты-эффективность", руб. (3 года терапии) | 8 350 398 | 7 919 306 | 5 691 721 | 5 213 881 | 6 406 744 | 4 849 388 | 13 696 762 |
| "Затраты-эффективность", руб. (1 год терапии) | 2 783 466 | 2 639 769 | 1 897 240 | 1 737 960 | 2 135 581 | 1 616 463 | 4 565 587 |
Анализ чувствительности. В настоящем исследовании был проведен однофакторный анализ чувствительности, который продемонстрировал устойчивость полученных результатов при снижении цен на препараты сравнения до 5% (кроме секукинумаба, обладающего наилучшим коэффициентом "затраты-эффективность").
Обсуждение
Следует отметить, что до настоящего момента в специализированных российских журналах не публиковались результаты фармакоэкономических исследований, принимающие во внимание не только клиническую эффективность современных препаратов для лечения псориаза, но и длительность их применения, основанную на данных реальной клинической практики. Кроме того, в данной статье впервые для этой нозологии проанализировано не лечение одним препаратом в течение горизонта моделирования, а разработана концепция "схемы терапии", предполагающая оценку затрат не только на препарат, с которого начинали лечение (1-я линия), но и препараты 2-й и 3-й линий, назначавшиеся в случае неэффективности предшествующего лечения. Помимо расходов на препараты учитывали и затраты на их введение, посещение специалистов и терапию НЯ.
В ходе сравнительного клинико-экономический анализа применения различных ГИБП и апремиласта в российской клинической практике для лечения больных обыкновенным псориазом среднетяжелой и тяжелой степени в рамках программы государственных гарантий (ПГГ) бесплатного оказания гражданам медицинской помощи были получены следующие результаты:- Анализ прямых медицинских затрат показал, что наименьшей общей стоимостью 3-летнего лечения в расчете на одного пациента обладает схема терапии, начинающейся с этанерцепта – 2 319 479 руб.
- Наименьшим показателем "затраты-эффективность" в расчете на одного пациента с достигнутым эффектом (PASI 90) характеризовалась схема терапии, начинающейся с секукинумаба. Соотношение "затраты-эффективность" для это схемы составляет 4 849 388 руб. за 3 года терапии и 1 616 463 руб. за 1 год. За ней следует схема терапии, начинающейся с биоаналога инфликсимаба (1 737 960 руб. за 1 год терапии).
- Анализ чувствительности продемонстрировал устойчивость полученных результатов при снижении цен на препараты сравнения до 5%.
Ограничения исследования
В данный фармакоэкономический анализ вошли как оригинальные ГИБП, так и биоаналог оригинального инфликсимаба, эффективность которого не изучалась в рандомизированных клинических исследования при обыкновенном псориазе. Соответственно, было сделано допущение о его аналогичной эффективности оригинальному инфликсимабу, что ограничивает результаты данного исследования.
Модель рассчитана на основе мета-анализа зарубежных рандомизированных клинических исследований и регистра пациентов. Эффективность препаратов в ре аль ной российской клинической практике может отличаться.
Заключение
Таким образом, в настоящее время с учетом зарегистрированных в государственном реестре предельных отпускных цен наиболее рациональным с клинико-экономической точки зрения препаратом для инициации лечения псориаза среднетяжелой и тяжелой степени у пациентов с неэффективностью базовой системной терапии является секукинумаб.
Используемые источники
- Федеральные клинические рекомендации по ведению больных псориазом. Москва 2015. [Электронный ресурс] http://cr.rosminzdrav.ru/#!/schema/866.
- Henseler T, Christophers E. Psoriasis of early and late onset: characterization of two types of psoriasis vulgaris. J Am Acad Dermatol 1985;13:450–6.
- Parisi R, Symmons DP, Griffiths CE, Ashcroft DM. Identification and Mana gement of Psoriasis and Associated ComorbidiTy (IMPACT) project team. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol 2013;133(2):377-85.
- Gibbs S. Skin disease and socioeconomic conditions in rural Africa: Tanzania. Int J Dermatol 1996;35(9):633–9.
- Danielsen K, Olsen AO, Wilsgaard T, Furberg AS. Is the prevalence of psoriasis increasing? A 30–year follow-up of a population–based cohort. Br J Dermatol 2013;168:1303–10.
- Michalek IM, Loring B, John SM. A systematic review of worldwide epidemiology of psoriasis. J Eur Acad Dermatol Venereol 2017;31(2):205.
- Institute for Health Metrics and Evaluation (IHME). Global Burden of Disease Study 2010: Results by Cause 1990–2010. Seattle: IHME; 2012.
- Smith AE, Kassab JY, Rowland Payne CM, Beer WE. Bimodality in age of onset of psoriasis, in both patients and their relatives. Dermatology 1993;186:181–6.
- Ferrandiz C, Pujol RM, Garcia-Patos V, et al. Psoriasis of early and late onset: a clinical and epidemiologic study from Spain. J Am Acad Dermatol 2002;46: 867–73.
- National Psoriasis Foundation. National Psoriasis Foundation Benchmark Survey on psoriasis and psoriatic arthritis. Summary of top-line results 2002.
- Кубанова А.А., Кубанов А.А., Мелехина Л.Е., Богданова Е.В. Организация оказания медицинской помощи по профилю “дерматовенерология” в Российской Федерации. Динамика заболеваемости инфекциями, передаваемыми половым путем, болезнями кожи и подкожной клетчатки, 2013-2015 гг. Вестн дерматол венерол 2016;3:16-32.
- Знаменская Л.Ф., Мелехина Л.Е., Богданова Е.В., Минеева А.А. Заболевае мость и распространенность псориаза в Российской Федерации. Вестник дерматол венерол 2012;5:20-9.
- Мишина О.С., Дворников А.С., Донцова Е.В. Анализ заболеваемости псориазом и псориатическим артритом в Российской Федерации за 2009-2011 гг. Доктор Ру 2013;4:52-5.
- Хобейш М.М. Рекомендации по терапии больных псориазом генно-инженерными биологическими препаратами. СПб., 2012, 92с.
- Global report on psoriasis. World Health Organization, 2016.
- Кубанов А.А., Карамова А.Э., Знаменская Л.Ф. и др. Индекс PASI (Psoriasis Area and Severity Index) в оценке клинических проявлений псориаза. Вестник дерматол венерол 2016;4:33-8.
- Nast A, Gisondi P, Ormerod AD, et al. European S3-Guidelines on the systemic treatment of psoriasis vulgaris. Update 2015. Short version. EDF in cooperation with EADV and IPC. JEADV 2015;29:2277–94.
- Бакулев А.Л. Стратегия “лечение до достижения цели” при псориазе. Актуальные вопросы устойчивости к биологической терапии. Вестник дерматол венерол 2016;5:32-8.
- Menter А, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis. J Am Acad Dermatol 2011;65:137-74.
- Papp KA, Tyring S, Lahfa M. A global phase III randomized controlled trial of etanercept in psoriasis: safety, efficacy, and effect of dose reduction. Br J Der matol 2005;152(6):1304–12.
- Papp K, Langley R, Lebwohl M, et al; PHOENIX 2 study investigators. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebocontrolled trial (PHOENIX 2). Lancet 2008;371(9625):1675–84.
- Menter A, Tyring S, Gordon K. Adalimumab therapy for moderate to severe psoriasis: A randomized, controlled phase III trial. J Am Acad Dermatol 2008; 58(1):106–15.
- Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis results of two phase 3 trials; for the ERASURE and FIXTURE Study Groups. N Engl J Med 2014;371:326-38.
- Choy EHS, Gladman DD, Sasso EH. Efficacy of adalimumab by disease duration in psoriatic arthritis: Subanalysis of ADEPT. J Am Acad Dermatol 2007;56(Suppl February 2007):AB186. abstract P2748.
- Reich K, Nestle FO, Kim P, et al. Infliхimab induction and maintenance therapy for moderate-to-severe psoriasis: a phase III, multicentre, double-blind trial. Lancet 2005;366:1367-74.
- Blauvelt A, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate-to-severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Amer Acad Dermatol 2017;76:60-9.
- Puig L. PASI90 response: the new standard in therapeutic efficacy for psoriasis. J Europ Acad Dermatol Venereol 2015;29(4):645-8.
- Соколовский Е.В., Круглова Л.С., Понич Е.С. “Болевые” точки системной терапии биологическими препаратами при псориазе. Российский журнал кожных и венерических болезней 2015;18(6):32-8.
- Гущина Ю.Ш., Зырянов С.К., Орлихина И.А. Клинические и фармакоэкономические аспекты изменения анти-ФНО терапии по немедицинским причинам. Качественная клиническая практика 2017;2:35-42.
- Mrowietz U, de Jong EM, Kragballe K, et al. A consensus report on appropriate treatment optimization and transitioning in the management of moderate-tosevere plaque psoriasis. J Eur Acad Dermatol Venerol 2013;168(4):825–36.
- Puig L, Dauden E, Carrascosa JM. Commentary on European and British guidelines for the treatment of psoriasis. Actas Dermosifiliogr 2010;24(12):1458–67.
- Методические рекомендации по оценке сравнительной клинической эффективности и безопасности лекарственного препарата. Утверждены приказом ФГБУ “ЦЭККМП” Минздрава России от 23 декабря 2016 г. No 145-од URL: http://rosmedex.ru/ocenka-texnologij-zdravooxraneniya/metodicheskie-rekomendacii/ (дата обращения: 30.03.2018).
- Ягудина Р.И., Куликов А.Ю., Серпик В.Г. Дисконтирование при проведении фармакоэкономических исследований. Фармакоэкономика. Современ ная фармакоэкономика и фармакоэпидемиология 2009;4:10-3.
- Государственный реестр предельных отпускных цен (дата обращения: 30.03.2018). https://grls.rosminzdrav.ru/pricelims.aspx.
- Постановление Правительства Москвы от 23 декабря 2016 г. No935-ПП “О Территориальной программе государственных гарантий бесплатного оказания гражданам медицинской помощи в городе Москве на 2017 год и на плановый период 2018 и 2019 годов”.
- Lucka TC, Pathirana D, Sammain A, et al. Efficacy of systemic therapies for moderate-to-severe psoriasis: a systematic review and meta-analysis of long-term treatment. J Eur Acad Dermatol Venereol 2012;26:1331–44.
- Nast A, Jacobs A, Rosumeck S, Werner RN. Efficacy and safety of systemic longterm treatments for moderate-to-severe psoriasis: A systematic review and metaanalysis. J Invest Dermatol 2015;135(11):2641-8.
- Puig L, López A, Vilarrasa E, Garcia I. Efficacy of biologics in the treatment of moderate-to-severe plaque psoriasis: a systematic review and meta-analysis of randomized controlled trials with different time points. J Eur Acad Dermatol Vene reol 2014;28(12):1633-53.
- Schmitt J, Rosumeck S, Thomaschewski G, et al. Efficacy and safety of systemic treatments for moderate-to-severe psoriasis: meta-analysis of randomized controlled trials. Br J Dermatol 2014;170:274–303.
- Sbidian E, Chaimani A, Garcia-Doval I, et al. Systemic pharmacological treatments for chronic plaque psoriasis: a network meta-analysis. Cochrane Database of Systematic Reviews 2017;12:CD011535.
- Каратеев Д.Е. Факторы, определяющие длительный успех терапии генноинженерными биологическими препаратами при ревматоидном артрите. Современная ревматология. 2015;9(3):54–60.
- Лыткина К.А., Зянгиров Р.Р. Безопасность биологических препаратов у пациентов с псориазом и псориатическим артритом: анализ данных регистров пациентов. РМЖ 2016;22:1511-6.
- Papp KA, Strober B, Augustin M, et al. PSOLAR: design, utility and preliminary results of a prospective, international, disease-based registry of patients with psoriasis who are receiving, or are candidates for, conventional systemic treatments or biologic agents. J Drugs Dermatol 2012;11(10):1210–7.
- Menter A, et al. Drug survival of biologic therapy in a large, disease-based registry of patients with psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). JEADV 2016;30:1148–58.
- Georgakopoulos JR, Ighani A, Phung M, Yeung J. Drug survival of secukinumab in real-world plaque psoriasis patients: a 52-week, multicenter, retrospective study. J Amer Acad Dermatol 2018;78(5):1019-20.
- Vujic I, Herman R, Sanlorenzo M, et al. Apremilast in psoriasis a prospective real-world study. J Eur Acad Dermatol Venereol 2018;32(2):254-9.
- Egeberg A, Ottosen MB, Gniadecki R, et al. Safety, efficacy and drug survival of biologics and biosimilars for moderate-to-severe plaque psoriasis. Br J Dermatol 2018;178:509–19.
- Crowley J, et al. Long-term safety and tolerability of apremilast in patients with psoriasis: Pooled safety analysis for ≥156 weeks from 2 phase 3, randomized, controlled trials (ESTEEM 1 and 2). J Amer Acad Dermatol 2017;77(2):310-7.
- Kalb RE, Fiorentino DF, Lebwohl MG, et al. Risk of serious infection with biologic and systemic treatment of psoriasis. Results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). JAMA Dermatol 2015;151(9):961-9.
- van de Kerkhof PC, Griffiths CE, Reich K, et al. Secukinumab long-term safety experience: A pooled analysis of 10 phase II and III clinical studies in patients with moderate to severe plaque psoriasis. J Am Acad Dermatol 2016;75(1):83-98.
- Fiorentino D, et al. Risk of malignancy with systemic psoriasis treatment in the Psoriasis Longitudinal Assessment Registry. J Am Acad Dermatol 2017;77:845-54.
- Gottlieb AB, Bissonnette R, Kerdel F, et al. Major adverse cardiovascular events in the Psoriasis Longitudinal Assessment and Registry Study (PSOLAR): Current status of observations. J Amer Acad Dermatol 2015;72(5, suppl. 1):AB240.
