Глюкокортикостероиды при системной красной волчанке: перспективы стероидосберегающей терапии
Разработка и внедрение в клиническую практику глюкокортикостероидов (ГКС) стали одним из самых больших достижений медицины XX века, сопоставимым по значению с открытием инсулина или антибиотиков. Однако одновременно с противовоспалительной активностью ГКС были описаны многочисленные нежелательные эффекты препаратов этой группы, которые развиваются даже при их применении в низких дозах. ГКС остаются одним из основных компонентов лечения у пациентов с системной красной волчанкой (СКВ). Изучение геномных и негеномных механизмов действия ГКС обосновывает их применение в более низких стартовых дозах (не более 30-40 мг/сут), в том числе при наличии волчаночного нефрита. Чтобы обеспечить возможность быстрого снижения дозы ГКС вплоть до полной их отмены у пациентов с СКВ, целесообразно проводить пульс-терапию метилпреднизолоном и назначать гидроксихлорохин и иммуносупрессивные препараты. Разрабатываются также новые препараты, обладающие стероидосберегающей активностью, такие как ингибиторы рецептора интерферонов I типа (анифролумаб) и ингибиторы кальциневрина (воклоспорин), эффективность которых установлена у пациентов с активной СКВ и волчаночным нефритом, соответственно.
В середине 30-х гг. прошлого столетия Edward Kendall (США) и Tadeus Reichstein (Швейцария) выделили кортикостероиды из коры надпочечников, а в 1948 г. Philip Hench, руководивший отделением ревматологии в клинике Мейо (США), впервые ввел кортизон прикованной к инвалидному креслу 29-летней пациентке с ревматоидным артритом, которая уже после первых инъекций смогла ходить. В 1950 г. три ученых были удостоены Нобелевской премии по физиологии и медицине за открытие гормонов коры надпочечников. Вскоре глюкокортикостероиды (ГКС) стали широко применять для лечения не только ревматоидного артрита, но и системной красной волчанки (СКВ) и других ревматических заболеваний, хотя уже в 1951 г. были описаны побочные эффекты длительной терапии ГКС в группе пациентов с ревматоидным артритом (отеки, округлость лица, тахикардия, артериальная гипертония и бессонница) [1]. В нашей стране первый опыт применения ГКС для лечения СКВ был опубликован в 1960 г. Е.М. Тареевым и В.А. Насоновой, которые отмечали не только эффективность, но и недостатки препаратов этой группы, в том числе риск развития стероидозависимости и нежелательных эффектов [2]. Е.М. Тареев говорил о необходимости пройти между Сциллой и Харибдой при лечении ГКС, т.е. подавить активность болезни и в то же время избежать осложнений [3]. Спустя 70 лет ГКС сохраняют ведущие позиции в лечении многих системных иммуновоспалительных заболеваний, хотя не прекращаются попытки ограничить их применение, прежде всего из-за побочных эффектов, которые в ряде случаев нивелируют пользу терапии.
Механизмы действия и место глюкокортикостероидов в лечении СКВ
ГКС дают быстрый эффект, который обычно проявляется уже в первые дни после начала приема, и, наряду с гидроксихлорохином, остаются одним из компонентов терапии у пациентов с любыми проявлениями СКВ [4]. Величина стартовой дозы и скорость ее снижения зависят от активности заболевания и наличия и тяжести поражения внутренних органов, прежде всего почек и центральной нервной системы. В последних рекомендациях EULAR по лечению СКВ (2019 г.) рекомендуемые стартовые дозы ГКС не указаны, однако в одновременно опубликованных рекомендациях по лечению волчаночного нефрита отмечено, что начальные дозы преднизолона для приема внутрь составляют 0,30,5 мг/кг [5]. Таким образом, у большинства пациентов с СКВ, в том числе с поражением почек, начинать лечение преднизолоном целесообразно в дозе не более 30-40 мг/сут. Стартовую дозу желательно постепенно снизить по крайней мере до 7,5 мг/сут в течение 3-6 мес. Чтобы обеспечить эффективность относительно невысоких стартовых доз ГКС и возможность более быстрого их снижения, эксперты EULAR рекомендуют два подхода, которые не исключают друг друга: (1) внутривенное введение метилпреднизолона в дозе от 250 до 1000 мг/сут на протяжении 3 дней и (2) применение иммуносупрессивных препаратов (метотрексат, азатиоприн, циклофосфамид, ингибиторы кальциневрина и др.) [4]. У пациентов со средне-тяжелым и тяжелым течением СКВ последние целесообразно назначать уже на первом этапе терапии. Например, лечение волчаночного нефрита предполагает применение ГКС в сочетании с циклофосфамидом в низкой дозе (500 мг каждые 2 недели в течение 3 мес) или микофенолатом мофетилом (2-3 г/сут).
Обоснованием современных схем применения ГКС являются представления о механизмах противовоспалительного действия препаратов этой группы, которые разделяют на геномные и негеномные [6]. Геномные эффекты ГКС опосредуются цитозольными глюкокортикоидными рецепторами, с которыми они связываются после прохождения через клеточную мембрану. Образующийся комплекс ГКС с рецептором проникает в ядро клетки, ингибирует активность различных факторов транскрипции и вызывает снижение синтеза провоспалительных цитокинов, таких как интерлейкин (ИЛ)-6 и фактор некроза опухоли α. Этот эффект ГКС называют трансрепрессией. При увеличении концентрации ГКС в цитоплазме они взаимодействуют с определенными последовательностями ДНК (глюкокортикоид-отвечающими элементами) и активируют транскрипцию некоторых генов, в том числе участвующих в обмене веществ. Полагают, что этот процесс – трансактивация – в основном опосредует нежелательные эффекты ГКС, такие как усиление глюконеогенеза, инсулинорезистентность, ингибирование костеобразования и др. [7], хотя механизмы противовоспалительного и токсического действия ГКС не следует трактовать упрощенно. Например, трансактивация сопровождается индукцией ИЛ-10, который подавляет прововоспалительные цитокины, а некоторые побочные эффекты ГКС могут быть связаны с трансрепрессией [6].
Негеномные эффекты ГКС опосредуются их взаимодействием с глюкокортикоидными рецепторами, расположенными в цитоплазме или связанными с мембранами, и неспецифическим взаимодействием с клеточными мембранами. Комплекс ГКС с цитозольным рецептором может оказывать прямое блокирующее действие (т.е. независимо от транскрипции) на фосфолипазу А2 и образование арахидоновой кислоты, в то время как активация мембранных рецепторов вызывает снижение активности лимфоцитов за счет р38 митогенактивируемой протеинкиназы [8]. Неспецифическое взаимодействие ГКС с оболочками иммунных клеток приводит к ингибированию образования АТФ и снижению клеточной активности. Негеномное действие ГКС начинается очень быстро (в течение 15 мин), так как оно не предполагает модуляцию транскрипции генов и синтез белков.
Возможность нарастания противовоспалительного действия, опосредованного геномными механизмами, при увеличении дозы ГКС зависит от степени насыщения глюкокортикоидных рецепторов (рис. 1) [9]. При применении низких доз ГКС, эквивалентных ≤7,5 мг преднизолона, степень связывания рецепторов составляет менее 50%. Противовоспалительная активность таких доз ГКС небольшая, однако она достаточна для поддерживающей терапии, направленной на сохранение достигнутой ремиссии иммуновоспалительного заболевания. При назначении средних доз ГКС (от 7,5 до 30 мг в пересчете на преднизолон) степень насыщения глюкокортикоидных превышает 50% и прогрессивно увеличивается, что позволяет использовать указанные дозы для стартовой терапии. Степень насыщения рецепторов достигает 100% при увеличении дозы ГКС примерно до 100 мг/сут, однако сегодня такие дозы не используются в клинической практике из-за высокой токсичности. Как видно на рис. 1, степень связывания глюкокортикоидных рецепторов близка к максимальной при применении ГКС в дозах 30-40 мг/сут. Это означает, что применение более высоких доз пероральных ГКС чаще всего не имеет смысла, так как не позволяет достичь значительного усиления геномного действия этих препаратов, в то время как увеличение их кумулятивной дозы приводит к более частому развитию побочных эффектов.
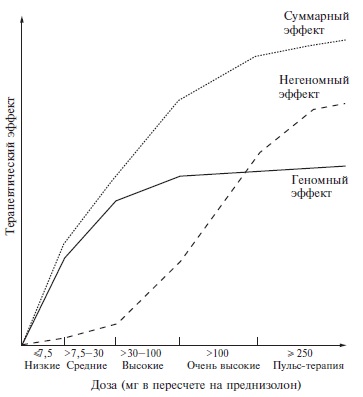
Дополнительный противовоспалительный эффект очень высоких доз ГКС опосредуется негеномными механизмами, что послужило основанием для внедрения пульс-терапии, т.е. кратковременного (в течение 13 дней) внутривенного введения метилпреднизолона в дозе ≥250 мг/сут, которое обеспечивает быстрый и выраженный противовоспалительный эффект и позволяет проводить терапию пероральными ГКС в более низких дозах и, соответственно, уменьшить их побочные эффекты, обусловленные геномными механизмами. По негеномной активности метилпреднизолон и дексаметазон в несколько раз превосходят преднизолон, поэтому для пульс-терапии предпочительно применять первые два препарата [10]. В рекомендациях EULAR метилпреднизолон предлагается вводить в дозе до 1000 мг/сут (суммарная доза 3000 мг), хотя результаты ряда исследований свидетельствуют о том, что дозы 250-500 мг/сут не менее эффективны и более безопасны при обострениях СКВ [11-13]. Некоторые авторы считают возможным вводить метилпреднизолон и в более низкой дозе – 125 мг [6]. Четких рекомендаций по выбору доз метилпреднизолона для пульс-терапии у пациентов с СКВ нет, поэтому этот вопрос следует решать индивидуально с учетом активности заболевания и тяжести висцеральных проявлений. Необходимо отметить, что пульс-терапия показана не всем пациентам с СКВ и обоснована только при средней или высокой активности заболевания [4].
Нежелательные эффекты глюкокортикостероидов
ГКС вызывают многочисленные побочные эффекты, включая кушингоид, ожирение, стрии, остеопороз и остеонекроз, сахарный диабет, дислипидемию, катаракту, артериальную гипертонию и др., риск развития которых зависит от дозы и длительности лечения, т.е. кумулятивной дозы (рис. 2) [14]. J. Curtis и соавт. с помощью почтового опроса изучили частоту основных нежелательных эффектов ГКС у 2446 пациентов (средний возраст 53±14 лет, 71% женщин) с различными заболеваниями, включая СКВ, получавших препараты этой группы в средней дозе 16±14 мг в пересчете на преднизолон в течение по крайней мере 60 дней [15]. По крайней мере одно нежелательное явление при лечении ГКС отметили более 90% респондентов. Наиболее распространенными побочными эффектами ГКС были увеличение массы тела, изменения кожи (истончение, синяки, акне) и расстройства сна, а также катаракта (15%) и переломы костей (12%). Риск побочного действия ГКС зависел от дозы и длительности лечения. В задачи настоящей публикации не входило обсуждение всех возможных побочных эффектов ГКС, поэтому ниже рассматриваются лишь некоторые из них.
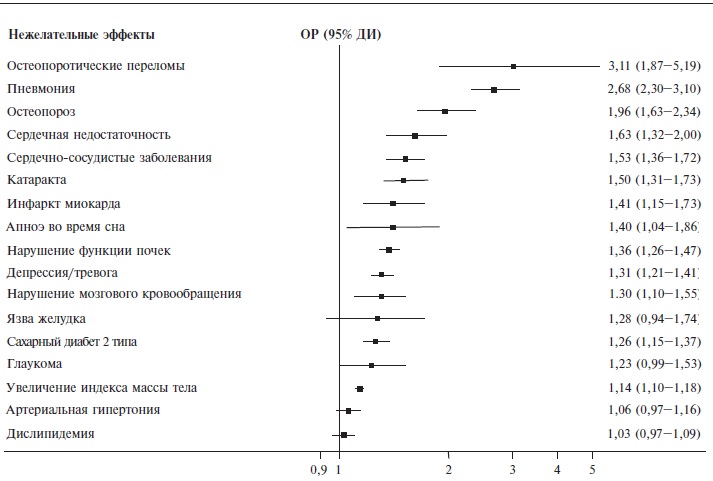
Одним из серьезных побочных эффектов ГКС является остеопороз, хотя при иммуновоспалительных ревматических заболеваниях, таких как СКВ, в патогенезе его играют роль различные факторы, в том числе возраст, пол, гормональные расстройства, воспаление и др. [16]. По данным мета-анализа 31 исследования, частота остеопороза, подтвержденного при денситометрии, у 3089 пациентов с СКВ составила 16%, а наличие его ассоциировалось с кумулятивной дозой и длительностью терапии ГКС, а также возрастом больных, длительностью заболевания и менопаузой [17]. Относительный риск развития остеопороза у больных СКВ был в 2,03 (95% доверительный интервал 1,33– 3,10, р=0,001) раза выше, чем в контрольной группе. Выраженный остеопороз нередко осложняется переломами позвонков и других костей, частота которых у пациентов с СКВ увеличивается в 1,2-4,7 раза [18]. В разных исследованиях переломы позвонков наблюдали у 18-50% больных СКВ. При мета-анализе 21 исследования было показано, что риск любых переломов у пациентов с СКВ увеличен в 2,07 раза (p<0,001), в том числе шейки бедра в 1,99 раза (p<0,001), остеопоротических переломов в 1,36 раза (p<0,001) и переломов позвонков в 2,97 раза (p<0,001) [19]. В крупном популяционном исследовании одним из факторов риска перелома было применение ГКС в течение предыдущих 6 мес [20]. Риск переломов значительно увеличивается при лечении ГКС в дозе более 7,5 мг в пересчете на преднизолон [21], хотя частота переломов повышается и при применении ГКС в более низких дозах [22]. После отмены пероральных ГКС риск переломов быстро снижается до исходного уровня [22].
К тяжелым осложнениям лечения ГКС относится аваскулярный остеонекроз, нередко мультифокальный, частота которого у пациентов с СКВ составляет 10-15% [23]. У 90% больных наблюдается двустороннее повреждение головок бедренных костей. Остеонекроз сопровождается болью и ограничением подвижности в суставах, хотя возможно и бессимптомное его течение. Патогенез остеонекроза изучен недостаточно, а в развитии его могут играть роль не только ГКС, но и другие факторы, в том числе специфичные для СКВ. В пользу последней гипотезы свидетельствует тот факт, что остеонекроз у пациентов с СКВ встречается чаще, чем у пациентов с другими заболеваниями, требующими лечения ГКС [24].
Лечение любыми иммуносупрессивными препаратами, включая ГКС, сопровождается повышением риска развития инфекционных осложнений, которые остаются ведущей причиной смертности пациентов с СКВ, в том числе в экономически развитых странах [25]. По данным анализа американской базы данных Medicaid, среди 33565 пациентов с СКВ частота серьезных инфекций составила 10,8 на 100 пациенто-лет, а среди больных волчаночным нефритом – 23,9 на 100 пациенто-лет [26]. У пациентов, получавших ГКС, риск инфекционных осложнений был в 1,5 раза выше, чем у больных, которые никогда не принимали препараты этой группы. Следует отметить, что лечение гидроксихлорохином, наоборот, ассоциировалось со снижением риска развития инфекций. Сходные данные были получены и в других исследованиях. Например, при мета-анализе 26 клинических исследований у 2611 пациентов с волчаночным нефритом самое значительное увеличение частоты тяжелых инфекций было выявлено при лечении ГКС в высоких дозах, в то время как частота инфекционных осложнений была ниже при лечении некоторыми иммуносупрессивными препаратами, такими как такролимус, микофенолат мофетил и азатиоприн [27]. Увеличение риска инфекций было отмечено даже при применении ГКС в низких дозах. Например, в японском исследовании частота серьезных инфекций у пациентов, получавших преднизолон в дозе 5,0-7,5 мг/сут, была достоверно выше, чем у больных, у которых доза препарата составляла 0-2,5 мг (скорректированное отношение рисков 6,80, 95% доверительный интервал 2,17-21,27) [28].
У пациентов с СКВ риск развития сердечно-сосудистых осложнений в 2-3 раза выше, чем в общей популяции [29], а сердечно-сосудистые заболевания, наряду с инфекциями и злокачественными опухолями, являются основной причиной смерти таких больных [30]. Увеличение риска сердечно-сосудистых осложнений при СКВ, как и других иммуновоспалительных заболеваниях, объясняется различными причинами, включая персистирующее воспаление, которое способствует развитию эндотелиальной дисфункции и повреждения сосудов. ГКС вызывают повышение АД и различные метаболические нарушения, которые вносят вклад в повышение сердечно-сосудистого риска у пациентов с СКВ. По данным систематизированного обзора клинических исследований, применение ГКС в высоких дозах было независимым предиктором сердечно-сосудистых осложнений, утолщения интимы-медии сонных артерий, образования бляшек, кальциноза коронарных артерий и увеличения жесткости артерий [31]. Увеличение риска развития субклинического атеросклероза было выявлено и при мета-анализе клинических исследований, в которых оценивали состояние сонных артерий у пациентов с СКВ [32]. Одним из факторов, способствовавших утолщению интимы-медии сонных артерий и образованию атеросклеротических бляшек, было лечение ГКС.
Какова безопасная доза глюкокортикостероидов и возможна ли их отмена при СКВ?
Целью лечения СКВ является достижение полной ремиссии заболевания, которая, в соответствии с критериями EULAR, характеризуется отсутствием клинической активности на фоне приема только гидроксихлорохина [4]. На практике более реалистичной целью терапии представляется низкая активность СКВ: счет SLEDAI ≤4 на фоне приема гидроксихлорохина, преднизолона в дозе ≤7,5 мг/сут и/или хорошо переносимых иммуносупрессивных препаратов в стабильных дозах. В американской когорте вероятность достижения низкой активности СКВ у пациентов европеоидной расы составила 52% через 1 год и 93% через 5 лет, а у больных волчаночным нефритом – 33% и 89%, соответственно [33]. Доза преднизолона 7,5 мг/сут считается относительно безопасной, хотя результаты ряда исследований свидетельствуют о том, что применение ГКС даже в более низких дозах сопровождается увеличением риска различных побочных эффектов, в частности инфекционных осложнений и остеопороза. Кроме того, кумулятивная доза ГКС зависит не только от величины поддерживающей дозы, но и длительности ее применения. Эти данные свидетельствуют о том, что абсолютно безопасной дозы ГКС не существует, поэтому в идеале необходимо стремиться к полной их отмене, хотя прекращение терапии может привести к развитию обострения СКВ.
А. Mathian и соавт. в 12-месячном рандомизированном клиническом исследовании изучали последствия отмены преднизолона у 124 пациентов с СКВ, у которых в течение года отсутствовала активность СКВ, а поддерживающая доза препарата составляла 5 мг/сут [34]. Продолжение приема преднизолона в дозе 5 мг/сут в течение 1 года сопровождалось более низким риском обострений СКВ, в том числе средне-тяжелых и тяжелых, по сравнению с таковым у пациентов, прекративших прием препарата (7% и 27%, соответственно). L. Ji и соавт. провели мета-анализ исследований, в которых изучалась возможность отмены ГКС в целом у 738 пациентов с СКВ [35]. Частота обострений заболевания после прекращения приема ГКС составила 24%, в том числе серьезных – 13%, а средний срок до развития обострения – около 21 мес. Отмена ГКС сопровождалась увеличением риска любых обострений СКВ на 38% (относительный риск 1,38; 95% доверительный интервал 1,01-1,89), в то время как повышение риска серьезных обострений не достигло статистической значимости. Те же авторы показали, что риск обострения СКВ после прекращения терапии ГКС был выше у пациентов молодого возраста, но не зависел от пола, длительности болезни, ремиссии и лечения ГКС, а также приема иммуносупрессивных препаратов [36]. Вероятность обострения снижалась при лечении гидроксихлорохином, хотя этот эффект был недостоверным. Помимо возраста, фактором риска развития обострения СКВ после отмены ГКС является сохранение серологических признаков активности (антител к дсДНК и/или гипокомплементемии) несмотря на отсутствие клинических проявлений заболевания [37,38]. Интересные результаты получили Y. Hao и соавт. в клиническом исследовании у 139 пациентов с СКВ, достигших низкой активности или ремиссии заболевания [39]. Безрецидивная выживаемость, рассчитанная с помощью метода Каплана-Мейера, у больных, прекративших прием ГКС, была значительно ниже, чем у пациентов, продолживших лечение преднизолоном в дозе ≤7,5 мг/сут (p=0,004), однако частота обострений существенно не отличалась при применении преднизолона в различных диапазонах низких доз (0-2,5 мг, 2,55,0 мг или 5,0-7,5 мг). В другом исследовании медленное снижение поддерживающей дозы преднизолона по 1 мг каждые 7 недель вплоть до полной отмены позволило избежать увеличения риска обострений в течение 2 лет по сравнению с таковым при продолжении приема препарата в дозе 5 мг/сут [40].
Хотя эксперты EULAR рекомендуют стремиться к полной отмене ГКС после достижения ремиссии СКВ, вопросы о том, когда, как и в каких случаях следует прекращать поддерживающую терапию этими препаратами, остаются спорными [41]. В клинических исследованиях отмена поддерживающих доз ГКС, особенно быстрая, сопровождалась увеличением риска развития обострений СКВ. Тем не менее, у большинства пациентов, как продолжавших, так и прекративших терапию ГКС после достижения стойкой ремиссии, обострения заболевания отсутствовали, что обосновывает попытки их отмены у многих пациентов. Факторами риска обострений СКВ после прекращения терапии были более молодой возраст и серологические признаки активности заболевания, в то время как медленное снижение подерживающих доз ГКС ассоциировалось со снижением вероятности ухудшения состояния больных. Тем не менее, предсказать возможные обострения СКВ при отмене ГКС сложно.
В рекомендациях EULAR одним из критериев низкой активности СКВ является доза ГКС, которая не должна превышать 7,5 мг/сут в пересчете на преднизолон, хотя на практике достаточная поддерживающая доза часто составляет 2,5-5 мг/сут.
Недавно группой экспертов в рамках инициативы DORIS (Definitions Of Remission In SLE) были разработаны новые критерии ремиссии СКВ, которые предлагается использовать как в клинической практике, так и в клинических и наблюдательных исследованиях [42]:- SLEDAI = 0.
- Общее мнение врача об активности <0,5 (0-3).
- Наличие серологических признаков активности (антитела к ДНК и/или снижение содержания комплемента) не препятствует установлению ремиссии.
- Пациент может принимать гидроксихлорохин, ГКС в низких дозах (преднизолон ≤5 мг/сут) и/или иммуносупрессивные препараты, в том числе генно-инженерные, в стабильных дозах.
В отличии от критериев EULAR, предложенное определение допускает возможность установления ремиссии СКВ при отсутствии клинических признаков активности у пациентов, продолжающих прием не только гидроксихлорохина, но и ГКС в дозе ≤5 мг/сут в пересчете на преднизолон. Основаниями для разработки нового определения СКВ послужили следующие соображения: с одной стороны, ремиссия СКВ после прекращения иммуносупрессивной терапии (за исключением гидроксихлорохина) на практике сохраняется редко, а, с другой стороны, активные попытки полной отмены иммуносупрессивных/противовоспалительных препаратов у пациентов, ответивших на лечение, могут оказаться излишними и привести к негативным последствиям. По мнению многих членов группы DORIS, желательной целью является достижение “безстероидной" ремиссии СКВ, однако эксперты все же приняли решение не включать отмену ГКС в критерии ремиссии, но “ограничили" их дозу.
Необходимо учитывать, что кумулятивная доза ГКС в значительной степени зависит от стартовых доз этих препаратов и темпов их снижения [43]. Соответственно, ограничение экспозиции ГКС на начальном этапе лечения (в том числе доз метилпреднизолона для пульстерапии) может иметь более важное значение для профилактики нежелательных эффектов, чем прекращение приема преднизолона в поддерживающей дозе 2,5-5,0 мг/сут. Очевидно также, что прекращение длительной терапии ГКС в низких дозах у части пациентов невозможно из-за сниженной эндогенной продукции кортизола.
Перспективы стероидосберегающей терапии
Эксперты EULAR рекомендуют всем пациентам с СКВ назначать гидроксихлорохин [4]. Чтобы избежать токсических эффектов препарата, прежде всего ретинопатии, суточная доза его не должна превышать 5 мг/кг (т.е. 300-400 мг в большинстве случаев), хотя в клинических исследованиях препарат изучался в дозе 6,5 мг/кг. По данным мета-анализов, лечение гидроксихлорохином снижает частоту обострений СКВ и инфекционных осложнений, увеличивает выживаемость больных, предупреждает прогрессирующее необратимое повреждение органов, тромбозы и снижение массы тела, улучшает липидный профиль [44-46]. Основным побочным эффектом гидроксихлорохина является ретинопатия, однако частота ее низкая [47]. Безопасность препарата подтверждена у беременных женщин, поэтому отменять препарат во время беременности не следует [48]. Несмотря на доказанные эффективность и безопасность гидроксихлорохина в лечении СКВ, на практике врачи далеко не всегда назначают этот препарат. Например, в российском многоцентровом исследовании ESSENCE, проводившемся в 6 городах, было показано, что ГКС получали практически все пациенты с СКВ, а производные аминохинолина – менее половины [49].
При среднетяжелом течении СКВ гидроксихлорохин и ГКС целесообразно применять в сочетании с метотрексатом или азатиоприном, а также микофенолата мофетилом, ингибиторами кальциневрина или белимумабом. В более тяжелых случаях, например, при наличии волчаночного нефрита III-IV класса обосновано назначение микофенолата мофетила или циклофосфамида, а при их неэффективности – ритуксимаба [4,5].
Несмотря на иммуносупрессивную терапию, у части больных СКВ сохраняется воспалительная активность и/или наблюдаются обострения. В канадском исследовании стойкая ремиссия заболевания была достигнута только у 10% пациентов, в то время как у 9% – персистировала активность, а у 67% – развивались обострения СКВ [50]. В многоцентровом 2-летнем исследовании, проводившемся в нескольких странах Европы, обострения СКВ были зарегистрированы более чем у половины из 412 пациентов [51]. В другом исследовании признаки воспалительной активности несмотря на иммуносупрессивную терапию были выявлены у 40% из 332 больных СКВ [52]. Приведенные данные свидетельствуют о том, что для улучшения результатов лечения многие пациенты с СКВ нуждаются в новых препаратах, обладающих стероидосберегающей активностью и позволяющих ограничить применение ГКС, в том числе за счет профилактики обострений заболеваний, которые обычно предполагают необходимость в увеличении дозы ГКС или возобновлении их приема.
В настоящее время в клинических исследованиях у пациентов с СКВ изучаются многочисленные лекарственные препараты (как генно-инженерные биологические препараты, так и синтетические молекулы), действующие на различные мишени в системе иммунного ответа (табл. 1) [53]. Разработка большинства из них еще продолжается, однако некоторые препараты, в частности воклоспорин и анифролумаб, уже прошли необходимые испытания и в некоторых странах одобрены для применения в клинической практике.
| Мишень | Препараты | Механизм действия |
|---|---|---|
| В-клетки | Обинутузумаб | Антитело к CD-20, вызывающее деплецию В-клеток |
| Обекселимаб | Антитело к CD-19, одновременно блокирующее Fc-рецепторы В-клеток | |
| Телитацицепт | Рекомбинантный белок, блокирующий активность BlyS и APRIL и подавляющий выживаемость зрелых В-клеток и плазматических клеток | |
| Т-клетки | Белатацепт | Белок, состоящий из Fc фрагмента IgG1 и внеклеточного домена CTLA-4 и блокирующий стимуляцию Т-клеток |
| Лулизумаб | Антитело к CD28, необходимому для активации Т-клеток | |
| Ригеримод | Фрагмент рибонуклеопротеина U1-70K, ингибирующий активность Т-клеток | |
| Дапирозулимаб пэгол | Пегилированный Fab фрагмент антитела к CD40L, блокирующий взаимодействие Т-клеток и антигенпрезентирующих клеток | |
| Итолизумаб | Антитело к CD6 рецептору на поверхности Т-клеток, ингибирующее Т-клеточный иммунный ответ | |
| Плазматические клетки | Даратумумаб | Антитело к CD38, вызывающее деплецию плазматических клеток |
| Интерферон | Анифролумаб | Антитело к рецептору интерферона I типа |
| Интерлейкины | Устекинумаб | Антитело к р40 субъединице ИЛ-12 и ИЛ-23 |
| Секукинумаб | Антитело к ИЛ-17 | |
| Кальциневрин | Воклоспорин | Новый аналог циклоспорина |
| mTOR | Сиролимус | Блокирует активацию Т- и В-клеток за счет ингибирования сигнальной молекулы mTOR (mammalian target of rapamycin) |
| JAK | Барицитиниб | Ингибитор сигнальной системы JAK-STAT |
| Тирозинкиназа Брутона | Фенебрутиниб | Ингибитор внутриклеточной сигнальной молекулы, модулирующей созревание, выживаемость и активацию В-клеток |
| Комплемент | Нарсоплимаб | Антитело к MASP-2 – сериновой протеазе, участвующей в активации лектинового пути |
| S1P (сфингозин-1-фосфат) | Финголимод | Модулирует S1P-рецепторы лимфоцитов |
| рецепторы | Ценеримод | Селективный агонист S1P-рецепторов |
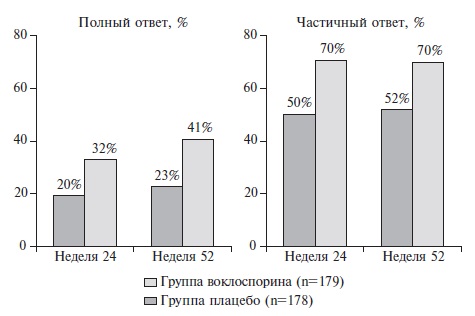
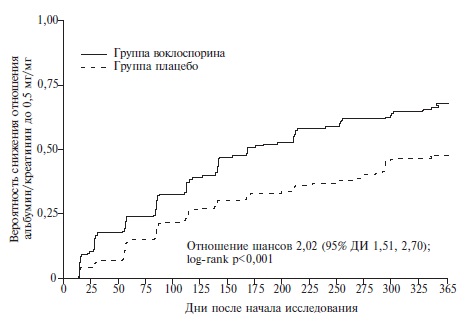
Воклоспорин – это новый ингибитор кальциневрина, который имеет определенные преимущества перед другими препаратами этой группы, включая отсутствие необходимости в мониторировании сывороточных концентраций во время лечения. Кроме того, воклоспорин в меньшей степени влияет на уровни липидов и глюкозы и не изменяет концентрации микофеноловой кислоты. Эффективность и безопасность воклоспорина в сочетании с ГКС и микофенолата мофетилом изучались в двойном слепом, рандомизированном, плацебо-контролируемом исследовании AURORA-1 у 357 пациентов с активным волчаночным нефритом, подтвержденным при биопсии почек (III, IV или V класс) [54]. Из исследования исключали пациентов со скоростью клубочковой фильтрации (СКФ) ≤45 мл/мин/1,73 м2. Терапию воклоспорином в дозе 23,7 мг два раза в сутки или плацебо продолжали в течение 52 недель. Пациенты обеих групп получали также микофенолата мофетил в дозе 2 г/сут и ГКС (метилпреднизолон в дозе 500 мг/сут внутривенно в первые два дня, а затем преднизолон внутрь в дозе 20-25 мг/сут). Дозу преднизолона быстро снижали до 2,5 мг/сут в течение 16 недель. Первичным показателем эффективности был полный почечный ответ: отношение белок/креатинин в моче ≤0,5 мг/кг, стабильная функция почек (СКФ≥60 мл/мин/1,73 м2 или отсутствие снижения СКФ более чем на 20%) и доза преднизолона не более 10 мг. Кроме того, оценивали частичный почечный ответ (снижение отношения белок/креатинин в моче по крайней мере на 50%) и ряд других вторичных конечных точек.
Через 52 недели частота полного почечного ответа в группах воклоспорина и плацебо составила 41% и 23%, соответственно (p<0,0001). Воклоспорин достоверно превосходил плацебо и по вторичным показателям эффективности, включая частоту полного почечного ответа через 24 недели, частичного почечного ответа через 24 и 52 недели и скорость снижения протеинурии (рис. 3, 4). Переносимость препарата была хорошей. Дополнительным важным результатом исследования была эффективность низких доз ГКС в лечении волчаночного нефрита. Как указано выше, суммарная доза внутривенного метилпреднизолона составляла всего 1000 мг, а исходная доза преднизолона – 20-25 мг/сут, причем ее быстро снижали до 2,5 мг/сут в течение 16 недель. Несмотря на это, частота ответа на лечение в контрольной группе больных, получавших ГКС и микофенолата мофетил, соответствовала таковой в предыдущих исследованиях, в которых ГКС применяли в более высокой дозе. Необходимо отметить, что эффективность воклоспорина у пациентов с СКВ без поражения почек не изучалась.
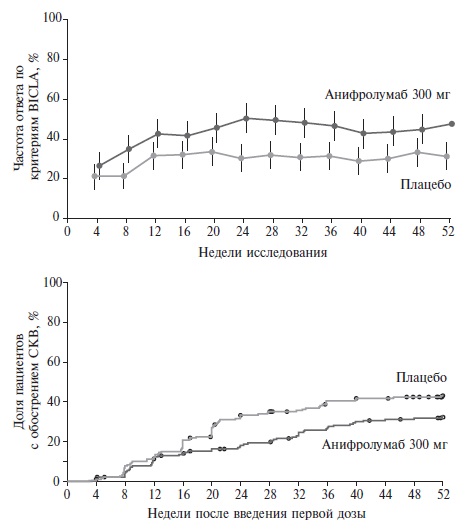
Важную роль в патогенезе СКВ играют интерфероны (ИФН) I типа (α, β, ε, κ и ω), которые через сигнальную систему JAK/STAT инициируют транскрипцию различных провоспалительных генов и оказывают действие на системы врожденного и адаптивного иммунного ответа [55,56]. Анифролумаб – это человеческое моноклональное антитело, взаимодействующее с рецептором ИФН I типа и блокирующее действие всех ИФН I типа. Эффективность и безопасность анифролумаба в лечении СКВ были установлены в рандомизированном, плацебо-контролируемом клиническом исследовании 3 фазы TULIP-2, в которое были включены 362 пациента со средней или высокой активностью СКВ [57]. Исследуемый препарат в дозе 300 мг или плацебо вводили внутривенно каждые 4 недели в течение 48 недель. Первичным показателем эффективности была частота ответа по критериям BICLA. Кроме того, изучали различные вторичные показатели эффективности, включая стероидосберегающее действие у 170 пациентов, которые исходно получали ГКС в дозе ≥10 мг/сут в пересчете на преднизолон.
По первичному показателю эффективности анифролумаб достоверно превосходил плацебо: через 52 недели частота ответа на лечение в двух группах составила 47,8% и 31,5%, соответственно (p=0,001) (рис. 5). Частота обострений СКВ при лечении анифролумабом была ниже, чем в контрольной группе, хотя разница не достигла статистической значимости (р=0,08). Кроме того, терапия анифролумабом оказывала благоприятное влияние на поражение кожи и привела почти к двукратному увеличению доли пациентов, у которых дозу преднизолона к 40-й неделе удалось снизить до 7,5 мг/сут и/или менее (51,5% против 30,2% в группе плацебо; р=0,01). В группе анифролумаба было отмечено увеличение частоты опоясывающего герпеса (7,2% против 1,1% в группе плацебо), однако кожные высыпания во всех случаях прошли, несмотря на продолжение лечения. Таким образом, результаты исследования TULIP-2 показали, что применение анифролумаба позволяет добиться увеличения частоты ответа на лечение у пациентов с активной СКВ, получающих гидроксихлорохин, ГКС и/или иммуносупрессивные препараты, и оказывает стероидосберегающее действие.
Заключение
Несмотря на высокий риск нежелательных эффектов, ГКС остаются основой лечения СКВ и на протяжении нескольких десятилетий используются как для индукции ремиссии заболевания, так и поддерживающей терапии. Изучение геномных и негеномных механизмов действия ГКС обосновывает их применение в более низких стартовых дозах, в том числе при наличии висцеральных проявлений СКВ, таких как волчаночный нефрит. Чтобы избежать нежелательных эффектов ГКС и прогрессирующего накопления повреждения внутренних органов, пациентам с активной СКВ целесообразно проводить пульс-терапию метилпреднизолоном и уже на начальном этапе лечения назначать гидроксихлорохин и иммуносупрессивные препараты. Стандартная пульс-терапия предполагает внутривенное введение метилпреднизолона в дозе 1000 мг/сут в течение 3 дней, хотя во многих случаях не менее эффективны более низкие дозы препарата. Например, при среднетяжелом течении СКВ, проявляющейся артритом, кожными высыпаниями и перикардитом, достаточным может быть применение метилпреднизолона в дозе 125-250 мг/сут в течение 3 дней.
Несмотря на стандартную иммуносупрессивную терапию, у части пациентов с СКВ персистирует воспалительная активность и/или развиваются обострения, что определяет необходимость в разработке новых препаратов, обладающих стероидосберегающей активностью и позволяющих улучшить результаты лечения. К таковым, в частности, относятся воклоспорин, ингибирующий кальциневрин, и анифролумаб, блокирующий рецепторы ИФН I типа, эффективность и стероидосберегающее действие которых установлены в контролируемых клинических исследованиях у пациентов с волчаночным нефритом и активной СКВ, соответственно.
Используемые источники
- Freyberg RH, Traeger CH, Patterson M, et al. Problems of prolonged cortisone treatment for rheumatoid arthritis; further investigations. J Am Med Assoc 1951;147(16):1538–43.
- Тареев Е.М., Насонова В.А. Место стероидных гормонов в комплексном лечении так называемых больших коллагенозов. Сов мед 1960;12:3-12.
- Тареев Е.М. Современные представления о лечении больных коллагенозами. Врачебное дело 1965;8:80-6.
- Fanouriakis A, Kostopoulou M, Alunno A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019;78(6):736-45.
- Fanouriakis A, Kostopoulou M, Cheema K, et al. 2019 Update of the Joint European League Against Rheumatism and European Renal AssociationEuropean Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020;79(6):713-23.
- Ruiz-Irastorza G, Ugarte A, Ruiz-Arruza I, Khamashta M. Seventy years after Hench’s Nobel prize: revisiting the use of glucocorticoids in systemic lupus erythematosus. Lupus 2020;29(10):1155-67.
- Porta S, Danza A, Arias Saavedra M, Carlomagno A, et al. Glucocorticoids in systemic lupus erythematosus. Ten questions and some issues. J Clin Med 2020;9(9):2709.
- Strehl C, Buttgereit, F. Unraveling the functions of the membrane-bound glucocorticoid receptors: First clues on origin and functional activity. Ann N Y Acad Sci 2014;1318:1–6.
- Buttgereit F, da Silva J, Boers M, et al. Standardised nomenclature for glucocorticoid dosages and glucocorticoid treatment regimens: current questions and tentative answers in rheumatology. Ann Rheum Dis 2002;61:718–22.
- Schmid D, Burmester GR, Tripmacher R, et al. Bioenergetics of human peripheral blood mononuclear cell metabolism in quiescent, activated, and glucocorticoid-treated states. Biosci Rep 2000;20:289–302.
- Danza A, Borgia I, Narvaez JI, et al. Intravenous pulses of methylprednisolone to treat flares of immunemediated diseases: how much, how long? Lupus 2018; 27:1177–84.
- Kong KO, Badsha H, Lian T, et al. Low-dose pulse methylprednisolone is an eective therapy for severe SLE flares. Lupus 2004;13:212–3.
- Badsha H, Kong K, Lian T, et al. Low-dose pulse methylprednisolone for systemic lupus erythematosus flares is ecacious and has a decreased risk of infectious complications. Lupus 2002;11:508–13.
- Price DB, Trudo F, Voorham J, et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy 2018;11:193-204.
- Curtis JR, Westfall AO, Allison J, et al. Population-based assessment of adverse events associated with long-term glucocorticoid use. Arthritis Rheum 2006;55(3):420-6.
- Bultink IE, Lems WF. Lupus and fractures. Curr Opin Rheumatol 2016;28(4):426-32.
- Gu C, Zhao R, Zhang X, Gu Z, et al. A meta-analysis of secondary osteoporosis in systemic lupus erythematosus: prevalence and risk factors. Arch Osteoporos 2019;15(1):1.
- Bultink IEM, Lems WF. Systemic lupus erythematosus and fractures. RMD Open 2015;1:e000069.
- Wang X, Yan S, Liu C, Xu Y, et al. Fracture risk and bone mineral density levels in patients with systemic lupus erythematosus: a systematic review and metaanalysis. Osteoporos Int 2016;27(4):1413-23.
- Bultink IE, Harvey NC, Lalmohamed A, et al. Elevated risk of clinical fractures and associated risk factors in patients with systemic lupus erythematosus versus matched controls: a population-based study in the United Kingdom. Osteoporos Int 2014;25:1275–83.
- Al Sawah S, Zhang X, Zhu B, et al. Effect of corticosteroid use by dose on the risk of developing organ damage over time in systemic lupus erythematsosus – the Hopkins Lupus Cohort. Lupus Sci Med 2015;2:e000066.
- Van Staa TP, Leufkens HG, Abenhaim L, et al. Use of oral corticosteroids and risk of fractures. J Bone Miner Res 2000;15(6):993-1000.
- Hussein S, Suitner M, Beland-Bonenfant S, et al. Monitoring of osteonecrosis in systemic lupus erythematosus: a systematic review and metaanalysis. J Rheumatol 2018;45:1462–76.
- Fukushima W, Fujioka M, Kubo T, et al. Nationwide epidemiologic survey of idiopathic osteonecrosis of the femoral head. Clin Orthop Relat Res 2010;468:2715-24.
- Моисеев С.В., Новиков П.И., Буланов Н.М. Системная красная волчанка: эпидемиология, отдаленные исходы и бремя болезни. Клин фармакол тер 2021;30(4):13-22 [Moiseev S, Novikov P, Bulanov N. Systemic lupus erythematosus: epidemiology, outcomes and burden. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):13-22 (In Russ.)].
- Feldman CH, Hiraki LT, Winkelmayer WC, et al. Serious infections among adult Medicaid beneficiaries with systemic lupus erythematosus and lupus nephritis. Arthritis Rheumatol 2015;67(6):1577-85.
- Singh JA, Hossain A, Kotb A, et al. Risk of serious infections with immunosuppressive drugs and glucocorticoids for lupus nephritis: a systematic review and network meta-analysis. BMC Med 2016;14:137.
- Abe K, Ishikawa Y, Kita Y, et al. Association of low-dose glucocorticoid use and infection occurrence in systemic lupus erythematosus patients: a prospective cohort study. Arthritis Res Ther 2022;24(1):179.
- Schoenfeld SR, Kasturi S, Cos KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum 2013;43:77–95.
- Barber M, Drenkard C, Falasinnu T, et al. Global epidemiology of systemic lupus erythematos. Nat Rev Rheumatol 2021;17:515-32.
- Tselios K, Sheane BJ, Gladman DD, et al. Optimal monitoring for coronary heart disease risk in patients with systemic lupus erythematosus: a systematic review. J Rheumatol 2016;43:54–65.
- Wu G-C, Liu H-R, Leng R-X, et al. Subclinical atherosclerosis in patients with systemic lupus erythematosus: a systemic review and meta-analysis. Autoimmun Rev 2016;15:22–37.
- Babaoğlu H, Li J, Goldman D, et al. Time to lupus low disease activity state in the Hopkins Lupus Cohort: role of African American ethnicity. Arthritis Care Res (Hoboken) 2020;72(2):225-32.
- Mathian A, Pha M, Haroche J, et al. Withdrawal of low-dose prednisone in SLE patients with a clinically quiescent disease for more than 1 year: a randomised clinical trial. Ann Rheum Dis 2020;79(3):339-46.
- Ji L, Xie W, Zhang Z. Low-dose glucocorticoids should be withdrawn or continued in systemic lupus erythematosus? A systematic review and meta-analysis on risk of flare and damage accrual. Rheumatology (Oxford) 2021;60(12):5517-26.
- Ji L, Xie W, Fasano S, Zhang Z. Risk factors of flare in patients with systemic lupus erythematosus after glucocorticoids withdrawal. A systematic review and meta-analysis. Lupus Sci Med 2022;9(1):e000603.
- Ji L, Gao D, Hao Y, Huang H, et al. Low-dose glucocorticoids withdrawn in systemic lupus erythematosus: a desirable and attainable goal. Rheumatology (Oxford) 2022 Apr 12:keac225.
- Fasano S, Coscia MA, Pierro L, Ciccia F. Which patients with systemic lupus erythematosus in remission can withdraw low dose steroids? Results from a single inception cohort study. Lupus 2021;30(6):991-7.
- Hao Y, Ji L, Gao D, Fan Y, et al. Flare rates and factors determining flare occurrence in patients with systemic lupus erythematosus who achieved low disease activity or remission: results from a prospective cohort study. Lupus Sci Med 2022;9(1):e000553.
- Tselios K, Gladman DD, Su J, Urowitz MB. Gradual glucocorticosteroid withdrawal is safe in clinically quiescent systemic lupus erythematosus. ACR Open Rheumatol 2021;3(8):550-7.
- Ruiz-Irastorza G. Prednisone in systemic lupus erythematosus: taper quickly, withdraw slowly. Rheumatology (Oxford) 2021;60(12):5489-90.
- van Vollenhoven RF, Bertsias G, Doria A, et al. 2021 DORIS definition of remission in SLE: final recommendations from an international task force. Lupus Sci Med 2021;8(1):e000538.
- Ruiz-Irastorza G, Garcia M, Espinosa G et al. First month prednisone dose predicts prednisone burden during the following 11 months: an observational study from the RELES cohort. Lupus Sci Med 2016;3:e000153.
- Ruiz-Irastorza G, Ramos-Casals M, Brito-Zeron P, Khamashta MA. Clinical efficacy and side effects of antimalarials in systemic lupus erythematosus: a systematic review. Ann Rheum Dis 2010;69(1):20-8.
- Pego-Reigosa JM, Nicholson L, Pooley N, et al. The risk of infections in adult patients with systemic lupus erythematosus: systematic review and meta-analysis. Rheumatology 2021;60:60–72.
- Tao CY, Shang J, Chen T, et al. Impact of antimalarial (AM) on serum lipids in systemic lupus erythematosus (SLE) patients: a systematic review and meta-analysis. Medicine 2019;98:e15030.
- Dima A, Jurcut C, Chasset F, Felten R, Arnaud L. Hydroxychloroquine in systemic lupus erythematosus: overview of current knowledge. Ther Adv Mus culo -skelet Dis 2022;14:1759720X211073001.
- Clowse MEB, Eudy AM, Balevic S, et al. Hydroxychloroquine in the pregnancies of women with lupus: a meta-analysis of individual participant data. Lupus Sci Med 2022;9(1):e000651.
- Насонов Е.Л., Соловьев С.К., Лила А.М. Клиническое течение и стандартная терапия системной красной волчанки в Российской Федерации. Современная ревматология. 2016;10(2):12-6 [Nasonov EL, Solovyev SK, Lila AM. The clinical course and standard therapy of systemic lupus erythematosus in the Russian Federation. Modern Rheumatology Journal 2016;10(2):12-6 (In Russ.)].
- Tselios K, Gladman DD, Touma Z, et al. Disease course patterns in systemic lupus erythematosus. Lupus 2019;28(1):114-122.
- Cervera R, Doria A, Amoura Z, et al. Patterns of systemic lupus erythematosus expression in Europe. Autoimmun Rev 2014;13(6):621-9.
- Gioti O, Chavatza K, Nikoloudaki M, et al. Residual disease activity and treatment intensification in systemic lupus erythematosus: A cross-sectional study to quantify the need for new therapies. Lupus 2022 Sep 28:9612033221129776.
- Liossis SN, Staveri C. What's new in the treatment of systemic lupus erythematosus. Front Med (Lausanne) 2021;8:655100.
- Rovin BH, Teng YKO, Ginzler EM, Arriens C, et al. Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2021;397(10289): 2070-80
- Gallucci S, Meka S, Gamero AM. Abnormalities of the type I interferon signaling pathway in lupus autoimmunity. Cytokine 2021;146:155633.
- Насонов Е.Л., Авдеева А.С., Попкова Т.В. Новые возможности фармакотерапии системной красной волчанки: перспективы применения анифролумаба (моноклональные антитела к рецепторам интерферона типа I). Научно-практическая ревматология 2021;59(5):537-46 [Nasonov EL, Avdeeva AS, Popkova TV. New possibilities of pharmacotherapy for systemic lupus erythematosus: Prospects for the use of anifrolumab (monoclonal antibodies to type I interferon receptor). Rheumatology Science and Practice 2021;59(5):537-46 (In Russ.)].
- Morand EF, Furie R, Tanaka Y, et al; TULIP-2 Trial Investigators. Trial of anifrolumab in active systemic lupus erythematosus. N Engl J Med 2020;382(3):211-21.
