Переносимость вакцины Гам-КОВИД-Вак (Спутник V) у взрослых пациентов с иммуновоспалительными ревматическими заболеваниями
Изучить переносимость и безопасность вакцины Гам-КОВИД-Вак (Спутник V) у взрослых пациентов с иммуновоспалительными ревматическими заболеваниями (ИВРЗ).
Было проведено одномоментное исследование, в котором основную группу составили пациенты в возрасте старше 18 лет с ИВРЗ, а контрольную – лица без ИВРЗ. Группы были сформированы путем последовательного сплошного включения пациентов, проходивших амбулаторное обследование в исследовательских центрах и сообщивших о введении, как минимум, одной дозы вакцины Гам-КОВИД-Вак (Спутник V). Информацию о нежелательных явлениях собирали с помощью онлайн-опросника.
В основную группу были включены 157 пациентов, в контрольную – 168. Основная и контрольная группы были сопоставимы по возрасту (46 [37; 61] и 48 [30; 60] лет, соответственно, p=0,523), половому составу (доля женщин 71,3% и 72,0%, p=0,903) и частоте большинства сопутствующих заболеваний. Оба компонента вакцины получили 131 (83,4%) и 159 (94,6%) пациентов в основной и контрольной группах, соответственно. Общая частота нежелательных явлений после введения первого компонента вакцины в основной группе была ниже, чем в контрольной (72,0% и 82,7%, p=0,024), в то время как после введения второго компонента вакцины она оказалась сопоставимой в двух группах (64,1% и 68,6%, p=0,454). Наиболее частыми нежелательными явлениями были боль в месте инъекции, общая слабость, миалгии, артралгии, озноб и лихорадка более 38оС. О развитии аллергических реакций сообщили 5 пациентов основной группы и 5 пациентов контрольной группы (p>0,05).
У пациентов с ИВРЗ вакцина Гам-КОВИД-Вак характеризуется удовлетворительной переносимостью, сопоставимой с таковой у людей без ревматических болезней.
Согласно официальной статистике ВОЗ, к ноябрю 2021 г. в мире было зарегистрировано более 250 млн случаев инфекции, вызванной SARS-CoV-2, и более 5 млн летальных исходов [1]. COVID-19 считают важной причиной повышенной заболеваемости и смертности пациентов с хроническими неинфекционными заболеваниями, в том числе иммунными воспалительными ревматическими заболеваниями (ИВРЗ). По данным Strangfeld и соавт., почти половина из 3729 пациентов с ревматическими заболеваниями и COVID-19, включенных в реестр врачей Глобального ревматологического альянса, были госпитализированы, а 10,5% – умерли [2]. Смерт ность, связанная с COVID-19, была ассоциирована как с общими (возраст, пол, сахарный диабет, хронические заболевания сердечно-сосудистой системы и органов дыхания), так и со специфическими для заболевания факторами, включая активность заболевания и лечение определенными иммуносупрессивными препаратами. Самым высоким риск неблагоприятного исхода был у пациентов, получавших терапию ритуксимабом, сульфасалазином, циклофосфамидом, такролимусом, циклоспорином, преднизолоном в дозе выше 10 мг/сут, в то время как увеличения риска тяжелого течения COVID-19 не было отмечено при применении лефлуномида, ингибиторов фактора некроза опухоли, интерлейкина (ИЛ)-6, ИЛ17, ИЛ-23 по сравнению с монотерапией метотрексатом. Аналогичные результаты были получены в работе Sparks и соавт., которые выявили увеличение риска госпитализации и смерти, связанной с COVID-19, у пациентов, получавших ритуксимаб или ингибиторы янус-киназ [3]. По данным отечественных исследований, опубликованных в 2020 г., пациенты с ревматическими заболеваниями составили около 3% среди 3480 больных, госпитализированных по поводу COVID-19, и 1,3% среди 1097 пациентов отделений реанимации и интенсивной терапии [4,5].
Эти факты подчеркивают важность профилактики COVID-19 среди пациентов с ИВРЗ. Согласно промежуточному анализу рандомизированного контролируемого исследования 3 фазы, гетерологичная вакцина против COVID-19 (Спутник V) на основе вектора rAd26 и rAd5 была эффективной и безопасной среди населения в целом [6]. Тем не менее, ее эффективность и безопасность у пациентов с ИВРЗ не изучались. Уровень принятия вакцины от COVID-19 среди населения России относительно низкий [7]. Кроме того, нерешительность в отношении вакцинации может быть выше среди пациентов с ИВРЗ и их лечащих врачей из-за опасений по поводу побочных эффектов. В этом исследовании мы оценили переносимость и безопасность вакцины Гам-КОВИД-Вак у пациентов с ИВРЗ.
Материал и методы
Ретроспективное исследование проводилось с 29 июня 2021 г. по 13 августа 2021 г. на базе Клиники им Е.М. Тареева Первого МГМУ им. И.М. Сеченова, медицинского центра К+31, ОСП “Российский геронтологический научно-клинический центр" РНИМУ имени Н.И. Пирогова, МГУ им М.В. Ломоносова и Областной клинической больницы г. Владимира. Выборка исследования была сформирована путем последовательного сплошного включения пациентов, проходивших амбулаторное обследование и лечение в исследовательских центрах. Критериями включения были возраст старше 18 лет, вакцинация одним или двумя компонентами препарата Гам-КОВИД-Вак (Спутник V), а также наличие установленного диагноза ИВРЗ у пациентов основной группы и его отсутствие у пациентов контрольной группы. Все пациенты дали информированное согласие на участие в исследовании. Исследование было одобрено этическим комитетом Первого МГМУ им. И.М. Сеченова.
Данные были собраны с помощью анонимной онлайнанкеты, которую участники исследования заполняли самостоятельно. С помощью анкеты собирали демографические данные, сведения о сопутствующих заболеваниях, иммуносупрессивной терапии, типе вакцины и сроках вакцинации, а также развитии местных и общих нежелательных явлений после вакцинации.
Основной конечной точкой было развитие местных (боль, отек, гиперемия) или общих (лихорадка >38,0оC, озноб, утомляемость, артралгии, миалгии, тошнота и/или рвота, другие желудочно-кишечные расстройства, головная боль) нежелательных явлений. Кроме того, оценивали выраженность нежелательных реакций (незначительная, умеренная, выраженная) и их продолжительность. Паци ентов просили указать данные о развитии аллергических реакций, обострения ИВРЗ и подтвержденного COVID-19 после вакцинации.
Качественные переменные представлены в виде абсолютных значений и частоты (%), количественные – в виде медиан и интерквартильных диапазонов. Для сравнения качественных переменных в независимых группах использовали критерии хи-квадрат и точный критерий Фишера, для сравнения количественных переменных в независимых группах – критерий Манна-Уитни, поскольку распределение всех количественных переменных отличалось от нормального (критерий Шапиро-Уилка). Статистически значимыми считали различия при значении p<0,05. Анализ проводили в программе SPSS v.23 (IBM).
Результаты
Процедура вакцинации. Результаты анкетирования были получены от 167 пациентов с ИВРЗ и 174 участников без ИВРЗ, которые получили по крайней мере одну дозу вакцины против SARS-CoV-2. Среди опрошенных 325 (95,3%) были иммунизированы вирусной векторной вакциной Гам-КОВИД-Вак (Спутник V), 10 (2,9%) – белковой субъединицей вакцины ЭпиВакКорона и 6 (1,8%) – инактивированной вакциной КовиВак. Все участники опроса, вакцинированные ЭпиВакКорона и КовиВак, были исключены из анализа из-за небольшой численности этих групп с целью уменьшения неоднородности выборки. В основную группу вошли 157 пациентов с ИВРЗ, в контрольную – 168 пациентов без ИВРЗ, которые получили хотя бы одну дозу вакцины Гам-КОВИД-Вак.
| ИВРЗ,n=157 | Контроль,n=168 | p | |
|---|---|---|---|
| Заполнение опросника менее, чем через 3 недели после вакцинации первым компонентом, n (%) | 19 (12,1) | 8 (4,8) | 0,025 |
| Развитие COVID-19 менее, чемчерез 3 недели после вакцинациипервым компонентом, n (%) | 2 (1,3) | 0 | 0,233 |
| Нежелательные явления после введения первого компонента, n (%) | 3 (1,9) | 0 | 0,112 |
131 (83,4%) пациенту с ИВРЗ и 159 (94,6%) пациентам контрольной группы были введены оба компонента вакцины. Основные причины вакцинации лишь первым компонентом вакцины представлены в табл. 1. Медиана времени от вакцинации до заполнения опросника в контрольной группе была значительно больше, чем в основной (105,0 [49,0; 151,5] дней и 54,0 [15,5; 101,5] дней, соответственно, p<0,001).
| ИВРЗ,n=157 | Контроль,n=168 | p | |
|---|---|---|---|
| Возраст, лет | 46 (37; 61) | 48 (30; 60) | 0,523 |
| Женский пол, n (%) | 112 (71,3) | 121 (72,0) | 0,903 |
| Индекс массы тела, кг/м2 | 25,2(21,5; 28,7) | 24,4(21,4; 28,8) | 0,346 |
| Сопутств. заболевания, n (%) | |||
| Артериальная гипертония | 54 (34,4) | 49 (29,2) | 0,341 |
| Инфаркт миокарда в анамнезе | 6 (3,8) | 3 (1,8) | 0,323 |
| Коронарная ангиопластика | 5 (3,2) | 4 (2,4) | 0,743 |
| Стенокардия | 1 (0,6) | 10 (6,0) | 0,011 |
| Фибрилляция предсердий | 7 (4,5) | 6 (3,6) | 0,781 |
| Сахарный диабет 1 типа | 0 | 1 (0,6) | 1,000 |
| Сахарный диабет 2 типа | 10 (6,4) | 16 (8,9) | 0,413 |
| Онкологические заболевания | 2 (1,3) | 5 (3,0) | 0,450 |
| Бронхиальная астма | 7 (4,5) | 19 (11,3) | 0,025 |
| Хроническая болезнь почек | 21 (13,4) | 6 (3,6) | 0,002 |
| Число заболеваний на пациента | 0 (0; 1) | 0 (0; 1) | 0,285 |
Демографические характеристики и сопутствующие заболевания. Исходные демографические и клинические показатели, включая средний возраст, половой состав, а также распространенность различных сопутствующих заболеваний, за исключением стенокардии и хронической болезни почек, были сопоставимыми в двух группах (табл. 2). В основной группе преобладали пациенты с воспалительными заболеваниями суставов и системными васкулитами (табл. 3). На момент вакцинации 131 (83,4%) пациент с ИВРЗ получали иммуносупрессивную терапию, в том числе комбинированную в 72 (45,9%) случаях.
| ИВРЗ | Количество пациентов |
|---|---|
| Ревматоидный артрит | 41 |
| АНЦА-ассоциированный васкулит | 35 |
| Системная красная волчанка | 14 |
| Анкилозирующий спондилит | 14 |
| Псориатический артрит | 13 |
| Системная склеродермия | 9 |
| Болезнь Шегрена | 5 |
| Недифференцированный артрит | 4 |
| Дерматомиозит | 4 |
| IgA-васкулит | 4 |
| Артериит Такаясу | 4 |
| Ревматическая полимиалгия | 4 |
| Антифосфолипидный синдром | 2 |
| IgG4-ассоциированное заболевание | 2 |
| Болезнь Бехчета | 1 |
| Саркоидоз | 1 |
Нежелательные явления. В целом, нежелательные явления после вакцинации были зарегистрированы у 123 (78,3%) пациентов в основной группе и 150 (89,3%) в контрольной (p=0,01). В группе пациентов с ИВРЗ любые побочные реакции после введения первой дозы вакцины возникали реже, чем в контрольной группе (72,0% и 82,7%, соответственно; p=0,024), тогда как после введения второй дозы частота нежелательных реакций была сходной у пациентов из двух групп (64,1% и 68,6%). Все отдельные местные и общие нежелательные явления и аллергические реакции возникали с одинаковой частотой после введения первой и второй доз вакцины у пациентов с ИВРЗ и контрольной группы (табл. 4). Частота продолжительных (>3 дней) нежелательных явлений после введения первого компонента вакцины, как местных (18,8% и 8,5% соответственно), так и общих (18,5% и 5,7%), в группе пациентов с ИВРЗ была выше, чем в контрольной. После введения второго компонента вакцины различия между группами по частоте продолжительных реакций были незначимы.
| Нежелательные явления | После первой дозы | p | После второй дозы | p | ||
|---|---|---|---|---|---|---|
| ИВРЗ, n=157 | Контроль, n=168 | ИВРЗ, n=131 | Контроль, n=159 | |||
| Любое нежелательное явление | 113 (72,0) | 139 (82,7) | 0,024 | 84 (64,1) | 109 (68,6) | 0,454 |
| Любая местная реакция | 96 (61,1) | 117 (69,6) | 0,129 | 64 (48,9) | 80 (50,3) | 0,815 |
| Продолжительность >3 дней | 18/96 (18,8) | 10/117 (8,5) | 0,040 | 6/64 (9,4) | 4/80 (5,0) | 0,340 |
| Боль | 89 (56,7) | 112 (66,7) | 0,068 | 62 (47,3) | 73 (45,9) | 0,814 |
| Отек | 35 (22,3) | 33 (19,6) | 0,587 | 24 (18,3) | 23 (14,5) | 0,425 |
| Гиперемия | 30 (19,1) | 32 (19,0) | 1,000 | 21 (16,0) | 24 (15,1) | 0,871 |
| Любая общая реакция | 92 (58,6) | 105 (62,5) | 0,497 | 67 (51,1) | 84 (52,8) | 0,814 |
| Продолжительность >3 дней | 17/92 (18,5) | 6/105 (5,7) | 0,007 | 13/67 (19,4) | 8/84 (9,5) | 0,100 |
| Лихорадка >38,0оC | 33 (21,0) | 39 (23,2) | 0,689 | 27 (20,6) | 35 (22,0) | 0,886 |
| Озноб | 47 (29,9) | 50 (35,7) | 0,289 | 30 (22,9) | 43 (27,0) | 0,497 |
| Утомляемость | 78 (49,7) | 90 (53,6) | 0,506 | 57 (43,5) | 71 (44,7) | 0,906 |
| Артралгии | 47 (29,9) | 42 (25,0) | 0,323 | 31 (23,7) | 33 (20,8) | 0,572 |
| Миалгии | 54 (34,4) | 60 (35,7) | 0,817 | 32 (24,4) | 32 (20,1) | 0,396 |
| Тошнота/рвота | 13 (8,3) | 6 (3,6) | 0,097 | 4 (3,1) | 5 (3,1) | 1,000 |
| Другие желудочно-кишечные расстройства | 13 (8,3) | 5 (3,0) | 0,051 | 4 (3,1) | 3 (1,9) | 0,705 |
| Головная боль | 51 (32,5) | 50 (29,8) | 0,632 | 36 (27,5) | 29 (18,2) | 0,067 |
| Аллергические реакции | 4 (2,5) | 2 (1,2) | 0,435 | 1 (0,8) | 3 (1,9) | 0,629 |
Аллергические реакции после введения вакцины были отмечены в общей сложности у 10 пациентов, а частота их развития была сопоставимой в обеих группах (табл. 4).
Выраженность нежелательных явлений, субъективно оцененных пациентами с ИВРЗ, представлена на рис. 1 и 2. Частота нежелательных реакций различной степени выраженности была сопоставимой в двух группах, за исключением боли в месте инъекции после введения первого компонента вакцины (p=0,023).
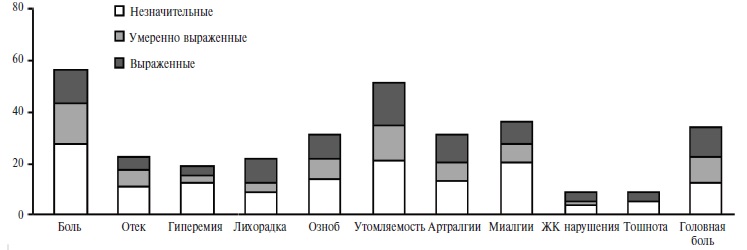
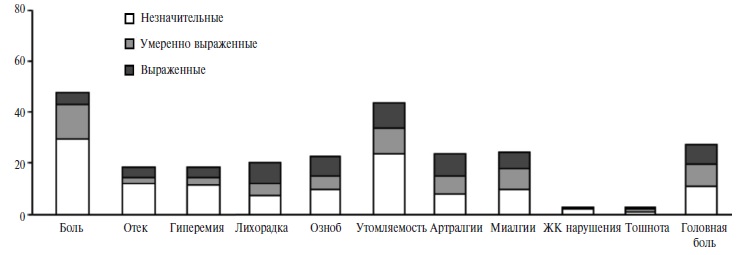
Течение ИВРЗ после вакцинации. Двадцать пять пациентов (16,5%) с ИВРЗ сообщили об ухудшении симптомов основного заболевания после вакцинации. Среди них преобладали пациенты с ревматоидным артритом (40%) и анкилозирующим спондилитом (16%). 18 пациентов (72%), сообщивших об обострении ревматического заболевания, получали иммуносупрессивную терапию, среди них 6 (24%) человек – комбинированную. В связи с усилением проявлений основного заболевания 5 пациентам потребовалась модификация иммуносупрессивной терапии, 8 – принимали нестероидные противовоспалительные препараты, а 13 – не предоставили никакой дополнительной информации о своем заболевании.
Случаи COVID-19 после вакцинации. О развитии COVID-19 после вакцинации сообщили 12 пациентов, среди них у 2 пациентов с ИВРЗ заболевание развилось после введения первого компонента вакцины. Среди пациентов, получивших оба компонента вакцины, о развитии COVID-19 сообщили 6 (4,5%) пациентов в основной группе и 4 (2,5%) в контрольной (p=0,355). У большинства из них отмечалось легкое течение COVID19, а признаки пневмонии отсутствовали, или объем поражения легких не превышал 25%. Только у 1 пациента с ревматоидным артритом наблюдалось тяжелое течение COVID-19 с развитием распространенного поражения легких (КТ-3) и дыхательной недостаточности, что потребовало введения тоцилизумаба в дозе 1200 мг суммарно.
Обсуждение
Представленное исследование является первой систематизированный попыткой оценки переносимости вакцины Гам-КОВИД-Вак у пациентов с ИВРЗ. Полученные данные свидетельствуют о том, что частота как местных, так и общих нежелательных явлений в этой группе пациентов не превышает таковую у лиц без ИВРЗ. В целом структура и выраженность нежелательных явлений, отмеченных в исследовании, соответствуют опубликованным ранее данным [6]. Частота более длительных (>3 дней) местных и общих реакций после введения первой дозы вакцины была выше в основной группе, однако этот результат следует интерпретировать с осторожностью, ввиду разного срока от вакцинации до заполнения анкеты, что повышает риск системных ошибок [8].
Эффективность и приемлемый профиль безопасности мРНК-вакцин против COVID-19 у пациентов с ИВРЗ были показаны в нескольких обсервационных исследованиях, однако данные о безопасности аденовирусных векторных вакцин в этой популяции ограничены. S. Cherian и соавт. изучали переносимость вакцинации у 724 пациентов с ревматическими заболеваниями, получивших хотя бы одну дозу ChAdOx1 (аденовирусная векторная вакцина AstraZeneca) или BBV152 (вакцина на основе инактивированного SARSCoV2) [9]. По крайней мере одно нежелательное явление было отмечено примерно у 60% пациентов, а частота их была сходной у больных с аутоиммунными ревматическими заболеваниями и заболеваниями опорно-двигательного аппарата другой природы. Четыре пациента сообщили об обострении артрита, который разрешился в течение 5 дней. Ни у одного пациента не было тяжелых нежелательных явлений, и ни одному из них не потребовалась госпитализация.
Двадцать пять (16,5%) из 157 пациентов с ИВРЗ, включенных в наше исследование, сообщили о нарастании выраженности симптомов заболевания после вакцинации. Ввиду ретроспективного характера исследования и отсутствия у авторов подробной медицинской документации эти данные не позволяют сделать окончательный вывод об истинном риске развития обострений ИВРЗ после вакцинации Гам-КОВИД-Вак. Следует отметить, что некоторые нежелательные эффекты вакцины, в том числе повышение температуры тела, артралгии и/или миалгии, могли быть расценены пациентами как проявления активности ИВРЗ. В пользу этого свидетельствует тот факт, что в части случаев для купирования “обострения" не потребовалось усиление иммуносупрессивной терапии, а для уменьшения симптомов было достаточно применения НПВП. Кроме того, после вакцинации мы не наблюдали ни одного подтвержденного случая повышения активности АНЦА-ассоциированного васкулита, обострение которого может привести к необратимому повреждению органов, прежде всего почек или легких. В более крупном многоцентровом обсервационном исследовании Barbhaiya и соавт. оценивали частоту обострений ревматического заболевания после введения мРНК-вакцин у 654 пациентов. Развитие обострения авторы наблюдали у 113 (17,0%) пациентов, в том числе у 26 (23,0%) – только после первой дозы, 48 (42,5%) – только после второй дозы, у 37 (32,7%) – после обеих доз [10]. В указанной работе авторы выявили два летальных исхода после введения второго компонента мРНК-вакцины у пациентов с ИВРЗ. Первый пациент страдал АНЦАассоциированным васкулитом, находился в стадии ремиссии и не получал какой-либо иммуносупрессивной терапии в течение 3 лет до вакцинации, за исключением низких доз преднизолона. Через три недели после введения второй дозы вакцины у пациента развился фульминантный геморрагический кожный васкулит с последующим летальным исходом. Второй пациент с псориатическим артритом и несколькими сопутствующими заболеваниями, включая сахарный диабет и ишемическую болезнь сердца, умер от инфаркта миокарда через 2 месяца после введения второй дозы вакцины. Причинно-следственной связи между двумя случаями смерти и вакцинацией авторам установить не удалось.
Частота развития COVID-19 после вакцинации в нашем исследовании была низкой как в основной, так и контрольной группе. Однако количество больных и срок наблюдения недостаточны для того, чтобы судить об эффективности вакцины Гам-КОВИД-Вак у пациентов с ИВРЗ. По данным S. Lawson-Tovey и соавт., в двух крупных регистрах доля вакцинированных пациентов среди больных с воспалительными ревматическими заболеваниями, перенесших COVID-19, была менее 1% [11]. Большинство пациентов, включенных в эти регистры, были привиты вакциной BNT162b2 (Pfizer/ BioNTech). На фоне увеличения заболеваемости COVID-19, связанного с распространением более контагиозного штамма B.1.617.2 (дельта), следует ожидать увеличения частоты инфицирования SARS-CoV-2 пациентов с ИВРЗ как в России, так и в других странах. В этих условиях большее значение имеет изучение влияния вакцинации на течение COVID-19. Дизайн нашего исследования не предусматривал анализ иммуногенности вакцины Гам-КОВИД-Вак, однако можно предположить, что, как и в случае с мРНК-вакцинами [12], антительный ответ может быть снижен у пациентов, получающих некоторые иммуносупрессивные препараты, в частности ритуксимаб.
Ограничениями нашего исследования являются ретроспективный характер, сравнительно небольшой размер выборки пациентов и сбор информации на основании анонимного анкетирования. В то же время наличие сопоставимой по большинству параметров контрольной группы является достоинством исследования и позволяет рассматривать его в качестве успешного пилотного проекта, выводы которого могут быть использованы для планирования дальнейших работ в этом направлении и принятия решений в клинической практике.
Заключение
Результаты контролируемого исследования свидетельствуют о том, что у пациентов с различными ИВРЗ векторная вакцина Гам-КОВИД-Вак (Спутник V) характеризуется удовлетворительной переносимостью, сопоставимой с таковой у людей сходного пола и возраста, не страдающих ИВРЗ. Ухудшение симптомов заболевания после введения вакцины у небольшой части пациентов, вероятно, не во всех случаях отражало истинное обострение и в любом случае не может служить основанием для отказа от вакцинации, учитывая риск тяжелого течения COVID-19 у пациентов с ИВРЗ, особенно получающих иммуносупрессивные препараты, в том числе глюкокортикостероиды в средних или высоких дозах или ритуксимаб. На необходимость вакцинации против COVID-19 у пациентов с ИВРЗ указывается и в рекомендациях различных профессиональных обществ, в частности Ассо циа ции ревматологов России [13].
Используемые источники
- WHO Coronavirus (COVID-19) Dashboard. https://covid19.who.int/.
- Strangfeld A, SchКfer M, Gianfrancesco MA, et al. Factors associated with COVID-19-related death in people with rheumatic diseases: Results from the COVID-19 Global Rheumatology Alliance physician-reported registry. Ann Rheum Dis 2021;80(7):930-42.
- Sparks JA, Wallace ZS, Seet AM, et al. Associations of baseline use of biologic or targeted synthetic DMARDs with COVID-19 severity in rheumatoid arthritis: Results from the COVID-19 Global Rheumatology Alliance physician registry. Ann Rheum Dis. 2021;80(9):1137-46.
- Munblit D, Nekliudov NA, Bugaeva P, et al. StopCOVID cohort: An observational study of 3,480 patients admitted to the Sechenov University hospital network in Moscow city for suspected COVID-19 infection. Clin Infect Dis 2021;73(1):1-11.
- Moiseev S, Avdeev S, Brovko M, et al. Rheumatic diseases in intensive care unit patients with COVID-19. Ann Rheum Dis 2021;80(2):e16.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021;397:671-81.
- Solís Arce JS, Warren SS, Meriggi NF, et al. COVID-19 vaccine acceptance and hesitancy in low- and middle-income countries. Nat Med 2021;27(8):1385-94.
- Bulanov NМ, Blyuss OB, Munblit DB, et al. Studies and research design in medicine 2021;12(1):5-18.
- Cherian S, Paul A, Ahmed S, et al. Safety of the ChAdOx1 nCoV-19 and the BBV152 vaccines in 724 patients with rheumatic diseases: a post-vaccination cross-sectional survey. Rheumatol Int 2021;41(8):1441-45.
- Barbhaiya M, Levine JM, Bykerk VP, et al. Systemic rheumatic disease flares after SARS-CoV-2 vaccination among rheumatology outpatients in New York City. Ann Rheum Dis 2021;80(10):1352-4.
- Lawson-Tovey S, Hyrich KL, Gossec L, et al. SARS-CoV-2 infection after vaccination in patients with inflammatory rheumatic and musculoskeletal diseases. Ann Rheum Dis 2021 Sep 6;annrheumdis-2021-221217
- Furer V, Eviatar T, Zisman D, et al. Immunogenicity and safety of the BNT162b2 mRNA COVID-19 vaccine in adult patients with autoimmune inflammatory rheumatic diseases and in the general population: a multicentre study. Ann Rheum Dis 2021;80(10):1330-8.
- Насонов Е.Л., Лила А.М., Мазуров В.И. и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания. Рекомендации Общероссийской общественной организации “Ассоциация ревматологов России”. Научно-практическая ревматология 2021;59(3):239-54 [Nasonov EL, Lila AM, Mazurov VI, et al. Coronavirus Disease 2019 (COVID-19) and Immune-mediated Rheumatic Diseases. Recommendations of the Association of Rheumatologists of Russia. Rheumatology Science and Practice 2021;59(3):239-54 (In Russ.)].
