Практические аспекты применения новых пероральных антикоагулянтов для профилактики ишемического инсульта у пациентов с фибрилляцией предсердий
Новые пероральные антикоагулянты (НПОАК) оказывают прямое ингибирующее действие на факторы свертывания крови – тромбин или фактор Xa. Во многих странах препараты этой группы постепенно вытесняют варфарин и другие антагонисты витамина К в профилактике ишемического инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий (ФП) благодаря более высокой эффективности и безопасности и удобству применения. В статье рассматриваются некоторые практические аспекты применения НПОАК: 1) следует ли учитывать тип ФП при назначении антикоагулянтов? 2) можно ли применять НПОАК при пороках сердца? 3) ведение пациентов с ФП при инфаркте миокарда, 4) наблюдение за пациентами, получающими НПОАК.
Риск ишемического инсульта и системных тромбоэмболий повышается у пациентов с любыми формами ФП, в том числе пароксизмальной и бессимптомной. Результаты мета-анализа клинических исследований почти у 100000 пациентов показали, что непароксизмальные формы ФП (персистирующая и постоянная) ассоции- руются с более высоким риском ишемического инсульта, чем пароксизмальная аритмия. Однако эти данные не меняют существующие показания к антикоагулянтной терапии, которую назначают с учетом дополнительных факторов риска, таких как пожилой и старческий возраст, наличие ишемического инсульта или транзиторных ишемических атак в анамнезе, сердечная недостаточность, артериальная гипертония и т.д., а не типа аритмии, выраженности клинических симптомов, частоты и длительности приступов ФП. Такой же тактики следует придерживаться и у больных инфарктом миокарда, у которых даже преходящая ФП в остром периоде приводит к значительному увеличению риска ишемического инсульта как во время госпитализации, так и в отдаленном периоде. НПОАК применяют для профилактики ишемического инсульта у пациентов с неклапанной ФП, однако фактически их нельзя назначать только больным с механическими протезами клапанов сердца и средне-тяжелым и тяжелым митральным стенозом, в то время как у пациентов с другими клапанными пороками и биопротезами клапанов сердца лечение этими препаратами допустимо. Перед началом и во время лечения НПОАК нет необходимости в мониторировании МНО и других стандартных показателей свертывания крови, так как они неинформативны и не позволяют надежно оценить антикоагулянтное действие этих препаратов. Измерение МНО перед назначением НПОАК необходимо только в случае перехода с приема варфарина и других антагонистов витамина К.
Новые пероральные антикоагулянты (НПОАК), в том числе ривароксабан, апиксабан, дабигатран и эдоксабан, оказывающие прямое ингибирующее действие на факторы свертывания крови, имеют преимущество перед антагонистами витамина К по эффективности и безопасности в профилактике ишемического инсульта у пациентов с неклапанной фибрилляцией предсердий (ФП) [1]. В связи с этим в европейских рекомендациях по лечению ФП, опубликованных в 2016 году, предпочтение отдается НПОАК [2]. Удобство применения НПОАК, связанное с отсутствием необходимости в регулярном мониторировании международного нормализованного отношения (МНО), обеспечивает более высокую приверженность к лечению, которая является залогом его эффективности. C. McHorney и соавт. проанализировали приверженность к терапии ривароксабаном (n=13645), апиксабаном (n=6304), дабигатраном (n=3360) и варфарином (n=13366) в обычной клинической практике на основании отпуска выписанных рецептов с помощью базы данных IMS [3]. В течение 6 мес доля пациентов, продолжавших прием НПОАК без перерывов (ривароксабан – 80,1%, апиксабан – 75,8% и дабигатран – 69,2%), превышала таковую в группе варфарина (64,5%). Более высокое значение показателя в группе ривароксабана, вероятно, отражало назначение препарата один раз в день и наличие календарной упаковки.
Эффективность и безопасность НПОАК в профилактике ишемического инсульта и системных тромбоэмболий у больных с ФП, в том числе в различных подгруппах, выделенных в зависимости от возраста, наличия сердечной недостаточности, хронической болезни почек, сахарного диабета, инсульта в анамнезе и других факторов, установлены в рандомизированных клинических исследованиях и подтверждены в клинической практике. В данной статье рассматриваются отдельные практические аспекты применения препаратов этой группы.
| Тип ФП | Определение |
|---|---|
| Впервые выявленная ФП | Впервые диагностированная ФП независимо от длительности аритмии или тяжести симптомов |
| Пароксизмальная ФП | Синусовый ритм восстанавливается самостоятельно, обычно в течение 48 ч, хотя пароксизмы ФП могут продолжаться до 7 дней. Если ритм восстановлен в течение 7 дней, то эпизод ФП следует считать пароксизмальной ФП |
| Персистирующая ФП | Эпизоды персистирующей ФП продолжаются более 7 дней, а для восстановления синусового ритма необходима медикаментозная или электрическая кардиоверсия. |
| Длительная персистирующей ФП | Персистирующая ФП, продолжающаяся ≥1 года, если выбрана стратегия контроля ритма. |
| Постоянная ФП | Пациент и врач считают возможным сохранение ФП, поэтому кардиоверсия не планируется. Если предполагается восстановление ритма, то аритмию называют "длительной персистирующей ФП" |
Следует ли учитывать тип фибрилляции предсердий при назначении антикоагулянтной терапии?
В зависимости от течения выделяют несколько вариантов ФП, в том числе пароксизмальную, персистирующую и постоянную формы (табл. 1) [2]. У большинства больных с возрастом наблюдается постепенное прогрессирование аритмии: приступы учащаются, сохраняются более длительное время и хуже купируются, а в конечном итоге трансформируются в постоянную форму. У значительной части пациентов помимо клинически явных эпизодов аритмии отмечаются бессимптомные приступы ФП, которые могут быть выявлены при мониторировании ЭКГ. В современных рекомендациях по диагностике и лечению ФП, предложенных различными профессиональными обществами, при оценке целесообразности антикоагулянтной терапии тип неклапанной ФП не учитывается [2,4]. Необходимость в антикоагуляции определяют на основании индекса CHA2DS2-VASc (табл. 2), величина которого зависит от возраста, пола и наличия других факторов риска ишемического инсульта и системных тромбоэмболий, в том числе инсульта в анамнезе, артериальной гипертонии, сердечной недостаточности, сахарного диабета и др. Если величина индекса составляет по крайней мере 2 балла у мужчин и 3 балла у женщин (так как женский пол сам по себе относят к факторам риска развития инсульта), то пациентам с неклапанной ФП независимо от формы аритмии, выраженности симптомов, частоты приступов и т.п., рекомендуют постоянную антикоагулянтную терапию.
| Факторы риска | Баллы | |
|---|---|---|
| Примечание: *ИБС, инфаркт миокарда, заболевание периферических артерий или бляшка в аорте | ||
| C | Сердечная недостаточность/дисфункция левого желудочка | 1 |
| H | Артериальная гипертония | 1 |
| A | Возраст ≥75 лет | 2 |
| D | Сахарный диабет | 1 |
| S | Инсульт/ТИА/тромбоэмболия | 2 |
| V | Заболевание сосудов* | 1 |
| A | Возраст 65-74 года | 1 |
| Sc | Женский пол | 1 |
| Максимальное значение | 9 | |
Антикоагулянтная терапия возможна и при наличии только одного фактора риска тромбоэмболических осложнений, однако в этом случае решение следует принимать индивидуально. Результаты некоторых исследований свидетельствуют о том, что НПОАК могут иметь преимущество перед варфарином у таких пациентов. C. Coleman и соавт. сопоставили эффективность и безопасность ривароксабана и варфарина в ретроспективном исследовании случай-контроль, проводившемся на основании медицинской базы данных [5]. Частоту неблагоприятных исходов оценивали в течение в среднем 1,6 лет у 3319 пациентов, получавших ривароксабан, и 3319 пациентов с сопоставимым риском тромбоэмболических осложнений, принимавших варфарин. Лечение ривароксабаном по сравнению варфарином сопровождалось достоверным снижением риска инсульта и системных эмболий в течение 1 года (отношение рисков 0,41, 95% доверительный интервал [ДИ] 0,17-0,98), в то время как частота кровотечений достоверно не отличалась между двумя группами. Сходные результаты были получены через 2 года.
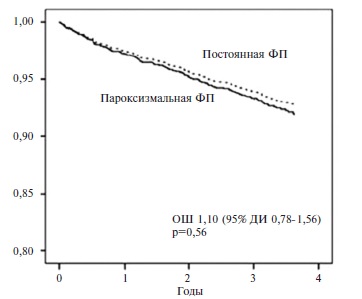
Современный подход к назначению антикоагулянтной терапии определяется тем, что риск тромбоэмболических осложнений увеличивается у пациентов с любыми формами ФП. Например, в шведском когортном исследовании в течение 3,6 лет была сопоставлена частота инсульта у 855 пациентов с пароксизмальной ФП и 1126 больных с постоянной формой аритмии [6]. По данным многофакторного анализа, риск развития ишемического инсульта был сопоставимым в группах сравнения (относительный риск 1,07; 95% ДИ 0,711,61) (рис. 1). Сходные результаты были получены и при анализе частоты любого инсульта. При этом у больных c пароксизмальной ФП частота ишемического инсульта с поправкой на возраст и пол была примерно в 2 раза выше, чем в популяции, а лечение варфарином в этой группе привело к снижению риска ишемического инсульта на 56%.
Результаты некоторых исследований свидетельствуют о том, что тип ФП все же может оказывать влияние на риск тромбоэмболических осложнений. A. Ganesan и с соавт. провели мета-анализ 12 исследований (n=99996; средний возраст от 62 до 73 лет), в которых изучались клинические исходы в зависимости от формы аритмии [7]. Длительность наблюдения варьировалась от 1 до 2,8 лет. У больных с непароксизмальной ФП (имеющиеся данные не позволили дифференцировать постоянную и персистирующую формы ФП) относительный риск развития инсульта или системных тромбоэмболий, рассчитанный с поправкой на различные переменные, составил 1,384 (95% ДИ 1,191-1,608; p<0,001) по срав нению с таковым у пациентов с пароксизмальной ФП. Риск смерти от любых причин также был выше у пациентов с непароксизмальной ФП (1,217; 95% ДИ 1,0851,365; p<0,001), в то время как частота кровотечений оказалась сопоставимой в двух группах. Следует отметить, что авторы не анализировали относительный риск тромбоэмболических осложнений у пациентов с различными значениями CHADS2/CHA2DS2-VASc, хотя эти данные имеют важное значение для интерпретации полученных результатов. В любом случае результаты мета-анализа не меняют существующую парадигму антикоагулянтной терапии у пациентов с неклапанной ФП. Во-первых, как указано выше, у пациентов с пароксизмальной ФП риск развития ишемического инсульта значительно выше, чем в общей популяции. Во-вторых, вероятность развития инсульта и системных тромбоэмболий зависит в большей степени не от наличия какого-то определенного фактора риска, а от величины индекса CHA2DS2-VASc, т.е. их количества. Соответственно, новые данные о неблагоприятном прогностическом значении типа ФП, если они будут подтверждены, могут иметь большее значение для пациентов со значением индекса CHA2DS2-VASc 0-1, у которых наличие дополнительного фактора риска может повлиять на решение о назначении антикоагулянтной терапии.
Как указано выше, у значительной части пациентов с ФП (до 40%) наблюдаются бессимптомные эпизоды аритмии. Q. Xiong и соавт. провели мета-анализ 6 клинических исследований, в которых сравнивали исходы у пациентов с ФП, сопровождавшейся и не сопровождавшейся симптомами [8]. Среди пациентов с бессимптомной ФП была выше доля мужчин, в то время как возраст больных двух групп достоверно не отличался. Достоверной разницы смертности от любых или сердечно-сосудистых причин или частоты инсульта/системных тромбоэмболий между двумя группами также не выявили.
Сходные данные были получены в регистре PREFER in AF, в который были включены 6196 пациентов с ФП [9]. У 508 (8,1%) из них отсутствовали симптомы. У пациентов с бессимптомной ФП индекс CHA2DS2-VASc был ниже, чем у больных с ФП, сопровождавшейся симптомами (2,9±1,7 и 3,4±1,8, соответственно; р<0,01). Тем не менее, в течение 1 года частота тромбоэмболических осложнений была сопоставимой в двух группах. Результаты этих исследований подтверждают, что отсутствие клинических симптомов у пациентов с неклапанной ФП не может быть основанием для отказа от антикоагулянтной терапии.
На практике при оценке целесообразности проведения антикоагуляции часто возникают и другие вопросы. Например, следует ли немедленно назначить антикоагулянтную терапию пациенту с первым пароксизмом ФП? Нужна ли антикоагуляция больным с редкими пароксизмами ФП, которые возникают 1-2 раза в год и заканчиваются быстрым восстановлением синусового ритма? В современных рекомендациях специально не оговариваются подобные ситуации. Как указано выше, эксперты подчеркивают, что необходимость в антикоагуляции следует оценивать на основании установленных факторов риска, входящих в шкалу CHA2DS2-VASc, а не частоты эпизодов ФП. У пациентов с "редкими" пароксизмами ФП необходимо также учитывать возможность наличия скрытых эпизодов аритмии, которые не всегда удается зарегистрировать. У небольшой части пациентов развитие пароксизма ФП может быть вызвано преходящими факторами, такими как употребление алкоголя, гипертиреоз, оперативное вмешательство, интенсивная физическая нагрузка. Их устранение может привести к стойкому восстановлению синусового ритма, особенно у пациентов более молодого возраста, не страдающих сердечно-сосудистыми заболеваниями. С другой стороны, пожилой возраст, артериальная гипертония, сердечная недостаточность, дилатация левого предсердия ассоциируются с прогрессированием ФП [10,11].
Разработаны различные индексы, которые позволяют предсказать течение ФП, в том числе HATCH, ALARMEc, APPLE, BASE-AF2 [12]. Индекс HATCH, включающий в себя сердечную недостаточность, возраст старше 75 лет, транзиторную ишемическую атаку или инсульт в анамнезе, хроническую обструктивную болезнь легких и артериальную гипертонию, был предложен на основании наблюдения 1219 пациентов с ФП [13]. В этом исследовании переход пароксизмальной ФП в персистирующую наблюдался почти у 50% больных с высоким значением индекса HATCH (>5) и только у 6% больных, у которых его значение составляло 0, т.е. отсутствовали перечисленные факторы риска. Другие индексы предполагают оценку дополнительных предикторов прогрессирования ФП, в частности дилатации левого предсердия. В целом все предложенные индексы недостаточно валидированы в клинических исследованиях, поэтому их практическое значение остается ограниченным [12]. Кроме того, эти индексы предполагается использовать для оценки вероятности рецидивов ФП после катетерной аблации и других вмешательств, направленных на удержание синусого ритма, а не для решения вопроса о назначении антикоагулянтной терапии.
Можно ли применять НПОАК при пороках сердца?
Применение НПОАК возможно только у пациентов с неклапанной ФП. При этом под "пороком сердца" следует понимать механический протез клапана сердца и средне-тяжелый или тяжелый стеноз митрального отверстия (обычно ревматической этиологии), так как именно таких пациентов исключали из всех рандомизированных клинических исследований НПОАК III фазы. Однако у пациентов с ФП нередко определяются и другие изменения клапанов сердца, которые не являются противопоказанием к назначению НПОАК (табл. 3) [14,15]. К ним относятся стеноз аортального отверстия, недостаточность аортального клапана, пролапс митрального клапана, реконструктивные операции на митральном клапане, биопротезы клапанов сердца, вмешательства на аортальном клапане. Пациентов с указанными пороками сердца включали в рандомизированные контролируемые исследования, которые подтвердили эффективность и безопасность НПОАК по сравнению варфарином у таких больных [16,17].
| Состояние | Возможность назначения НПОАК |
|---|---|
| Механический протез клапана сердца | Противопоказаны |
| Средне-тяжелый или тяжелый стеноз митрального отверстия (обычно ревматической этиологии) | Противопоказаны |
| Другие легкие или средне-тяжелые пороки нативных клапанов сердца (легкие или средне-тяжелые аортальный стеноз или недостаточность, митральная недостаточность и т.д.) | Таких пациентов включали в клинические исследования |
| Тяжелый аортальный стеноз | Данные ограничены (исключали из RE-LY). Большинству пациентов проводится оперативное вмешательство. |
| Биологические протезы клапанов сердца (>3 мес после операции) | Не рекомендуются больным ревматическим митральным стенозом. Применение возможно, если протезирование выполнено по поводу митральной недостаточности или порока аортального клапана |
| Реконструктивное вмешательство на митральном клапане (>3 мес после операции) | Пациентов включали в некоторые исследования НПОАК |
| Чрескожная транслюминальная пластика аортального клапана или транскатетерная имплантация аортального клапана | Проспективные исследования не проводились. Может потребоваться комбинация с одним или двумя антитромбоцитарными препаратами |
| Гипертрофическая кардиомиопатия | Данные немногочисленны, однако применение НПОАК может быть приемлемым |
Следует отметить, что эффективность и безопасность НПОАК недостаточно изучены у пациентов с биопротезами клапанов и больных, перенесших реконструктивные вмешательства на клапанах. Большинство таких пациентов не нуждаются в длительной антикоагулянтной терапии после операции, поэтому по мнению экспертов Европейской ассоциации аритмологов (EHRA) им могут быть назначены НПОАК при наличии ФП [15]. Единственным исключением считают имплантацию биопротеза пациенту с митральным стенозом. В таких случаях после операции обычно сохраняется выраженная дилатация левого предсердия, что может быть доводом в пользу применения антагониста витамина К.
У пациентов с гипертрофической кардиомиопатией обструктивного типа ФП ассоциируется с высоким риском тромбоэмболий. Опыт применения НПОАК у таких больных ограничен [18]. Тем не менее, гипертрофическую кардиомиопатию не считают противопоказанием к назначению препаратов этой группы. В рекомендациях Европейской ассоциации аритмологов отмечено, что ФП при гипертрофической кардиомиопатии во многом сходна с ФП у больных сердечной недостаточностью с сохранной систолической функцией левого желудочка, у которых НПОАК по эффективности и безопасности не уступали варфарину [15]. Например, в исследовании ROCKET AF принимали участие 9033 пациента с ФП и сердечной недостаточностью. Эффективность и безопасность ривароксабана в дозе 20 мг один раз в день по сравнению с варфарином были сопоставимыми у больных с хронической сердечной недостаточностью и без сердечной недостаточности [19]. Эффективность ривароксабана не зависела от величины фракции выброса левого желудочка (<40% или ≥40%), функционального класса по NYHA и типа сердечной недостаточности (со сниженной или сохранной фракцией выброса).
Фибрилляция предсердий при инфаркте миокарда
ФП встречается у 6-21% больных острым инфарктом миокарда и ассоциируется со значительным ухудшением прогноза, в том числе увеличением как госпитальной летальности, так и смертности в отдаленном периоде [20]. Основными предикторами развития ФП считают пожилой возраст, сердечную недостаточность и снижение функции левого желудочка. У пациентов с инфарктом миокарда, осложнившимся ФП, повышен риск тромбоэмболических осложнений, в том числе ишемического инсульта. В исследовании GUSTO-I, в которое были включены более 40000 больных острым инфарктом миокарда, частота инсульта во время госпитализации составила 3,1% при наличии ФП и только 1,3% при ее отсутствии (р<0,0001) [21]. В исследовании OPTIMAAL скорректированный относительный риск инсульта в течение первых 30 дней после инфаркта миокарда у больных с впервые выявленной ФП равнялся 14,6 (95% ДИ 5,87–36,3, р<0,001) [22]. Повышение риска развития инсульта отмечалось и после выписки пациентов из стационара и сохранялось до конца исследования (2,79, 95% ДИ 1,43–3,68, р<0,001).
G. Batra и соавт. проанализировали прогностическое значение различных вариантов ФП более чем у 155000 пациентов с острым инфарктом миокарда, включенных в шведские регистры [23]. Авторы оценивали частоту различных исходов с помощью модели регрессии Кокса. В течение 90 дней после инфаркта миокарда. ФП была выявлена у 24023 (15,5%) больных. Были выделены следующие типы аритмии: впервые развившаяся ФП и синусовый ритм при выписке (3,7%), впервые развившаяся ФП, сохранявшаяся при выписке (3,9%), пароксизмальная ФП (4,9%) и хроническая ФП (3,0%). Частота сердечно-сосудистых исходов (смерть от любых причин, инфаркт миокарда или ишемический инсульт) у пациентов с любым типом ФП и синусовым ритмом составила 90,9 и 45,2 на 100 пациенто-лет, соответственно (скорректированное отношение рисков 1,28; 95% ДИ 1,19-1,37) и существенно не отличалась у больных с разными вариантами аритмии. Среди неблагоприятных исходов в наибольшей степени увеличился риск ишемического инсульта (2,29, 95% ДИ 1,92-2,74). Увеличение риска сердечно-сосудистых исходов, ассоциированное с ФП, было сопоставимым у больных инфарктом миокарда с подъемом сегмента ST и без подъема сегмента ST. Таким образом, результаты этого крупного исследования показали, что риск развития неблагоприятных исходов, в том числе ишемического инсульта, у больных острым инфарктом миокарда не зависит от типа ФП.
C. Siu и соавт. оценивали клинические исходы у 431 пациента с острым инфарктом миокарда с подъемом сегмента ST, не сопровождавшимся нарушением функции сердца [24]. У 59 (13,7%) из них во время госпитализации зарегистрировали развитие преходящей ФП. Эти пациенты были старше больных, у которых отсутствовала ФП (79±1,4 и 64±0,7 лет; p<0,01). Кроме того, в группе больных с ФП была выше доля женщин (37% и 23%; p<0,02). В течение 1 года частота инсульта у больных, перенесших и не перенесших ФП во время госпитализации, составила 10,2% и 1,8%, соответственно (p<0,01). Преходящая ФП у больных инфарктом миокарда ассоциировалась также с увеличением частоты развития ФП в течение года (22,0% и 1,3%; p<0,01), но не влияла на общую смертность (5,6% и 6,8%; р=0,73). С помощью модели регрессии Кокса было показано, что возраст старше 65 лет и преходящая ФП во время инфаркта миокарда были независимыми предикторами последующего развития ФП и ишемического инсульта.
В рекомендациях Европейского общества кардиологов по ведению больных инфарктом миокарда с подъемом сегмента ST указано, что в случае развития ФП в острую фазу инфаркта миокарда (de novo) необходимо обсуждать целесообразность назначения пероральных антикоагулянтов [25]. Как и в других случаях, решение следует принимать на основании величины индекса CHA2DS2-VASc. Восстановление синусового ритма перед выпиской не должно служить основанием для отказа от антикоагуляции, учитывая повышенный риск развития рецидивов ФП и ишемического инсульта у таких пациентов.
Для профилактики неблагоприятных исходов у больных инфарктом миокарда, в том числе после стентирования коронарных артерий, применяют антитромбоцитарные препараты, однако они недостаточно эффективны в профилактике ишемического инсульта у пациентов с ФП. В связи с этим больным с острым инфактом миокарда и ФП, перенесшим стентирование коронарной артерии, рекомендуют назначать тройную антитромботическую терапию пероральным антикоагулянтом, аспирином и клопидогрелом на срок не более 6 мес (длительность ее в основном определяется риском кровотечений) с последующим переходом на лечение двумя препаратами – пероральным антикоагулянтом и антиагрегантом. Через 12 мес целесообразно отменить антиагрегант и продолжить лечение только пероральным антикоагулянтом. Если стентирование не проводилось, то в течение первых 12 мес после инфаркта миокарда проводят двойную антитромботическую терапию пероральным антикоагулянтом и антигрегантом (аспирином или клопидогрелом), а затем продолжают антикоагулянтную терапию [2].
Тактика ведения пациентов с ФП после стентирования коронарных артерий в ближайшее время может быть пересмотрена с учетом результатов клинических исследований, в которых сравнивали двойную и тройную антитромботическую терапию [26]. В исследование PIONEER AF-PCI были включены 2124 больных с неклапанной ФП, которым было выполнено стентирование коронарной артерии [27]. Примерно в половине случае показанием к вмешательству был острый коронарный синдром. Пациенты были рандомизированы на три группы и получали ривароксабан в дозе 15 мг один раз в день (сниженная доза по сравнению со стандартной дозой 20 мг) + ингибитор P2Y12 (преимущественно клопидогрел) в течение 12 мес, ривароксабан в дозе 2,5 мг два раза в день (эта доза зарегистрирована у больных с острым коронарным синдромом без ФП) + два антитромбоцитарных препарата или стандартную терапию антагонистом витамина К и двумя антитромбоцитарными препаратами. Лечение ривароксабаном в сочетании с одним или двумя антитромбоцитарными препаратами сопровождалось достоверным снижением риска развития клинически значимых кровотечением на 41% и
37%, соответственно, по сравнению со стандартной терапией. Суммарная частота смерти от сердечно-сосудистых причин, нефатального инфаркта миокарда и инсульта была сопоставимой в трех группах, как и частота тромбоза стента. Таким образом, применение ривароксабана в дозе 15 мг один раз в день (у пациентов с нарушенной функцией почек дозу снижали до 10 мг) в сочетании с клопидогрелом по эффективности в профилактике неблагоприятных исходов не уступало тройной антитромботической терапии у пациентов с ФП, перенесших стентирование коронарной артерии, но имело значительное преимущество по безопасности.
Сходные данные были получены в исследовании REDUAL PCI, в котором у 2725 больных с ФП, перенесших чрескожное вмешательство на коронарных артериях, сравнивали дабигатран в дозах 110 или 150 мг два раза в день с комбинации с ингибитором P2Y12 (клопидогрелом или тикагрелором) и тройную антитромботическую терапию [28]. В течение в среднем 14 мес частота больших и клинически значимых небольших кровотечений была самой низкой при применении дабигатрана в дозе 110 мг два раза в день в сочетании с одним ингибитором P2Y12. При этом суммарная частота тромбоэмболических осложнений (инфаркт миокарда, инсульт или системная эмболия), смерти или незапланированной реваскуляризации достоверно не отличалась у больных, получавших двойную или тройную антитромботическую терапию. Следует отметить, что при применении дабигатрана в дозе 110 мг два раза в день в сочетании с одним ингибитором P2Y12 была отмечена тенденция к увеличению частоты отдельных неблагоприятных исходов по сравнению с таковой в группе сравнения. Этот факт имеет важное значение, если следовать новым рекомендациям Европейского общества кардиологов 2017 года, предполагающим применение НПОАК в комбинации с аспирином и/или клопидогрелем у пациентов с ИБС, нуждающихся в антикоагулянтной терапии, в наименьшей изученной дозе [25]. В настоящее время проводятся исследования AUGUSTUS и ENTRUST-PCI, в которых изучаются два других НПОАК – апиксабан и эдоксабан – у пациентов с ФП, перенесших чрескожное вмешательство на коронарных артериях.
Таким образом, результаты двух исследований показали, что лечение НПОАК в комбинации с клопидогрелом в течение года после стентирования коронарных артерий у больных с ФП не менее эффективно, но более безопасно, чем стандартная тройная антитромботическая терапия. Следует подчеркнуть, что пациенты с ФП, перенесшие инфаркт миокарда или стентирование коронарной артерии более 1 года назад, не нуждаются в сопутствующем приеме антитромбоцитарных препаратов. Таким больным для профилактики тромбоэмболических осложнений следует назначать только НПОАК.
Наблюдение за пациентами, получающими НПОАК
Хотя НПОАК могут оказать влияние на стандартные показатели свертывания крови, такие как МНО/протромбиновое время и активированное частичное тромбопластиновое время, их измерение перед началом лечения или для оценки эффективности терапии не имеет смысла и не рекомендуется [15]. При терапии НПОАК измерять исходное МНО целесообразно только в период перехода с варфарина или другого антагониста витамина К на НПОАК. В практическом руководстве Европейской ассоциации аритмологов (EHRA, 2018) содержатся общие рекомендации, которые могут быть использованы при лечении любыми НПОАК [15]. По мнению экспертов, лечение этими препаратами можно начать немедленно, если МНО на фоне приема антагониста витамина К составляет ≤2,0. Пациентам со значением МНО от 2,0 до 2,5 НПОАК также можно назначить в тот же день или (лучше) на следующий день. Если МНО превышает 2,5, то перед назначением НПОАК необходимо повторно измерить этот показатель через 1-3 дня. При оценке возможных сроков снижения МНО следует учитывать его исходную величину и период полувыведения антагониста витамина К (аценокумарол – 8-24 ч, варфарин – 36-48 ч, фенопрокумон – 120-200 ч).
Следует отметить, что в инструкциях по применению НПОАК указано, что эти препараты могут быть назначены вместо варфарина, если МНО составляет ≤3 для ривароксабана, ≤2,5 для эдоксабана и ≤2,0 для апиксабана и дабигатрана.
Все НПОАК частично выводятся почками в неизмененном виде, в большей степени дабигатран (80%) и эдоксабан (50%) и в меньшей – ривароксабан (35%) и апиксабан (27%) [15], поэтому нарушение функции почек может сопровождаться увеличением концентрации препаратов в крови и усилением их антикоагулянтного действия. В связи с этим пациентам с хронической болезнью почек целесообразно назначать ингибиторы фактора Ха, которые в меньшей степени выводятся почками (ривароксабан или апиксабан). При лечении НПОАК необходимо регулярно контролировать функцию почек (по крайней мере ежегодно), чтобы своевременно скорректировать дозу препарата. Например, рекомендуемая доза ривароксабана у пациентов со сниженным клиренсом креатинина (30-50 мл/мин) составляет 15 мг один раз в день. Чтобы определить минимальную кратность определения функции почек (в месяцах) у пациентов с клиренсом креатинина 30-60 мл/мин, его значение следует разделить на 10. Например, если клиренс креатинина составляет 40 мл/мин, то функцию почек необходимо контролировать каждые 4 мес. При наличии дополнительных факторов риска (пожилой возраст, сопутствующие заболевания) может потребоваться более частое мониторирование функции почек, особенно при лечении дабигатраном.
В клинической практике функцию почек чаще всего оценивают на основании расчетной скорости клубочковой фильтрации. Однако применительно к лечению НПОАК предпочтительно рассчитывать клиренс креатинина по формуле Кокрофта-Гоулта, так как именно этот показатель использовался во всех клинических исследованиях препаратов этой группы.
Заключение
Риск ишемического инсульта и системных тромбоэмболий повышается у пациентов с любыми формами ФП, в том числе пароксизмальной и бессимптомной. Резуль таты мета-анализа клинических исследований почти у 100000 пациентов показали, что непароксизмальные формы ФП (персистирующая и постоянная) ассоциируются с более высоким риском ишемического инсульта, чем пароксизмальная аритмия. Однако эти данные не меняют существующие показания к антикоагулянтной терапии, которую назначают с учетом дополнительных факторов риска, таких как пожилой и старческий возраст, наличие ишемического инсульта или транзиторных ишемических атак в анамнезе, сердечная недостаточность, артериальная гипертония и т.д., а не типа аритмии, выраженности клинических симптомов, частоты и длительности приступов ФП. Такой же тактики следует придерживаться и у больных инфарктом миокарда, у которых даже преходящая ФП в остром периоде приводит к значительному увеличению риска ишемического инсульта как во время госпитализации, так и в отдаленном периоде. НПОАК применяют для профилактики ишемического инсульта у пациентов с неклапанной ФП, однако фактически их нельзя назначать только больным с механическими протезами клапанов сердца и средне-тяжелым и тяжелым митральным стенозом, в то время как у пациентов с другими клапанными пороками и биопротезами клапанов сердца лечение этими препаратами допустимо. Перед началом и во время лечения НПОАК нет необходимости в мониторировании МНО и других стандартных показателей свертывания крови, так как они неинформативны и не позволяют надежно оценить антикоагулянтное действие этих препаратов. Измерение МНО перед назначением НПОАК необходимо только в случае перехода с приема варфарина и других антагонистов витамина К.
Используемые источники
- Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955–62. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893–962.
- McHorney CA, Ashton V, Laliberté F, et al. Adherence to rivaroxaban compared with other oral anticoagulant agents among patients with nonvalvular atrial fibrillation. J Manag Care Spec Pharm 2017;23(9):980-8.
- Сулимов В.А., Голицын С.П., Панченко Е.П. и др. Национальные рекомендации по диагностике и лечению фибрилляции предсердий. 2012.
- Coleman CI, Turpie AGG, Bunz TJ, et al. Effectiveness and safety of rivaroxaban versus warfarin in nonvalvular atrial fibrillation patients with a non-sex-related CHA2DS2-VASc score of 1. Eur Heart J Cardiovasc Pharmacother 2018 Jul 17. doi: 10.1093/ehjcvp/pvy025. [Epub ahead of print].
- Friberg L, Hammar N, Rosenqvist M. Stroke in paroxysmal atrial fibrillation: report from the Stockholm Cohort of Atrial Fibrillation. Eur Heart J 2010;31(8): 967-75.
- Ganesan AN, Chew DP, Hartshorne T et al. The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. Eur Heart J 2016;37(20):1591-602.
- Xiong Q, Proietti M, Senoo K, Lip GY. Asymptomatic versus symptomatic atrial fibrillation: A systematic review of age/gender differences and cardiovascular outcomes. Int J Cardiol 2015;191:172-7.
- Bakhai A, Darius H, De Caterina R, et al. Characteristics and outcomes of atrial fibrillation patients with or without specific symptoms: results from the PREFER in AF registry. Eur Heart J Qual Care Clin Outcomes 2016;2(4):299-305.
- Kerr CR, Humphries KH, Talajic M, et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: results from the Canadian Registry of Atrial Fibrillation. Am Heart J 2005;149(3):489-96.
- De Vos CB, Breithardt G, Camm AJ, et al. Progression of atrial fibrillation in the REgistry on Cardiac rhythm disORDers assessing the control of Atrial Fibrillation cohort: clinical correlates and the effect of rhythm-control therapy. Am Heart J 2012;163(5):887-93.
- Deng H, Bail Y, Shantsila A, et al. Clinical scores for outcomes of rhythm control or arrhythmia progression in patients with atrial fibrillation: a systematic review. Clin Res Cardiol 2017;106:813–23.
- de Vos CB, Pisters R, Nieuwlaat R, et al. Progression from paroxysmal to persistent atrial fibrillation clinical correlates and prognosis. J Am Coll Cardiol 2010; 55(8):725–31.
- Lip GYH, Collet JP, Caterina R, et al; ESC Scientific Document Group. Antithrombotic therapy in atrial fibrillation associated with valvular heart disease: a joint consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology Working Group on Thrombosis. Europace 2017;19:1757–8.
- Steffel J, Verhamme P, Potpara TS, et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J 2018;39(16):1330-93.
- Renda G, Ricci F, Giugliano RP, De Caterina R. Non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation and valvular heart disease. J Am Coll Cardiol 2017;69:1363–71.
- Noseworthy PA, Yao X, Shah ND, Gersh BJ. Comparative effectiveness and safety of non-vitamin K antagonist oral anticoagulants versus warfarin in patients with atrial fibrillation and valvular heart disease. Int J Cardiol 2016;209:181–3.
- Dominguez F, Climent V, Zorio E, et al. Direct oral anticoagulants in patients with hypertrophic cardiomyopathy and atrial fibrillation. Int J Cardiol 2017; 248:232–8.
- van Diepen S, Hellkamp AS, Patel MR, et al. Efficacy and safety of rivaroxaban in patients with heart failure and nonvalvular atrial fibrillation: insights from ROCKET AF. Circ Heart Fail 2013;6:740–7.
- Schmitt J, Duray G, Gersh BJ, Hohnloser SH. Atrial fibrillation in acute myocardial infarction: a systematic review of the incidence, clinical features and prognostic implications. Eur Heart J 2009;30(9):1038–45.
- Crenshaw BS, Ward SR, Granger CB, et al. Atrial fibrillation in the setting of acute myocardial infarction: the GUSTO-I experience. Global Utilization of Streptokinase and TPA for Occluded Coronary Arteries. J Am Coll Cardiol 1997; 30:406–13.
- Lehto M, Snapinn S, Dickstein K, et al. Prognostic risk of atrial fibrillation in acute myocardial infarction complicated by left ventricular dysfunction: the OPTIMAAL experience. Eur Heart J 2005;26:350–6.
- Batra G, Svennblad B, Held C, Jernberg T, Johanson P, Wallentin L, Oldgren J. All types of atrial fibrillation in the setting of myocardial infarction are associated with impaired outcome. Heart 2016;102(12):926–33.
- Siu CW, Jim MH, Ho HH, et al. Transient atrial fibrillation complicating acute inferior myocardial infarction: implications for future risk of ischemic stroke. Chest 2007;132(1):44–9.
- The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). 2017 ESC Guidelines for themanagement of acute myocardial infarction in patients presenting with ST-segment elevation. Europ Heart J 2018;39:119–77.
- Duerschmied D, Brachmann J, Darius H, et al. Antithrombotic therapy in patients with non-valvular atrial fibrillation undergoing percutaneous coronary intervention: should we change our practice after the PIONEER AF-PCI and REDUAL PCI trials? Clin Res Cardiol 2018;107(7):533-8.
- Gibson CM, Mehran R, Bode C, et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016;375(25):2423-34.
- Cannon CP, Bhatt DL, Oldgren J, et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2017;377(16):1513-24.
