Сравнительная эффективность олокизумаба и тоцилизумаба в лечении COVID-19 у госпитализированных больных
Сравнить эффективность олокизумаба и тоцилизумаба в профилактике перевода на искусственную вентиляцию легких (ИВЛ) и смерти у госпитализированных пациентов с COVID-19
В ретроспективное исследование включали всех пациентов с подтвержденным диагнозом COVID-19, которые во время госпитализации получали олокизумаб подкожно или тоцилизумаб внутривенно в любых дозах. Первичной конечной точкой исследования были перевод на ИВЛ или смерть во время госпитализации, вторичными – два компонента первичной конечной точки по отдельности и длительность госпитализации. Отношения шансов (ОШ) и 95% доверительные интервалы (ДИ) рассчитывали с помощью многофакторного линейного регрессионного анализа.
В ретроспективное исследование были включены 244 госпитализированных пациента с COVID-19, которые получили по крайней мере одну подкожную инъекцию олокизумаба (n=157) или внутривенное введение тоцилизумаба (n=87). В обеих группах преобладали пациенты пожилого и старческого возраста, страдавшие сердечно-сосудистыми и другими сопутствующими заболеваниями. У всех пациентов определялись признаки иммунного гипервоспалительного ответа, а у 197 (80,7%) из них перед введением исследуемых препаратов была начата оксигенотерапия. Частота комбинированной первичной конечной точки и обоих ее компонентов достоверно не отличалась между группами олокизумаба и тоцилизумаба, а сопоставимая эффективность двух препаратов в профилактике неблагоприятных исходов COVID-19 была подтверждена при многофакторном регрессионном анализе (ОШ 0,58; 95% ДИ 0,27-1,23). Медиана длительности госпитализации в двух группах была одинаковой (16 дней).
Подкожное введение олокизумаба и внутривенное введение тоцилизумаба было сопоставимым по эффективности в профилактике интубации и смерти у пациентов с синдромом иммунного гипервоспалительного ответа, вызванного SARS-CoV-2.
Н а протяжении всей пандемии COVID-19 ведущей причиной госпитализации и смертности больных, инфицированных SARS-CoV-2, остается острый респираторный дистресс синдром, который чаще развивается у людей пожилого и старческого возраста и характеризуется быстрым прогрессированием дыхательной недостаточности на фоне распространенной вирусной пневмонии. В российских отделениях реанимации и интенсивной терапии (ОРИТ) летальность больных с COVID-19, нуждавшихся в респираторной поддержке, составила в среднем 65% и в значительной степени зависела от выраженности гипоксии. Летальность была относительно невысокой (10,1%) у пациентов, получавших кислород через канюли, но значительно увеличивалась у больных, которых переводили на неинвазивную (НИВЛ) и особенно искусственную (ИВЛ) вентиляцию легких (36,8% и 76,5%, соответственно) [1]. Основными факторами риска смерти больных, госпитализированных в ОРИТ, были возраст, а также мужской пол и сопутствующие заболевания, такие как ожирение, сахарный диабет 2 типа и коронарная болезнь сердца.
Одной из причин развития прогрессирующего поражения легких при COVID-19 считают иммунный гипервоспалительный ответ, вызванный SARS-CoV-2 и сопровождающийся выбросом различных цитокинов [2]. Ранее синдром выделения цитокинов, который часто называют “цитокиновым штормом”, был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [3]. Признаки гипервоспалительного ответа при COVID-19 включают в себя стойкую лихорадку и снижение степени насыщения крови кислородом (SpO 2 ) в сочетании с увеличением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (СРБ), ферритина и фибриногена [4]. Ведущую роль в патогенезе синдрома выделения цитокинов, вызванного SARS-CoV-2, отводят интерлейкину (ИЛ)6, повышение содержания которого ассоциировалось с более тяжелым течением COVID-19 и увеличением риска смерти больных [5].
Эффективным методом профилактики тяжелого течения COVID-19 является вакцинация. В когортном исследовании, проведенном в США в марте-августе 2021 г., было показано, что иммунизация мРНК-вакцинами приводит к снижению частоты госпитализаций пациентов с COVID-19, а также риска интубации и смерти у госпитализированных больных [6]. В нашем когортном исследовании у 158 госпитализированных пациентов c COVID-19, развившимся несмотря на вакцинацию Гам-КОВИД-Вак (Спутник V), риск смерти от любых причин был на 62% ниже (отношение шансов 0,38, 95% доверительный интервал 0,19-0,77), чем у 473 больных с SARS-CoV-2 инфекцией, не получавших какие-либо вакцины против COVID-19 [7]. Эффективность вакцинации в профилактике смерти была сопоставимой в подгруппах пациентов, выделенных с учетом пола, возраста и наличия сердечно-сосудистых заболеваний, и была выше у пациентов с более высокими титрами нейтрализующих антител к рецептор-связывающему домену спайкового белка вируса.
Для лечения синдрома гипервоспалительного ответа у пациентов с COVID-19 применяют глюкокортикостероиды, прежде всего дексаметазон, и различные ингибиторы ИЛ-6. Первые сообщения об успешном опыте применения тоцилизумаба, блокирующего рецептор ИЛ-6, у больных с тяжелым течением COVID-19 были опубликованы уже вскоре после начала пандемии SARS-CoV-2 инфекции в Китае [8,9], а затем и в других странах, включая Россию [10]. В большинстве контролируемых и неконтролируемых клинических исследований, проводившихся во время пандемии, изучался тоцилизумаб в форме раствора для внутривенного введения. В Российской Федерации для лечения COVID19 у госпитализированных пациентов одобрен также олокизумаб, который представляет собой моноклональное антитело, непосредственно связывающихся не с рецепторами ИЛ-6, а c самим цитокином [11]. Олокизумаб выпускается в форме раствора для подкожного применения, хотя у пациентов с тяжелым течением COVID-19 допускается и внутривенное его введение [12].
Целью ретроспективного исследования было сравнение эффективности олокизумаба и тоцилизумаба в профилактике перевода на ИВЛ и смерти у госпитализированных пациентов с COVID-19.
Материал и методы
Дизайн исследования. В ретроспективное исследование, проводившееся на базе перепрофилированной клиники им. Е.М. Тареева с июня 2020 г. по февраль 2021 г., включали всех пациентов с COVID-19, которым во время госпитализации вводили олокизумаб подкожно или тоцилизумаб внутривенно в любых дозах. Диагноз COVID-19 устанавливали на основании типичных клинических проявлений и данных компьютерной томографии легких при наличии положительного результата полимеразной цепной реакции мазка из носа и/или полости рта.
Конечные точки. Всех пациентов, включенных в исследование, наблюдали до выписки из стационара или смерти. Первичной конечной точкой исследования были перевод на ИВЛ или смерть во время госпитализации, вторичными – два компонента первичной конечной точки по отдельности и длительность госпитализации.
На основании историй болезни у всех пациентов регистрировали демографические, клинические и лабораторные показатели, а также сопутствующие заболевания, которые могли оказать влияние на течение COVID-19, в том числе артериальную гипертонию, ишемическую болезнь сердца (ИБС), включая инфаркт миокарда в анамнезе, инсульт в анамнезе, фибрилляцию предсердий, ожирение, сахарный диабет, заболевания органов дыхания (хроническая обструктивная болезнь легких, бронхиальная астма, интерстициальные болезни легких), хроническую болезнь почек (ХБП), хронические заболевания печени, ревматические аутоиммунные заболевания, злокачественные опухоли и гемобластозы. Ожирение диагностировали на основании величины индекса массы тела (≥30,0 кг/м 2 ). При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты. При компьютерной томографии оценивали распространенность двусторонней вирусной пневмонии в процентах [12]. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI. Стадию ХБП определяли в соответствии с рекомендациями KDIGO [13]. Тяжесть гипоксии перед введением препарата оценивали на основании SpO 2 и необходимости в респираторной поддержке (не требуется, низкопоточная оксигенотерапия через канюли, высокопоточная оксигенотерапия, НИВЛ или ИВЛ).
Статистический анализ. Статистическая обработка данных выполнена с помощью программ IBM SPSS Statistics (version 21) и GraphPad Prism 8. Нормальность распределения проверяли с помощью критерия Колмогорова– Смирнова. Количественные переменные представлены в виде медианы и межквартильного интервала, качественные признаки – в виде абсолютного числа и процента. Медианы количественных переменных двух независимых групп сравнивали с помощью U-критерия Манна-Уитни, медианы качественных переменных – с помощью критерия c2-Пирсона (количество наблюдений ≥10) и точного критерия Фишера (количество наблюдений <10). Анализ Каплана-Мейера применяли для оценки кумулятивной частоты развития комбинированного исхода, которую сравнивали между группами с помощью log-rank теста. Для выявления факторов, ассоциированных с развитием комбинированного исхода, использовали метод логистической регрессии. Исходную однофакторную модель корректировали по возрасту. Для преобразования количественных переменных в номинальные признаки (0 – нет признака, 1 – есть признак) использовались стандартные пороговые значения (альбумин, СКФ, тромбоциты) или медианы количественного ряда (лимфоциты, СРБ, D-димер). Результат представлен в виде отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Достоверным считали уровень значимости р <0,05. Все результаты представлены с двусторонним уровнем значимости
| Показатели | Группа олокизумаба, n=157 | Группа тоцилизумаба, n=87 | р |
|---|---|---|---|
| Примечание: приведены медианы и интерквартильный диапазон, если не указано иное. *перед введением препаратов. ХБП хроническая болезнь почек, НПВП нестероидные противовоспалительные препараты, ИМТ индекс массы тела, ИБС ишемическая болезнь сердца | |||
| Мужской пол, n (%) | 76 (48,4) | 46 (54,1) | 0,396 |
| Возраст, годы | 70 [60; 78] | 66 [58; 76] | 0,211 |
| Возраст, n (%) | 0,134 | ||
| <50 | 13 (8,3) | 14 (16,4) | - |
| 50-59 | 24 (15,3) | 11 (12,9) | - |
| 60-69 | 39 (24,8) | 27 (31,8) | - |
| 70-79 | 48 (30,6) | 16 (18,8) | - |
| ≥80 | 33 (21,0) | 17 (20,0) | - |
| ИМТ, кг/м2 | 29,7 [26,1;33,1] | 30,6 [27,1;34,8] | 0,146 |
| Дни до госпитализации, Сопутств. болезни, n (%) | 7 [4;9] | 7 [5;9] | 0,326 |
| Гипертония | 114 (72,6) | 57 (67,1) | 0,365 |
| ИБС | 31 (19,7) | 22 (25,9) | 0,534 |
| Инфаркт миокарда в анамнезе | 5 (3,2) | 5 (5,9) | 0,314 |
| Фибрилляция предсердий | 20 (12,7) | 11 (12,9) | 0,940 |
| Инсульт в анамнезе | 7 (4,4) | 2 (2,3) | 0,439 |
| Сахарный диабет | 33 (21,0) | 28 (32,9) | 0,041 |
| Ожирение | 74 (47,1) | 46 (54,1) | 0,300 |
| Болезни легких | 31 (19,7) | 14 (16,5) | 0,606 |
| ХБП 3-4 стадии | 6 (3,8) | 4 (4,7) | 0,741 |
| Болезни печени | 5 (3,2) | 3 (3,5) | 0,886 |
| Опухоли и гемобластозы | 12 (7,6) | 6 (7,1) | 0,869 |
| Ревматические болезни | 9 (5,7) | 6 (7,1) | 0,683 |
| Клин. проявления, n (%) | |||
| Лихорадка | 9 (5,7) | 6 (7,1) | 0,683 |
| Лихорадка | 9 (5,7) | 6 (7,1) | 0,683 |
| Лихорадка | 45 (28,7) | 25 (29,4) | 0,902 |
| Кашель | 129 (82,2) | 68 (80) | 0,679 |
| Одышка | 20 (12,7) | 11 (12,9) | 0,979 |
| Миалгия/артралгия | 27 (17,2) | 14 (16,5) | 0,886 |
| Аносмия/агевзия | 20 (12,7) | 14 (16,5) | 0,425 |
| Тошнота/рвота | 27 (17,2) | 14 (16,5) | 0,886 |
| Диарея | 28 (17,8) | 16 (18,8) | 0,849 |
| SpO2 , % | 94 [91;95] | 93 [90;95] | 0,443 |
| SpO2 ≤93%, n (%) | 73 (46,5) | 44 (51,8) | 0,489 |
| КТ легких, n (%) | 0,371 | ||
| 1 (1-24%) | 30 (19,1) | 17 (20,0) | - |
| 2 (25-49%) | 64 (40,8) | 28 (32,9) | - |
| 3 (50-74%) | 56 (35,7) | 32 (37,7) | - |
| 4 (≥75%) | 7 (4,4) | 8 (9,4) | - |
| Лабораторные показатели | |||
| Лимфоциты, ×109/л | 0,5 [0,4;0,6] | 0,5 [0,4;0,7] | 0,989 |
| Креатинин, мкмоль/л | 98,1 | 100,5 | 0,362 |
| СРБ, мг/л | [90,1;113,3] 71,9 [53,0;122,3] |
[90,0;118,6] 79,2 [53,0; 165,5] |
0,803 |
| D-димер, μг/мл | 0,7 [0,4; 0,7] | 0,7 [0,6; 1,8] | 0,009 |
| Оксигенотерапия*, n (%) | 0,048 | ||
| Не требуется | 33 (21,0) | 7 (8,2) | - |
| Через канюли | 120 (76,4) | 77 (90,6) | - |
| НИВЛ | 2 (1,3) | 0 | - |
| ИВЛ | 2 (1,3) | 1 (1,2) | - |
| Сопутств. терапия, n (%) | |||
| Антибиотики | 129 (82,2) | 77 (90,6) | 0,079 |
| НПВП | 25 (15,9) | 18 (21,2) | 0,307 |
| Фавипиравир | 13 (8,3) | 7 (8,2) | 0,990 |
| Глюкокортикостероиды | 154 (98,1) | 82 (96,5) | 0,440 |
| Гепарины | 148 (94,3) | 79 (92,9) | 0,683 |
| Длит. госпитализации, дни | 16 [13; 21] | 16 [12; 19] | 0,533 |
Результаты
Характеристика больных. 244 из 1396 госпитализированных пациентов с подтвержденным диагнозом COVID-19 во время госпитализации в клинику получили по крайней мере одну подкожную инъекцию олокизумаба (n=157) или внутривенное введение тоцилизумаба (n=87). Две группы были сопоставимы по возрасту и полу (табл. 1). В обеих группах преобладали пациенты пожилого и старческого возраста (более 70% из них были в возрасте 60 лет и старше, а около 20% 80 лет и старше). У большинства пациентов имелись различные сопутствующие заболевания. Чаще всего встречались сердечно-сосудистые болезни (артериальная гипертония, ишемическая болезнь сердца и фибрилляция предсердий), ожирение, сахарный диабет и хронические заболевания легких. По частоте и спектру сопутствующих заболеваний две группы существенно не отличались, за исключением сахарного диабета, который чаще наблюдался у пациентов группы тоцилизумаба.
Распространенность вирусной пневмонии в группах пациентов, получавших олокизумаб или тоцилизумаб, также была сходной и примерно в 70% случаев соответствовала КТ-2 и КТ-3. Медиана SpО2 при поступлении была сопоставимой в двух группах (94% и 93%), как и доля пациентов, у которых этот показатель на воздухе составлял ≤93% (47,1% и 50,6%). Большинство пациентов непосредственно перед введением исследуемых препаратов нуждались в оксигенотерапии через канюли. В группе олокизумаба доля таких пациентов была ниже, чем в группе тоцилизумаба (76,4% и 90,6%, соответственно). В единичных случаях олокизумаб или тоцилизумаб вводили на фоне НИВЛ или ИВЛ. У всех больных имелись признаки синдрома гипервоспалительного ответа, в частности медиана содержания СРБ в группах олокизумаба и тоцилизумаба, составляла 71,9 и 79,2 мг/л, соответственно. Медиана количества лимфоцитов была одинаковой в двух группах (0,5 ×109 /л). Примерно у трети больных в обеих группах сохранялась лихорадка (38,0о С) при медиане срока госпитализации 7 дней от начала заболевания.
| Конечные точки | Группа олокизумаба | Группа тоцилизумаба | р |
|---|---|---|---|
| Примечание: *исключены пациенты, находящиеся на НИВЛ и ИВЛ на момент введения ингибитора ИЛ-6; **исключены пациенты, находившиеся на ИВЛ на момент введения исследуемого препарата | |||
| ИВЛ или смерть | |||
| Вся когорта | 33/157 (21,0) | 25/85 (29,4) | 0,144 |
| Не нуждавшиеся в O2 | 3/33 (9,1) | 0/7 (0,0) | 0,407 |
| Получавшие О2 | 30/124 (24,2) | 25/78 (32,1) | 0,222 |
| Перевод на НИВЛ* | 7/153 (4,7) | 5/84 (6,0) | 0,644 |
| Перевод на ИВЛ** | 31/155 (20,0) | 22/84 (26,2) | 0,319 |
| Смерть | 30/157 (19,1) | 25/85 (29,4) | 0,068 |
Лечение. Олокизумаб был введен подкожно 157 пациен там в интервале от 1 до 18 дней после госпитализации (медиана 3 [1; 5]). У 150 из них препарат применяли в дозе 64 мг, а у 7 – 128 мг. Повторно препарат был введен 16 пациентам (во всех случаях по 64 мг). Тоцилизумаб вводили внутривенно 85 пациентам в интервале от 1 до 17 дней после госпитализации (медиана 2 [1; 5]). У 58 больных, получивших однократную инфузию препарата, доза составила 400 мг, у 9 – 200 мг, у 1 – 800 мг. Оставшиеся пациенты получали дозы 160 мг (1), 320 мг (2), 480 мг (1), 560 мг (3) и 600 мг (1). Повторно тоцилизумаб применяли у 9 больных, в том числе в дозе 400 мг у 6, 200 мг у 2 и 800 мг у 1.
Сопутствующая терапия была сходной в группах олокизумаба и тоцилизумаба, в частности практически все больные получали глюкокортикостероиды и низкомолекулярные гепарины, а большинство – антибактериальные препараты.
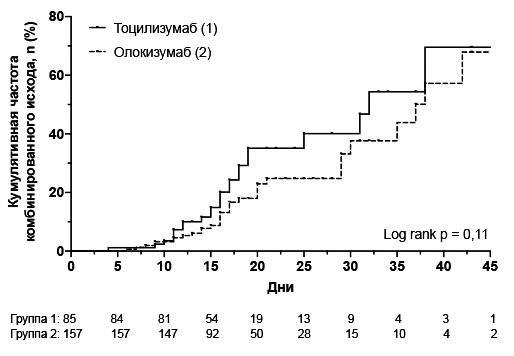
Конечные точки. Частота комбинированной первичной конечной точки, включавшей в себя перевод на ИВЛ и смерть, как и частота обоих ее компонентов в группе олокизумаба была несколько ниже, чем в группе тоцилизумаба, однако разница между группами оказалась статистически незначимой (табл. 2). Во всей выборке частота развития комбинированного исхода была достоверно выше у пациентов, получавших респираторную поддержку на момент введения препарата (27,2% против 7,5%, p=0,008). При этом частота первичной конечной точки среди пациентов, которым не требовалась или требовалась оксигенотерапия, достоверно не отличалась между группами олокизумаба и тоцилизумаба. Кумулятивная частота первичной конечной точки, которую анализировали с помощью метода Каплана-Мейера, в двух группах была сопоставимой (log rank p=0,118; рис. 1).
По данным логистического регрессионного анализа, факторами, ассоциировавшимися с увеличением риска интубации или смерти, были возраст, сахарный диабет и необходимость в респираторной поддержке перед введением исследуемых препаратов (табл. 3). В то же время в многофакторной модели с поправкой на различные факторы, включая возраст и оксигенотерапию, выбор между олокизумабом или тоцилизумабом не оказывал влияния на шансы достижения первичной конечной точки (ОШ 0,58; 95% ДИ 0,27-1,23). Медиана длительности госпитализации в двух группах была одинаковой (16 дней).
| Конечные точки | Однофакторный анализ | Многофакторный анализ | ||
|---|---|---|---|---|
| ОШ (95% ДИ) | р | ОШ (95% ДИ) | р | |
| Примечание: многофакторный анализ по всем признакам с поправкой на возраст и респираторную поддержку | ||||
| Мужской пол | 0,68 [0,38-1,23] | 0,203 | - | - |
| Возраст, годы | 1,07 [1,04-1,10] | <0,001 | 1,07 [1,03-1,11] | <0,001 |
| Ожирение | 0,93 [0,52-1,68] | 0,819 | - | - |
| Артериальная гипертония | 1,15 [0,52-2,53] | 0,732 | - | - |
| Ишемическая болезнь сердца | 0,98 [0,40-2,41] | 0,970 | - | - |
| Инфаркт миокарда в анамнезе | 1,38 [0,34-5,51] | 0,649 | - | - |
| Фибрилляция предсердий | 0,69 [0,27-1,75] | 0,438 | - | - |
| Инсульт в анамнезе | 0,18 [0,02-1,54] | 0,119 | - | - |
| Сахарный диабет | 2,27 [1,22-4,30] | 0,012 | 3,56 [1,58-8,05] | 0,002 |
| Хронические заболевания легких | 2,62 [1,31-5,22] | 0,006 | 1,34 [0,59-3,09] | 0,485 |
| ХБП 3-4 стадии | 0,79 [0,16-3,81] | 0,765 | - | - |
| Хронические заболевания печени | 0,44 [0,05-3,68] | 0,452 | - | - |
| Солидные опухоли и гемобластозы | 1,65 [0,59-4,62] | 0,408 | - | - |
| Ревматические заболевания | 1,64 [0,54-5,04] | 0,384 | - | - |
| Респираторная поддержка | 4,61 [1,37-15,58] | 0,014 | 5,67 [1,11-28,91] | 0,037 |
Обсуждение
Результаты нашего ретроспективного исследования свидетельствуют о том, что подкожное введение олокизумаба по эффективности в профилактике интубации и смерти не уступает внутривенному введению тоцилизумаба у госпитализированных больных с COVID-19, осложненного синдромом иммунного гипервоспалительного ответа. Частота комбинированной первичной конечной точки, включавшей интубацию и смерть от любых причин, в группе олокизумаба была недостоверно ниже, чем в группе тоцилизумаба. Вероятно, это было связано с тем, что олокизумаб несколько чаще вводили на более раннем этапе (т.е. при отсутствии потребности в оксигенотерапии), чем тоцилизумаб, в то время как частота сахарного диабета, ухудшающего прогноз при COVID-19, была выше во второй группе. В логистической регрессионной модели как необходимость в респираторной поддержке, так и сахарный диабет ассоциировались с достоверным увеличением риска перевода на ИВЛ и смерти у обследованных пациентов с COVID-19. Тем не менее, две группы пациентов не отличались по другим показателям, сопровождающимся увеличением риска тяжелого течения заболевания, а их сопоставимая эффективность в профилактике неблагоприятных исходов COVID-19 была подтверждена при многофакторном регрессионном анализе. Сходные данные были ранее получены и другими авторами [14].
Практически все больные, включенные в наше исследование, получали ингибиторы ИЛ-6 в сочетании с глюкокортикостероидами. В рандомизированном контролируемом исследовании RECOVERY, в которое были включены более 4000 пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся гипоксией и увеличением содержания СРБ ≥75 мг/л, достоверное снижение риска смерти на 21% было отмечено только у больных, получавших тоцилизумаб в сочетании с глюкокортикостероидами [15]. В этом исследовании доля пациентов, которым тоцилизумаб вводили без глюкокортикостероидов, была относительно небольшой (18%), а дизайн исследования не предполагал изучение эффективности тоцилизумаба в зависимости от сопутствующей терапии. Соответственно, результаты исследования RECOVERY не позволяют сделать окончательные выводы по поводу оптимальной схемы противовоспалительной терапии у пациентов с COVID-19. Тем не менее, применение глюкокортикостероидов в сочетании с ингибиторами ИЛ-6 представляется оправданным при отсутствии явных противопоказаний, таких как декомпенсированный сахарный диабет, так как они сами по себе снижают риск неблагоприятных исходов у больных со среднетяжелым и тяжелым течением COVID-19 [16].
Мы не сравнивали сроки улучшения состояния и нормализации лабораторных показателей при подкожном введении олокизумаба или внутривенном применении тоцилизумаба, учитывая ретроспективный дизайн нашего исследования. Тем не менее, медиана длительности госпитализации в группах сравнения была одинаковой (16 дней), что косвенно свидетельствовало о сопоставимой скорости действия двух препаратов.
Несмотря на адекватную терапию, включавшую ингибиторы ИЛ-6, частота интубации и смерти в нашем исследовании была достаточно высокой и составила в целом 23,8%. Однако большинство пациентов в исследованной когорте составляли лица пожилого и старческого возраста (каждый пятый – в возрасте 80 лет и старше), у которых имелись различные сопутствующие заболевания, ассоциирующиеся с тяжелым течением COVID-19 и более высоким риском смерти, прежде всего сердечно-сосудистые заболевания, ожирение и сахарный диабет 2 типа. В исследовании RECOVERY среди 2022 больных, получавших тоцилизумаб, летальность была даже выше, чем в нашей когорте (31%), хотя среди обследованных нами пациентов было больше лиц в возрасте 70 лет и старше (47% против 35%) и меньше мужчин (50% против 66%) [15]. Кроме того, большинство пациентов, включенных в наше исследование, получали олокизумаб или тоцилизумаб на фоне оксигенотерапии, а в этой выборке частота первичной конечной точки была в 3 раза выше, чем в выборке больных, которые не нуждались во введении кислорода перед применением исследуемых препаратов (27,2% и 7,5%, соответственно).
Мы не сравнивали частоту перевода на ИВЛ и смерти при назначении ингибиторов ИЛ-6 с контролем, т.е. с группой больных, не получавших ингибиторы ИЛ-6, так как эффективность препаратов этой группы в профилактике неблагоприятных исходов у пациентов с COVID-19 установлена в рандомизированных контролируемых исследованиях. Так, в исследовании RECOVERY применение тоцилизумаба у пациентов COVID-19 ассоциированной пневмонией привело к снижению риска смерти на 15% (отношение рисков 0,85%, 95% ДИ 0,76-0,94; р=0,0028) по сравнению с таковым на фоне стандартной терапии [15]. Среди больных, не находившихся на ИВЛ на момент рандомизации, риск интубации или смерти в течение 28 дней в группе тоцилизумаба снизился на 16% по сравнению с контролем (отношение рисков 0,84, 95% ДИ 0,77-0,92; p<0,0001). В июле 2021 года применение ингибиторов рецепторов ИЛ-6 (тоцилизумаба и сарилумаба) для лечения тяжелого COVID-19 было рекомендовано экспертами ВОЗ [17]. Основанием для этой рекомендации послужили результаты мета-анализа 27 рандомизированных контролируемых исследований препаратов этой группы у 10930 пациентов с COVID-19 (медиана возраста 61 год) [18]. Полученные данные показали, что применение ингибиторов рецептора ИЛ-6 сопровождается снижением риска смерти в течение 28 дней на 14% по сравнению с обычной терапией или плацебо (отношение шансов 0,86, 95% ДИ 0,79-0,95), а также снижением риска интубации или смерти на 23% (отношение шансов 0,77, 95% ДИ 0,70-0,85)
Как и тоцилизумаб, олокизумаб первоначально разрабатывался для лечения ревматоидного артрита. Эффективность его установлена в 24-недельном многоцентровом, двойном слепом, плацебо-контролируемом исследовании CREDO 3 у 428 пациентов с активным ревматоидным артритом, не ответивших на монотерапию метотрексатом [19]. В этом исследовании олокизумаб в дозе 64 мг подкожно каждые 2 или 4 недели в сочетании с метотрексатом достоверно превосходил плацебо в комбинации с метотрексатом по частоте ответа по критериям Американской коллегии ревматологов (ACR 20; 63,6% и 70,4% против 25,9%; p<0,0001 для обоих сравнений), а также по различным вторичным показателям эффективности. В мае 2020 г. олокизумаб был зарегистрирован для лечения пациентов старше 18 лет с ревматоидным артритом средней или высокой степени активности в комбинации с метотрексатом при недостаточной эффективности монотерапии метотрексатом или ингибиторами фактора некроза опухоли, а в июне 2020 года препарат был включен во Временные рекомендации Минздрава РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). В отличие от тоцилизумаба и сарилумаба, которые блокируют рецептор ИЛ-6, олокизумаб – это гуманизированное моноклональное IgG/k антитело, взаимодействующее с самим цитокином. Теоретически уровень блокады ИЛ-6 (рецептор или сам цитокин) может отразиться на эффективности лечения, однако результаты нашего исследования свидетельствуют об обратном. Более того, полученные нами данные подтверждают эффективность подкожного применения олокизумаба в стандартной дозе 64 мг, которая была сопоставимой с эффективностью внутривенного введения тоцилизумаба в дозе 400 мг. Тем не менее, при тяжелом течении COVID-19, когда скорость действия препарата имеет критическое значение, оправданно внутривенное введение олокизумаба, в том числе в более высокой дозе [12]. При отсутствии адекватного ответа на введение первой дозы целесообразно повторное введение олокизумаба.
Наше исследование имеет ограничения. Ретроспективный дизайн его не позволял учесть все факторы, которые могли оказать влияние на исходы COVID-19 у обследованных больных, хотя группы олокизумаба и тоцилизумаба были сопоставимы по демографическим и большинству клинических показателей, а сходное влияние двух препаратов на риск неблагоприятных исходов было подтверждено при многофакторном регрессионном анализе, который проводили с поправкой на пол, возраст и другие параметры. Практически все больные группы сравнения получали тоцилизумаб в фиксированной дозе 400 мг, хотя дозу препарата рекомендуется подбирать в зависимости от массы тела. Например, в исследовании RECOVERY доза тоцилизумаба у пациентов с массой тела >90 кг составляла 800 мг, от >65 кг до 90 кг – 600 мг и от >40 кг до ≤65 кг – 400 мг [15]. Однако дефицит тоцилизумаба, наблюдавшийся через несколько месяцев после начала пандемии не только в России, но и других странах, не позволял широко применять этот препарат в более высокой дозе. При этом доза 400 мг примерно соответствует нижней границе рекомендуемой во временных рекомендациях дозы тоцилизумаба, подобранной по массе тела (4-8 мг/кг) [12]. Кроме того, результаты отдельных исследований свидетельствуют о том, что у больных с COVID19 фиксированная доза тоцилизумаба 400 мг по эффективности не уступает дозе 8 мг/кг [20]. Нельзя также исключить, что гипотетический прирост эффективности тоцилизумаба при назначении более высокой дозы у пациентов пожилого и старческого возраста, получающих глюкокортикостероиды и нуждающихся в респираторной поддержке, может нивелироваться увеличением риска развития бактериальных инфекций. Как указано выше, мы не оценивали динамику температуры тела и лабораторных показателей, в частности СРБ, в двух группах, так как ключевым показателем эффективности любой патогенетической терапии COVID-19 у госпитализированных больных является снижение риска перевода на ИВЛ и смерти. Более того, быстрое снижение содержания СРБ при введении ингибиторов ИЛ-6 не исключает возможность прогрессирования дыхательной недостаточности у пациентов с COVID-19 и, соответственно, не может служить адекватным показателем эффективности лечения.
В нашем исследовании, проводившемся в условиях обычной клинической практики, подкожное введение олокизумаба, блокирующего ИЛ-6, по эффективности в профилактике интубации и смерти у пациентов с синдромом иммунного гипервоспалительного ответа, вызванного SARS-CoV-2, не уступало внутривенному введению тоцилизумаба.
Используемые источники
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармакол тер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outcomes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020; 29(3):25-36 (In Russ.)].
- Mehta P, McAuley DF, Brown M, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet 2020;395:1033–4.
- Насонов Е.Л. Иммунопатология и иммунофармакотерапия коронавирусной болезни 2019 (COVID-19): фокус на интерлейкин 6. Научно-практическая ревматология. 2020;58(3):245-61 [Nasonov EL. Immunopathology and immunopharmacotherapy of coronavirus disease 2019 (COVID-19): focus on interleukin-6. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice 2020;58(3):245-61 (In Russ.)].
- Caricchio R, Gallucci M, Dass C, et al. Preliminary predictive criteria for COVID-19 cytokine storm. Ann Rheum Dis 2021;80(1):88-95.
- Udomsinprasert W, Jittikoon J, Sangroongruangsri S, Chaikledkaew U. Circulating levels of interleukin-6 and interleukin-10, but not tumor necrosis factoralpha, as potential biomarkers of severity and mortality for COVID-19: systematic review with meta-analysis. J Clin Immunol. 2021;41(1):11-22.
- Tenforde MW, Self WH, Adams K, et al.; Influenza and Other Viruses in the Acutely Ill (IVY) Network. Association between mRNA vaccination and COVID19 hospitalization and disease severity. JAMA 2021;326:2043-54.
- Надточеева В.Б., Буланов Н.М., Акулкина Л.А. и др. Эффективность вакцины Гам-КОВИД-Вак (Спутник V) в профилактике тяжелого течения COVID-19 и смерти у госпитализированных взрослых пациентов. Клин фармакол тер 2022;31(2):20-6 [Nadtocheeva V, Bulanov N, Akulkina L, et al. Outcomes of breakthrough COVID-19 in hospitalized adult patients vaccinated with Gam-COVID-Vac (Sputnik V). Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022;31(2):20-6 (In Russ.)].
- Luo P, Liu Y, Qiu L, et al. Tocilizumab treatment in COVID-19: a single center experience. J Med Virol 2020;92(7):814-8.
- Xu X, Han M, Li T, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A 2020;117:10970–5.
- Фомина Д.С., Потешкина Н.Г., Белоглазова И.П. и др. Сравнительный анализ применения тоцилизумаба при тяжелых COVID-19-ассоциированных пневмониях у пациентов разных возрастных групп. Пульмонология 2020;30(2):164-72 [Fomina DS, Poteshkina NG, Beloglazova IP, et al. Comparative analysis of tocilizumab in severe COVID-19-associated pneumonia in patients of different age groups. Pulmonologiya 2020;30(2):164-72 (In Russ.)].
- Новиков П.И., Бровко М.Ю., Акулкина Л.А. и др. Эффективность и безопасность олокизумаба, ингибирующего интерлейкин-6, в лечении COVID19 у госпитализированных пациентов. Клин фармакол тер 2022;32(2):51-6 [Novikov P, Brovko M, Akulkina L, et al. Efficacy and safety of olokizumab, interleukin-6 inhibitor, in hospitalized patients with COVID-19. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2022; 31(2):51-6 (In Russ.)].
- Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 15 (22.02.2022).
- Lameire NH, Levin A, Kellum JA, et al. Harmonizing acute and chronic kidney disease definition and classification: report of a Kidney Disease: Improving Global Outcomes (KDIGO) Consensus Conference. Kidney Int 2021;100(3):516-26.
- Бобкова С.С., Жуков А.А., Проценко Д.Н. и др. Сравнительная эффективность и безопасность применения препаратов моноклональных антител к ИЛ-6 упациентов с новой коронавирусной инфекцией COVID-19 тяжелого течения. Ретроспективное когортное исследование. Вестник интенсивной терапии им. А.И. Салтанова 2021;1:69–76 [Bobkova SS, Zhukov AA, Protsenko DN, et al. Comparative study of monoclonal anti-IL6 antibodies in severe new coronavirus disease COVID-19 patients. Annals of Critical Care 2021; 1:69–76 (In Russ.)].
- RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2021;397:1637-45.
- RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with Covid-19. N Engl J Med 2021; 384(8):693-704.
- World Health Organization. Therapeutics and COVID-19. Living Guideline, 6 July 2021.
- WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group, Shankar-Hari M, Vale CL, Godolphin PJ, et al. Association between administration of IL-6 antagonists and mortality among patients hospitalized for COVID-19: A meta-analysis. JAMA 2021;326(6):499-518.
- Nasonov E, Fatenejad S, Feist E, et al. Olokizumab, a monoclonal antibody against interleukin 6, in combination with methotrexate in patients with rheumatoid arthritis inadequately controlled by methotrexate: efficacy and safety results of a randomised controlled phase III study. Ann Rheum Dis 2022;81:469-79.
- Stukas S, Goshua G, Kinkade A, et al. Reduced fixed dose tocilizumab 400 mg IV compared to weight-based dosing in critically ill patients with COVID-19: A before-after cohort study. Lancet Reg Health Am. 2022 Mar 23:100228.
