Эффективность и безопасность устекинумаба в лечении псориаза и псориатического артрита
Устекинумаб – полностью человеческие моноклональные антитела класса IgG1 k , блокирующие интерлейкины 12 и 23, которые играют важную роль в патогенезе различных аутоиммунных заболеваний. Эффективность и безопасность устекинумаба установлены в рандомизированных клинических исследованиях у больных псориазом (PHOENIX-1 и PHOENIX-2) и псориатическим артритом (PSUMMIT-1 и PSUMMIT-2). В клинических исследованиях устекинумаб оказывал действие на различные проявления псориатической болезни (поражение кожи, суставов, энтезит, дактилит), давал быстрый эффект, нарастающий при продолжении лечения и обладал хорошей переносимостью и низкой иммуногенностью.
Устекинумаб (Стелара) – это человеческие моноклональные IgG1 антитела, которые взаимодействуют с р40 субъединицей интерлейкина (ИЛ)-12 и ИЛ-23 и блокируют их связывание с рецептором ИЛ12R-β1 на поверхности иммунных клеток [1]. Указанные цитокины секретируются акти вированными антигенпрезентирующими клетками, в частности макрофагами и дендритными клетками, и участвуют в патогенезе различных аутоиммунных заболеваний. Устекинумаб зарегистрирован для лечения псориаза и псориатического артрита (ПсА) [2], а недавно его эффективность и безо пасность были установлены в рандоми зированных клинических исследованиях у пациентов с болезнью Крона (это показание в Российской Федерации не зарегистрировано). В клинических исследованиях изучается возможность применения устекинумаба и при других заболеваниях. Например, опубликованы результаты многоцентрового, двойного слепого, рандомизированного исследования II фазы, в котором устекинумаб по эффективности превосходил плацебо у пациентов с активной системной красной волчанкой [3]. Полученные данные обосновывают дальнейшее изучение препарата в клинических исследованиях III фазы.
Псориаз
Псориаз – это системное иммуновоспалительное заболевание (псориатическая бо лезнь), которое поражает кожу, суставы, ногти и ассоциируется с увеличением риска развития сердечно-сосудистых заболеваний, дислипидемии, сахарного диабета и метаболического синдрома [4-6]. Важную роль в патогенезе псориаза играет хроническое системное воспаление, которые опосредуется провоспалительными цитокинами, в том числе ИЛ-12 и ИЛ-23.
Эффективность и безопасность устекинумаба в лечении псориаза были установлены в двух двойных слепых, многоцентровых, плацебо-контролируемых исследованиях III фазы (PHOENIX-1 и PHOENIX-2), которые проводились параллельно в целом примерно у 2000 пациентов со средне-тяжелым или тяжелым бляшечным псориазом [7,8]. Оба исследования состояли из трех фаз. Во время первой 12-недельной плацебо-контролируемой фазы пациентов распределяли на 3 группы и назначали устекинумаб в дозах 45 или 90 мг подкожно (0, 4 недели, а затем каждые 12 недель) или плацебо. Через 12 недель паци ентов группы плацебо повторно рандо мизировали и переводили на лечение устекинумабом. Соответственно, во время второй фазы все пациенты получали активный препарат в дозах 45 или 90 мг каждые 12 недель. Во время третьй фазы в исследовании PHOENIX-1 пациенты, достигшие ответа по критериям PASI 75, продолжали лечение устекинумабом или переходили на прием плацебо, в то время как в исследовании PHOENIX-2 изучали возможность повышения эффективности лечения устекинумабом путем сокращения интервала дозирования с 12 до 8 недель у пациентов с частичным ответом на лечение. Первичной конечной точкой была частота ответа по критериям PASI 75 через 12 недель.
В обоих исследованиях устекинумаб по эффективности достоверно превосходил плацебо. В исследовании PHOENIX-1 через 12 недель на лечение ответили 67,1% и 66,4% больных, получавших устекинумаб в дозах 45 и 90 мг, соответственно, и только 3,1% пациентов группы плацебо (p<0,0001) (рис. 1). Частота практически полной ремиссии псориаза (PASI 90) в группах устекинумаба 45 и 90 также значительно превышала (41,6% и 36,7%, соответственно) таковую в группе плацебо (2,0%). Действие препарата проявлялось в течение первых 2 недель и достигало максимума через 24 недели, когда ответ по критериям PASI 75 был достигнут более чем у 3/4 больных, а примерно у половины пациентов наблюдалось практически полное разрешение поражения кожи. Продолжение терапии устекинумабом до 76 недель позволяло сохранить достигнутый эффект, в то время как отмена препарата во время третьей фазы исследования обычно сопровождалась ухудшением поражения кожи, отмечавшимся через 16 недель после введения последней дозы препарата. Следует отметить, что 85,6% больных, которым потребовалось возобновление терапии устекинумабом, ответили на лечение (PASI 75) через 12 недель. Результаты 5-летнего наблюдения пациентов, включенных в исследование PHOENIX-1, подтвердили эффективность длительной терапии устекинумабом в дозах 45 или 90 мг каждые 12 недель [9]. В конце указанного срока частота ответа по критериям PASI 75, PASI 90 и PASI 100, составила 63-72%, 40-49% и 22-26%, соответственно. Важным результатом исследования стало значительное снижение индекса тяжести псориаза ногтей (NAPSI), который в группах устекинумаба снизился примерно в 2 раза через 24 недели.
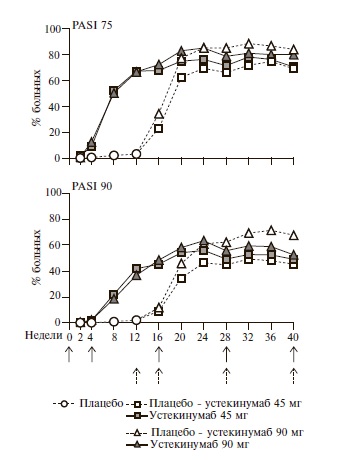
Сходные результаты были получены в исследовании PHOENIX-2: через 12 недель частота ответа по критериям PASI 75 при лечении устекинумабом в дозах 45 и 90 мг составила 66,7% и 75,7%, соответственно, и достоверно превышала таковую в группе плацебо (3,7%; p<0,0001). У пациентов с частичным ответом на лечение (PASI 50-74) сокращение интервала дозирования устекинумаба в дозе 90 мг с 12 до 8 недель привело к достоверному увеличению частоты ответа по критериям PASI 75 с 33,3% до 68,8% (р=0,004), в то время как интенсификация терапии устекинумабом в дозе 45 мг не вызывала улучшение результатов лечения. Через 5 лет ответ по критериям PASI 75 сохранялся у 80% пациентов, продолжавших лечение устекинумабом, а практически полное разрешение поражения кожи (PASI 90) наблюдалось примерно у половины больных [10].
В рандомизированном исследовании ACCEPT была сопоставлена эффективность устекинумаба и ингибитора фактора некроза опухоли-a этанерцепта у 903 больных псориазом [11]. Через 12 недель частота ответа по критериям PASI 75 на лечение устекинумабом в дозах 45 и 90 мг (67,5% и 73,8%, соответственно) была достоверно выше таковой на лечение этанерцептом (56,8%; р=0,01 и р<0,001). Частота практически полного разрешения псориаза кожи (PASI 90) также была значительно выше при лечении устекинумабом (p<0,001). У половины пациентов, не ответивших на лечение этанерцептом, переход на инъекции устекинумаба позволил достичь ответа по критериям PASI 75.
В целом результаты рандомизированных контролируемых исследований показали, что устекинумаб оказывает быстрое действие и позволяет добиться значительного уменьшения поражения кожи (PASI 75) более чем у 3/4 больных средне-тяжелым и тяжелым бляшечным псориазом и практически полного разрешения псориаза кожи примерно у половины пациентов. У большинства пациентов продолжение терапии устекинумабом в течение до 5 лет позволяло сохранить дос тиг нутый эффект.
Псориатический артрит
ПсА развивается примерно у каждого третьего больного псориазом и характеризуется поражением периферических суставов, энтезисов (энтезит) и сухожилий пальцев кистей и стоп (дактилит, теносиновит), а также тел позвонков (спондилит) и илиосакральных сочленений (сакроилиит) [12]. Поражение кожи обычно предшествует появлению болей в суставах, однако у части пациентов они развиваются одновременно, или кожные бляшки появляются после артрита. Лечение ПсА с поражением периферических суставов начинают с базисных противовоспалительных препаратов, таких как метотрексат, а генно-инженерные биологические препараты (ГИБП) назначают в случае их неэффективности [13,14]. Более раннее применение ГИБП может обсуждаться при наличии неблагоприятных прогностических факторов, таких как полиартрит, особенно эрозивный, выраженные функциональные нарушения, активный энтезит и/или дактилит, не отвечающие на стандартное лечение, преимущественное поражение позвоночника, которое не удается контролировать нестероидными противовоспалительными препаратами.
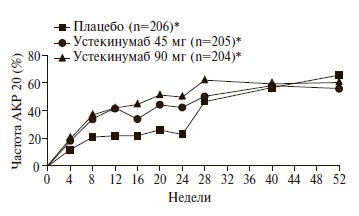
Эффективность и безопасность устекинумаба в лечении ПсА были установлены в двух рандомизированных, двойных слепых, плацебо-контролируемых исследованиях PSUMMIT-1 и PSUMMIT-2 [15,16]. В первое исследование были включены 615 больных активным ПсА, ранее не получавших ингибиторы ФНО-a. Пациенты были рандомизированы на три группы и получали устекинумаб в дозах 45 или 90 мг подкожно (0, 4 недели, а затем каждые 12 недель) или плацебо. Если в течение 16 недель счет болезненных и припухших суставов уменьшался менее чем на 5%, то пациентов группы плацебо переводили на устекинумаб 45 мг, а у больных, получавших препарат в дозе 45 мг, ее увеличивали до 90 мг. Результаты терапии оценивали через 24 недели по критериям Американской коллегии ревматологов (АКР 20). Частота ответа по критериям АКР 20 при применении устекинумаба в обеих дозах (42,4% и 49,5%, соответственно) достоверно превышала таковую в группе плацебо (22,8%; p<0,0001 для обоих сравнений). Достоверные преимущества устекинумаба перед плацебо были выявлены и при анализе частоты ответа по критериям АКР 50 и АКР 70. Частота ответа на лечение устекинумабом существенно не зависела от сопутствующей терапии метотрексатом, который получали около половины больных, включенных в исследование. Во время 52-недельного исследования на фоне лечения устекинумабом было отмечено постепенное нарастание частоты ответа по АКР 20, которая достигла максимума через 28 недель при применении дозы 90 мг и через 40 недель – дозы 45 мг (рис. 2). Устекинумаб вызывал значительное улучшение псориаза кожи, дактилита и энтезита, а также спондилита (счета BASDAI), причем при продолжении терапии в течение 2 лет было отмечено нарастание эффекта препарата в отношении дактилита и энтезита.
В рандомизированное, плацебо-контролируемое исследование PSUMMIT-2, имевшее сходный дизайн, были включены около 300 больных активным ПсА. Более половины из них ранее получали ингибиторы ФНО-a, причем большинство пациентов имели опыт лечения несколькими препаратами этой группы, а 70% из них прекратили терапию из-за недостаточной эффективности. Через 24 недели частота ответа по АКР 20 у больных, получавших устекинумаб в дозах 45 и 90 мг (43,7% и 43,8%, соответственно), была достоверно выше, чем в группе плацебо (20,2%; p<0,001 для обоих сравнений). Как и следовало ожидать, у пациентов, ранее получавших ингибиторы ФНО-a, частота ответа на лечение устекинумабом была несколько ниже таковой у больных, которые до исследования не получали ГИБП (устекинумаб 45 мг: 36,7% и 53,5%, устекинумаб 90 мг: 34,5% и 55,3%, соответственно). Тем не менее, и в выборке пациентов с активным ПсА, имевших опыт лечения ГИБП, устекинумаб по эффективности достоверно превосходил плацебо. Результаты мета-анализа исследований PSUMMIT-1 и PSUMMIT-2 показали также, что терапия устекинумабом в течение 24 недель задерживает прогрессирование структурных изменений суставов у больных ПсА [17].
Характерным симптомом ПсА является энтезит, который наблюдается у 30-50% пациентов и сопровождается выраженной болью, нарушением функциональной активности и снижением качества жизни [18]. Имеются данные, свидетельствующие о том, что ключевую роль в его патогенезе играет ИЛ-23 [19]. Как указано выше, в регистрационных исследованиях лечение устекинумабом вызывало уменьшение проявлений энтезита. В исследовании ECLIPSA специально изучалась эффективность устекинумаба у 47 пациентов с ПсА, сопровождавшимся активным энтезитом [20]. Больные были рандомизированы на две группы и получали устекинумаб в дозе 45 мг подкожно (90 мг у пациентов с массой тела более 100 кг) или ингибиторы ФНО-a (в основном адалимумаб). Первичной конечной точкой было полное разрешение энтезита, который оценивали с помощью индекса SPARCC, через 24 недели. Исходно значение этого индекса было сопоставимым в группах устекинумаба и ингибиторов ФНО-a (4,8±2,6 и 3,5±2,3, соответственно). Через 24 недели первичная конечная точка была достигнута у 73,9% и 41,7% больных, получавших устекинумаб или ингибитор ФНО-a, соответственно (p=0,018). Более высокая эффективность устекинумаба в лечении активного энтезита была подтверждена и при анализе динамики других индексов (MASES, LEI), которые применяют для оценки энтезита. Кроме того, устекинумаб имел преимущества перед ингибиторами ФНО-a по эффективности в лечении псориаза кожи. Полное разрешение поражения кожи (PASI 100) было отмечено у 59% и 29% больных двух групп, соответственно (p=0,039), а практически полное (PASI 90) – у 86% и 29% (p=0,0001). В то же время эффективность лечения артрита в двух группах была сопоставимой. По мнению авторов, наличие энтезита у пациентов с ПсА может учитываться при выборе ГИБП.
Эффективность длительной терапии устекинумабом у пациентов с активным ПсА подтверждается данными, полученными в открытых исследованиях и регистрах. На ежегодной конференции EULAR в 2018 году были представлены предварительные результаты проспективного исследования SUSTAIN, в которое в 75 центрах в Германии были включены 336 больных ПсА, получающих устекинумаб в зарегистрированной дозе [21]. У 54% из них ранее проводилась терапия ингибиторами ФНО-a, которые были отменены из-за недостаточной эффективности. Только 38% пациентов получали метотрексат. Счет болезненных и припухших суставов значительно снизился уже через 4 недели после начала лечения устекинумабом, т.е. после первой инъекции (рис. 3). При продолжении терапии отмечено дальнейшее уменьшение признаков активности ПсА. Через 16 недель эффективность лечения оценили как “хорошую" или “очень хорошую" 76,2% врачей и 71,2% больных, а через 76 недель – 89,9% и 90,7%. К концу наблюдения 98% врачей и пациентов считали безопасность устекинумаба “очень хорошей" или “хорошей".

В целом результаты клинических исследований подтвердили эффективность устекинумаба в лечении ПсА и послужили основанием для включения препарата в современные рекомендации по диагностике и лечению этого заболевания. В рекомендациях Европейской антиревматической лиги (EULAR) указано, что устекинумаб целесообразно применять при неэффективности ингибиторов ФНО-a, в то время как в рекомендациях Группы по изучению и оценке псориаза и ПсА (GRAPPA) устекинумаб рассматривается как ГИБП первой линии (наряду с ингибиторами ФНО-a и секукинумабом).
Безопасность устекинумаба
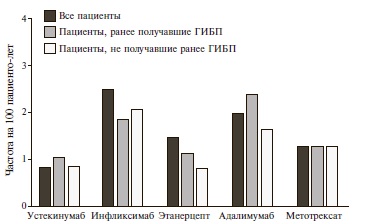
K. Papp и соавт. обобщили опыт изучения безопасности длительной терапии устекинумабом в целом у 3117 больных псориазом и ПсА, продолжавших лечение в течение до 5 лет (примерно 9000 пациенто-лет наблюдения) [22]. У 1482 пациентов длительность лечения превышала 4 года, а у 838 из них – 5 лет. Частота серьезных инфекций была низкой и не отличалась между группами пациентов, получавших устекинумаб в дозах 45 и 90 мг (0,98 и 1,19 на 100 пациенто-лет, соответственно). Среди инфекций чаще всего встречались назофарингит и инфекции мочевыводящих путей. Как правило, они не требовали отмены препарата. Общая частота инфекций со временем снижалась, в то время как частота серьезных инфекций варьировалась от года к году, но тенденции к ее увеличению выявлено не было. Какихлибо особых инфекций, которые можно было связать с особенностями действия устекинумаба, зарегистрировано не было. В частности, не было отмечено случаев атипичных микобактериальных инфекций, диссеминированного сальмонеллеза или системных грибковых инфекций. Лечение ингибиторами ФНО-a может осложниться активацией латентного туберкулеза, однако при применении устекинумаба был зарегистрирован всего один такой случай у пациента, не получавшего противотуберкулезные средства с профилактической целью [23]. Частота инфекций при применении устекинумаба была сопоставимой с таковой в общей популяции больных псориазом. По данным регистра PSOLAR, в которое включены более 11000 пациентов с псориазом, частота серьезных инфекций при лечении устекинумабом (0,83 на 100 пациенто-лет) была ниже, чем при применении ингибиторов ФНО-a (от 1,47 до 2,49 на 100 пациенто-лет) (рис. 4) [24]. Увеличения риска развития злокачественных опухолей или сердечно-сосудистых исходов также выявлено не было, а общая смертность больных, получавших устекинумаб, соответствовала таковой в общей популяции.
Иммуногенность устекинумаба была низкой. Частота образования антител к этому препарату варьировалась от 3,8% до 5,4%, а их наличие не ассоциировалось с развитием инъекционных реакций. Анафилактических реакций зарегистрировано не было. V. Strand и соавт. провели систематизированный обзор 443 исследований, в которых изучалась иммуногенность различных ГИБП [25]. Хотя результаты различных исследований варьировались в широких пределах, тем не менее, частота формирования антител к препаратам была самой высокой при лечении инфликсимабом, адалимумабом и биоаналогом инфликсимаба и самой низкой при применении секукинумаба, устекинумаба, этанерцепта и голимумаба.
Заключение
Результаты рандомизированных контролируемых клинических исследований, длительных открытых исследований и данные регистров подтверждают высокую эффективность и безопасность устекинумаба (Стелара), блокирующего эффекты ИЛ-12 и ИЛ-23, в лечении псориаза и ПсА. Достоинства данного препарата включают в себя воздействие на различные проявления псориатической болезни (поражение кожи, суставов, энтезит, дактилит), быстрый эффект, нарастающий при продолжении лечения, удобную схему применения (подкожные инъекции каждые 3 мес), хорошую переносимость и низкую иммуногенность.
Используемые источники
- Моисеев С.В., Новиков П.И., Буланов Н.М. и др. Устекинумаб в лечении псориаза и псориатического артрита. Клин фармакол тер 2017;26(5):80-86. [Moiseev SV, Novikov PI, Bulanov NM, et al. Ustekinumab in the treatment for psoriasis and psoriatic arthritis. Klinicheskaya farmakologiya i terapiya = Clin P harmacol Ther 2017;26(5):80-6. (In Russ.)].
- Коротаева Т.В., Логинова Е.Ю. Иммунопатогенетические механизмы действия устекинумаба – нового лекарственного средства для лечения псо- р иатического артрита и псориаза. Современная ревматология 2015;9(2): 51–6 [Korotaeva TV, Loginova EY. Immunopathogenetic mechanisms of action of ustekinumab, a new drug for the treatment of psoriatic arthritis and psoriasis. Sovremennaya revmatologiya = Modern Rheumatology Journal 2015;9(2):51-6. (In Russ.)].
- van Vollenhoven RF, Hahn BH, Tsokos GC, et al. Efficacy and safety of ustekinumab, an IL-12 and IL-23 inhibitor, in patients with active systemic lupus ery- thematosus: results of a multicentre, double-blind, phase 2, randomised, controlled study. Lancet 2018;392:1330-9.
- Круглова Л.С., Моисеев С.В. Блокатор ИЛ-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин фармакол тер 2017;26(2):5-12. [Kruglova LS, Moiseev SV. Inhibition of interkeukin-17 – new horizons of efficacy and safety in the treatment of psoriasis. Klinicheskaya far- makologiya i terapiya = Clin Pharmacol Ther 2017;26(2):5-12 (In Russ.)].
- Parisi R, Rutter MK, Lunt M, et al. Psoriasis and the risk of major cardiovascular events: cohort study using the clinical practice research datalink. J Invest Dermatol 2015;135:2189–97.
- Shiba M, Kato T, Funasako M, et al. Association between psoriasis vulgaris and coronary heart disease in a hospital-based population in Japan. PLoS One 2016;11:e0149316.
- Leonardi CL, Kimball AB, Papp KA, et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet 2008;371:1665–74.
- Papp KA, Langley RG, Lebwohl M, et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet 2008;371:1675–84.
- Kimball AB, Papp KA, Wasfi Y, et al. Long-term efficacy of ustekinumab in patients with moderate-to-severe psoriasis treated for up to 5 years in the PHOENIX 1 study. J Eur Acad Dermatol Venereol 2013;27:1535–45.
- Langley RG, Lebwohl M, Krueger GG, et al. Long-term efficacy and safety of ustekinumab, with and without dosing adjustment, in patients with moderate-to- severe psoriasis: results from the PHOENIX 2 study through 5 years of follow-up. Br J Dermatol 2015;172(5):1371-83.
- Griffiths CE, Strober BE, van de Kerkhof P, et al. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med 2010;362:118–28.
- Коротаева Т.В. Псориатический артрит: классификация, клиническая кар- тина, диагностика, лечение. Научно-практическая ревматология. 2014;52(6): 650–9. [Korotaeva TV. Psoriatic arthritis: classification, clinical presentation, diagnosis, treatment. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2014;52(6):650-659. (In Russ.)].
- Gossec L, Smolen JS, Ramiro S, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with phar- macological therapies: 2015 update. Ann Rheum Dis 2016;75:499–510.
- Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis: treatment recommendations for psoriatic arthritis 2015. Arthritis Rheumatol 2016;68:1060–71.
- McInnes IB, Kavanaugh A, Gottlieb AB, et al. Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multi- centre, double blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013;382: 780–9.
- Ritchlin C, Rahman P, Kavanaugh A, et al. Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological antitumour necrosis f actor therapy: 6-month and 1-year results of the phase 3, multicentre, double blind, placebo-controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014; 73:990–9.
- Kavanaugh A, Ritchlin C, Rahman P, et al. Ustekinumab, an anti-IL-12/23 p40 m onoclonal antibody, inhibits radiographic progression in patients with active psoriatic arthritis: results of an integrated analysis of radiographic data from the p hase 3, multicentre, randomised, double-blind, placebo-controlled PSUMMIT-1 and PSUMMIT-2 trials. Ann Rheum Dis 2014;73:1000–6.
- Polachek A, Li S, Chandran V, Gladman D. Clinical enthesitis in a prospective longitudinal psoriatic arthritis cohort: Incidence, prevalence, characteristics and o utcome. Arthritis Care Res (Hoboken) 2017;69(11):1685-91.
- Reinhardt A, Yevsa T, Worbs T, et al. Interleukin-23-dependent γ/δ T cells produce interleukin-17 and accumulate in the enthesis, aortic valve, and ciliary body in mice. Arthritis Rheumatol 2016;68:2476-86.
- Araujo EG, Englbrecht M, Hoepken S, et al. Effects of ustekinumab versus tumor necrosis factor inhibition on enthesitis: Results from the enthesial clearance in psoriatic arthritis (ECLIPSA) study. Semin Arthritis Rheum 2018 Jun 13. pii: S0049-0172(18)30150-1.
- Wendler J, Movshovich E, Behrens J, et al. Early and long-term treatment response as well as high tolerability lead to high treatment satisfaction of a thera- py with ustekinumab in patients with active psoriatic arthritis – results of the noninterventional study SUSTAIN. Ann Rheum Dis 2018, June 12th. DOI: 10.1136/annrheumdis-2018-eular.6364.
- Papp KA, Griffiths CE, Gordon K, et al. Long-term safety of ustekinumab in p atients with moderate-to-severe psoriasis: final results from 5 years of follow-up. Br J Dermatol 2013;168(4):844-54.
- Tsai T-F, Chiu H-Y, Song M, Chan D. A case of latent tuberculosis reactivation in a patient treated with ustekinumab without concomitant isoniazid chemopro- phylaxis in the PEARL trial. Br J Dermatol 2013;168:444–6.
- Kalb RE, Fiorentino DF, Lebwohl MG, et al. Risk of serious infection with bio- logic and systemic treatment of psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). JAMA Dermatol 2015;151(9):961-9.
- Strand V, Balsa A, Al-Saleh J, et al. Immunogenicity of biologics in chronic inflammatory diseases: A systematic review. BioDrugs 2017;31(4):299-316.
