Изолированный предсердный амилоидоз – состояние проблемы
Амилоидоз – группа заболеваний, отличительным признаком которых является отложение в тканях и органах фибриллярного гликопротеида – амилоида. При системном амилоидозе часто поражается сердце, а иногда встречается его изолированное вовлечение. Очень важна ранняя диагностика амилоидоза, учитывая крайне неблагоприятный прогноз при клинически значимом поражении сердца. Диагноз амилоидоза сердца должен быть подтвержден гистологическим исследованием эндомиокарда. В настоящее время современная неинвазивная диагностика амилоидоза сердца основана на проведении эхокардиографии, магнитно-резонансной томографии (МРТ) сердца с контрастированием и радионуклидных методов исследования. Дополнительно необходимо определять тип моноклональных иммуноглобулинов в сыворотке крови и мочи. Лечение амилоидоза сердца включает терапию сердечной недостаточности и подавление синтеза патологических белков-предшественников. Настоящий обзор посвящен особой форме амилоидоза сердца – изолированному предсердному амилоидозу.
Впервые термин "амилоид" был использован в 1831 году немецким ученым М. Шлейденом, который обнаружил аморфное внеклеточное вещество и ошибочно посчитал его крахмалоподобным из-за характерной реакции с йодом [1]. Немецкий патолог Рудольф Вирхов в 1853 г. предложил термин "амилоид" для обозначения вещества, откладывающегося в органах больных "сальной болезнью" (так называли амилоидоз в начале XIX века) при туберкулезе, сифилисе, лепре [2]. В настоящее время установлено, что полисахариды составляют не более 4% от массы амилоида, однако термины "амилоид" и "амилоидоз" закрепились.
Отличительным свойством всех типов амилоида является способность к двойному лучепреломлению в сочетании с дихроизмом, что проявляется свечением в поляризованном свете предварительно окрашенных конго-красным конгофильных амилоидных отложений с изменением красного цвета на яблочно-зеленый (дихроизм) (рис. 1). Окраска тиофлавином Т, позволяющая определить светло-зеленую флюоресценцию, более чувствительна, чем окраска конго-красным, но менее специфична, поэтому для более точной диагностики амилоидоза рекомендуют применять оба этих метода [3-6].
![Окрашенные конго красным образцы из правого предсердия [12].](/img/articles/2018.3/izolirovannyj-predserdnyj-amiloidoz-sostoyanie-problemy__fig1.jpg)
В настоящее время особое значение придают установлению типа амилоидоза, так как некоторые его формы нуждаются в срочном лечении, а также отличаются в отношении прогноза [3-6]. В то же время, несмотря на достижения в понимании патогенеза и генетических аспектов, вопрос о тактике лечении больных амилоидозом остается нерешенным [7,8].
Типы амилоидоза
Классификация и терминология в отношении амилоидоза не до конца однозначны. С клинической точки зрения различают системные (генерализованные) и локальные формы амилоидоза. Накопление AL-амилоида приводит к развитию первичного амилоидоза, ATTR-амилоида – семейного и старческого (сенильного) амилоидоза, AA-амилоида – вторичного амилоидоза [3]. Наиболее часто встречающиеся типы системного амилоидоза представлены в табл. 1.
| Тип амилоидоза | Частота поражения сердца (%) | Частота клинических проявлений поражения сердца (%) | Тип белка* | Предшественник амилоида | Лечение |
|---|---|---|---|---|---|
| Примечание: *первой буквой A обозначают амилоид, следующие за ней буквы указывают на белок-предшественник. AL: амилоид легких цепей; ATTR: транстиретиновый амилоид; AA: амилоид сывороточного протеина А; AANF: амилоид мозгового натрийуретического пептида. Сенильный (старческий) амилоидоз обнаруживается у большинства пациентов после 80 лет, однако лишь у незначительной части приводит к значимой сердечной недостаточности. **Не всегда относят к системной форме амилоидоза. Ig – иммуноглобулины | |||||
| Первичный | 85 | 33 | AL | Igλ, Igk | Химиотерапия, аутотрансплантация стволовых клеток |
| Семейный | 10 | 25 | ATTR | Транстиретин | Трансплантация печени |
| Вторичный | редко | редко | AA | АpoSAA | Контроль воспаления |
| Сенильный | <5 | 10 | ATTR | Транстиретин | Поддерживающая |
| Изолированный предсердный | - | - | AANF | МНУП | - |
Самой частой причиной развития амилоидоза сердца является отложение фрагментов легких цепей иммуно глобулинов (так называемый первичный, или AL-амилоидоз), продуцируемых клональными клетками в красном костном мозге у пациентов как с миеломной болезнью, так и без нее [9].
Семейная форма амилоидоза является следствием накопления мутантного белка транстиретина, который ранее называли преальбумином [10]. Транстиретин является растворимым белком, участвующим в транспорте тироксина и витамина А. С течением времени даже нормальный (немутантный) транстиретин способен откладываться в сердце, особенно у пожилых людей, что приводит к развитию сенильного амилоидоза [6]. В редких случаях поражение сердца отмечается при вторичном амилоидозе, развивающемся при таких воспалительных заболеваниях, как ревматоидный артрит, болезнь Крона, туберкулез или лепра (отложение AA-амилоида или протеина A). Амилоидоз, ассоциированный с проведением диализа, в том числе с вовлечением сердца, развивается в результате накопления депозитов микроглобулина [11]. Кроме того, выделяют изолированный предсердный амилоидоз, или AANFамилоидоз, – особую форму амилоидоза, при которой белком предшественником амилоида является предсердный натрийуретический пептид (ПНП) [11]. Место AANF-амилоидоза в классификации не установлено, его относят как к генерализованным, так и к локальным формам амилоидоза. Именно о данной форме амилоидоза и пойдет речь в настоящем обзоре.
Распространенность AANF-амилоидоз
С. Röcken и соавт. проанализировали 245 образцов ткани предсердий, полученных во время кардиохирургических вмешательств (средний возраст пациентов – 64 года). AANF-амилоидоз был выявлен у 16,3% больных [12]. O. Leone и соавт. исследовали 128 образцов миокарда ушек предсердия (66 – левого и 62 – правого) у 72 пациентов с постоянной или персистирующей фибрилляцией предсердий и 104 образца ушек предсердий у 52 пациентов с синусовым ритмом (контроль). Распространенность AANF-амилоидоза достоверно отличалась между двумя группами и составила 46% у пациентов с фибрилляцией предсердий и 12% в контрольной группе [13]. И, наконец, при прицельном исследовании миокарда предсердий у 100 пациентов в возрасте старше 80 лет AANF-амилоидоз был выявлен в 91% случаев [14]. У 4% пациентов отмечено сочетание ATTR- и AANF-амилоидоза [14]. Накопление амилоида подтверждалось при гистологическом изучении образца, окрашенного конго красным. Типирование амилоида проводилось при иммуногистохимическом исследовании с применением антител к ПНП человека и для дифференциальной диагностики – к человеческому транстиретину и компоненту амилоида Р.
Депозиты амилоидоза были выявлены во всех участках миокарда предсердий, в особенности в интерстиции субэндокардиального слоя и субэндокардиальном миокарде, а также в зонах анатомического расположения путей проведения нервного импульса в предсердиях. Интенсивность накопления в левом предсердии была выше, чем в правом [12,14].
Клиническое значение AANF-амилоидоза
Наличие AANF-амилоидоза в проведенных исследованиях коррелировало с длительностью зубца Р и возрастом. Независимыми предикторами его выявления служили фибрилляция предсердий и ревматические пороки сердца. По данным множественного регрессионного анализа, AANF-амилоидоз был единствен ным, не зависимым от пола и возраста фактором, ассоциированным с наличием фибрилляции предсердий [12]. Распространенность AANF-амилоидоза у пациентов с постоянной и персистирующей формой фибрилляции предсердий выше, чем у больных с синусовым ритмом. Степень накопления амилоидного белка при данной форме амилоидоза коррелировала с длительностью фибрилляции предсердий и женским полом [13]. Клинико-демографическими предикторами AANF-амилоидоза были возраст старше 80 лет, гипертрофия миокарда левого желудочка (толщина задней стенки более 14 мм) и наличие множественных рубцов в миокарде желудочков.
Патогенез
Хроническая сердечная недостаточность является ведущей причиной заболеваемости и смертности в развитых странах [15]. Механическое повреждение и влияние циркулирующих нейрогормонов и цитокинов при сердечной недостаточности приводят к процессу, называемому ремоделированием сердца [16]. Как правило, наблюдают два типа клеточного ответа: гипертрофию, дисфункцию и гибель кардиомиоцитов и повышенное отложение и перестройку внеклеточного вещества, часто ассоциированные с отложением амилоида. Инфильтрация амилоидом приводит к разрушению внеклеточного матрикса и развитию диастолической дисфункции из-за прогрессирующего утолщения и ригидности миокарда [17].
Мозговой натрийуретический пептид (МНУП) играет важную роль в поддержании гемодинамики. Однако связи между развитием AANF-амилоидоза и ухудшением сократительной способности миокарда сердца (фракцией выброса левого желудочка) показано не было. Это позволяет предположить, что процессы, ведущие к повышению уровня МНУП, не обязятельно способствуют отложению амилоида в предсердиях.
Так как распространенность AANF-амилоидоза у людей пожилого и старческого возраста очень высокая, считается, что он является неизбежным проявлением старения организма.
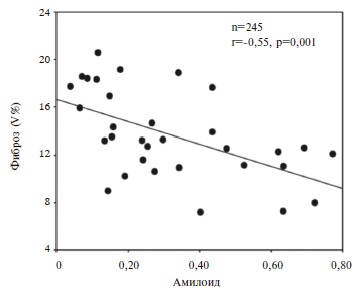
В проведенных недавно исследованиях была показана важная роль фиброза предсердий в развитии фибрилляции предсердий [18,19]. Участки фиброзной ткани создают электрическую неоднородность миокарда и включаются в цикл macro re-entry [18]. У пациентов с фибрилляцией предсердий и выраженным фиброзом предсердий также было показано повышение активности ренин-ангиотензин-альдостероновой системы [20,21]. Именно поэтому предполагается потенциальная эффективность терапии ингибиторов АПФ при фибрилляции предсердий [19,22]. Однако C. Röcken и соавт. выявили значимую обратную зависимость между количеством амилоида и степенью фиброза (рис. 2) [12]. Кроме того, в этом исследовании фиброз не оказывал влияния на частоту фибрилляции предсердий, поэтому авторы выделили группу пациентов, у которых терапия ингибиторами АПФ будет малоэффективной: пациенты с митральными и аортальными пороками или продвинутыми стадиями AANF-амилоидоза. Эти данные согласуются с результатами исследования F. Yo shi hara и соавт. [23], которые продемонстрировали обратную зависимость между уровнем МНУП и распространенностью коллагена в левом предсердии [12]. В любом случае, амилоид вызывает структурные изменения миокарда предсердий, нарушающие сократимость и проводимость кардиомиоцитов, а также токсическое повреждение путем накопления свободных радикалов, перекисного окисления липидов и апоптоза клеток. [24].
Хотя AANF-амилоидоза встречается намного чаще AL-амилоидоза, его роль в патогенезе сердечных аритмий у пожилых людей остается не до конца ясной [24].
Изолированный предсердный амилоидоз: причина или следствие?
Вышеуказанные исследования поднимают закономерный вопрос, является ли AANF-амилоидоз причиной фибрилляции предсердий у пожилых людей. Мно го численные регрессионные анализы показали, что возраст, коронарная болезнь сердца, тип проведенной кардиохирургической операции, но не амилоидоз были значимыми предикторами развития фибрилляции предсердий. Присутствие амилоида коррелировало с возрастом пациентов, длительностью волны P и типом кардиохирургической операции. При этом фибрилляция предсердий не являлась значимым фактором риска формирования амилоида. Более того, AANF-амилоидоз встречается намного чаще, чем фибрилляция предсердий: среди восьмидесятилетних пациентов около 10% страдают фибрилляцией предсердий, а частота AANFамилоидоза в этой популяции достигает 90% [25-28]. В исследовании C. Röcken и соавт. [12] было показано, что фибрилляция предсердий ассоциирована с более высоким содержанием амилоида по сравнению с таковым при синусовом ритме. Это свидетельствует о том, что фибрилляция предсердий способствует накоплению амилоида, но не запускает его формирование.
В нескольких исследованиях выявлено значимое повышение уровня МНУП пациентов с фибрилляцией предсердий [29-32], особенно ее клапанной формой [33-34]. Содержание мРНК МНУП повышено у пациентов с клапанной патологией [34], что еще раз подтверждает предположение о том, что положительная корреляция между AANF-амилоидозом, типом хирургической операции и фибрилляцией предсердий обусловлена повышенным синтезом и секрецией МНУП, усиливающим накопление амилоида. В опытах на животных уровень МНУП повышался после индукции фибрилляции предсердий [35,36]. C. Röcken и соавт. сделали вывод о влиянии возраста и других неясных в настоящее время причин на формирование AANF-амилоидоза [12]. На развитие AANF-амилоидоза оказывают также влияние заболевания сердца (патология митрального клапана, персистирующая фибрилляция предсердий). В 1988 году Н. Hodkinson and А. Pomerance [37] описали связь между сенильным сердечным амилоидозом и фибрилляцией предсердий, однако они не представили информацию о типе амилоидного белка и не анализировали влияние пола и возраста. C. Röcken и соавт. также полагают, что присутствие амилоида предрасполагает к развитию фибрилляции предсердий, которая, в свою очередь, способствует накоплению амилоида в миокарде, что ведет к формированию "порочного круга" [12]. Любопытно, что авторы показали также обратную корреляцию между терапией блокаторами кальциевых каналов и амилоидозом. Точная причина таких взаимосвязей до сих пор не ясна и нуждается в уточнении [12].
Диагностика
Несмотря на сложности в диагностике амилоидоза, особенно на ранних стадиях заболевания, для некоторых типов амилоидоза все же существуют диагностические алгоритмы. Однако ни в одном из проанализированных исследований не была освещена проблема диагностики AANF-амилоидоза, вероятно, ввиду малой его изученности. Во всех ранее проведенных работах AANF-амилоидоз диагностировали путем исследования образцов периоперационных тканей миокарда.
"Золотым" стандартом диагностики амилоидоза сердца является эндомиокардиальная биопсия с гистологическим анализом препарата. Среди неинвазивных методов исследования особое значение имеют эхокардиография, МРТ сердца с гадолинием и радионуклидные методы диагностики. Эхокардиография не имеет высокой ценности на ранних стадиях заболевания, однако позднее позволяет выявить ряд признаков, таких как концентрическое симметричное утолщение стенок обоих желудочков и межжелудочковой перегородки без дилатации и утолщение стенок увеличенных в размерах предсердий, а также зернистую инфильтрацию миокарда [38]
При МРТ сердца снижение интенсивности сигнала от миокарда в сочетании c отсроченным контрастированием сигнала от суб эндокарда после введения гадолиния (из-за наличия амилоидных отложений) позволяет провести дифференциальную диагностику амилоидоза от других кардиомиопатий [39].
Радионуклидная диагностика амилоидоза сердца представляет особый интерес в оценке тяжести заболевания и прогноза [40]. Ряд радиофармпрепаратов обладают способностью накапливаться в амилоиде (99mТс-пирофосфат, mТс-3,3 дифосфоно-1,2-пропанокарбоксиловая кислота) [41,42]. Учитывая важную роль в патогенезе амилоидоза сердца нарушений ритма и проводимости сердца, особое значение имеют исследования миокарда c¹²³I мета-йод-бензил-гуанидином [43,44].
Лечение
Специфическая терапия AANF-амилоидоза не разработана. Более того, ее необходимость остается спорной, учитывая недостаточную изученность AANF-амилоидоза и его роли в формировании фибрилляции предсердий. В будущих исследованиях необходимо уточнить влияние AANF-амилоидоза на стратегии таких вмешательств, как катетерная аблация при фибрилляции предсердий и операция по типу "лабиринт" [19,22].
Заключение
Таким образом, в настоящее время не до конца понятна роль AANF-амилоидоза в формировании нарушений ритма сердца, в том числе фибрилляции предсердий, и сердечной недостаточности, не существует алгоритмов диагностики и лечения этого состояния, что требует дальнейших исследований.
Используемые источники
- Schleiden MJ. Grundzige der wissenschaftlichen Botanik. Leipzig: Verlag vonWilhelm Engelmann; 1842.
- Virchow R. Virchow’s Archiv fur pathologische Anatomie und fur klinische Medicin. 1854;135–8.
- Falk RH, Comenzo RL, Skinner M. The systemic amyloidoses. N Engl J Med 1997;337:898–909.
- Khan MF, Falk RH. Amyloidosis. Postgrad Med J 2001;77:686–93.
- Gertz MA, Lacy MQ, Dispenzieri A. Amyloidosis. Hematol Oncol Clin North Am 1999;13:1211–33.
- Merlini G, Westermark P. The systemic amyloidoses: clearer understanding of the molecular mechanisms offers hope for more effective therapies. J Intern Med 2004;255:159–78.
- Buxbaum JN. The systemic amyloidoses. Curr Opin Rheumatol 2004;16:67–75.
- Hirschfield GM, Hawkins PN. Amyloidosis: new strategies for treatment. Int J Biochem Cell Biol 2003;35:1608–13.
- Dubrey SW, Cha K, Anderson J, et al. The clinical features of immunoglobulin light-chain (AL) amyloidosis with heart involvement. QJM 1998;91:141–57.
- Hattori T, Takei Y, Koyama J, Nakazato M, Ikeda S. Clinical and pathological studies of cardiac amyloidosis in transthyretin type familial amyloid polyneuropathy. Amyloid 2003;10:229–39.
- Dubrey SW, Cha K, Anderson J, et al. The clinical features of immunoglobulin light-chain (AL) amyloidosis with heart involvement. QJM 1998;91:141–57.
- Rocken C, Peters B, Juenemann G, et al. Atrial amyloidosis: an arrhythmogenic substrate for persistent atrial fibrillation. Circulation 2002;106:2091–97.
- Leone O, Boriani G, Chiappini B, et al. Amyloid deposition as a cause of atrial remodelling in persistent valvular atrial fibrillation. Eur Heart J 2004;25:1237-41.
- Kawamura S, Takahashi M, Ishihara T, Uchino F. Incidence and distribution of isolated atrial amyloid: histologic and immunohistochemical studies of 100 aging hearts. Pathol Int 1995;45(5):335-42.
- Beauchamp A, Peeters A, Tonkin A, Turrell G. Best practice for prevention and treatment of cardiovascular disease through an equity lens: a review. Europ J Cardiovasc Prevention Rehab 2010;17(5):599–606.
- Corradi D, Maestri R, MacChi E, Callegari S. The atria: from morphology to function. J Cardiovasc Electrophysiol 2011;22(2):223–35.
- Biolo A, Ramamurthy S, Connors LH, et al. Matrix metalloproteinases and their tissue inhibitors in cardiac amyloidosis: relationship to structural, functional myocardial changes and to light chain amyloid deposition. Circulation: Heart Failure. 2008;1(4):249–57.
- Li D, Fareh S, Leung TK, et al. Promotion of atrial fibrillation by heart failure in dogs: atrial remodeling of a different sort. Circulation 1999;100:87–95.
- Li D, Shinagawa K, Pang L, et al. Effects of angiotensin-converting enzyme inhibition on the development of the atrial fibrillation substrate in dogs with ventricular tachypacing-induced congestive heart failure. Circulation 2001;104:2608–14.
- Goette A, Staack T, Röcken C, et al. Increased expression of extracellular-signal regulated kinases and angiotensin-converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000;35:1669–77.
- Davies MJ, Pomerance A. Pathology of atrial fibrillation in man. Br Heart J 1972;34:520–5.
- Nattel S. New ideas about atrial fibrillation 50 years on. Nature 2002;415:219–26.
- Yoshihara F, Nishikimi T, Sasako Y, et al. Plasma atrial natriuretic peptide concentration inversely correlates with left atrial collagen volume fraction in patients with atrial fibrillation: plasma ANP as a possible biochemical marker to predict the outcome of the maze procedure. J Am Coll Cardiol 2002;39:288–94.
- Romero FJ, Bosch-Morell F, Romero MJ, et al. Lipid peroxidation products and antioxidants in human disease. Environm Health Perspectiv 1998;106(5):1229–33.
- Westermark P, Johansson B, Natvig JB. Senile cardiac amyloidosis: evidence of two different amyloid substances in the ageing heart. Scand J Immunol 1979; 10:303–8.
- Steiner I. The prevalence of isolated atrial amyloid. J Pathol 1987;153:395–8.
- Kawamura S, Takahashi M, Ishihara T, et al. Incidence and distribution of isolated atrial amyloid: histologic and immunohistochemical studies of 100 aging hearts. Pathol Int 1995;45:335–42.
- Cornwell GGI, Murdoch W, Kyle RA, et al. Frequency and distribution of senile cardiovascular amyloid: a clinicopathologic correlation. Am J Med 1983;75: 618–23.
- Wallen T, Landahl S, Hedner T, et al. Atrial peptides, ANP(1–98) and ANP(99–126) in health and disease in an elderly population. Eur Heart J 1993;14:1508–13.
- Berglund H, Boukter S, Theodorsson E, et al. Raised plasma concentrations of atrial natriuretic peptide are independent of left atrial dimensions in patients with chronic atrial fibrillation. Br Heart J 1990;64:9–13.
- Rossi A, Enriquez-Sarano M, Burnett JC Jr, et al. Natriuretic peptide levels in atrial fibrillation: a prospective hormonal and Doppler-echocardiographic study. J Am Coll Cardiol 2000;35:1256–62.
- Tuinenburg AE, Van Veldhuisen DJ, Boomsma F, et al. Comparison of plasma neurohormones in congestive heart failure patients with atrial fibrillation versus patients with sinus rhythm. Am J Cardiol 1998;81:1207–10.
- Hryniewiecki T, Rawczynska-Englert I, Orlowska-Baranowska E, et al. Atrial natriuretic peptide in rheumatic mitral valve disease. Pol Arch Med Wewn 1993;89:293–7.
- Tuinenburg AE, Brundel BJ, Van Gelder IC, et al. Gene expression of the natriuretic peptide system in atrial tissue of patients with paroxysmal and persistent atrial fibrillation. J Cardiovasc Electrophysiol 1999;10:827–35.
- Willems R, Sipido KR, Holemans P, et al. Different patterns of angiotensin II and atrial natriuretic peptide secretion in a sheep model of atrial fibrillation. J Cardiovasc Electrophysiol 2001;12:1387–92.
- Wijffels MC, Kirchhof CJ, Dorland R, et al. Electrical remodeling due to atrial fibrillation in chronically instrumented conscious goats: roles of neurohumoral changes, ischemia, atrial stretch, and high rate of electrical activation. Circulation 1997;96:3710–20.
- Hodkinson HM, Pomerance A. The clinical significance of senile cardiac amyloidosis: a prospective clinico-pathological study. Q J Med 1977;183:381–7.
- Selvanayagam J., Hawkins P., Paul B. et al. Evaluation and management of the cardiac amyloidosis. J Am Coll Cardiol 2007;50(2):2101–10.
- Zhao L, Tian Z, Fang Q. Diagnostic accuracy of cardiovascular magnetic resonance for patients with suspected cardiac amyloidosis: a systematic review and meta-analysis. BMC Cardiovasc Disord 2016;16:129.
- Сергиенко В.Б., Терещенко С.Н., Аншелес А.А. и др. Радионуклидные методы в диагностике амилоидоза сердца. Рациональная фармакотерапия в кардиологии 2018;14(1):94-100.
- Perugini E, Guidalotti PL, Salvi F, et al. Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol 2005;46(6):1076-84.
- Rapezzi C, Quarta CC, Guidalotti PL, et al. Usefulness and limitations of 99mTc3,3-diphosphono1,2-propanodicarboxylic acid scintigraphy in the aetiological diagnosis of amyloidotic cardiomyopathy. Eur J Nucl Med Mol Imaging 2011;38(3):470-8.
- Сергиенко В.Б., Аншелес А.А. Радионуклидная диагностика с нейротропными радиофармпрепаратами. М.: Инфра-М; 2014.
- Швалев В.Н., Реутов В.П., Сергиенко В.Б. и др. Механизмы развития кардиологических заболеваний при возрастных нарушениях состояния нервной системы. Казанский мед журнал 2016;97(4):598-606
