Антигеликобактерная эрадикационная терапия – выход из тупика или движение вглубь лабиринта?
К настоящему времени установлено, что эрадикация Helicobacter pylori может ускорить сроки рубцевания язвы, улучшить качество жизни пациента и уменьшить частоту рецидивов, но не позволяет ликвидировать заболевание. Это связано с тем, что Helicobacter pylori является не облигатно-патогенным, а условно-патогенным микробом. Соответствен но, стратегия эрадикационной терапии при заболеваниях, ассоциированных с условно-патогенной микрофлорой, в том числе с Helicobacter pylori, как минимум является ошибочной.
Уровень развития современной медицины, как и любого другого направления в науке, зависит от объема знаний и навыков, накопленных многими десятками предшествующих поколений. В то же время следует признать, что мы, как и современники Гиппократа, двигаемся вперед путем совершения проб и ошибок. Можно согласиться с тем, что число этих ошибок уменьшилось, но в целом оно еще очень велико. Достаточно упомянуть тот факт, что в нас тоящее время в каждом разделе медицины с периодичностью 3-5 лет происходит пересмотр рекомендаций по вопросам диагностики и лечения различных заболеваний. Ранее же ревизия сложившихся представлений занимала столетия и даже тысячелетия.
Открытие антибиотиков без преувеличения является одним из величайших достижений медицины, поскольку их использование позволило радикально сократить смертность от инфекционных заболеваний во всем мире. В конце ХХ века на слизистой оболочке желудка и двенадцатиперстной кишки пациентов с язвенной болезнью были выявлены грамотрицательные, неспорообразующие бак терии – Helicobacter pylori. Включение в программу лечения гастродуоденальных язв антибиотиков, обладающих антигеликобактерной активностью, в комбинации с блокаторами протонной помпы, позволило добиться максимального сокращения сроков рубцевания язвы, которое почти в 100% случаев сопровождалось эрадикацией бактерии. Данный факт послужил основанием для вывода о том, что H. pylori в сочетании с гиперхлоргидрией являются главными причинами язвенной болезни. Таким образом, о язвенной болезни стали говорить как об инфекционном заболевании. Однако лечением таких пациентов по-прежнему за ни маются не инфекционисты, а гастроэнтерологи. Поскольку выздоровлению пациентов инфекционных отделений всегда предшествует эрадикация инфекционного агента – виновника заболевания, данный подход был распространен и на пациентов с язвенной болезнью.
Длительное время существовало стойкое убеждение, что с эрадикацией H. pylori будет ликвидирована и язвенная болезнь. Прошло более 30 лет с момента открытия микроорганизма, в связи с чем появилась возможность подвести определенные итоги. Воздержимся пока от собственных оценок и обратимся к высказыванию И.В. Маева – одного из ревностных приверженцев версии о главной роли H. pylori в патогенезе язвенной болезни. "Несмотря на уже многолетнюю активную борьбу … с H. pylori-инфекцией, распространенность язвенной болезни как в нашей стране, так и в большинстве стран мира не снижается. Стабильно высокой (на уровне 10%) остается и частота ее грозных осложнений (перфорации, пенетрации, кровотечения и др.)" [1].
Приведенная фраза фактически является авторитетным признанием того, что утверждение о ведущей роли H. pylori в патогенезе язвенной болезни является ошибочным. Действи тельно, в значительной части случаев язвенная болезнь развивается без всякого участия H. pylori (H. pylori-негативные формы болезни). В США частота язвенной болезни, не ассоциированной с H. pylori, варьируется от 39 до 52%, а в Австралии достигает 45% [2,3]. Представленные данные наглядно демонстрируют, что роль H. pylori без достаточных оснований чрезмерно демонизирована.
Поскольку принципы лечения гастродуоденальных язв тесно увязаны с представлением о роли H. pylori, возникает вопрос, отразилось ли это на алгоритме антибактериальной терапии больных? На данный вопрос в целом можно ответить утвердительно. Корректировка схем лечения действительно осуществляется каждые несколько лет. Последние рекомендации сформулированы в Маастрихт-V-Флорентийском консенсусе [4]. Значительная часть всех пяти вариантов Мааст рихт ского консенсуса посвящена рассмотрению вопроса: что делать, если неэффективна та или иная схема терапии? Соответственно, в последнем варианте, как и в четырех предыдущих изданиях, преимущественно обсуждается тактика преодоления резистентности H. pylori к используемым антибиотикам. При этом стратегический вопрос о целесообразности обязательного достижения эрадикации H. pylori даже не возникает, он автоматически, в течение более 30 лет, переносится из одних рекомендаций в другие, хотя, как уже отмечалось, заболеваемость язвенной болезнью на планете за данный период не снижается. Более того, в новых рекомендациях без достаточных оснований расширяется круг заболеваний и синдромов, при которых рекомендуется проводить эрадикационную терапию.
Недавно, на страницах данного журнала Я.С. Цим мерман опубликовал дискуссионную статью, в которой привел целый ряд фактов, заставляющих усомниться в гипертрофированной роли H. pylori и в адекватности стратегии консервативной терапии гастродуоденальных язв. С учетом собственного опыта мы целиком разделяем точку зрения Я.С. Циммермана о том, что авторысоставители "Маастрихтских консенсусов" по существу монополизировали право определять показания к эрадикации H. pylori и методику проведения эрадикационной терапии, провозгласив стратегию на тотальную ликвидацию H. pylori (test and treat strategy: выявлять и уничтожать!), что научно бездоказательно и практически неосуществимо [5]. Твердо убеждены, что подобный подход является однобоким, ошибочным и требует учета альтернативных фактов. С учетом изложенного в предлагаемой статье мы постараемся более подробно остановиться на дискуссионных моментах, касающихся вопросов стратегии антигеликобактерной эрадикационной терапии.
В противовес утверждению о главной роли H. pylori в патогенезе гастродуоденальных язв считаем необходимым напомнить хорошо известный факт, установленный еще В.Х. Василенко (1970 г.) – "Язвы заживают при лечении, без лечения и вопреки лечению" [6]. С учетом того, что у значительной части больных возникновение заболевания возможно и при отсутствии H. py lori, данное наблюдение убедительно свидетельствует о существовании причин, которые играют более важную роль в патогенезе гастродуоденальных язв, чем наличие микроба. Считаем, что в патогенезе гастродуоденальных язв среди многочисленных факторов риска ведущими являются "немодифицируемые": наследственность, пол и возраст человека. Непосредственная же реализация их роли осуществляется за счет имеющейся врожденной или приобретенной локальной гипоплазии сосудов в двенадцатиперстной кишке или желудке, которая также относится к категории немодифицируемых факторов [7]. Помимо немодифицируемых, в патогенезе гастродуоденальных язв важную вспомогательную роль играет огромное количество факторов, которые считаются "модифицируемыми"; к их числу относится и H. pylori. С учетом выраженного положительного ответа на антигеликобактерную терапию есть основание сделать вывод, что среди модифицируемых факторов H. pylori играет одну из главных ролей.
Опыт последних тридцати с лишним лет показал, что эрадикация геликобактера, сокращая сроки рубцевания язв, одновременно ведет к снижению соотношения гастродуоденальных язв, ассоциированных и не ассоциированных с H. pylori, но при этом, вопреки ожиданиям, не ведет к ликвидации язвенной болезни [8]. Большой интерес представляют наблюдения хирургов, установивших, что частота рецидивов после успешно выполненных органосберегающих операций (стволовой ваготомии с экономной резекцией язвы) составляет 0% в течение более 25 лет после вмешательства. При этом положительный H. pylori-статус у оперированных больных выявляют с той же частотой, что и в популяции [9,10]. Важно отметить рост смертности от осложнений длительно не рубцующихся гастродуоденальных язв, что дает повод провести переоценку показаний к проведению планового оперативного лечения при указанных состояниях. Приведенные примеры наглядно демонстрируют, что в значительном числе случаев успешное хирургическое устранение части стенки желудка или двенадцатиперстной кишки, включающей участок локальной гипоплазии сосудов, является гораздо более эффективной мерой, чем эрадикация H. pylori.
Негативный парадокс обсуждаемой проблемы заключается в том, что к настоящему времени данный микроб без достаточных оснований рассматривается в качестве главной причины возникновения уже целого ряда других заболеваний. Показания к их эрадикационной терапии были сформулированы еще консенсусом "Маастрихт II". В последующих согласительных документах дополнительно указывался ряд новых патологических состояний, при которых также рекомендовалось проведение эрадикационной терапии. К настоящему времени показаниями к диагностике и лечению H. pylori служат следующие [4,11]:
- язвенная болезнь: в стадии обострения и ремиссии на момент обращения, в анамнезе, у родственников первой линии;
- хронический гастрит;
- функциональная диспепсия;
- длительное лечение ингибиторами протонной помпы (гастроэзофагеальная рефлюксная болезнь, прием нестероидных противовоспалительных препаратов, глюкокортикостероидов, аспирина, антикоагулянтов);
- рак желудка у родственников первой линии;
- ранний рак желудка; • желание пациента;
- страх рака желудка; • эмигрант первого поколения из регионов с высокой частотой инфекции;
- необъяснимая железодефицитная анемия, идиопатическая тромбоцитопеническая пурпура, дефицит вита мина B12.
При этом игнорируется тот факт, что данный подход находится в противоречии с представлениями о патогенезе, особенностях течения, лечения и исходов классических облигатно- и условно-патогенных инфекций [12]. Известно, что биомасса микробов, заселяющих желудочно-кишечный тракт взрослого человека, составляет 2,5–3 кг и более и включает в себя до 450–500 видов. Около 90% данного микробиоценоза представлено облигатной (обязательной) нормальной микрофлорой, выполняющей множество жизненно важных функций [13]. Без преувеличения, значение данной микрофлоры сопоставимо с ролью такого важного органа, как печень. Остальная часть микробиоценоза представлена факультативной (возможной, необязательной) микрофлорой, часто встречающейся у здоровых людей и являющейся условно-патогенной [14]. Условно-патогенными считают микроорганизмы, представляющие собой большую группу грибов, бактерий, простейших и вирусов. Они являются нормальными обитателями кожи и слизистых оболочек, мирно сосуществующими с организмом человека, что свидетельствует о том, что иммунная система хозяина не воспринимает их как угрозу и ведет себя нейтрально. При этом они способны долгое время существовать в окружающей среде.
H. pylori относится к категории условно-патогенных инфекций. Особенностью микроорганизмов данного типа является то, что они многие годы и даже всю жизнь могут находиться в организме человека, не проявляя признаков какой-либо агрессии. Агрессивные свойства данные инфекционные агенты проявляют лишь в условиях пассивного проникновения во внутреннюю среду в больших количествах и (или) резкого снижения общего и местного иммунитета человека (нарушение целостности покровов, бактерицидной активности секретов, подавление фагоцитарной реакции, снижение числа микробов-антагонистов и др.). Это связано с тем, что условно-патогенные микробы, в отличие от облигатно-патогенных, не обладают факторами активного проникновения во внутреннюю среду, подавления защитных сил организма, не выделяют экзотоксины. Патогенное влияние на организм они оказывают с помощью эндотоксина и ферментов-токсинов [12].
Важно отметить, что по данным Я.С. Циммермана и соавт., у 90,5% больных язвенной болезни наряду с H. pylori периульцерозную зону колонизируют 93 вида микроорганизмов (стрептококки, грибы рода Candida, энтеробактерии, коринебактерии и др., чаще всего в виде микробных ассоциаций) [15,16]. Термин "условнопатогенные микроорганизмы" в значительной мере условен, поскольку провести четкую грань, отличающую указанных возбудителей от облигатно-патогенных, вряд ли возможно. Тем не менее, считаем необходимым высказать точку зрения, что к категории облигатнопатогенных следует относить те инфекционные агенты, которые в максимальной степени соответствуют постулатам Роберта Коха (1890 г.). В них утверждается, что возбудителями определенных инфекционных болезней являются те микроорганизмы, которые:
- постоянно встречаются в организме больных людей (или животных) и отсутствуют у здоровых;
- микроорганизм должен быть выделен от больного человека (или животного), а его штамм должен быть выращен в чистой культуре;
- при заражении чистой культурой микроорганизма здоровый человек (или животное) заболевает.
Данные больные являются заразными, поэтому они нуждаются в изоляции от окружающих и соблюдении требований противоэпидемического режима и должны получать лечение в специализированных инфекционных отделениях. В подобных случаях убедительным и вполне обоснованным выглядит требование добиваться, в обязательном порядке, эрадикации инфекционных агентов, вызвавших данное заболевание.
Таким образом, в возникновении перечисленных патологических состояний H. pylori играет роль важного модифицируемого, но не главного фактора риска. В этой связи, утверждение, что при всех перечисленных состояниях антигеликобактерная терапия должна быть эрадикационной, вызывает большие сомнения. Накоп ленный мировой опыт допускает эмпирическое использование антибактериальных препаратов сразу после установления диагноза при заболеваниях, ассоциированных с условно-патогенной флорой (пневмонии, инфекции желчевыводящих, мочевыводящих путей и др.). При этом учитываются результаты предшествующих эпидемиологических исследований по региону, лечение пациентов данной категории осуществляется вне инфекционного стационара – в общетерапевтических, хирургических и других отделениях. Часто в результате лечения удается достичь и эрадикации агента, причастного к возникновению пневмонии или другого подобного заболевания, однако задача обязательного достижения подобной цели не стоит. Более того, прием антибиотиков прекращается задолго до того, как ликвидированы пневмоническая инфильтрация и основные лабораторные и клинические прояв ления. Таким образом, главной целью лечения заболеваний, ассоциированных с условно-патогенной флорой, является не эрадикация условно-патогенных бактерий, а достижение клинического выздоровления при острой болезни или ремиссии хронического заболевания. Принципиальным является тот факт, что после выздоровления не ставится задача контроля степени эрадикации возбудителя заболевания, более того, после успешного завершения лечения возбудитель часто так и остается неизвестным [17].
Отсутствие убедительных доказательств целесообразности эрадикации H. pylori при гастродуоденальных язвах делает еще менее обоснованным утверждение о необходимости добиваться той же цели при прочих перечисленных выше заболеваниях. Обсуждения заслуживают, прежде всего, хронический гастрит и функциональная диспепсия, ассоциированные с H. pylori, и рак желудка. Считается, что при естественном течении H. pylori-ассоциированнного хронического гастрита у 1-2% больных нарушается стройная система клеточного обновления слизистой оболочки желудка. Это ведет к атрофии и прогрессированию морфологических изменений в слизистой оболочке, что способствует формированию рака желудка ("каскад Correa") [18].
Заболеваемость раком желудка характеризуется примерно 10-кратными географическими колебаниями, что может свидетельствовать о более важной роли этнической и наследственной предрасположенности. Рак желудка очень часто встречается в странах Восточной Азии (Японии и Корее), Южной Америке и Восточной Европе и значительно реже в Южной Азии, Северной Америке, Северной и Восточной Африке, Австралии, Новой Зеландии [19,20]. Особый интерес представляет тот факт, что в африканской популяции, где отмечается максимальная распространенность H. pylori (до 97%), рак желудка распространен в минимальной степени, а в Японии, где распространенность H. pylori составляет около 43%, заболеваемость раком этой локализации высокая. С учетом изложенного, трудно согласиться с утверждением, что инфекция H. pylori является канцерогеном 1 группы для человека [21]. Сомнение в обоснованности данного утверждения усиливается еще более, если обратиться к статистике распространенности рака желудка в России за период 2005-2015 гг. (рис. 1) [22].
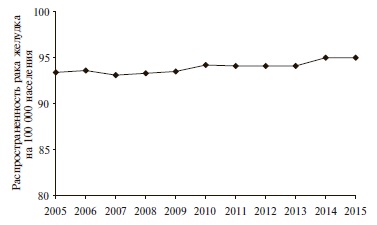
Приведенные данные наглядно свидетельствуют о том, что внедрение в практику эрадикационной стратегии не способствует снижению распространенности рака желудка в России. Более того, отмечается его статистически недостоверный, но неуклонный рост за период 2005-2010 гг., что делает сомнительным утверждение о целесообразности проведения эрадикационной терапии с целью профилактики возникновения данного вида онкопатологии.
Большой интерес представляет исследование, которое в течение около 7,5 лет проводилось в китайской провинции, где отмечается высокая заболеваемость раком желудка. Пациенты с сопоставимым риском возникновения рака желудка были распределены на две группы и получали плацебо (n=813) или эрадикационную терапию (n=817). В первые 5 лет кумулятивная заболеваемость раком желудка была выше в группе плацебо, однако к концу исследования частота его в сравниваемых группах достоверно не различалась [23]. Приведенные данные наглядно свидетельствуют о том, что эрадикационная терапия может на несколько лет замедлить скорость прогрессирования рака желудка, но не способна его предотвратить. В литературе приводятся данные о том, что эрадикационная терапия является эффективным элементом профилактики рака лишь в тех случаях, когда ее назначают до развития преднеопластических состояний. Установлено, что III и IV стадии атрофического гастрита по системе OLGA ассоциируются с повышенным риском развития рака желудка [24]. Эрадикационная терапия у пациентов с кишечной метаплазией не приводит к обратному развитию последней, она может лишь замедлить прогрессирование метаплазии до неоплазии.
Все схемы эрадикационной терапии, сформулированные в пяти Маастрихтских рекомендациях, предлагаются не в качестве рекомендаций, возможных к использованию, а вменяются в виде обязательств, непременных к исполнению. В этой связи представляет интерес наблюдение о распространенности язвенной болезни у лиц, занятых в производстве антибиотиков. При этом установлено, что средний возраст больных с дуоденальными язвами (39,8 лет), занятых в производстве антибиотиков, соответствовал таковому больных с язвами двенадцатиперстной кишки контрольной группы, работа которых не была связана с данным производством. В то же время, средний возраст пациентов с язвами желудка в основной группе (38,7 лет) был ниже возраста, характерного для лиц с язвами данной локализации (40-50 лет) в контроле. Это дает основание говорить о том, что продолжительный контакт человека с антибиотиком ведет к росту резистентности условнопатогенной флоры, что, в конечном счете, способствует более раннему возникновению язвы желудка у лиц, работа которых связана с производством антибиотиков [25].
Суммарная распространенность хронического гаст рита и функциональной диспепсии сопоставима с распространенностью H. pylori в популяции (не менееполовины населения). Известно, что при естественном течении хронического гастрита 1-2 из 100 человек могут умереть от рака желудка. При III и IV стадии атрофического гастрита эрадикационная терапия бесполезна. Требование о необходимости проведения эрадикации на более ранних стадиях означает, что в программу лечения следует включать не менее 50% населения планеты. В то же время, ранее приведенные примеры свидетельствуют о том, что, во-первых, эрадикационная терапия не остановит прогрессирования ни хронического гастрита, ни функциональной диспепсии. Во-вторых, у 1-2 из 100 человек с хроническим гастритом опухоль может развиться на несколько лет позже, чем при естественном течении заболевания, но умрут они, в любом случае, от рака желудка. Что касается остальных 98-99 пациентов, то они, фактически, превращаются в "живой термостат-инкубатор" для выращивания огромного количества новых штаммов бактерий, резистентных к новым антибиотикам.
Завершая обсуждение роли H. pylori в патогенезе и лечении H. pylori-ассоциированных заболеваний, можно сделать ряд выводов, которые дают основание усом ниться в достаточной обоснованности и целесообразности стратегии эрадикационной терапии при отмеченных заболеваниях. Если ориентироваться на распространенность H. pylori и ассоциированных с ним заболеваний, ситуацию в целом можно рассматривать как грозную пандемию, охватившую территорию всей планеты. Однако при более близком рассмотрении становится ясно, что сравнение с пандемией носит исключительно формальный характер. Как известно, классическим примером пандемии является "черная смерть", или эпидемия чумы, которая наблюдалась в Европе в XIV веке. Она почти одновременно буйствовала на территории Африки и Евразии. Последствия инфекции были ужасны: Европа опустела, потеряв по некоторым подсчетам до 40% населения, на территории Китая и Индии вымерли несколько сотен городов и деревень, количество мертвых в Африке и вовсе не подлежит подсчету. Таким образом, одной из главных особенностей пандемии является не только высокая распространенность инфекции в популяции, но и исключительно высокий риск смерти при заражении. При этом абсолютное большинство лиц с H. pylo riассоциированными заболеваниями представлено пациентами с хроническим гастритом, которые даже не знают о существовании у них ни гастрита, ни H. pylori. Сам же гастрит представляет угрозу для жизни лишь у 1-2 из 100 человек. С учетом представленных фактов термин пандемия для данной ситуации не подходит.
Следующая особенность состоит в том, что возбудители пандемических заболеваний все без исключения относятся к категории облигатно-патогенных, в то время как H. pylori является условно-патогенным. Важно подчеркнуть, что у выздоровевших после заразных болезней людей иммунная система вырабатывает барьер от определенного возбудителя: стойкий, нестойкий или пожизненный. При этом далеко не у всех переболевших классическим инфекционным заболеванием, вызванным облигатно-патогенным возбудителем, вырабатывается пожизненный иммунитет. Например, к числу болезней, после которых образуется стойкий иммунитет на всю жизнь, относят краснуху, эпидемический паротит, гепатит А, дифтерию, корь, полиомиелит, ветряную оспу. Нестойкий или кратковременный иммунитет формируется после таких заболеваний, как коклюш, гепатит В, грипп, туберкулез, брюшной тиф, дизентерия. К условно-патогенным возбудителям иммунная система относится нейтрально, поэтому нет оснований отрицать, что H. pylori после эрадикации может неоднократно возвращаться к одному и тому же человеку.
Эрадикация облигатно-патогенного возбудителя тож дественна полному выздоровлению инфекционного больного, эрадикация же H. pylori, как показало время, ведет лишь к сокращению сроков рубцевания язвы и к более продолжительной ремиссии, но не к ликвидации самого заболевания. Распространенность рака желудка, как отмечено ранее, не только не снижается, но продолжает расти. С учетом изложенного при остром возникновении или рецидиве гастродуоденальных язв проведение антигеликобактерной терапии следует признать целесообразным. При этом главным критерием эффективности лечения следует считать достижение ремиссии заболевания (купирование клинических проявлений, рубцевание язвы). Однако, поскольку эрадикация не является гарантией предотвращения рецидива заражения H. pylori и не сопровождается ликвидацией "H. рylori-ассоциированных заболеваний", лечебную стратегию, предписывающую обязательно добиваться эрадикации геликобактера, следует считать ошибочной.
Избирательно используя лишь те данные, которые свидетельствовуют о гипотетической пользе эрадикации H. pylori и игнорируя альтернативные точки зрения, Маастрихтские рекомендации продолжают настоятельно пропагандировать версию о целесообразности достижения эрадикации. Однако, поскольку микроб быстро и успешно вырабатывает устойчивость к новым классам антибиотиков, в недалеком будущем могут появиться рекомендации включать в схемы эрадикации антибиотики, которые пока считаются резервными. В конечном счете, попытка "привязать" к геликобактеру все новые заболевания приведет к тому, что в эрадикационную терапию может быть вовлечено не менее половины человечества. Упорствуя в желании непременно убить условно-патогенного микроба, мы рискуем убить и хозяина, не избавив его при этом от заболевания, по поводу которого проводилась эрадикация. Обращаясь к базовым положениям медицинской науки, считаем возможным сформулировать главный дискуссионный вопрос. Соответствуют ли существующие подходы антигеликобактерной эрадикационной терапии правилу из клятвы Гиппократа – "Прежде всего, не навреди"?
Используемые источники
- Маев И.В., Самсонов А.А., Андреев Н.Г., Андреев Д.Н. Важные практи - ческие результаты и современные тенденции в изучении забо леваний желудка и двенадцатиперстной кишки. Росс журнал гастроэнтерол гепатол и колопроктол 2012;4:17–27.
- Исаков В.А., Домарадский И.В. Хеликобактериоз. Москва, 2003.
- Авраменко А.А. Гоженко А.И. Хеликобактериоз. Николаев, 2007.
- Malfertheiner P, Megraud F, O'Morain C et al. Management of Helicobacter pylori infection – the Maastricht V/Florence Consensus Report. Gut 2017;66(1): 6–30.
- Циммерман Я.С. Стойкие заблуждения современной гастроэнтерологии. К лин фармакол тер 2016;25(5):5-13.
- Василенко В.Х. Чего мы не знаем о язвенной болезни. Актуальные вопросы гастроэнтерологии 1970;3:3–17.
- Литовский И.А., Гордиенко А.В. Дискуссионные вопросы патогенеза гастродуоденальных язв. Вестн Росс ВМА 2015;52(4):197–204.
- Баранская Е.К. Современные подходы к лечению язвенной болезни. В кн.: Профилактика и лечение хронических заболеваний верхних отделов ж елудочно-кишечного тракта. Москва, 2013:75–8.
- Крылов Н.Н. Место хирургического лечения язвенной болезни в эпоху с тандартизации медикаментозной терапии. Росс мед вести 1999;2:58–61.
- Johnston AJ, Proxmal gastric vagotomy: does it have a place in the management of peptic ulcer? W J Surg 2000;24:259–63.
- Ивашкин В.Т., Маев И.В., Лапина Т.Л. Рекомендации Российской гастро - э нтеро логической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Росс журнал гастроэнтерол гепатол и колопроктол 2012;1:87-9.
- Зверев В.В., Бойченко М.Н. Медицинская микробиология, вирусология и иммунология. В 2-х т. Том 1. Москва, 2010.
- Курилович С.А., Светлов И.О., Солдатов Г.С. Микробиоценоз кишечника. С овре менные представления о норме и патологии. Принципы коррекции нарушений. Новосибирск, 1998.
- Бондаренко В.М., Боев Б.В., Лыкова Е.А., Воробьев А.А. Дисбактериозы желудочно-кишечного тракта. Росс журнал гастроэнтерол гепатол и колопро ктол 1998;1:66—70.
- Циммерман Я.С., Захарова Ю.А., Ведерников В.Е. Микрофлора слизистой оболочки желудка, ее свойства и роль в развитии острого и хронического гастрита. Клин медицина 2012;11:41–46.
- Циммерман Я.С., Захарова Ю.А., Ведерников В.Е. Сравнительная оценка диагностических тестов определения Helicobacter pylori и спектр мукозной микрофлоры желудка при гастрите и язвенной болезни. Клин медицина 2013;4:42–48.
- Чучалин А.Г., Синопальников А.И., Козлов Р.С. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. Москва, 2010.
- Correa P. Human gastric carcinogenesis: a multistep and multifactorial process. F irst American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992;52(24): 6735-40.
- Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer. Methods Mol Biol 2009;472:467-77.
- Crew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol 2006;12(3):354-62.
- Malfertheiner P, Megraud F, O’Morain СА, et al. European Helicobacter Study Group. Management of Helicobacter pylori infection-the Maastricht IV. Florence Consensus Report. Gut 2012;61(5):646–64.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2016 г. Москва, 2017.
- Wong BC, Lam SK, Wong WM, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA 2004;291(2):187–94.
- Wei J, Nagy TA, Vilgelm A, et al. Regulation of p53 tumor suppressor by Helicobacter pylori in gastric epithelial cells. Gastroenterology 2010;139:1333-43.
