Кальций и витамин D в профилактике и лечении остеопороза
Кальций и витамин D имеют ключевое значение для поддержания здоровья костной ткани. Однако на протяжении последнего десятилетия их эффективность в профилактике остеопороза (ОП) вызывает споры, учитывая неоднозначность результатов контролируемых клинических исследований. Более того, высказываются опасения по поводу безопасности кальция для сердечно-сосудистой системы. Тем не менее, результаты нескольких метаанализов клинических исследований показали, что применение препаратов кальция ± витамина D у людей пожилого возраста, прежде всего женщин, задерживает снижение минеральной плотности костной ткани и вызывает уменьшение риска переломов. Убедительных данных в пользу увеличения риска сердечно-сосудистых исходов на фоне приема кальцийсодержащих препаратов также не получено. Препараты кальция и витамина D не заменяют бисфосфонаты и другие антиостеопоротические препараты у пациентов с ОП, однако лечение ОП необходимо всегда проводить на фоне адекватного потребления кальция и витамина D с пищей или в виде пищевых добавок. Назначение комбинированных препаратов, содержащих кальций и витамин D, необходимо также пациентам, получающим глюкокортикостероиды, даже в низких дозах, в течение более 3 мес, для профилактики стероидного ОП.
Остеопороз (ОП) – это самое распространенное заболевание костной ткани, характеризующееся снижением костной массы, ухудшением микроархитектуры и повышением хрупкости костей, которые приводят к увеличению риска переломов. В 2010 году в странах Европейского Союза расчетное число пациентов с ОП составляло 27,5 млн человек, в том числе 22 млн женщин [1], а в США – 10,2 млн [2]. При этом число людей со сниженной костной массой в несколько раз выше и, например, в США достигает 43,4 млн. По данным российского эпидемиологического исследования, ОП имеется примерно у каждой третьей женщины и каждого четвертого мужчины в возрасте 50 лет и старше [3]. Ожидается, что в Европе ежегодное число остеопоротических переломов (ОПП) увеличится с 3,5 млн в 2010 году до 4,5 млн в 2025 году, или на 28% [2]. Ежегодные затраты, связанные с ОП, в странах Европейского Союза в 2010 году составили 37 млрд евро, а в России прямые медицинские и немедицинские затраты на лечение ОПП за 1 год могут приближаться к 25 млрд руб. [4].
Важную роль в патогенезе ОП играет недостаточное потребление кальция и витамина D с пищей, поэтому на протяжении многих лет комбинированные препараты, содержащие эти и другие минералы, широко используют как для профилактики, так и лечения (в комбинации с бисфосфонатами или другими средствами) ОП. Дефицит кальция может препятствовать достижению адекватной пиковой костной массы у подростков и способствовать ее снижению у людей пожилого возраста.
Актуальность проблемы дефицита кальция была недавно подтверждена результатами крупного исследования, которое проводилось под эгидой Международного фонда остеопороза (IOF) [5]. В соответствии с рекомендациями IOF 2014 г. мужчины в возрасте от 50 до 70 лет должны потреблять 1000 г кальция в сутки, а женщины в возрасте старше 50 лет и мужчины в возрасте старше 70 лет – 1200 мг/сут [6]. По данным проведенного анализа, в 74 странах мира среднее потребление кальция с пищей варьировалось от 175 до 1233 мг/сут. Однако во многих странах Азии оно не превышало 500 мг/cут, а в большинстве стран Африки и Южной Америки составляло от 400 до 700 мг/сут. Среднее потребление кальция с пищей превышало 1000 мг/сут только в странах Северной Европы, а в России составило около 780 мг/сут. Во многих странах пониженное потребление кальция с пищей отмечалось преимущественно у женщин и людей пожилого возраста, для которых адекватное поступление этого минерала имеет особое значение. По данным других исследований, в нашей стране дефицит потребления кальция с пищей определялся у 60-90% россиян [7,8]. В рекомендациях Российской ассоциации по ОП указано, что в среднем российские женщины в возрасте 50 лет и старше потребляют менее 700 мг кальция в сутки, поэтому большинство из них нуждаются в увеличении потребления молочных продуктов или добавлении препаратов, содержащих как минимум 500 мг кальция, чтобы обеспечить рекомендуемое его потребление в 1200 мг/сут [9].
Сходные данные были получены и при анализе распространенности дефицита витамина D в популяции. J. Hilger и соавт. проанализировали 195 исследований, проводившихся в 54 странах более чем у 168000 участников [10]. Средние сывороточные уровни 25-гидроксивитамина D в популяции варьировались в широких пределах, однако в 37% исследований они были ниже 50 нмоль/л, что указывало на дефицит витамина. Результаты эпидемиологических исследований свидетельствуют о том, что частота недостаточности витамина D в популяции достигает 50%, а выраженный дефицит витамина наблюдается у 1 млрд человек [11]. Факторы, способствующие развитию дефицита витамина D, включают в себя недостаточное его потребление с пищей, преимущественное пребывание в закрытых помещениях, загрязнение окружающей среды, которое ограничивает воздействие на человека солнечного света, необходимого для активации синтеза витамина D из 7-дигидрохолестерина в эпидермисе.
Минеральная плотность костной ткани
Результаты некоторых исследований свидетельствуют о том, что минеральная плотность костной ткани (МПКТ) зависит от потребления кальция с пищей. Например, в Корее подобная ассоциация была изучена более чем у 4600 мужчин и женщин в возрасте старше 50 лет, распределенных на группы в зависимости от потребления кальция и сывороточной концентрации 25-гидроксивитамина D [12]. Недостаточное потребление кальция ассоциировалось с более низкой МПКТ в области шейки бедра как при более низкой, так и более высокой сывороточной концентрации 25-гидроксивитамина D. Полученные данные свидетельствовали о том, что более высокие сывороточные уровни витамина D не позволяют компенсировать дефицит потребления кальция с пищей.
J. Wu и соавт. оценивали эффективность кальция в профилактике снижения МПКТ на основании метаанализа 17 контролируемых клинических исследований у 2537 женщин постменопаузального возраста [13]. Результаты моделирования показали, что возраст и количество кальция, поступающего с пищей, были ключевыми факторами, влиявшими на изменение МПКТ. У женщин в возрасте 50, 60, 70 и 80 лет, потребляющих 1200 мг кальция в сутки в течение 2 лет, можно ожидать увеличения МПКТ на 1,33%, 1,94%, 2,60% и 3,27%, соответственно, в то время как при потреблении кальция в дозе 700, 1200, 1300 и 2000 мг/сут в течение того же срока у женщины в возрасте 60 лет степень увеличения МПКТ может составить 1,62%, 1,94%, 1,97% и 2,13%, соответственно. Таким образом, адекватное суточное потребление кальция составило 1200 мг/сут, так как дальнейшее его увеличение не приводило к существенному дополнительному эффекту на МПКТ у женщин постменопаузального возраста.
У женщин быстрое снижение МПКТ начинается за 1 год до последней менструации и продолжается в течение примерно 2 лет после наступления менопаузы, после чего скорость снижения МПКТ замедляется [14]. В течение указанного 3-летнего периода средняя скорость снижения МПКТ в области поясничных позвонков и шейки бедра составляет 2,5% и 1,8% в год, соответственно [15]. За 5 лет степень снижения МПКТ достигает 10%, а увеличение потребления кальция позволяет нивелировать или по крайней мере уменьшить этот эффект.
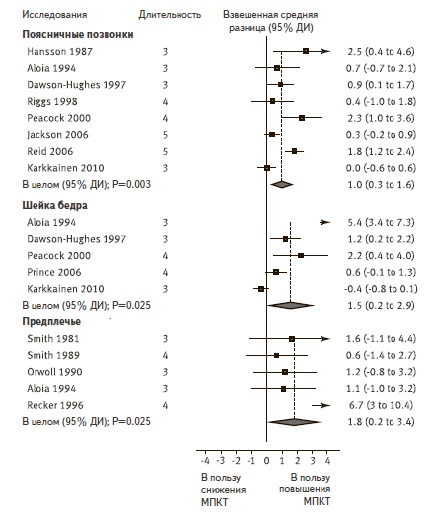
V. Tai и соавт. провели мета-анализ 59 рандомизированных контролируемых исследований, в которых изучалось влияние кальция (±витамина D) на МПКТ у лиц в возрасте старше 50 лет (подавляющее большинство участников исследований составили женщины) (рис. 1) [16]. В 15 исследованиях (n=1533) оценивали результаты потребления кальция с пищей, а в 51 исследовании (n=12257) изучали кальцийсодержащие препараты. Увеличение потребления кальция с пищей привело к увеличению МПКТ в области бедренной кости и всего скелета на 0,6-1,0% через 1 год и МПКТ в области бедренной кости, поясничных позвонков, шейки бедра и всего скелета на 0,7-1,8% через 2 года. Существенных изменений МПКТ в области предплечья выявлено не было. Применение препаратов кальция ассоциировалось с увеличением МПКТ в области бедренной кости, шейки бедра, поясничных позвонков, предплечья и всего скелета на 0,7-1,8% через 1, 2 и 2,5 года (рис. 1). Степень увеличения МПКТ в более поздние сроки была сопоставимой с таковой в течение первого года. Монотерапия препаратами кальция и препаратами, содержащими кальций и витамин D, оказывала сопоставимое влияние на МПКТ. Это согласуется с результатами мета-анализов, которые свидетельствуют о том, что витамин D сам по себе не вызывает увеличения МПКТ [17,18].
Таким образом, адекватное потребление кальция с пищей ассоциируется с более высокой МПКТ в области шейки бедра, а увеличение потребления кальция с пищей или применение кальцийсодержащих препаратов у женщин в период перименопаузы вызывает умеренное увеличение МПКТ в области различных костей и всего скелета.
Риск падений
Непосредственной причиной переломов у людей как без ОП, так и с ОП являются падения, частота которых увеличивается с возрастом. Витамин D и кальций принимают участие в регуляции мышечной функции, поэтому была высказана гипотеза о том, что их применение может способствовать улучшению силы мышц и снижению риска падений. В нескольких исследованиях было показано, что низкие сывороточные концентрации 25-гидроксивитамина D, особенно менее 20 нг/мл (50 нмоль/л), ассоциируются с увеличением риска падений [19,20].
K. Stockton и соавт. при мета-анализе 17 рандомизированных контролируемых исследований (n=5072) не выявили увеличения силы мышц при применении витамина D у взрослых с сывороточной концентрацией 25гидроксивитамина D >25 нмоль/л [21]. В то же время в других исследованиях у пациентов с концентрацией 25гидроксивитамина D <25 нмоль/л применение витамина D привело к значительному увеличению силы мышц бедер. C. Beaudart и соавт. провели мета-анализ 30 рандомизированных контролируемых исследований, в которых изучалось влияние витамина D на функцию мышц у 5615 участников в среднем возрасте около 60 лет [22]. Витамин D оказывал небольшое, но статистически значимое положительное действие на обшую силу мышц (р=0,02), которое не сопровождалось увеличением мышечной массы. Эффективность витамина D была выше у пациентов с сывороточной концентрацией 25-гидроксивитамина D <30 нмоль/л, а также у людей в возрасте 65 лет и старше.
Результаты некоторых исследований продемонстрировали возможность снижения частоты падений при применении витамина D. Напри мер, Y. Michael и соавт. при мета-анализе 9 исследований, в которых изучался витамин D, выявили снижение риска падений на 17% (отношение рисков 0,83, 95% доверительный интервал [ДИ] 0,77-0,89) [23]. Сходные данные были получены M. Murad и соавт. при мета-анализе 26 исследований в целом у 45782 участников [24]. В этом мета-анализе риск падений при применении витамина D снизился на 14% (отношение рисков 0,86; 95 ДИ 0,77-0,96). В то же время в других мета-анализах не было отмечено снижения риска падений при применении витамина D [25,26].
В целом результаты изучения эффективности витамина D в профилактике падений у пожилых людей оказались неоднозначными, что может объясняться различными причинами, включая особенности изученных популяций, критерии оценки недостаточности витамина D, дозы и формы препарата, длительность лечения, приверженность. Тем не менее, результаты исследований не позволяют исключить, что витамин D в дозах от 700 до 1000 МЕ/сут увеличивает силу мышц и может способствовать снижению риска падений у пожилых людей, особенно при наличии дефицита этого витамина [27].
Профилактика переломов
Эффективность препаратов кальция и витамина D в профилактике ОПП изучались в многочисленных исследованиях, в которые включали людей пожилого возраста, преимущественно женщин. В самом крупном рандомизированном контролируемом исследовании (WHI) приняли участие 36282 американки в возрасте от 50 до 79 лет, которые получали кальция карбонат, содержащий 1000 мг элементарного кальция, + витамин D в дозе 400 МЕ/сут или плацебо [28]. Примерно 10% из них перенесли переломы в возрасте старше 55 лет. Длительность наблюдения составляла 7 лет. В конце периода наблюдения МПКТ бедренной кости в основной группе была на 1,06% выше, чем в контрольной (р<0,01). Во всей выборке лечение препаратом кальция и витамином D не привело к существенному снижению риска переломов бедренной кости, позвонков или любых переломов. В то же время среди женщин, которые приняли по крайней мере 80% доз назначенных препаратов, в основной группе было выявлено достоверное снижение риска переломов бедренной кости на 29% (отношение рисков 0,71, 95% ДИ 0,52-0,97) при отсутствии изменений частоты переломов позвонков и костей предплечья/запястья. Эффективность препарата кальция и витамина D зависела также от возраста и была выше у женщин старше 60 лет, у которых риск переломов снизился на 21% (отношение рисков 0,79; 95% ДИ 0,64-0,98). В 2013 году те же авторы провели повторный анализ результатов исследования WHI, а также объединили их с данными проспективного когортного исследования WHI, в которое были включены более 90000 женщин [29]. До начала рандомизированного контролируемого исследования около 40% женщин не принимали препараты кальция и витамина D. В этой выборке риск переломов шейки бедра при лечении препаратом кальция и витамином D снизился на 38% (ОР 0,62, 95% ДИ 0,38-1,00), а в объединенной выборке двух исследований – на 35% (ОР 0,65, 95% ДИ 0,44-0,98).
Сходные результаты были получены в другом достаточно крупном 5-летнем двойном слепом, плацебоконтролируемом исследовании, в которое были включены 1460 женщин в возрасте старше 70 лет [30]. В этом исследовании сравнивали кальция карбонат в дозе 1200 мг/сут (без витамина D) и плацебо. По крайней мере один ОПП был зарегистрирован у 16% женщин. Во всей выборке риск любых переломов снизился на 13%, однако разница между группами сравнения не достигла статистической значимости. Однако у 800 женщин, у которых приверженность к лечению была высокой, риск переломов снизился на 34% (отношение рисков 0,66; 95% ДИ 0,45-0,97).
Tang B. и соавт. в 2007 году провели мета-анализ 29 рандомизированных клинических исследований (n= 63897), в которых изучалась эффективность кальция ± витамина D у лиц в возрасте 50 лет и старше [31]. 92% пациентов составили женщины в среднем возрасте 67,8 лет. В 17 исследованиях (n=52625) оценивали влияние терапии на риск переломов, а в 23 исследованиях (n=41419) – на изменения МПКТ. В целом при лечении препаратами кальция ± витамином D риск любых переломов снизился на 12% (отношение рисков 0,88; 95% ДИ 0,83-0,95; p=0,0004), а снижение костной массы замедлилось на 0,54% в области бедренной кости и на 1,19% в области позвонков. Высокая приверженность к лечению сопровождалось более значительным снижением риска переломов (на 24%, p<0,0001). Кроме того, повышение эффективности лечения отмечалось при применении кальция в дозах 1200 мг или более и витамина D в дозах 800 МЕ и более.
В другом мета-анализе были проанализированы результаты 7 основных рандомизированных исследований, в которых изучалась эффективность витамина D и кальция или только витамина D в целом у 68517 участников пожилого возраста (средний возраст 70 лет) [32]. Около 85% из них составили женщины. Применение кальция с витамином D привело к снижению общего риска переломов на 8% (ОР 0,92, 95% ДИ 0,86-0,99, р=0,025) и риска переломов шейки бедра на 16% (ОР 0,84, 95% ДИ 0,70-1,01, р=0,07). Более выраженное снижение риска переломов последней локализации (на 26%) было отмечено в исследованиях, в которых доза витамина D составляла 10 мкг (ОР 0,74, 95% ДИ 0,600,91, р=0,005). В то же время монотерапия витамином D не оказывала влияния на частоту переломов.
Эффективность препаратов кальция в комбинации с витамином D в профилактике остеопороза была недавно подтверждена в мета-анализе Американского национального фонда остеопороза, в который были включены результаты 8 плацебо-контролируемых исследований (n=30970), опубликованных в 2011-2015 гг. [33]. Длительность наблюдения составляла от 1 до 7 лет. Дозы кальция варьировались от 500 мг/сут в одном исследовании до 1000-1200 мг/сут в оставшихся исследованиях, а доза витамина D составляла 800 МЕ/сут в 6 исследованиях и 400 или 700 МЕ/сут в двух оставшихся исследованиях. Лечение препаратами кальция и витамина D привело к достоверному снижению риска любых переломов на 15% и переломов бедренной кости на 30%.
В то же время в некоторых мета-анализах не была подтверждена польза кальция и/или витамина D в профилактике ОПП у людей пожилого возраста [34].
Таким образом, применение кальция и витамина D у людей пожилого возраста задерживало снижение МПКТ и вызывало умеренное снижение риска ОПП. Этот эффект был подтвержден не во всех исследованиях и/или мета-анализах, что не вызывает удивления, так как эффективность препаратов кальция и витамина D зависит от многих факторов, в частности адекватности их потребления с пищей и приверженности к лечению. Как указано выше, в рандомизированном контролируемом исследовании WHI более выраженное снижение частоты переломов шейки бедра было выявлено у женщин, которые до исследования не получали препараты кальция и витамина D, а во время его проведения принимали более 80% доз препаратов. Соответственно, результаты исследований в значительной степени определяются особенностями выбранной популяции. Необходимо также учитывать, что в клинические исследования, в которых изучалась эффективность препаратов кальция и витамина D в профилактике ОП, не включали мужчин, или их доля была очень небольшой. В связи с этим приведенные выше данные касаются в основном женщин постменопаузального возраста. Важность адекватного потребления кальция и витамина D с пищей и/или в виде комбинированных препаратов подчеркивается во всех последних рекомендациях по профилактике и лечению ОП [9,35,36].
По эффективности в лечении ОП препараты кальция и витамина D уступают бисфосфонатам и другим антиостеопоротическим препаратам и, соответственно, не могут служить альтернативой последним. Однако во всех плацебо-контролируемых исследованиях остеопоротических средств пациенты как основной, так и контрольной групп получали кальций или витамин D в адекватных дозах, поэтому они являются обязательным компонентом антиостеопоротической терапии.
ОП является одним из основных побочных эффектов глюкокортикостероидов (ГКС), которые широко применяют для лечения различных иммуновоспалительных заболеваний. Переломы наблюдаются более чем у 10% пациентов, получающих длительную терапию ГКС, а у 30-40% из них определяются рентгенологические признаки переломов позвонков [37,38]. Наиболее выраженное снижение МПКТ отмечается в течение первых 3-6 мес после начала лечения ГКС, однако при продолжении терапии костная масса продолжается снижаться, хотя и более медленно [39]. Риск развития стероидного ОП значительно увеличивается как при применении более высоких суточных доз ГКС, так и при повышении кумулятивной дозы ГКС, т.е. длительное лечение низкими поддерживающими дозами этих препаратов, например, у пациентов с различными ревматическими заболеваниями, такими как системная красная волчанка или системные васкулиты, также ассоциируется с высоким риском развития стероидного ОП и ОПП. Абсолютный риск переломов у пациентов, получающих ГКС, зависит также от демографических и других показателей, в том числе возраста, пола, наличия сопутствующих факторов риска ОП, таких как снижение массы тела, заболевания щитовидной железы, злоупотребление алкоголем или курение. В недавно опубликованных рекомендациях Американ ской коллегии ревматологов по профилактике и лечению стероидного ОП подчеркивается, что профилактику этого состояния необходимо проводить у всех пациентов, которые принимают ГКС в дозе ≥2,5 мг/сут (в пересчете на преднизолон) в течение по крайней мере 3 мес, а к числу основных условий эффективной профилактики и лечения стеродного ОП отнесено адекватное потребление кальция (800-100 мг/сут) и витамина D (600-800 МЕ/сут) [40].
Для компенсации недостаточного потребления кальция и витамина D с пищей могут быть использованы различные комбинированные препараты, например, Кальцемин® Адванс, в одной таблетке которого содержится 500 мг кальция и 200 МЕ витамина D3. В состав препарата входят также некоторые микроэлементы (магний, цинк, медь, марганец и бор), которые играют роль в процессах костного ремоделирования [41]. Эффекты микроэлементов на метаболизм и свойства костной ткани могут быть прямыми (влияние на пролиферацию или активность остеобластов или остеокластов) и непрямыми (участие в регуляции метаболизма минералов) или связаны с их включением в матрикс костей [42].
Например, магний, образуя кристаллы с фосфатами, принимает участие в образовании апатитов – структурной единицы минерального компонента костной ткани. Во Фрамингемском исследовании потребление магния прямо ассоциировалось с костной массой [43]. Недавно благоприятный эффект магния на состояние костной ткани был подтвержден в клинических исследованиях у здоровых молодых женщин [44,45].
Цинк служит коферментом для многих металлоферментов и участвует в регуляции активности остеобластов, синтеза коллагена и активности щелочной фосфатазы. Дефицит цинка может сопровождаться снижением всасывания кальция в кишечнике и повышением уровня паратгормона, который активирует костный обмен [46]. В одном исследовании средние сывороточные концентрации цинка у женщин с остеопорозом были значительно ниже, чем у женщин с остеопенией или здоровых женщин [47]. У пациентов с переломами дополнительный прием цинка способствовал образованию костной мозоли [48].
Медь выступает в качестве кофактора для лизилоксидазы, ответственной за образование поперечных связей (сшивок) в волокнах костного коллагена. Дефицит этого микроэлемента у детей вызывает активацию остеокластов и резорбцию костной ткани, ухудшение механической прочности костей и приводит к нарушениям формирования скелета, задержке роста, переломам [42]. Бор уменьшает экскрецию кальция с мочой и повышает уровень витамина D в крови. Опыты на животных и клинические исследования свидетельствуют о том, что этот микроэлемент может стимулировать рост костной ткани. Например, у женщин, получавших бор в дозе более 1 мг/л с питьевой водой, было выявлено повышение концентрации остеокальцина, являющегося маркером костеобразования [49].
В открытом 12-месячном контролируемом исследовании у 100 женщин в постменопаузе с остеопенией Кальцемин® Адванс замедлял резорбцию костной ткани, не вызывая гиперкальциемию и повышение экскреции кальция с мочой [50]. Антирезорбтивный эффект препарата подтверждался изменениями маркеров костной резорбции (C-телопептида коллагена 1 типа) и костеобразования (активности костной щелочной фосфатазы). В другом 52-недельном исследовании у пациенток, принимавших Кальцемин® Адванс, отме чалось как минимум сохранение исходной МПКТ в исследуемой области или ее повышение (прирост костной массы составил в среднем 3,55%), в то время как у больных группы сравнения, принимавших карбонат кальция, наблюдалось снижение МПКТ в исследуемой области в среднем на 1,02% [51].
Нежелательные эффекты кальция и витамина D
На протяжении последнего десятилетия продолжаются споры по поводу возможных нежелательных эффектов применения кальция, в частности повышения риска сердечно-сосудистых исходов [52]. Еще в 2008 году в 5-летнем рандомизированном клиническом исследовании Auckland Calcium Study было выявлено увеличение риска инфаркта миокарда у пожилых женщин, получавших препарат кальция, по сравнению с таковым в группе плацебо [53]. Сходные данные были получены в нескольких мета-анализах. Например, M. Bolland и соавт. при анализе рандомизированных контролируемых исследований препаратов кальция показали, что применение кальция и витамина D ассоциировалось с увеличением риска инфаркта миокарда на 25% и суммарного риска инфаркта миокарда и инсульта на 15% [54]. Увеличение риска сердечно-сосудистых исходов при лечении препаратами кальция было отмечено также в когортных исследованиях, проводившихся в Швеции и Финляндии [55,56]. В основе неблагоприятного эффекта кальция на сердечно-сосудистую систему может лежать преходящая гиперкальциемия, способствующая развитию кальциноза сосудов.
Однако увеличение риска сердечно-сосудистых исходов под действием кальция не было подтверждено в других крупных исследованиях и мета-анализах. Например, в исследовании WHI не было отмечено увеличения риска инфаркта миокарда, коронарной болезни сердца, инсульта или любых сердечно-сосудистых исходов у женщин, получавших кальций и витамин D, как во всей выборке, так и в выборке пациенток, которые не получали подобные препараты до исследования [29]. Следует отметить, что в этом исследовании лечение препаратом кальция и витамином D ассоциировалось с увеличением риска образования камней в почках, хотя частота нефролитиаза в основной и контрольной группах составила всего 0,35% и 0,30%, соответственно. Неблагоприятный эффект кальция на риск сердечно-сосудистых осложнений не был установлен и в мета-анализе, проводившемся под эгидой Амери кан ского национального фонда остеопороза [57]. На основании полученных данных Национальный фонд остеопороза и Американское общество профилактической кардиологии опубликовали совместное заявление, в котором указано, что применение кальция ± витамина D с пищей или в виде пищевых добавок не сопровождается увеличением риска сердечно-сосудистых или цереброваскулярных осложнений и смерти от любых причин у здоровых взрослых людей, а потребление кальция в дозе не более 2000-2500 мг/сут можно считать безопасным для сердечно-сосудистой системы [58].
Заключение
Адекватное потребление кальция и витамина D с пищей или в виде пищевых добавок является основой профилактики ОП. В клинических исследованиях длительное применение препаратов кальция и витамина D у женщин постменопаузального возраста задерживало снижение МПКТ и вызывало снижение риска переломов. Последний эффект был более выраженным при высокой приверженности к лечению. Препараты кальция и витамина D не могут служить альтернативой бисфосфонатам и другим антиостеопоротическим средствам у пациентов с ОП, однако лечение ОП необходимо проводить на фоне адекватного потребления кальция с пищей или в виде пищевых добавок. ОП часто осложняет лечение ГКС, которые по-прежнему широко используют для лечения различных иммуновоспалительных заболеваний. Снижение МПКТ наблюдается даже при относительно непродолжительном применении этих препаратов в небольших дозах. В связи с этим все больные, получающие ГКС в дозе ≥2,5 мг/сут в пересчете на преднизолон в течение по крайней мере 3 мес, нуждаются в адекватном потреблении кальция и витамина D c целью профилактики стероидного ОП. Результаты клинических исследований и мета-анализов не позволяют сделать вывод о том, что применение кальция ассоциируется с увеличением риска сердечно-сосудистых исходов у здоровых людей.
Используемые источники
- Hernlund E, Svedbom A, Ivergord M, et al. Osteoporosis in the European Union: medical management, epidemiology and economic burden. A report prepared in collaboration with the International Osteoporosis Foundation (IOF) and the European Federation of Pharmaceutical Industry Associations (EFPIA). Arch Osteoporosis 2013;8:136.
- Wright NC, Looker A, Saag K, et al. The recent prevalence of osteoporosis and low bone mass based on bone mineral density at the femoral neck or lumbar spine in the United States. J Bone Miner Res 2014;29(11):2520-6.
- Михайлов Е.Е., Беневоленская Л.И. Эпидемиология остеопороза и переломов. Руководство по остеопорозу. М.: Бином. Лаборатория знаний, 2003: 10–53 [Mihajlov EE, Benevolenskaya LI. Epidemiology of osteroporosis and fractures. In: Handbook for osteoporosis. Moscow, 200:10–53 (In Russ.)].
- Добровольская О.В., Торопцова Н.В., Лесняк О.М. Экономические аспекты осложненного остеопороза: стоимость лечения в течение первого года после перелома. Современная ревматология 2016;10(3):29–34 [Dobrovolskaya OV, Toroptsova NV, Lesnyak OM. Economic aspects of complicated osteoporosis: The cost of treatment in the first year after fracture. Sovremennaya Revma tologiya = Modern Rheumatology Journal 2016;10(3):29–34 (In Russ.)].
- Balk EM, Adam GP, Langberg VN, et al. Global dietary calcium intake among adults: a systematic review. Osteoporos Int 2017;28:3315–24.
- Cosman F, de Beur SJ, LeBoff MS, et al. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int 2014;25:2359–81.
- Оглоблин Н.А., Спиричев В.Б., Батурин А.К. О потреблении населением Рос сии кальция с пищей. Вопросы питания 2005;5:14–7 [Ogloblin NA, Spirichev VB, Baturin AK. Dietary intake of calcium in Russia. Voprosy pitaniya 2005;5:14–7 (In Russ)].
- Никитинская О.А., Торопцова Н.В. Социальная программа “Остео скри нинг. Россия” в действии. Фарматека 2012;6:90–3 [Nikitinskaya OA, Torop cova NV. Social program “Osteoscrining in Russia”. Farmateka 2012;6:90–3 (In Russ.)].
- Профилактика, диагностика и лечение дефицита витамина D и кальция среди взрослого населения и у пациентов с остеопорозом: рекомендации Российской ассоциации по остеопорозу. Под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа, 2016, 96 с.
- Hilger J, Friedel A, Herr R, et al. A systematic review of vitamin D status in populations worldwide. Br J Nutr 2014;111(1):23-45.
- Caccamo D, Ricca S, Curri M, Ientile R. Health risks of hypovitaminosis D: A review of new molecular insights. Int J Mol Sci 2018;19:892.
- Joo NS, Dawson-Hughes B, Kim YS, et al. Impact of calcium and vitamin D insufficiencies on serum parathyroid hormone and bone mineral density: analysis of the fourth and fifth Korea National Health and Nutrition Examination Survey (KNHANES IV-3, 2009 and KNHANES V-1, 2010). J Bone Miner Res 2013; 28(4):764-70.
- Wu J, Xu L, Lv Y, et al. Quantitative analysis of efficacy and associated factors of calcium intake on bone mineral density in postmenopausal women. Osteoporos Int 2017;28(6):2003-10.
- Karlamangla AS, Burnett-Bowie S-A, Crandall CJ. Bone health during the menopause transition and beyond. Obstet Gynecol Clin N Amer 2018;45(4):695–708.
- Greendale GA, Sowers M, Han W, et al. Bone mineral density loss in relation to the final menstrual period in a multiethnic cohort: results from the Study of Women's Health Across the Nation (SWAN). J Bone Miner Res 2012;27:111-8.
- Tai V, Leung W, Grey A, et al. Calcium intake and bone mineral density: systematic review and meta-analysis. BMJ 2015;351:h4183.
- Reid IR, Bolland MJ, Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. Lancet 2014;383:146-55.
- Bolland MJ, Grey A, Avenell A. Effects of vitamin D supplementation on musculoskeletal health: a systematic review, meta-analysis, and trial sequential analysis. Lancet Diabetes Endocrinol 2018;6(11):847-58.
- Snijder MB, Van Schoor NM, Pluijm SM, et al. Vitamin D status in relation to one-year risk of recurrent falling in older men and women. J Clin Endocrinol Metab 2006;91(8):2980–5.
- Flicker L, Mead K, MacInnis RJ, et al. Serum vitamin D and falls in older women in residential care in Australia. J Am Geriatr Soc 2003;51(11):1533–8.
- Stockton KA, Mengersen K, Paratz JD, et al. Effect of vitamin D supplementation on muscle strength: a systematic review and meta-analysis. Osteoporos Int 2011;22(3):859-71.
- Beaudart C, Buckinx F, Rabenda V, et al. The effects of vitamin D on skeletal muscle strength, muscle mass, and muscle power: a systematic review and metaanalysis of randomized controlled trials. J Clin Endocrinol Metab 2014;99(11): 4336-45.
- Michael YL, Whitlock EP, Lin JS, et al. Primary care-relevant interventions to prevent falling in older adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2010;153(12):815-25.
- Murad MH, Elamin KB, Abu Elnour NO, et al. The effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab 2011;96(10): 2997–3006.
- Bolland MJ, Grey A, Gamble GD, et al. Vitamin D supplementation and falls: a trial sequential meta-analysis. Lancet Diabetes Endocrinol 2014;2(7):573–80.
- Bolland MJ, Grey A, Avenell A. Effects of vitamin D supplementation on musculoskeletal health: a systematic review, meta-analysis, and trial sequential analysis. Lancet Diabetes Endocrinol 2018;6(11):48-58.
- Dhaliwal R, Aloia JF. Effect of vitamin D on falls and physical performance. Endocrinol Metab Clin N Am 2017;46:919–33.
- Jackson RD, Lacroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006;354:669–83.
- Prentice RL, Pettinger MB, Jackson RD, et al. Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study. Osteoporos Int 2013;24(2):567-80.
- Prince RL, Devine A, Dhaliwal SS, Dick IM. Effects of calcium supplementation on clinical fracture and bone structure: results of a 5-year, double-blind, placebocontrolled trial in elderly women. Arch Intern Med 2006;166(8):869-75.
- Tang BM, Eslick GD, Nowson C, et al. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet 2007;370(9588):657-66.
- DIPART (Vitamin D Individual Patient Analysis of Randomized Trials) Group. Patient level pooled analysis of 68 500 patients from seven major vitamin D fracture trials in US and Europe. BMJ 2010;340:b5463.
- Weaver CM, Alexander DD, Boushey СJ, et al. Calcium plus vitamin D supplementation and risk of fractures: an updated meta-analysis from the National Osteoporosis Foundation. Osteoporos Int 2016;27(1):367-76.
- Zhao JG, Zeng XT, Wang J, Liu L. Association between calcium or vitamin D supplementation and fracture incidence in community-dwelling older adults: A systematic review and meta-analysis. JAMA 2017;318(24):2466-82.
- Cosman F, de Beur JS, LeBoff MS, et al. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int 2014;25:2359–81.
- Kanis JA, Cooper C, Rizzoli R, et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2019; 30(1):3-44.
- Curtis J,Westfall AO, Allison J, et al. Population-based assessment of adverse events associated with long-term glucocorticoid use. Arthritis Rheum 2006;55: 420–6.
- Angeli A, Guglielmi G, Dovio A, et al. High prevalence of asymptomatic vertebral fractures in post-menopausal women receiving chronic glucocorticoid therapy: a cross-sectional outpatient study. Bone 2006;39:253–9.
- Laan RF, van Riel PL, van de Putte LB, et al. Low-dose prednisone induces rapid reversible axial bone loss in patients with rheumatoid arthritis: a randomized, controlled study. Ann Intern Med 1993;119:963–8.
- Buckley L, Guyatt G, Fink HA, et al. 2017 American College of Rheumatology Guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol 2017;69(8):1521-37.
- Pepa GD, Brandi ML. Microelements for bone boost: the last but not the least. Clin Cases Miner Bone Metab 2016;13(3):181-5.
- Gaffney-Stomberg E. The impact of trace minerals on bone metabolism. Biol Trace Elem Res 2019;188(1):26-34.
- Tucker KL, Hannan MT, Chen H, et al. Potassium, magnesium, and fruit and vegetable intakes are associated with greater bone mineral density in elderly men and women. Am J Clin Nutr 1999;69:727-36.
- Kim MH, Yeon JY, Choi MK, Bae YJ. Evaluation of magnesium intake and its relation with bone quality in healthy young women. Biol Trace Elem Res 2011; 144:109-17.
- Carpenter TO, DeLucia MC, Zhang JH, et al. A randomized controlled study of effects of dietary magnesium oxide supplementation on bone mineral content in healthy girls. J Clin Endocrinol Metab. 2006;91:4866-72.
- Suzuki T, Kajita Y, Katsumata S, Matsuzaki H, Suzuki K. Zinc deficiency increases serum concentrations of parathyroid hormone through a decrease in serum calcium and induces bone fragility in rats. J Nutr Sci Vitaminol (Tokyo) 2015;61(5):382–90
- Mutlu M, Argun M, Kilic E, et al. Magnesium, zinc and copper status in osteoporotic, osteopenic and normal post-menopausal women. J Intern Med Res 2007; 35:692-5.
- Sadighi A, Mahdavi-Roshan M, Sadeghzadeh M, et al. The effects of zinc supplementation on serum zinc, alkaline phosphatase activity and fracture healing of bones. Saudi Medical Journal 2008;29:1276-9.
- Boyacioglu O, Orenay-Boyacioglu S, Yildirim H, Korkmaz M. Boron intake, osteocalcin polymorphism and serum level in postmenopausal osteoporosis. J Trace Elem Med Biol 2018; 48:52-6.
- Никитинская О.А., Торопцова Н.В., Беневоленская Л.И. Фармакологичес кая профилактика первичного остеопороза. РМЖ 2008;16(6):409–13. [Niki tin skaia OA, Toroptsova NV, Benevolenskaia LI. Drug prevention of primary osteoporosis. RMZh 2008;16(6):409–13 (In Russ.)].
- Лила А.М., Мазуров В.И. Роль Кальцемина Адванс в профилактике постменопаузального остеопороза (результаты 12-месячного клинического исследования). РМЖ 2007;15(26):1991–7 [Lila AM, Mazurov VI. Calcemin Advance in the prevention of postmenopausal osteoporossis in 12-month clinical trial. RMZh 2007;15(26):1991–7 (In Russ.)].
- Chiodini I, Bolland MJ. Calcium supplementation in osteoporosis: useful or harmful? Eur J Endocrinol 2018;178(4):D13-25.
- Bolland MJ, Barber PA, Doughty RN, et al. Vascular events in healthy older women receiving calcium supplementation: randomised controlled trial. BMJ 2008336(7638):262-6.
- Bolland MJ, Grey A, Avenell A, et al. Calcium supplements with or without vita- min D and risk of cardiovascular events: reanalysis of the Women's Health Initiative limited access dataset and meta-analysis. BMJ 2011;342:d2040.
- Michaelsson K, Melhus H, Warensj Lemming E, et al. Long term calcium intake and rates of all cause and cardiovascular mortality: community based prospective longitudinal cohort study, BMJ 2013;346:228.
- Pentti K, Tuppurainen MT, Honkanen R, et al. Use of calcium supplements and the risk of coronary heart disease in 52–62-year-old women: The Kuopio Osteoporosis Risk Factor and Prevention Study. Maturitas 2009;63:73-8.
- Chung M, Tang AM, Fu Z, et al. Calcium intake and cardiovascular disease risk: an updated systematic review and meta-analysis, Ann Intern Med 2016;165: 856–66.
- Kopecky SL, Bauer DC, Gulati M, et al. Lack of evidence linking calcium with or without vitamin D supplementation to cardiovascular disease in generally healthy adults: A clinical guideline from the National Osteoporosis Foundation and the American Society for Preventive Cardiology. Ann Intern Med 2016;165:867-8.
