Современные представления о нейрофизиологических механизмах и клинических проявлениях статодинамических расстройств, возможностях их коррекции
Поддержание равновесия тела в пространстве обеспечивается функциональной полноценностью вестибулярной, зрительной, проприоцептивной систем и опорно-двигательного аппарата при общем контроле структурами центральной нервной системы (ЦНС), которые объединены понятием “система обеспечения статодинамического контроля” (СОСДК). Вклад каждого из вышеуказанных компонентов этой системы “ощущается” при патологических состояниях, а также в процессе старения организма: их дисфункция ведет к снижению эффективности статодинамического контроля. Основными функциями СОСДК являются поддержание постуральной ориентации и постурального равновесия. Под первой подразумевается способность организма поддерживать правильное положение сегментов тела по отношению к вектору гравитации, визуальным и слуховым стимулам (т.е. внешней информации), а также по отношению друг к другу за счет проприоцептивных стимулов (т.е. внутренней информации). Вторая включает способность головного мозга сохранять равновесие в момент воздействия различных дестабилизирующих сил: при этом человек может находиться в состоянии покоя (статическое равновесие) или в процессе контролируемого движения (динамическое равновесие). Важнейшим направлением патогенетической терапии пациентов со статодинамическими нарушениями является стимуляция нейропластичности, позволяющая изменить функционирование нейронального матрикса СОСДК, создавая, таким образом, основу для эффективного саногенеза и компенсации нарушенных функций.
Вклинической неврологии статодинамические нарушения традиционно ассоциируются с жалобой пациентов на чувство "головокружения", под которым больные подразумевают самые различные ощущения: чувство падения, вращения собственного тела в пространстве, дурноту, нечеткость зрения, нарушение концентрации внимания, шаткость походки и пр. На основании характера субъективных "переживаний" пациентами данных ощущений выделяют несколько типов головокружения [1]:
1. Системное (истинное вращательное головокружение, вертиго) – ощущение векторного перемещения самого пациента или окружающей обстановки, сопровождающееся нарушением равновесия, страхом, желанием крепко держаться за опору, тошнотой, рвотой, лабильностью АД. Больные часто описывают такое состояние словами: "как после карусели". Системное головокружение считается периферическим, связанным с поражением вестибулярного аппарата.
2. Несистемное головокружение охватывает другие варианты субъективных ощущений:
липотимия – состояние "потери сознания", часто с сопутствующим сердцебиением, потемнением в глазах (в данном случае необходимо исключать патологию сердечнососудистой системы);
неустойчивость – нарушение равновесия с пошатыванием в положении стоя, при ходьбе. Считается, что в основе развития данного клинического феномена лежат органическая патология ЦНС, дисметаболи ческие нарушения или токсическое воздействие. Терминологически такие варианты нарушения статодинамической функции описывают как "атаксия" и "постуральная неустойчивость";
неопределенные ощущения – "туман" в голове, "легкое опьянение", нечеткость восприятия окружающего мира, потеря ориентации в пространстве. Полагают, что этот тип головокружения возникает при астеноневротическом синдроме, тревожном рас стройстве или общем ухудшении состояния здоровья в рамках какого-либо заболевания, воздействующего на весь организм (например, злокачественное новообразование) [2].
Необходимо отметить, что нарушение равновесия считается одним из наиболее частых симптомов, встречающихся в медицинской практике [3]. При этом жалобы на головокружение и неустойчивость встречаются у 5-10% больных, обратившихся к врачу общей практики и у 10-20% пациентов, посещающих невролога [4]. По данным эпидемиологических исследований, головокружение и неустойчивость хотя бы раз в жизни испытывают 20-30% респондентов, а ежегодно данные жалобы беспокоят 4,9% людей [5]. Нередко расстройства равновесия приводят к значительному ухудшению качества жизни больного, социальной дезадаптации, стойкой утрате трудоспособности [6].
Частота статодинамических нарушений увеличивается с возрастом. Кроме того, существует гендерная предрасположенность к нарушениям равновесия – женщин головокружение беспокоит в 2,7 раза чаще, чем мужчин [5]. Если спроецировать эти данные на население Российской Федерации, то получается, что головокружение и ассоциированное с ним нарушение статодинамического контроля могут наблюдаться более чем у 7 млн человек [2].
Поддержание вертикального положения тела является сложнейшей задачей, особенно если принять во внимание многосуставное устройство костного скелета и большое количество возможных поз, которые может принять человеческий организм, а также способность людей находить нужную позу из самых различных исходных положений и сохранять ее при действии переменных внешних сил [7].
Ранее существовавшее представление о наличии изолированной системы статодинамического контроля, функционирующей на основе ряда рефлексов, в настоящее время признано некорректным [8,9]. Полагают, что поддержание равновесия является сложным моторным навыком, не имеющим какого-либо локализованного центра в головном мозге и реализуемым при взаимодействии множества сенсомоторных процессов [10,11]. В целом статодинамический контроль может быть определен как способность управлять общим центром массы (ОЦМ) тела в пределах базы поддержки его опоры c целью предотвращения падения или потери равновесия в статическом и динамическом положениях. Двумя основными функциями системы статодинамического контроля являются поддержание постуральной ориентации и постурального равновесия [12]. Под постуральной ориентацией подразумевают способность организма активно поддерживать правильное положение сегментов тела по отношению к вектору гравитации, визуальным и слуховым стимулам (т.е. внешней информации), а также по отношению друг к другу за счет проприоцептивных стимулов (т.е. внутренней информации) [12]. "Постуральное равновесие" – способность головного мозга сохранять равновесие в момент воздействия различных дестабилизирующих сил: при этом человек может находиться в состоянии покоя (статическое равновесие) или в процессе контролируемого движения (динамическое равновесие) [13].
В СОСДК можно выделить несколько функциональных подсистем, представленных на рис. 1 [12]. Дис фун к ция в одной или нескольких из этих подсистем приводит к нарушению равновесия, которое пациенты описывают термином "головокружение" и/или "неус той чивость".
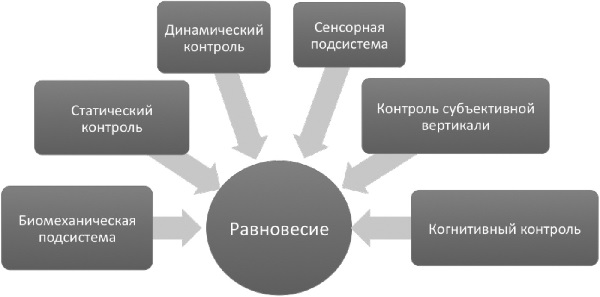
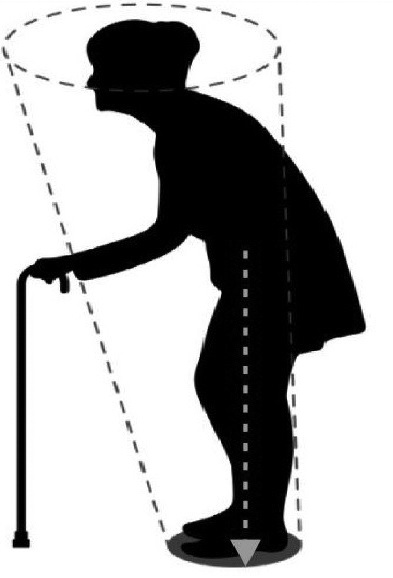
Биомеханическая подсистема. Одним из наиболее важных биомеханических факторов, определяющих успешность сохранения равновесия, является возможность управлять ОЦМ по отношению к опоре, т.е. ступням. Уменьшение площади опоры, боль в области ступней, снижение силы мышц дистальных отделов нижних конечностей и пр. неминуемо приводят к нарушению равновесия [14]. Согласно исследованиям G. McCollum и соавт. (1989), С. Crutchfield и соавт. (1989), границы сохранения равновесия (т.е. пространство в пределах которого, человек может смещать ОЦМ без изменения площади опоры) выглядят как конус (рис. 2) [13,15]. Эти же авторы предположили существование в головном мозге внутреннего представления о границах этого конуса, внутри которого можно смещать ОЦМ без потери равновесия. В. Erdeniz (2019) высказал мнение, что при ряде нейродегенеративных заболеваний с поражением базальных ганглиев развитие постуральной неустойчивости как раз связано с изменением внутреннего представления о границах конуса сохранения равновесия [16].
Подсистема статического контроля. Существуют 3 двигательные стратегии, направленные на сохранение равновесия тела в положении стоя: голеностопная, бедренная и стратегия дополнительного шага (с касанием или без касания окружающих предметов). Голено стопная стратегия используется в условиях незначительного дисбаланса при нахождении человека на устойчивой поверхности и помогает восстановить ОЦМ за счет движений в голеностопных суставах [17]. Эффективность применения голеностопной стратегии напрямую зависит от проприоцепции [18]. Тазобед ренная стратегия – это использование компенсаторного движения в тазобедренных суставах для достижения равновесия тела при стоянии на узкой или неустойчивой опоре, когда нет возможности эффективно применить голеностопную стратегию, а также при необходимости резкого смещения ОЦМ [19]. Другой "позной" стратегией сохранения равновесия является использование дополнительного шага, в особенности при ходьбе. При воздействии внешних факторов головному мозгу требуется около 100 мс для принятия решения о выборе той или иной стратегии сохранения равновесия [20]. Использование позитронно-эмиссионной томографии (ПЭТ) и функциональной спектроскопии в ближнем инфракрасном свете (фБИКС) позволило установить, что ответственными за поддержание равновесия в положении стоя являются нейрональные центры, расположенные в черве мозжечка, зрительных зонах коры, префронтальной и дорсолатеральной префронтальной коре [21,22].
Следует отметить, что указанные выше двигательные стратегии являются реактивными, т.е. реализуемыми после воздействия на организм дестабилизирующего фактора [23]. Существует и проактивная стратегия, направленная на предупреждения потери равновесия до воздействия дестабилизирующего фактора [24], например, изменение расположения ОЦМ у людей, находящихся в автобусе и ожидающих замедления скорости его движения перед остановкой. Использование проактивной стратегии сохранения равновесия требует участия корковых и подкорковых нейрональных центров головного мозга для планирования и реализации адекватного двигательного ответа для предотвращения избыточного смещения ОЦМ [25].
Подсистема динамического контроля. Поддержание устойчивости тела в движении (при ходьбе, беге) значительно отличается от такового в покое, хотя бы потому, что при движении человека ОЦМ не находится в пределах границ конуса равновесия [18]. Для сохранения баланса при движении вперед (в сагиттальной плоскости) используется стратегия заведения руки под падающий ОЦМ во время отмашки рук. В то же время для поддержания равновесия тела во фронтальной плоскости необходим сочетанный контроль над смещением тела в бок и постановкой ступней [26]. В настоящее время представляется сложным точно определить все участки головного мозга, отвечающие за функционирование подсистемы динамического контроля. Т. Bhatt и соавт. (2018) анализировали данные функциональной магнитно-резонансной томографии головного мозга у здоровых добровольцев, которые представляли себе в уме акт ходьбы по велодорожке, а также поскальзывания и падения на ней [27]. Было показано, что по сравнению с состоянием покоя при возникновении ментального образа движения (ходьбы) в головном мозге происходит активация нейронов в левой дополнительной моторной зоне коры (BA32), которые участвуют в планировании последовательностей движения. В то же время при воображении момента подскальзывания и падения отмечалось значительное повышение активности целого ряда корковых и подкорковых структур, в том числе левой дополнительной моторной зоны коры (BA6), левой верхней лобной извилины, покрышечной части справа (BA45), левой нижней теменной дольки (BA40), правой парагиппокампальной извилины, левой извилистой извилины, а также задней части мозжечка с двух сторон.
Сенсорная подсистема. Статодинамический контроль осуществляется с использованием афферентной информации от зрительной, слуховой, проприоцептивной и вестибулярной систем. При этом в каждый момент времени в головном мозге происходит оценка значимости поступающих сенсорных стимулов с выбором приоритетных сигналов для формирования адекватной стратегии сохранения равновесия [28]. Н. Karim и соавт. (2013) [29] с помощью фБИКС выявили двустороннюю активацию височно-теменных областей коры головного мозга у испытуемых, которым предлагалось сохранять устойчивость в положении стоя при закрытии глаз и нахождении на качающейся платформе. В положении стоя в хорошо освещенном помещении при наличии твердой ровной опоры под ногами головной мозг для обеспечения статодинамического контроля использует поступающую сенсорную информацию в следующей пропорции: проприоцепция – 70%, зрение – 10%, вестибулярные стимулы – 20% [30]. Однако, как только человек наступает на неровную поверхность, происходит смещение значимости афферентной информации в сторону вестибулярных и зрительных стимулов – феномен "переоценки" (re-weight). При ряде нейродегенеративных заболеваний, например, болезни Альцгеймера, наблюдается снижение скорости "переоценки" афферентной информации в случае такой необходимости, что клинически проявляется постуральной неустойчивостью [19]. Сенсорная информация, участвующая в статодинамическом контроле, частично избыточна [31], что необходимо для компенсации функционального дефекта, возникающего при поражении других сенсорных систем.
Подсистема контроля субъективной вертикали. В нор ме головной мозг за счет работы отолитового аппарата постоянно получает информацию о направлении вектора силы притяжения, что позволяет правильно ориентировать части тела относительно гравитации. При этом здоровые люди в темноте способны выставить тонкую светящуюся линию в вертикаль, параллельную силе притяжения (оценка субъективной зрительной вертикали), с точностью до 0,5° [32]. Ощущение субъективной вертикали имеет множество нейрональных представительств в головном мозге, что отражает сложность его возникновения [33]. Кроме того, ощущение субъективной зрительной вертикали не зависит от ощущения субъективной проприоцептивной вертикали, необходимого для поддержания равновесия при отсутствии зрительного конт роля [34]. В клинической практике наблюдается изолированное смещение субъективной зрительной вертикали при одностороннем угнетении функции вестибулярного аппарата вследствие, например, вестибулярного нейронита. В то же время изолированное нарушение ощущения субъективной проприоцептивной вертикали возникает у пациентов с односторонним пространственным игнорированием после инсульта [35].
Подсистема когнитивного контроля. Сохранение равновесия тела является сложным когнитивным процессом. Даже нахождение в положении стоя требует определенного усиления внимания, что проявляется увеличением времени реакции на внешние стимулы у стоящих людей по сравнению с людьми, которые сидят в удобном положении [36]. Кроме того, поддержание равновесия значительно ухудшается при дополнительной когнитивной нагрузке [37]. В работе Н. Fujita и соавт. (2016) [38] испытуемым предлагалось попеременно стоять на одной и двух ногах, выполняя тест Струпа (словесно-цветовой интерференции). С помощью фБИКС исследователи установили, что при стоянии на одной ноге происходила дополнительная активация дорсолательного участка префронтальной коры справа, а эффективность выполнения теста достоверно снизилась по сравнению с результатами, полученными в условиях устойчивого равновесия.
Подводя итог вышесказанному, можно суммировать, что поддержание равновесия тела в пространстве обеспечивается функциональной активностью вестибулярной, зрительной, проприоцептивной систем и опорно-двигательного аппарата при общем контроле структурами ЦНС, которые объединены понятием СОСДК. Роль каждой из этих систем более четко проявляется при ряде патологических состояний и при старении, когда дисфункция того или иного компонента ведет к снижению эффективности статодинамического контроля.
Терапия нарушения равновесия является крайне сложной задачей в виду большого количества неоднородных по патогенезу заболеваний, проявляющихся потерей статодинамического контроля. Из фармако логических средств в настоящее время используют: вестибулярные супрессанты (антихолинергические, антигистаминные препараты и бензодиазепины), глюкокортикостероиды (вестибулярный нейронит, болезнь Меньера), антидепрессанты (персистирующее постуральное-перцептуальное головокружение, вестибулярная мигрень), β-адреноблокаторы и антиконвульсанты (вестибулярная мигрень), диуретик ацетазоламид (болезнь Меньера, эпизодическая атаксия 2 типа), 4аминопиридин (спинноцеребеллярная атаксия), миорелаксант баклофен (синдром нистагма, бьющего вниз), пирибедил (постуральная неустойчивость) и т.д.
Одним из важнейших направлений патогенетической терапии пациентов со статодинамическими нарушениями является стимуляция нейропластичности, которая позволяет модулировать функционирование нейросетей, ответственных за поддержание равновесия тела, создавая тем самым основу для эффективного саногенеза и компенсации нарушенных функций. Такой подход в особенности оправдан в лечении пациентов с цереброваскулярной патологией (дисциркуляторной энцефалопатией и последствиями перенесенных острых нарушений мозгового кровообращения), нейроде ге неративными заболеваниями, персистирующим постурально-перцептуальным головокружением, вестибулярным нейронитом и рядом других заболеваний.
Среди немедикаментозных способов активации нейропластичности большое значение имеет выполнение упражнений вестибулярной гимнастики, которые обеспечивают компенсацию статодинамических нарушений на основе трех принципов: адаптации (ремоделирование нейрональных связей), замещения (усиление роли "здоровых" сенсорных сигналов в сохранении контроля равновесия) и привыкания (увеличение порога для сенсорных раздражителей). Анализ результатов выполнения данных упражнений демонстрирует их высокую эффективность у пациентов с хроническим головокружением. В особенности это касается способности к самообслуживанию и улучшения качества жизни. При этом наиболее эффективна индивидуальная программа вестибулярной гимнастики (реабилитации) на основе комплексного обследования.
Из фармакологических агентов, способных индуцировать нейропластические процессы в головном мозге, следует выделить винпоцетин (Кавинтон®). Дей ствую щим веществом Кавинтона® является этиловый эфир аповинкаминовой кислоты. В основе клинического эффекта препарата лежит ингибирование фосфодиэстеразы (Са/кальмодулинзависимой 1-го типа) и потенциалзависимых Na+-каналов, что позволяет ему непосредственно действовать на глутаматные рецепторы, ингибировать перекисное окисление липидов, вызывать вазодилатацию, тормозить агрегацию тромбоцитов и увеличивать деформируемость эритроцитов Винпоцетин оказывает нормализующее действие на артерии головного мозга как с повышенным, так и пониженным тонусом, восстанавливая способность к ауторегуляции церебрального кровообращения и предотвращая развитие вазоконстрикторных реакций. Кроме того, Кавинтон препятствует нейрональной гибели в области гиппокампа, стимулирует норадренергическую систему восходящей ретикулярной формации [40] и оказывает модулирующее влияние на нейропластичность (увеличивает рост дендритных шипиков) [41].
В открытом клиническом исследовании мы оценивали эффективность Кавинтона® Комфорте (новой диспергируемой формы) в сочетании с упражнениями вестибулярной гимнастики в лечении хронического головокружения у пациентов с дисциркуляторной энцефалопатией [42]. В группе пациентов, получавших Кавинтон® Комфорте в составе комплексной терапии, через 3 месяца отмечались статистически значимые позитивные изменения всех исследуемых параметров – длительности и выраженности головокружения (ВАШГ), расширение двигательной активности пациентов в течение дня (Шкала оценки влияния головокружения на повседневную активность – Dizziness Handicap Inventory [DHI]), повышение приверженности к лечению (Drug Attitude Inventory [DAI]). Важно, что уровень нейротрофического фактора мозга (BDNF) в плазме крови у пациентов этой группы повысился практически в 3 раза по сравнению с исходным значением. Этот факт свидетельствует о том, что в основе терапевтической эффективности препарата лежит модуляция нейропластичности головного мозга.
В 2019 году мы изучили эффективность длительного применения Кавинтона® Комфорте в лечении головокружения у пациентов с дисциркуляторной энцефалопатией (исследование ЭДЕЛЬВЕЙС) [43]. Наиболее значимыми предикторами развития статодинамических нарушений у данной категории пациентов были возраст старше 70 лет, общий балл когнитивных функций по монреальской шкале ≤25 (Montreal Cognitive Assess ment, МоСА) и низкий уровень BDNF в крови (<10пг/мл). Эти результаты свидетельствуют о том, что возраст сам по себе не является единственным фактором, определяющим развитие постуральной неустойчивости и ощущения головокружения у пациентов с дисциркуляторной энцефалопатией, это отмечают и другие исследователи [44]. Через 2 мес терапии в группе пациентов, получавших Кавинтон® Комфорте, мы наблюдали значимое снижение интенсивности головокружения (по ВАШ-Г) и его влияния на повседневную активность (по шкале DHI) по сравнению с исходными параметрами, а через 3 мес – по сравнению с группой контроля. Тенденция к еще более выраженному субъективному улучшению состояния пациентов сохранялась на протяжении 5 мес терапии (максимальный клинический эффект), а затем инвертировалась. Тем не менее, даже через 2 мес после завершения 6-месячного курса приема винпоцетина у пациентов основной группы отмечалось значимо менее выраженное ощущение головокружения и уменьшение его влияния на повседневную активность по сравнению с исходным уровнем и соответствующими показателями в группе контроля. Важно отметить, что динамика улучшения состояния у пациентов с дисциркуляторной энцефалопатией по данным шкалы DHI значимо коррелировала (коэффициент корреляции Пирсона >0,5) с увеличением экспрессии BDNF в плазме крови на протяжении всего наблюдения, что свидетельствует о наличии четкой связи между субъективным улучшением состояния и активизацией нейропластических процессов в головном мозге. Помимо субъективного изменения состояния пациентов, по данным видеонистагмографии через 3 мес терапии выявлено объективное улучшение показателей теста плавного слежения и теста исследования саккад по сравнению с исходными значениями и соответствующими результатами у больных контрольной группы. Такая же закономерность отмечена при оценке обоих тестов и через 6 мес исследования, а для теста исследования саккад – даже через 2 мес после отмены винпоцетина (по завершению 8-го месяца наблюдения).
Таким образом, клинические проявления функциональной неполноценности СОСДК разнообразны, что связано со сложностью ее организации. Тем не менее, базисные патогенетические звенья возникновения постуральных нарушений по большей части поддаются количественной оценке в клинических условиях, что позволяет осуществлять системный анализ, с помощью которого возможен переход от неспецифических (симптоматических) методов лечения больных (например, вестибулярной супрессии), зачастую по-прежнему основанных на эмпирических наблюдениях, к специфическим, в основе которых лежит адресное терапевтическое воздействие на ключевые механизмы развития различных заболеваний, проявляющихся статодинамическим нарушениям. В связи с этим необходимы дальнейшие исследования, направленные на выявление ключевых патофизиологических механизмов, отве чающих за развитие различных клинических форм нарушений равновесия (включая математическое моделирование статодинамических нарушений у человека с использованием экспериментальных данных), что позволит эффективно применить фундаментальные знания об основных биологических механизмах локомоции в клинической практике.
Используемые источники
- Bisdorff A, Brevern M, Lempert T, Newman-Toker D. Classification of vestibular symptoms: Towards an international classification of vestibular disorders. J Vestibul Res 2009;19:1-13
- Замерград МВ. Возрастные аспекты диагностики и лечения головокружения. Автореф. дис. докт. мед. наук. Москва; 2015. 48 с
- Agus S, Benecke H, Thum C, Strupp M. Clinical and demographic features of vertigo: Findings from the REVERT Registry. Front Neurol 2013;4:48-55
- Brandt T. Vertigo its multicensory syndromes. Springer, 2000, 503.
- Neuhauser HK, Lempert T. Vertigo: epidemiologic aspects. Semin Neurol 2009; 29(5):473-81.
- World Health Organization, 2016. Falls. http://wwww.who.int/mediacentre/ factsheets/fs344.
- Balestrucci P, Daprati E, Lacquaniti F, et al. Effects of visual motion consistent or inconsistent with gravity on postural sway. Exp Brain Res 2017;235:1999-2010.
- Magnus R. Körperstellung. Berlin, Heidelberg: Springer, 1924.
- Roberts TDM. Neurophysiology of postural mechanisms. 2nd Edn. London, Boston: Butterworth-Heinemann Ltd, 1978.
- Neptune R, Vistamehr A. Dynamic balance during human movement: measurement and control mechanisms. J Biomech Eng 2018 {Epub ahead of print]. doi: 10.1115/1.4042170
- Peterka J, Murchison F, Parrington C, et al. Implementation of a central sensorimotor integration test for characterization of human balance control during stance. Front Neurol 2018;9:10.
- Horak F. Postural orientation and equilibrium: what do we need to know about neural control of balance to prevent falls? Age Ageing 2006;35:7-11.
- Crutchfield C, Shumway-Cook A, Horak FB. Balance and coordination training. In: Scully R, Barnes M (eds). Physical Therapy. New York: Lippincott, 1989:82543.
- Tinetti ME, Speechlev M, Ginter SF. Risk factors for falls among elderly persons living in the community. N Eng J Med 1988;319:1701-7.
- McCollum G, Leen TK. Form and exploration of mechanicalstability limits in erect stance. J Motor Behav 1989;21:225–44.
- Erdeniz B, Selveraj D, Bulut M. Neuroanatomy of postural stability: links to Parkinson’s disease. Turk J Neurol 2019;25:1-6.
- Horak FB. Clinical measurement of postural control in adults. Phys Ther 1987;67:1881-5.
- McIlroy WE, Maki BE. Age-related changes in compensatory stepping in response to unpredictable perturbations. J Gerontol 1996;51:289-96.
- Horak FB, Kuo A. Postural adaptation for altered environments, tasks and intentions. In: Biomechanics and Neuronal Control of Posture and Movement. New York: Springer, 2000: 267–81.
- Shupert CL, Horak FB. Adaptation of postural control in normal and pathologic agei ng: implications for fall prevention programs. J Appl Biomech 1999;15: 64–74.
- Mihara M, Miyai I, Hatakenaka M, et al. Role of the prefrontal cortex in human balance control. Neuroimage 2008;43:329-36.
- Ouchi Y, Okada H, Yoshikawa E, et al. Brain activation during maintenance of standing postures in humans. Brain 1999;122:329-38.
- Shumway-Cook A, Woollacott MH. Motor control: translating research into clinical practice. Philadelphia, PA: Lippincott Williams & Wilkins, 2007.
- Aruin AS, Latash ML. The role of motor action in anticipatory postural adjustments studied with self-induced and externally triggered perturbations. Exp Brain Res 1995;106(2):291-300.
- Petersen TH, Willerslev-Olsen M, Conway BA, Nielsen JB. The motor cortex drives the muscles during walking in human subjects. J Physiol 2012;590:2443-52.
- Bauby CE, Kuo AD. Active control of lateral balance in human walking. J Biomech 2000;33:1433-40.
- Bhatt T, Patel P, Dusane S, et al. Neural mechanisms involved in mental imagery of slip-perturbation while walking: A preliminary fMRI study. Front Behav Neurosci 2018;12:203.
- Paillard T. Plasticity of the postural function to sport and/or motor experience. Neurosci Biobehav Rev 2017;72:129-52.
- Karim H, Fuhrman SI, Sparto P, et al. Functional brain imaging of multi-sensory vestibular processing during computerized dynamic posturography using nearinfrared spectroscopy. Neuroimage 2013;74:318-25.
- Peterka RJ. Sensorimotor integration in human postural control. J Neurophys 2002;88:1097–118.
- Herdman SJ. Vestibular rehabilitation. 3rd Edition. Philadelphia: F.A. Davis Company, 2007; 504 p.
- Masoud B, Athareh F, Ahmadreza N. The application of subjective visual vertical in balance system disorders. Audit Vestib Res 2018;27(1):1-11.
- Karnath HO, Ferber S, Dichgans J. The neural representation of postural control in humans. PNAS 2000;97:13931-6.
- Bisdorff AR, Wolsley CJ, Anastasopoulos D, et al. The perception of body verticality (subject postural vertical) in peripheral and central vestibular disorders. Brain 1996;119:1523-34.
- Karnath H, Fetter M, Niemeier M. Disentangling gravitational, environmental, and egocentric reference frames in spatial neglect. J Cogn Neurosci 1998;10:680-90.
- Teasdale N, Simoneau M. Attentional demands for postural control: the effects of ageing and sensory reintegration. Gait Posture 2001;14:203-10.
- Camicioli R, Howieson D, Lehman S. Talking while walking: the effect of a dual task in ageing and Alzheimer’s disease. Neurol 1997;48:955-8.
- Fujita H, Kasubuchi K, Wakata S, et al. Role of the frontal cortex in standing postural sway tasks while dual-tasking: a functional near-infrared spectroscopy study examining working memory capacity. Biomed Res Int 2016;7053867.
- Kiss B, Karpati E. Mechanism of action of vinpocetine. Acta Pharm Hung 1996;66(5):213-24.
- Gulyás B, Tóth M, Schain M, et al. Evolution of microglial activation in ischaemic core and peri-infarct regions after stroke: A PET study with the TSPO molecular imaging biomarker [11C] vinpocetine. J Neurol Sci 2012;320:110-17.
- Скоромец А.А, Алиев К.Т., Лалаян Т.В. и др. Когнитивные функции и лечение их нарушений при хронической недостаточности кровообращения в вертебрально-базилярной системе у пожилых. Журнал неврол психиат 2013;113(4):18-24.[Skoromets AA, Aliev KT, Lalayan TV, et al. Cognitive functions and treatment of their impairment in elderly patients with the vertebrobasilar issufficiensy Zh Nevrol Psikhiatr Im SS Korsakova 2013;113(4):18-24. (In Russ.)].
- Живолупов С.А., Самарцев И.Н., Яковлев Е.В. и др. Эффективность винпоцетина (Кавинтона Комфорте) в лечении головокружения у пациентов с дисциркуляторной энцефалопатией и его влияние на концентрацию нейротрофического фактора мозга (BDNF) в плазме. Клин фармакол тер 2016; 25(1):48-53 [Zhivolupov SA, Samartsev IN, Yakovlev E.V et al. The effectiveness of vinpocetine (Cavinton Comforte) in treatment of dizziness among patients with vascular encephalopathy and its influence on concentration of brain-derived neurotrophic factor (BDNF) in blood plasma. Clin Pharm Ther = Klinicheskaya farmakologiya i terapiya 2016;25(1):48-53 (In Russ.)].
- Самарцев И.Н., Живолупов С.А., Бутакова Ю.С. и др. Эффективность длительного приема винпоцетина при лечении головокружения и ассоциированных статодинамических нарушений у пациентов с хронической недостаточностью мозгового кровообращения (исследование ЭДЕЛЬВЕЙС). Неврология, нейропсихиатрия, психосоматика 2019;11(1):36–47 [Samartsev IN, Zhivolupov SA, Butakova YS, et al. Efficiency of long-term vinpocetine administration in the treatment of dizziness and associated statodynamic disorders in patients with chronic cerebrovascular insufficiency (EDELWEISS study). Neurology Neuropsychiatry Psychosomatics 2019;11(1):36-47. (In Russ.)].
- Mahlknecht P, Kiechl S, Bloem BR, et al. Prevalence and burden of gait disorders in elderly men and women aged 60-97 years: a populationbased study. РLoS One 2013;8(7): e69627.
