Диагностическое значение определения сывороточного кальпротектина при болезни Стилла взрослых
Уточнить диагностическое значение сывороточного кальпротектина (СК) при болезни Стилла взрослых (БСВ).
Уровень СК определяли у 48 (29 женщин и 19 мужчин, средний возраст 32,8±12,5 лет) пациентов с БСВ, соответствовавшей классификационным критериям Yamaguchi и соавт.
Уровень СК был повышен у 87,5% пациентов с БСВ и статистически значимо коррелировал с такими неспецифическими показателями, как концентрация сывороточного ферритина (r=0,54), С-реактивный белок (r=0,71), количество лейкоцитов (r=0,56), СОЭ (r=0,51) и системный счет (r=0,56). В то же время клинические показатели, входящие в перечень классификационных критериев, в том числе сыпь, серозит, спленомегалия, гепатомегалия или нарушение функции печени, боль в горле, не зависели от уровня СК.
Полученные данные не позволяют считать уровень СК специфическим серологическим маркером БСВ.
Болезнь Стилла взрослых (БСВ) – редкое аутовоспалительное заболевание неизвестной этиологии, характеризующееся ежедневными резкими подъемами температуры тела более 39°С, артралгиями или артритом, гепатоспленомегалией и нарушением лабораторных показателей, включая нейтрофильный лейкоцитоз, повышение сывороточной активности аминотрансфераз и гиперферритинемию. У трети больных болезнь приобретает хроническое течение с неблагоприятным прогнозом и приводит к развитию различных осложнений, включая перикардит, тампонаду сердца, диссеминированное внутрисосудистое свертывание, печеночную и дыхательную недостаточность [1-3].
В настоящее время с целью оценки активности воспаления при БСВ определяют такие неспецифичные показатели острофазового ответа, как СОЭ, C-реактивный белок (СРБ) и ферритин сыворотки крови, однако они не специфичны для БСВ. Сывороточный кальпротектин (СК) – это потенциальный показатель острофазового ответа при ряде воспалительных и аутоиммунных заболеваний [4-14]. Целью исследования было уточнить диагностическое значение СК при БСВ.
Материал и методы
В исследование включали пациентов с БСВ, соответствовавшей классификационным критериям Yamaguchi и соавт. [15]. Тяжесть БСВ оценивали на основании системного счета, представляющего собой сумму клинических признаков (0 – нет, 1 – наличие признака) [16], в том числе лихорадки, сыпи, плеврита, пневмонита, перикардита, гепатомегалии или нарушения функции печени, спленомегалии, боли в горле, миалгии, абдоминальной боли, лейкоцитоза более 15×109/л, лимфоаденопатии.
При поступлении в клинику у всех пациентов определяли СОЭ (по Вестергрену), концентрацию высоко чувствительного СРБ в сыворотке крови иммунонефелометрическим методом с латексным усилением на анализаторе N-ProSpec (Siemens, ФРГ), сывороточный ферритин иммунотурбометрическим методом на биохимическом анализаторе Cobas Integra 400 Plus (Roche Diagnostics, Швейцария), СК с помощью набора Buhlmann MRP8/14 ELISA для количественного определения S100A8/ S100A9 в сыворотке крови человека (Buhlmann Laboratories AG, Швейцария). Верхняя граница нормы используемого набора для СК согласно инструкции производителя составляла 3,9 мкг/мл.
Количественные переменные описывались числом больных, средним арифметическим значением (М), стандартным отклонением от среднего арифметического значения (δ), медианой, 25-м и 75-м процентилями. Качественные переменные описывались абсолютными и относительными частотами (процентами). Различия считали статистически значимыми при уровне p<0,05.Для количественных переменных проводился тест на соответствие нормальному закону распределения. При оценке полученных результатов были использованы χ2-критерий Пирсона, U-критерий Манна-Уитни и критерий Краскела-Уоллиса. Для определения взаимного влияния показателей проводили корреляционный анализ Спирмена и Пирсона. Анализ данных выполнен с использованием программы Statistica 10 for Windows (StatSoft Inc., США).
Результаты
В исследование были включены 48 больных с БСВ (29 женщин, 19 мужчин) в возрасте в среднем 32,8±12,5 лет и медианой длительности заболевания 2,0 (0,8;6) года (табл. 1). Сорок шесть из них получали глюкокортикостероиды. У 12 больных терапия базисными противовоспалительными препаратами не проводилась, в то время как 36 пациентов принимали метотрексат, в том числе в комбинации с адалимумабом (2), тоцилизумабом (3), ритуксимабом (2), инфликсимабом (1), этанерцептом (1); 5 пациентов – лефлуномид, в том числе в комбинации с тоцилизумабом (3) и этанерцептом (1), по 1 больному – циклоспорин и гидроксихлорохин.
| Признак | Значение |
|---|---|
| Симптомы, n (%) | |
| Боль в горле | 33 (68,8) |
| Миалгия | 39 (83,0) |
| Артралгия | 47 (97,9) |
| Артрит | 41 (85,4) |
| Утренняя скованность | 24 (50,0) |
| Сыпь | 38 (79,2) |
| Абдоминальная боль | 11 (22,9) |
| Гепатомегалия или нарушение функции печен | 39 (81,3) |
| Лимфоаденопатия | 34 (70,8) |
| Спленомегалия | 22 (46,8) |
| Серозит | 20 (41,7) |
| Лихорадка | 22 (45,8) |
| Системный счет, М±σ | 6,0±2,5 |
| Лабораторные показатели | |
| СРБ, мг/л | 92 (8,6; 139,5) |
| СОЭ, мм/ч | 35 (19,5; 52,5) |
| Ферритин, мкг/мл | 346 (150; 1891) |
| Лейкоциты, ×109/л | 13,8 (9,9; 23,2) |
| АЛТ, ед/л | 17,4 (11,4; 26,1) |
| АСТ, ед/л | 16,8 (13,0; 21,9) |
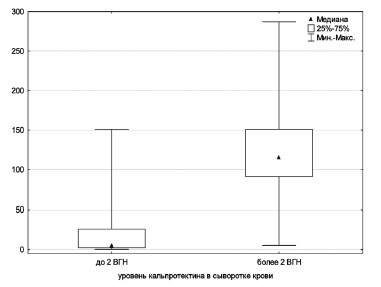
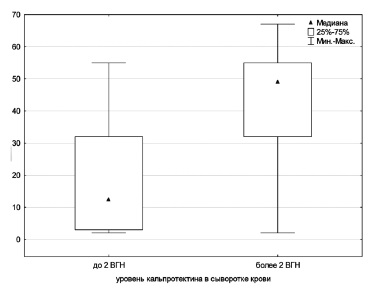
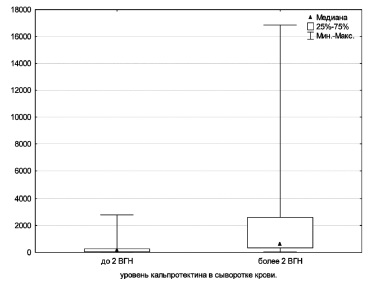
Медиана уровня СК составила 12,4 (5,6; 24,0) мкг/мл. Концентрация СК превышала верхнюю границу нормы у 42 (87,5%) из 48 больных. У пациентов с высокими значениями СК отмечалось более значительное увеличение числа лейкоцитов, СОЭ, уровней СРБ и ферритина (табл. 2). Уровень СК статистически значимо (р<0,05) коррелировал с показателями острофазового ответа, в том числе ферритином (r=0,54), СРБ (r=0,71) количеством лейкоцитов в крови (r=0,56) и СОЭ (r=0,51).
| Признаки и показатели | Уровень СК, мкг/мл | p | |||
|---|---|---|---|---|---|
| <3,9 (n=6) | 3,9-7,7 (n=12) | 7,8-15,6 (n=9) | >15,6 мкг/мл (n=21) | ||
| Примечание: *верхняя граница нормы для СК составляла 3,9 мкг/мл | |||||
| Лихорадка, n (%) | 5 (83,3) | 1 (8,3) | 5(55,6) | 15(71,4) | 0,002 |
| Сыпь, n (%) | 5 (83,3) | 10 (83,3) | 7 (77,8) | 16 (76,2) | 0,957 |
| Серозит, n (%) | 2 (33,3) | 2 (16,7) | 3 (33,3) | 13 (61,9) | 0,070 |
| Гепатомегалия или нарушение функции печени, n (%) | 5 (83,3) | 8 (66,7) | 6 (66,7) | 20 (95,2) | 0,130 |
| Cпленомегалия, n (%) | 2 (33,3) | 3 (27,3) | 4 (44,4) | 13 (61,9) | 0,254 |
| Лимфаденопатия, n (%) | 4 (66,7) | 5 (41,7) | 6 (66,7) | 19 (90,5) | 0,029 |
| Боль в горле, n (%) | 5 (83,3) | 7 (58,3) | 4 (44,4) | 17 (81,0) | 0,163 |
| Лейкоциты, ×109/л | 10,9 (9,0; 11,8) | 9,3 (5,9; 13,3) | 12,5 (9,9; 14) | 23,1 (14,6; 27,0) | 0,001 |
| СРБ, мг/л | 3,5 (3,4; 25,8) | 5,4 (1,6; 55,3) | 73,9 (45,9; 101,0) | 142,0 (94,9; 167,0) | 0,001 |
| СОЭ, мм/ч | 21,0 (3,0; 33,0) | 10,5 (2,5; 22,0) | 35,0 (25,0; 48,0) | 50,0 (37,0; 55,0) | 0,001 |
| Ферритин, мкг/мл | 66,3 (37,5; 165,0) | 215,0 (54,6; 756,0) | 346,0 (176,0; 579,0) | 1816,0 (344,0; 3300,0) | 0,002 |
| АЛТ, ед/л | 19,3 (16,5; 20,0) | 15,6 (12,8; 23,8) | 23,4 (8,1; 29,3) | 14,5 (9,8; 26,2) | 0,838 |
| АСТ, ед/л | 18,9 (17,8; 21,9) | 21,2 (14,7; 23,6) | 16,7 (14,1; 21,0) | 13,9 (12,4; 18,9) | 0,174 |
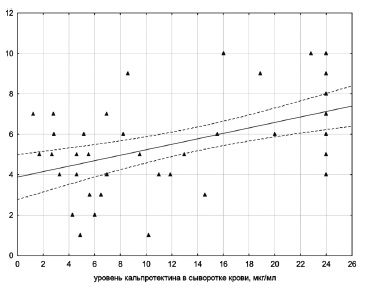
У больных с уровнем СК, превышавшим верхнюю границу нормы по крайней мере в два раза (>7,8 мкг/мл), были статистически значимо выше медианы СРБ, СОЭ, ферритина и количества лейкоцитов (рис. 1-4). В то же время клинические показатели, входящие в перечень классификационных критериев, в том числе сыпь, серозит, спленомегалия, гепатомегалия или нарушение функции печени, боль в горле, не зависели от уровня СК, хотя он статистически значимо коррелировал с системным счетом (r=0,56, p<0,05; рис. 5).
Обсуждение
Более чем у трети пациентов БСВ развиваются тяжелые системные проявления, ухудшающие прогноз [1,2]. При этом диагностика БСВ представляет собой сложный процесс, требующий обязательного исключения инфекций, злокачественных новообразований и других ревматических заболеваний. В определенной степени эти трудности связаны с отсутствием специфических симптомов и биомаркеров заболевания [17,18]. В связи с этим продолжается поиск серологических маркеров, которые могли бы использоваться для диагностики БСВ [14]. Многообещающим в этом плане представляется кальпротектин – белок, вырабатываемый главным образом нейтрофилами, моноцитами и макрофагами [911]. Он участвует в регуляции хемотаксиса, активации дегрануляции и фагоцитоза неийтрофилов, ингибировании синтеза иммуноглобулинов, пролиферации и дифференцировки клеток и может быть связующим звеном между воспалением и адаптивным иммунным ответом [11].
Изучению уровня СК при БСВ посвящены всего несколько работ с неоднозначными результатами [1214]. В одном исследовании уровень СК у 25 пациентов с БСВ был существенно выше, чем у здоровых добровольцев и значимо коррелировал с ферритином сыворотки (r=0,686, p<0,001), количеством лейкоцитов (r=0,774, p<0,001) и СРБ (r=0,588, p =0,001), а также с системным счетом, отражающим тяжесть болезни (r=0,803, p<0,001) [12]. В то же время корреляция СК с СОЭ отсутствовала. В следующей работе у 36 пациентов с БСВ опредяли уровни СК и интерлейкина (ИЛ)-18. Содержание СК коррелировало с числом лейкоцитов, СОЭ, уровнями ферритина и СРБ и системным счетом, в то время как уровень ИЛ-18 коррелировал только с содержанием ферритина и системным счетом [13]. Авторы третьего исследования сопоставили уровни СК у пациентов с БСВ и другими ревматическими заболеваниям и здоровых добровольцев. При БСВ уровень СК был достоверно выше, чем у больных ревматоидным артритом, системной красной волчанкой, синдромом Шегрена и здоровых добровольцев и коррелировал с содержанием ферритина (r=0,294, p<0,05).
В нашем исследовании уровень СК был повышен у большинства пациентов с БСВ и статистически значимо (р<0,05) коррелировал не только с уровнями ферритина (r=0,54) и СРБ (r=0,71), количеством лейкоцитов (r=0,56), системным счетом (r=0,56), но и с СОЭ (r=0,51). Однако клинические проявления, относящиеся к классификационным критериям БСВ [15], такие как сыпь, серозит, спленомегалия, гепатомегалия или нарушение функции печени, боль в горле, не зависели от уровня СК.
Заключение
Полученные данные позволяют считать СК перспективным показателем для оценки активности и тяжести БСВ. Однако СК является неспецифичным показателем, поэтому его определение с диагностической целью имеет небольшое значение.
Используемые источники
- Fautrel B. Adult-onset Still disease. Best Pract Res Clin Rheumatol 2008;22(5): 773-92.
- Chen DY, Lan JL, Lin FJ, Hsieh TY. Association of intercellular adhesion molecule-1 with clinical manifestations and interleukin-18 in patients with active, untreated adult-onset Still’s disease. Arthritis Rheum 2005;53:320-7.
- Biron C, Chambellan A, Agard C, et al. Acute respiratory failure revealing adultonset Still’s disease: diagnostic value of low glycosylated ferritin level. Clin Rheumatol 2006;25:766-8.
- Александрова Е.Н., Новиков А.А., Насонов Е.Л. Роль лабораторных биомаркеров в оценке эффективности терапии ревматоидного артрита генноинженерными биологическими препаратами. В кн.: Генно-инженерные биологические препараты в лечении ревматоидного артрита. Москва: ИМАПРЕСС; 2013:101–22 [Aleksandrova EN, Novikov AA, Nasonov EL. The role of laboratory biomarkers in assessing the effectiveness of the treatment of rheumatoid arthritis genetically engineered biological agents. In: Biological agents in the treatment of rheumatoid arthritis. Moscow: IMA-PRESS; 2013. P. 101–22 (In Russ.)].
- Soyfoo MS, Roth J, Vogl T, et al. Phagocyte-specific S100A8/A9 protein levels during disease exacerbations and infections in systemic lupus erythematosus. J Rheumatol. 2009;36(10):2190–4.
- Pepper RJ, Hamour S, Chavele KM, et al. Leukocyte and serum S100A8/S100A9 expression reflects disease activity in ANCA-associated vasculitis and glomerulonephritis. Kidney Int 2013;83(6):1150–8.
- Aochi S, Tsuji K, Sakaguchi M, et al. Markedly elevated serum levels of calciumbinding S100A8/A9 proteins in psoriatic arthritis are due to activated monocytes/macrophages. J Amer Acad Dermatol 2011;64(5):879–87.
- Пчелинцева А.О., Жорняк А.П., Иониченок Н.Г. и др. Динамика уровня кальпротектина, его взаимосвязь с клинико-лабораторными параметрами активности, значение для прогнозирования ответа на терапию у больных ревматоидным артритом на фоне лечения этанерцептом. Научно-практическая ревматология. 2015;53(4):379–84. [Pchelintseva AO, Zhornyak AP, Ionichenok NG, et al. Changes in calprotectin level, its relationship to the clinical and laboratory parameters of disease activity and significance for predicting the therapeutic response in rheumatoid arthritis patients treated with etanercept. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice 2015;53(4):379-84. (In Russ.)].
- Kopeć-Mędrek M, Widuchowska M, Kucharz EJ. Calprotectin in rheumatic diseases: a review.Reumatologia 2016;54(6):306–9.
- Ometto F, Friso L, Astorri D, et al. Calprotectin in rheumatic diseases. Exper Biol Med, 2017;242:859-73.
- Авдеева А.С. Клиническое значение кальпротектина при ревматических заболеваниях. Научно-практическая ревматология 2018;56(4):494-9 [Avdeeva AS. Clinical significance of calprotectin in rheumatic diseases. NauchnoPrakticheskaya Revmatologiya = Rheumatology Science and Practice 2018;56(4): 494-499 (In Russ.)].
- Jung SY, Park YB, Ha YJ, et al. Serum calprotectin as a marker for disease activity and severity in adult-onset Still's disease. J Rheumatol 2010;37(5):1029–34.
- Kim HA, An JM, Nam JY, et al. Serum S100A8/A9, but not follistatin-like protein 1 and interleukin 18, May be a useful bio marker of disease activity in adultonset Still’s disease. J Rheumatol 2012;39(7):1399–1406.
- Guo Q, Zha X, Li C, et al. Serum calprotectin a promising diagnostic marker for adult-onset Still’s disease. Clin Rheumatol 2016;35:73–9.6
- Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classification of adult Still’s disease. J Rheumatol 1992;19:424-30.
- Pouchot J, Sampalis JS, Beaudet F, et al. Adult Still’s disease: manifestations, disease course, and outcome in 62 patients. Medicine (Baltimore) 1991;70(2): 118–36.
- Efthimiou P, Kontzias A, Ward CM, Ogden NS. Adult-onset stills disease: can recent advances in our understanding of its pathogenesis lead to targeted therapy? Nat Clin Pract Rheumatol 2007;3(6):328–35.
- Cagatay Y, Gul A, Cagatay A, et al. Adult-onset Still’s disease. Int J Clin Pract 2009;63(7):1050–5.
