Канакинумаб в лечении подагрического артрита
Ключевую роль в развитии острого подагрического артрита играет активация NLRP3 инфламмасомы под действием кристаллов моноурата натрия. В состав инфламмасомы входит прокаспаза-1, которая превращается в активную каспазу-1, вызыващую секрецию интерлейкина (ИЛ-1β) – основного провоспалительного цитокина, индуцирующего острый воспалительный ответ. Канакинумаб – это человеческие моноклональные IgG1 антитела к интерлейкину (ИЛ)-1β, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. В двух рандомизированных клинических исследованиях 3 фазы канакинумаб (одна инъекция 150 мг подкожно) превосходил триамцинолона ацетонид по эффективности в лечении острого подагрического артрита у пациентов с частыми приступами подагры. Лечение канакинумабом по сравнению с глюкокортикостероидом привело к значительному увеличению времени до первого обострения и снижению риска обострений на 62% за 12 недель. Применение канакинумаба у пациентов с острым подагрическим артритом обосновано при наличии противопоказаний к назначению нестероидных противовоспалительных препаратов и/или колхицина, недостаточной их эффективности или плохой переносимости.
Подагра – это хроническое системное заболевание, которое характеризуется стойкой гиперурикемией и образованием кристаллов моноурата натрия, откладывающихся в суставах и других тканях [1]. В странах Европы и США распространенность подагры составляет 3-6% у мужчин и 1-2% у женщин [2]. Заболеваемость увеличивается с возрастом и достигает пика в возрасте 40-50 лет у мужчин и после 60 лет у женщин. Подагра проявляется рецидивирующими приступами острого моноартрита, которые продолжаются от нескольких часов до 7-10 дней. Если гиперурикемия не контролируется, то со временем продолжающееся отложение кристаллов моноурата натрия и воспаление приводят к развитию хронической тофусной подагры (тофусы в cуставах и мягких тканях, хронический эрозивный артрит с функциональными нарушениями, подагрическая нефропатия). Ключевую роль в патогенезе острого подагрического артрита играют активация NLRP3 инфламмасомы под действием кристаллов моноурата натрия и выделение интерлейкина 1β [1], поэтому основные стратегии лечения подагры включают в себя профилактику приступов артрита путем уратснижающей терапии, вызывающей рассасывание кристаллов, и купирование атак артрита с помощью противовоспалительных препаратов, включая ингибиторы интерлейкина 1β, такие как канакинумаб.
Диагностика подагры
Подагра известна с глубокой древности. Первые описания этого заболевания содержатся в египетских папирусах, датируемых 2600 годом до нашей эры, и в трудах Гиппократа [3]. Очень точное описание подагрического приступа в конце XVII века дал английский врач Thomas Sydenham, который на протяжении многих лет сам страдал этим заболеванием: “После приятно проведенного вечера и обильного ужина человек ложится спать, но примерно в два часа ночи просыпается от сильнейшей боли. Возникает она обычно с большого пальца ноги и нарастает настолько быстро, что через час-два человек практически не может пошевелиться. Раздирающая боль распространяется на все кости и связки ног. Больному кажется, что в палец впилась клыками огромная собака и что кто-то раздирает сухожилия. Больного сильно знобит. Палец становится красным, горячим, иногда опухает." [4].
У 85-90% больных подагра начинается с моноартрита с поражением сустава нижних конечностей (чаще всего страдают первый плюснефаланговый сустав, другие суставы стопы или голеностопный сустав), который развивается под действием различных провоцирующих факторов, таких как острые заболевания, хирургические вмешательства, дегидратация, употребление алкоголя или большого количества мяса, прием некоторых лекарственных средств, в том числе диуретиков. Острая нестерпимая боль часто возникает ночью, быстро нарастает, достигая максимума в течение нескольких часов, сопровождается покраснением и опуханием пораженного сустава, ограничением подвижности и резкой болезненностью при дотрагивании. Приступ полностью проходит в течение 14 дней (обычно быстрее). Подобные приступы обычно повторяются в течение ближайших нескольких месяцев или лет, а у трети нелеченных больных в течение 5 лет развивается хроническая подагра, характеризующаяся хроническим деструктивным полиартритом, деформацией суставов и образованием тофусов – отложений кристаллов моноурата натрия, окруженных мононуклеарными и гигантскими клетками [3]. Тофусы представляют собой безболезненные узелки размером от нескольких миллиметров до 2-3 см. Внесуставные тофусы обычно локализуются на ушных раковинах, в области локтевой поверхности предплечий, ахиллова сухожилия и др.
Картина острого моноартрита с поражением сустава нижних конечностей типична, но не специфична для подагры. Сходные клинические проявления могут наблюдаться при септическом артрите, а также болезни отложения кристаллов пирофосфата кальция, псориатическом артрите, реактивном артрите [5]. В связи с этим диагноз подагры должен основываться на совокупности клинических и анамнестических данных, результатов лабораторных и других методов исследования. В крупном исследовании SUGAR были проанализированы различные признаки, которые повышали вероятность диагноза подагры, подтвержденного при анализе пунктата синовиальной жидкости или содержимого тофуса, у 983 пациентов с артритом, поступавших в ревматологическое отделение [6]. Наиболее важное диагностическое значение имели особенности приступа, в частности быстрое нарастание боли и ее полное купирование в течение 2 недель, локализация поражения, наличие тофусов, гиперурикемия, результаты ультразвукового исследования и др. (табл. 1).
| Признаки | Отн. шансов (95% доверительный интервал |
|---|---|
| Покраснение сустава | 2,13 (1,06-4,29) |
| Боль, достигающая максимума в течение <24ч | 7,34 (1,17-46,06) |
| Прекращение приступа в течение 2 недель | 3,58 (1,85-6,95) |
| Тофусы | 7,29 (2,42-21,99) |
| Поражение первого плюснефалангового сустава, в том числе в анамнезе | 2,30 (1,18-4,49) |
| Локализация поражения при текущем артрите | |
| Первый плюснефаланговый сустав | 2,82 (1,37-5,81) |
| Другой сустав стопы или голеностопный суста | 2,28 (1,00-5,19) |
| Сывороточный уровень мочевой кислоты >360 мкмоль/л (6 мг/дл) | 3,35 (1,57-7,15) |
| “Двойной контур" при УЗИ | 7,23 (3,47-15,04) |
| Эрозии или кисты при рентгенографии суставов | 2,49 (1,26-4,90) |
В 2018 г. эксперты Европейской антиревматической лиги (EULAR) опубликовали новые рекомендации по диагностике подагры, в которых выделены основные клинические признаки, с большой долей вероятности указывающие на наличие подагры, в том числе моноартрит с поражением сустава стопы или голеностопного сустава, похожие приступы острого артрита в анамнезе, быстрое нарастание боли и опухания (в течение <24 ч), покраснение кожи в области пораженного сустава, мужской пол, гиперурикемия и сопутствующие сердечно-сосудистые заболевания [7]. Однако в рекомендациях отмечена неспецифичность указанных признаков и не предлагается балльная их оценка, содержавшаяся в предыдущих рекомендациях ACR/EULAR 2015 года [8].
Важное значение в диагностике подагры имеет гиперурикемия, которая является одним из основных факторов риска развития этого заболевания. По данным систематизированного обзора популяционных проспективных исследований, частота развития подагры варьировалась от 3 случаев на 1000 пациенто-лет при сывороточном уровне мочевой кислоты <6 мг/дл до 70 случаев на 1000 пациенто-лет при повышении уровня мочевой кислоты>10 мг/дл. Сходные результаты были получены при анализе частоты рецидивирования подагры, которая достигала 60-90% при гиперурикемии более 9 мг/дл [9]. Даже при отсутствии симптомов у 1525% пациентов с гиперурикемией можно выявить отложение кристаллов моноурата натрия [7]. Однако высокая гиперурикемия не всегда приводит к развитию подагры. Например, в исследовании Normative Aging Study развитие подагрического артрита в течение 5 лет было отмечено только у 22% мужчин с бессимптомной гиперурикемией >9 мг/дл [10]. Гиперурикемию саму по себе не следует считать надежным диагностическим признаком подагры. В двух исследованиях ее специфичность составила всего 53-61% [11,12]. Отсутствие гиперурикемии делает диагноз подагры маловероятным, но полностью его не исключает. Например, в одном исследовании у 14% из 339 пациентов с острым подагрическим артритом сывороточный уровень мочевой кислоты был ниже 6 мг/дл [13].
“Золотым стандартом" диагностики подагры является поляризационная микроскопия синовиальной жидкости или содержимого тофуса, позволяющая выявить кристаллы моноурата натрия. В рекомендациях EULAR это исследование предлагается проводить всем больным с предполагаемым диагнозом подагры, в том числе всем взрослым пациентам с недифференцированным или впервым возникшим артритом независимо от его локализации (табл. 2) [7]. Синовиальная жидкость может быть взята не только из воспаленного, но и интактного, но ранее поражавшегося сустава. Если проведение инвазивного исследования по каким-то причинам невозможно, что в обычной клинической практике – не редкость, то для подтверждения диагноза целесообразно использовать дополнительные методы, в частности ультразвуковое исследование. Высокоспецифичными признаками считают феномен “двойного контура" и наличие тофусов – гиперэхогенных узелков, хорошо дифференцируемых от окружающих тканей [14]. Следует учитывать, что чувствительность метода ниже у пациентов с длительностью заболевания менее 2 лет. Перспективным методом диагностики подагры считают также биэнергетическую компьютерную томографию.
| Рекомендации | Класс рекомендации | Степень доказанности |
|---|---|---|
| 1. У всех больных с предполагаемой подагрой рекомендуется исследование синовиальной жидкости или аспирата содержимого тофуса, так как наличие кристаллов моноурата натрия позволяет установить определенный диагноз подагры | 2b | B |
| 2. Подагру следует подозревать у всех взрослых пациентов с острым артритом. Если анализ синовиальной жидкости не возможен, то в пользу этого диагноза свидетельствуют следующие клинические признаки: моноартрит с поражением суставов стопы, особенно первого плюснефалангового сустава, или голеностопного сустава, сходные эпизоды острого артрита в анамнезе, резкая боль и припухание сустава, которые быстро нарастают и достигают максимума в течение первых суток, эритема, мужской пол, сопутствующие сердечнососудистые заболевания и гиперурикемия. Перечисленные проявления характерны, но не специфичны для подагры. | 2b | B |
| 3. Поиск кристаллов в синовиальной жидкости настоятельно рекомендуется всем пациентам с артритом неясной природы. | 3 | C |
| 4. Диагноз подагры не может основываться только на наличии гиперурикемии | 2a | B |
| 5. Если диагноз подагры вызывает сомнение, а пункция сустава невозможна, то рекомендуется использование визуализирующих методов с целью выявления отложений кристаллов моноурата натрия или изменений, характерных для других заболеваний. | 1b | A |
| 6. Обычная рентгенография может быть использована для выявления отложений кристаллов моноурата натрия, но обладает ограниченной ценностью в диагностике обострения подагры. Более информативным у пациентов с предполагаемым обострением подагры или хроническим подагрическим артритом может оказаться ультразвуковое исследование, которое позволяет выявить “скрытые" тофусы или феномен “двойного контура", типичный для отложения уратов в суставах | 1b | A |
| 7. У всех пациентов с подагрой необходимо выявлять факторы риска хронической гиперурикемии, в том числе хроническую болезнь почек, избыточную массу тела, прием лекарственных средств, таких как диуретики, аспирин в низкой дозе, циклоспорин, такролимус, употребление большого количества алкоголя (особенно пива и крепких спиртных напитков), недиетических содовых напитков, мяса, ракообразных/моллюсков. | 1a | A |
| 8. У пациентов с подагрой необходимо оценивать наличие сопутствующих заболеваний, включая ожирение, нарушение функции почек, артериальную гипертонию, ишемическую болезнь сердца, сердечную недостаточность, сахарный диабет и дислипидемию. | 1a | A |
Методы лечения подагры
Лечение подагры предполагает коррекцию факторов риска гиперурикемии, прежде всего с помощью диеты, уратснижающую терапию и применение противовоспалительных препаратов с целью купирования приступов подагрического артрита и их профилактики в первые 6 мес после назначения уратснижающих средств [15]. Неотъемлемым компонентом ведения пациентов является лечение сопутствующих заболеваний, прежде всего сердечно-сосудистых. Хотя важность диетотерапии не вызывает сомнения, переоценивать ее эффективность также не следует, поэтому во всех случаях необходимо определить целесообразность назначения уратснижающих препаратов, которые снижают частоту приступов подагры и обеспечивают возможность растворения кристаллов моноурата натрия. В последних рекомендациях EULAR, опубликованных в 2017 году, указано, что уратснижающая терапия необходима всем пациентам с рецидивирующим подагрическим артритом (≥2 приступов в год), тофусами, уратной артропатией и/или камнями в почках, однако ее можно начать и после первого приступа артрита у пациентов молодого возраста (<40 лет), а также при очень высокой гиперурикемии (>8,0 мг/дл, или 480 мкмоль/л) или при наличии сопутствующих заболеваний, таких как хрони ческая почечная недостаточность, артериальная гипертония, ишемическая болезнь сердца, сердечная недостаточность.
Лечение обычно начинают с аллопуринола в низкой дозе (100 мг/сут), которую постепенно увеличивают на 100 мг каждые 2-4 недели (максимальная доза – 900 мг/сут) до достижения целевого сывороточного уровня мочевой кислоты (360 мкмоль/л). При недостаточной эффективности или непереносимости аллопуринола его можно заменить на другой ингибитор ксантиноксидазы – фебуксостат (80-120 мг/сут), который метаболизируется в печени и практически не выводится почками. За рубежом используются также урикозурические средства (бензбромарон и др.), однако в Российской Федерации они не зарегистрированы.
Для купирования приступов подагрического артрита и их профилактики применяют колхицин (в первый день в дозе 1 мг в течение 12 ч от начала приступа, а затем 0,5 мг через 1 ч) и/или нестероидные противовоспалительные препараты (НПВП). Реже назначают глюкокортикостероиды в дозе 30-35 мг/сут в пересчете на преднизолон на 3-5 дней [15]. Колхицин в дозе 0,5-1 мг/сут рекомендуется также применять в течение первых 6 мес после назначения уратснижающей терапии для профилактики приступов подагрического артрита. Применения колхицина и НПВП необходимо избегать у пациентов с тяжелым нарушением функции почек.
Альтернативой перечисленным противовоспалительным препаратам в случае их неэффективности служат ингибиторы интерлейкина-1b, в частности зарегистрированный в Российской Федерации канакинумаб. Основанием для назначения этого пре парата пациентам с частыми рецидивами подагрического артрита могут быть и противопоказания к применению стандартных противовоспалительных средств [16,17].
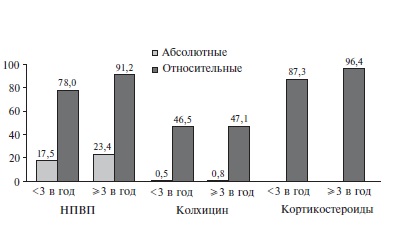
J. Saseen в крупном исследовании изучил частоту абсолютных и относительных противопоказаний к назначению колхицина, НПВП и глюкокортикостероидов у 15669 пациентов с подагрой, которые были разделены на две когорты в зависимости от частоты приступов в год (<3 или ≥3) (рис. 1) [18]. Про ти вопоказания оценивали на основании инструкций по применению или базы данных Thomson Reuters Micromedex 2.0 (табл. 3) [19]. Среди больных с частотой приступов <3 в год абсолютные или относительные противопоказания к назначению НПВП имелись в 78,7% случаев, колхицина – в 46,5%, глюкокортикостероидов – в 87,3%. Еще выше частота противопоказаний оказалась у пациентов с более частыми приступами подагрического артрита – 91,5%, 47,1% и 96,4%, соответственно. Необходимо отметить, что хотя противопоказания к лечению колхицином были выявлены фактически у каждого второго пациента как с частыми, так и более редкими приступами подагры, тем не менее, частота абсолютных противопоказаний была очень низкой (0,5-0,8%).
| Препараты | Абсолютные противопоказания | Относительные противопоказания |
|---|---|---|
| Примечание: мощные ингибиторы CYP3A4 – атазанавир, кларитромицин, дарунавир с ритонавиром, индинавир, итраконазол, кетоконазол, лопинавир с ритонавиром, нефазодон, нелфинавир, ритонавир, саквинавир с ритонавиром, телитромицин, типранавир с ритонавиром. Ингибиторы Р-гликопротеина – циклоспорин, ранолазин. Умеренные ингибиторы CYP3A4 – дилтиазем, верапамил, ампренавир с ритонавиром, фосампренавир с ритонавиром. ХБП – хроническая болезнь почек | ||
| НПВП | ХБП 3-5 стадии Сердечная недостаточность Гастродуоденальная язва или кровотечение Лечение варфарином | Сердечно-сосудистые заболевания ХБП 1-2 стадии Артериальная гипертония Лечение ингибиторами АПФ или блокаторами ангиотензиновых рецепторов, аспирином, b-адреноблокаторами, глюкокортикостероидами, диуретиками |
| Колхицин | ХБП или заболевание печени И лечение мощным ингибитором CYP3A4 или ингибитором Р-гликопротеина Применение ингибитора Р-гликопротеина или мощного ингибитора CYP3A4 | Хроническая болезнь почек или заболевание печени И лечение умеренным ингибитором CYP3A4 Прием дигоксина, фибратов, умеренных ингибиторов CYP3A4 или статинов |
| Глюкокортикостероиды | Нет | Сахарный диабет, дислипидемия, сердечная недостаточность, артериальная гипертония, гастродуоденальная язва или кровотечение Лечение аспирином, дигоксином, НПВП, варфарином |
Сходные данные приводят R.Keenan и соавт., которые проанализировали влияние сопутствующих заболеваний на лечение подагры у 575 больных [20]. У многих пациентов имелись различные противопоказания к назначению по крайней мере одного противоподагрического препарата. Например, колхицин в трети случаев применяли несмотря на наличие противопоказаний.
Эффективность и безопасность канакинумаба в лечении и профилактике подагрического артрита
Центральную роль в развитии приступов подагрического артрита играет образование NLRP3 инфламмасомы при взаимодействии кристаллов моноурата натрия с фагоцитами [21]. Этот процесс лежит в основе патогенеза многих аутовоспалительных заболеваний, в том числе криопирин-ассоциированного периодического синдрома [22]. NLRP3 (криопирин) относится к семейству внутриклеточных NOD-подобных рецепторов, которые распознают молекулярные фрагменты, ассоциированные с повреждением (DAMP). К последним относятся кристаллы моноурата натрия. При активации NLRP3 связывается с другими белками с образованием в макрофагах и нейтрофилах инфламмасомы, в состав которой входят также белок ASC и прокаспаза-1. Последняя превращается в активную каспазу-1, которая вызывает активацию и секрецию ИЛ-1β, являющегося основным провоспалительным цитокином и индуцирующего острый воспалительный ответ [23].
Для подавления ИЛ-1β могут быть использованы генно-инженерные биологические препараты, в частности канакинумаб (зарегистрирован в Российской Федерации под торговым наименованием Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1β, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Эффективность канакинумаба установлена в лечении системного ювенильного идиопатического артрита, болезни Стилла взрослых, семейной средиземноморской лихорадки (периодической болезни), а также криопирин-ассоциированного периодического синдрома и других редких генетических аутовоспалительных заболеваний [24].
Эффективность канакинумаба в профилактике приступов подагрического артрита была впервые показана в 24-недельном рандомизированном контролируемом исследовании 2 фазы у 432 больных подагрой, начавших уратснижающую терапию аллопуринолом в дозе 100-300 мг/сут [25]. В этом исследовании тестировали различные дозы канакинумаба (одна подкожная инъекция в дозах 25, 50, 100, 200 или 300 мг; четыре инъекции с 4-недельным интервалом – 50 мг, 50 мг, 25 мг и 25 мг), который сравнивали с колхицином (0,5 мг/сут ежедневно в течение 16 недель). Применение канакинумаба в дозах 50 мг и более привело к снижению среднего числа обострений на пациента на 62-72% по сравнению с колхицином и риска развития по крайней мере одного обострения на 64-72% (рис. 2). Во всех группах канакинумаба процент больных, перенесших по крайней мере один подагрический приступ (15-27%), был достоверно ниже, чем в группе колхицина (44%, p<0,05).
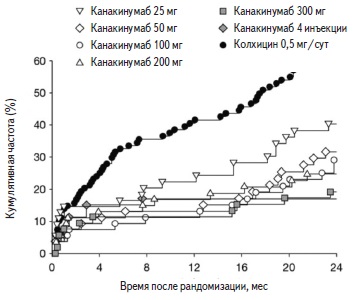
Таким образом, это исследование показало, что канакинумаб (однократная инъекция в дозе ≥50 мг или 4 инъекции с 4-недельным интервалом) может быть использован для профилактики приступов подагрического артрита в первые месяцы после назначения урат снижающей терапии и по эффективности превосходит колхицин, который считается стандартом профилактики обострений подагры.
Эффективность и безопасность канакимуба при остром подагрическом артрите подтверждены в двух рандомизированных, многоцентровых, контролируемых, 12-недельных исследованиях 3 фазы (β-RELIEVED and β-RELIEVED-II), которые проводились по одинаковому протоколу в Европе, США и других странах [26]. В целом в них были включены 456 больных с острым подагрическим артритом (около 90% – мужчины), у которых отмечались противопоказания к назначению НПВП и/или колхицина, плохая их переносимость или неэффективность. В течение первых 5 дней после развития приступа пациентам вводили одну дозу канакинумаба 150 мг подкожно или триамцинолона ацетонида 40 мг внутримышечно.
У большинства пациентов (82,6%) имелись сопутствующие заболевания, в том числе артериальная гипертония (59,5%) или хроническая болезнь почек 2-5 стадии (83,7%), а средняя частота приступов артрита за предыдущий год составила 6,5. Только 42% больных получали уратснижающую терапию. После завершения 12-недельных исследований 335 больных продолжили участие в продленной фазе двух исследований. Во время этого периода исследуемые препараты вводили при необходимости.
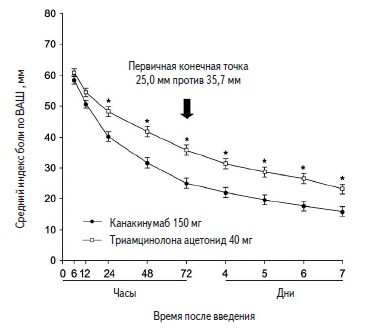
Целями обоих исследований были следующие: (1) подтвердить, что канакинумаб в дозе <150 мг подкожно превосходит триамцинолона ацетонид в дозе 40 мг внутримышечно по эффективности в купировании боли в пораженном суставе через 72 ч после введения (интенсивность боли оценивали с помощью визуальной аналоговой шкалы длиной 100 мм); (2) доказать, что канакинумаб увеличивает время до первого рецидива подагрического артрита по сравнению с триамцинолона ацетонидом. Необходимым условием было достижение обеих первичных конечных точек.
Средний исходный индекс боли в двух группах исходно составил 74,1 мм. Уже через 6 ч после введения препарата в группе канакинумаба он снизился в большей степени, чем в группе триамцинолона, а разница между группами достигла статистической значимости через 24 ч и сохранялась через 7 дней. Через 72 ч средний индекс боли в группах канакинумаба и триамцинолона составил 25,0 и 35,7 мм, соответственно (разница между группами 10,7 мм, p<0,0001) (рис. 3). Доля пациентов, которым потребовался прием дополнительных препаратов, в том числе глюкокортикостероидов внутрь, в группе канакинумаба также была достоверно ниже, чем в группе триамцинолона (37,3% и 54,6%, соответственно; p=0,0001; пероральные глюкокортикостероиды – 11,1% и 23,6%). Преимущество канакинумаба перед глюкокортикостероидом было подтверждено и при анализе мнения врачей и пациентов об эффективности лечения, а также динамики болезненности (p≤0,0001), припухлости (p≤0,01) и эритемы (p≤0,05).
Лечение канакинумабом привело к быстрому снижению медиан уровней С-реактивного белка и сывороточного амилоидного А-белка (SAA), которые оставались низкими на протяжении всего 24-недельного исследования и во всех точках были ниже, чем в группе глюкокортикостероида (p≤0,0001 через 72 ч и 7 дней). Следует отметить, что сохранение субклинической воспалительной активности даже вне приступов подагры в редких случаях может привести к развитию АА-амилоидоза. Остановить прогрессирование амилоидоза у таких пациентов можно только путем длительного многолетнего лечения ингибитором интерлейкина-1β.
Мы наблюдали 66-летнего мужчину с хронической тофусной подагрой, которая осложнилась развитием АА-амилоидоза, проявлявшегося нефротическим синдром и нарушением функции почек и подтвержденного при гистологическом исследовании биоптата почки. Применение канакинумаба позволило не только купировать нефротический синдром, но и задержать прогрессирующее ухудшение функции почек, которое потребовало бы назначения почечной заместительной терапии [27].
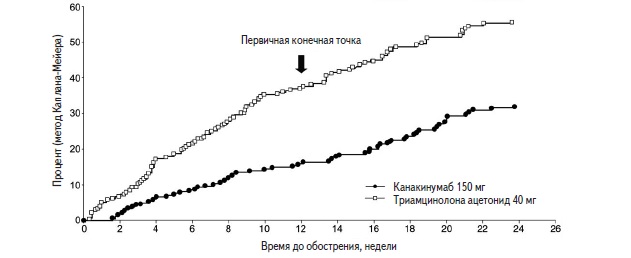
Лечение канакинумабом сопровождалось значительным увеличением времени до первого обострения и снижением риска обострений на 62% за 12 недель по сравнению с триамцинолона ацетонидом (p≤0,0001) (рис. 4). В группе канакинумаба по сравнению с группой триамцинолона ацетонида были значительно ниже доля пациентов, перенесших одно обострение во время исследования (16,0% и 35,8%, соответственно), среднее число обострений на пациента (0,19 и 0,51) и процент больных, у которых зарегистрировали по крайней мере два обострения (2,7% и 11,4%). Эффекты канакинумаба сохранялись на протяжении всего 24-недельного исследования: увеличение медианы времени до обострения со 131 в группе сравнения до >168 дней в основной группе, снижение риска развития обострения на 56% по сравнению с триамцинолона ацетонидом (p≤0,0001) и среднего числа обострений на пациента с 0,87 в группе триамцинолона ацетонида до 0,40 в группе канакинумаба (p<0,0001).
Лечение канакинумабом было в целом безопасным, а большинство нежелательных явлений оказались легкими или средне-тяжелыми. Частота инфекций в группе канакинумаба была выше, чем в группе триамцинолона (20,4% и 12,2%, соответственно). Серьезные инфекции были зарегистрированы только в группе канакинумаба, однако частота их была низкой (1,8%). У всех 4 пациентов антибиотикотерапия привела к выздоровлению. Оппортунистических инфекций отмечено не было.
D. Solomon и соавт. изучали эффективность кана кинумаба в профилактике приступов подагры на основании ретроспективного анализа результатов рандомизированного исследования CANTOS, в котором этот препарат сравнивали с плацебо у 10059 пациентов с перенесенным инфарктом миокарда и уровнем высокочувствительного СРБ по крайней мере 19,1 нмоль/л [28]. 762 их них страдали подагрой. Канакинумаб в разных дозах (50, 150 или 300 мг каждые 3 мес) применяли в течение в среднем 3,7 лет. Во время исследования по крайней мере один приступ подагрического артрита развился у 195 пациентов. У 87 из них имелась подагра в анамнезе, а у 34 – наблюдались повторные приступы подагры. В группе плацебо частота приступов подагрического артрита составила 0,38 на 100 пациенто-лет и зависела от сывороточных уровней мочевой кислоты: 0,28, 1,36 и 5,94 на 100 пациенто-лет при уровне мочевой кислоты ≤404,5 мкмоль/л, 404,6-535,3 мкмоль/л и ≥535,4 мкмоль/л, соответственно. Лечение канакинумабом не влияло на сывороточные уровни мочевой кислоты, но привело к значительному снижению уровня высокочувствительного СРБ. В группах канакинумаба риск развития подагрического артрита достоверно снизился по сравнению c плацебо на 55-60%, причем этот эффект не зависел от дозы ингибитора интерлейкина1β или сывороточного уровня мочевой кислоты (табл. 4). Хотя исследование CANTOS не предполагало изучение эффективности длительной терапии канакимубом в профилактике приступов подагрического артрита, тем не менее, ретроспективный анализ полученных данных показал, что применение этого препарата снижает риск их развития по сравнению с плацебо.
| Исходные сывороточные уровни мочевой кислоты |
Плацебо | Канакинумаб (все дозы) | Отн. шансов (95% ДИ | ||||
|---|---|---|---|---|---|---|---|
| Число пациентов |
Число приступов |
Частота на 100 пациенто-лет (95% ДИ) |
Число пациентов |
Число приступов |
Частота на 100 пациенто-лет (95% ДИ) |
||
| ≤404,5 мкмоль/л | 2326 | 24 | 0,28 (0,18–0,41) | 4614 | 19 | 0,,11 (0,07–0,17) | 0,40 (0,22–0,73) |
| 404,6–535,3 мкмоль/л | 831 | 41 | 1,36 (1,00–1,85) | 1684 | 41 | 0,65 (0,48–0,89) | 0,48 (0,31–0,74) |
| ≥535,4 мкмоль/л | 186 | 34 | 5,94 (4,25–8,32) | 418 | 36 | 2,55 (1,84–3,54) | 0,45 (0,28–0,72) |
Заключение
У многих пациентов с подагрическим артритом имеются сопутствующие заболевания, которые часто ограничивают применение стандартных противовоспалительных препаратов. Кроме того, последние могут взаимодействовать с различными лекарственными средствами, не всегда эффективны или плохо переносятся. Основания для назначения канакинумаба пациентам с острым подагрическим артритом включают в себя противопоказания к применению НПВП и колхицина, недостаточную их эффективность или плохую переносимость. Соответственно, чаще всего необходимость в применении канакинумаба возникает у пациентов с тяжелым и часто рецидивирующим подагрическим артритом, которые плохо отвечают на колхицин и/или НПВП, и больных с различными сопутствующими заболеваниями, которым стандартные противовоспалительные препараты нельзя назначить из-за абсолютных противопоказаний. Канакинумаб в дозе 150 мг подкожно может быть использован для купирования острого подагрического артрита у взрослых пациентов с частыми обострениями заболевания (≥3 за предыдущий год). Препарат следует вводить как можно раньше после развития приступа. При необходимости повторного введения канакинумаба интервал между инъекциями должен составлять не менее 12 недель. При неэффективности первой инъекции вводить препарат повторно нецелесообразно. По эффективности в лечении острого подагрического приступа канакинумаб достоверно превосходил глюкокортикостероиды. Если пациент не получает уратснижающую терапию, то после купирования острого подагрического артрита необходимо начать лечение аллопуринолом. В этом случае введение канакинумаба позволяет свести к минимуму риск развития обострений подагрического артрита, который увеличивается в первые месяцы после начала любой уратснижающей терапии.
Используемые источники
- Dalbeth N, Merriman TR, Stamp LK. Gout. Lancet 2016;388(10055):2039-52.
- Kuo C-F, Grainge MJ, Zhang W, Doherty M. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol 2015;11:649–62.
- Richette P, Bardin T. Gout. Lancet 2010;375:318–28.
- Насонова В., Барскова В. Болезнь изобилия. Наука и жизнь 2004;7. https://www.nkj.ru/archive/articles/2216/.
- Zhang W, Doherty M, Bardin T, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65:1312–24.
- Taylor WJ, Fransen J, Jansen TL, et al. Study for Updated Gout Classification Criteria (SUGAR): identification of features to classify gout. Arthritis Care Res (Hoboken) 2015;67:1304–15.
- Richette P, Doherty M, Pascual E, et al. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout. Ann Rheum Dis 2019 Jun 5. pii: annrheumdis-2019-215315.
- Neogi T, Jansen T, Dalbeth N, et al. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2015;74(10):1789–98.
- Shiozawa A, Szabo SM, Bolzani A, et al. Serum uric acid and the risk of incident and recurrent gout: a systematic review. J Rheumatol 2017;44:388–96.
- Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the normative aging study. Am J Med 1987;82:421–6.
- Malik A, Schumacher HR, Dinnella JE, et al. Clinical diagnostic criteria for gout: comparison with the gold standard of synovial fluid crystal analysis. J Clin Rheumatol 2009;15:22–4.
- Janssens HJEM, Fransen J, van de Lisdonk EH, et al. A diagnostic rule for acute gouty arthritis in primary care without joint fluid analysis. Arch Intern Med2010;170:1120–6.
- Schlesinger N, Norquist JM, Watson DJ. Serum urate during acute gout. J Rheumatol 2009;36:1287–9.
- Ogdie A, Taylor WJ, Neogi T, et al. Performance of ultrasound in the diagnosis of gout in a multicenter study: comparison with monosodium urate monohydrate crystal analysis as the gold standard. Arthritis Rheumatol 2017;69:429–38.
- Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017;76(1):29-42.
- Елисеев М.С., Насонов Е.Л. Применение канакинумаба при подагре. Научно-практическая ревматология 2018;56:41-8. [Eliseev MS, Nasonov EL. Therapy with canakinumab for gout. Rheumatology Science and Practice 2018;56:41-8 (In Russ.)].
- Елисеев М.С., Желябина О.В., Мукагова М.В., Насонов Е.Л. Клинический опыт применения блокатора интерлейкина 1β канакинумаба у больных хронической тофусной подагрой: купирование артрита и профилактика обострений при назначении аллопуринола. Современная ревматология 2015;9(2):16-22 [Eliseev MS, Zhelyabina OV, Mukagova MV, Nasonov EL. Clinical experience with the interleukin 1β blocker canakinumab in patients with chronic tophaceous gout: abolishment of arthritis and prevention of exacerbations when allopuninol is used. Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(2):16-22 (In Russ.)].
- Saseen JJ. Comparison of patient characteristics and gout-related health-care resource utilization and costs in patients with frequent versus infrequent gouty arthritis attacks. Rheumatology (Oxford) 2012;51(11):2004-12.
- Reuters T. Micromedex Healthcare Series [intranet database] Version 5.1. Greenwood Village, CO: Thomson Reuters (Healthcare) Inc, 2011.
- Keenan RT, O’Brien WR, Lee KH, et al. Prevalence of contraindications and prescription of pharmacologic therapies for gout. Am J Med 2011;124;155−63.
- Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 2006;440:237–41.
- Козловская Л.В., Рамеев В.В., Новиков П.И. и др. Криопирин-ассоциированный периодический синдром. Клин фармакол тер 2016;25(2):82-9. [Kozlovskaya LV, Rameev VV, Novikov PI, et al. Сryopyrin-associated periodic syndrome. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2016; 25(2):82-9 (In Russ.)].
- Насонов Е.Л., Елисеев М.С. Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология 2016;54(1):60-77. [Nasonov EL, Eliseev MS. Role of interleukin 1 in the development of human diseases. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice 2016;54(1):60-77 (In Russ.)].
- Моисеев С.В., Рамеев В.В. Канакинумаб в лечении периодической болезни и других аутовоспалительных заболеваний – исследование CLUSTER. Клин фармакол тер 2018;24(4):59-64. [Moiseev SV, Rameev VV. The interleukin-1b inhibitors for the treatment of familial Mediterranean fever and other autoinflammatory diseases: CLUSTER trial. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2018;24(4):59-64 (In Russ.)].
- Schlesinger N, Mysler E, Lin HY, et al. Canakinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: results of a doubleblind, randomised study. Ann Rheum Dis 2011;70:1264-71.
- Schlesinger N, Alten RE, Bardin T, et al. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomised, multicentre, active-controlled, double-blind trials and their initial extensions. Ann Rheum Dis 2012;71(11):1839-48.
- Рамеев В.В., Елисеев М.С., Моисеев С.В. Концепция аутовоспаления в генезе подагры и гиперурикемии. Клин фармакол тер 2019;28(2):28-33 [Rameev VV, Eliseev MS, Moiseev SV. Autoinflammation in the pathogenesis of gout and hyperuricemia. Clin Pharmacol Ther 2019;28(2). Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019;28(2):28-33 (In Russ.)].
- Solomon DH, Glynn RJ, MacFadyen JG, et al. Relationship of interleukin-1β blockade with incident gout and serum uric acid levels: exploratory analysis of a randomized controlled trial. Ann Intern Med 2018;169(8):535-42.
