Ингибиторы янус-киназ: перспективы применения при ревматоидном и псориатическом артрите и других ревматических заболеваниях
Ингибиторы янус-киназы подавляют внутри-клеточную сигнальную систему JAK/STAT, которая опосредует действие многочисленных цитокинов и факторов роста, играющих ключевую роль в патогенезе ревматических заболеваний. В отличие от генно-инженерных биологических препаратов (ГИБП), они предназначены для приема внутрь и не вызывают образование нейтрализующих антител. В ревматологии ингибиторы янус-киназ применяют в комбинации со стандартными базисными противовоспалительными препаратами (БПВП) у больных РА, не отвечающих на лечение БПВП или ГИБП, однако возможна и монотерапия тофацитинибом или барицитинибом, если одновременное применение БПВП по каким-то причинам невозможно или нежелательно (плохая переносимость, противопоказания). В исследовании ORAL Shift монотерапия тофацитинибом, которую проводили после отмены метотрексата у пациентов с РА, достигших низкой активности заболевания на фоне приема двух препаратов, по эффективности не уступала комбинированной терапии тофацитинибом и метотрексатом. В плацебо-контролируемых исследованиях установлена эффективность тофацитиниба в лечении псориатического артрита и псориаза, а также воспалительных заболеваний кишечника. Кроме того, эффективность и безопасность ингибиторов янус-киназ изучаются у больных анкилозирующим спондилитом и другими аутоиммунными заболеваниями.
Генно-инженерные препараты (ГИБП) в настоящее время применяют для лечения ревматоидного артрита (РА) и других заболеваний преимущественно в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов (БПВП). ГИБП представляют собой моноклональные антитела, растворимые рецепторы или гибридные молекулы, которые блокируют функцию различных цитокинов, таких как фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-1b, ИЛ-6, ИЛ-17, ИЛ-23, или Т- и В-клеток, играющих ключевую роль в патогенезе ревматических заболеваний. В последние годы большой интерес у исследователей и разработчиков лекарственных средств вызывает изучение внутриклеточных сигнальных систем, опосредующих действие цитокинов и факторов роста, которое привело к появлению нового класса лекарственных препаратов, получивших название таргетных БПВП. Пока к этой группе относят только ингибиторы янус-киназ, оказывающие действие на внутриклеточную систему JAK/STAT, которая включает в себя янус-киназы (JAK1, JAK2, JAK3 и тирозинкиназу 2) и белок-трансдуктор и активатор транскрипции (STAT – signal transducer and activator of transcription) [1-3]. При взаимодействии цитокина с соответствующим рецептором JAK фосфорилируют белки STAT, которые индуцируют транскрипцию генов, опосредующих действие цитокинов.
В Российской Федерации зарегистрированы два ингибитора янус-киназ – тофацитиниб и барицитиниб, однако в клинических исследованиях изучается еще около десятка подобных препаратов [4]. Все ингибиторы янус-киназ – это низкомолекулярные синтетические препараты. В отличие от ГИБП, они предназначены для приема внутрь и не обладают иммуногенностью, т.е. не вызывают образование антител, которые могут нейтрализовать активность белковых молекул и снизить эффективность лечения. В ревматологии ингибиторы янус-киназ применяют для лечения РА и псориатического артрита (ПсА), однако в ближайшем будущем можно ожидать расширения показаний к назначению этих препаратов.
Тактика применения ингибиторов янус-киназ для лечения ревматодного артрита
В рекомендациях Европейской антиревматической лиги (EULAR) 2016 г. лечение РА было предложено начинать с монотерапии стандартными БПВП, прежде всего метотрексатом, дозу которого следует быстро увеличить до 25-30 мг/нед в случае хорошей переносимости [5]. Если в течение 6 мес не удается добиться низкой активности или ремиссии РА, то при наличии неблагоприятных прогностических факторов (сохраняющаяся высокая активность заболевания, аутоантитела, ранние эрозии, отсутствие ответа на два БПВП) к терапии целесообразно присоединить ГИБП или ингибитор янус-киназ. При выборе между последними предпочтение было отдано ГИБП, учитывая больший опыт их применения в клинической практике.
Недавно были опубликованы обновленные рекомендации EULAR по лечению РА [6]. В целом стратегия лечения этого заболевания не претерпела особых изменений, в частности препаратом первой линии по-прежнему остается метотрексат. Тем не менее, изменения коснулись выбора препаратов второй линии. В новой версии рекомендаций повышена роль ингибиторов янус-киназ, т.е. сегодня при выборе тактики дальнейшей терапии у пациентов, не ответивших на метотрексат или другие стандартные БПВП, нет оснований отдавать предпочтение именно ГИБП и рассматривать таргетные БПВП как препараты “резерва". Основанием для пересмотра рекомендаций EULAR послужили результаты клинических исследований, подтвердивших высокую эффективность и благоприятный профиль безопасности ингибиторов янус-киназ в лечении РА, а также накопление опыта их применения в клинической практике. Так, к апрелю 2019 года в мире тофацитиниб получали более 200 000 больных РА.
Программа регистрационных исследований ингибиторов янус-киназ была сходной и предусматривала изучение различных схем их применения преимущественно у больных РА, у которых лечение стандартными БПВП и/или ГИБП не позволило достичь необходимого ответа. Эффективность и безопасность тофацитиниба в комбинации со стандартными БПВП сравнивали с плацебо и/или адалимумабом в 5 исследованиях, в том числе ORAL Scan, ORAL Standard, ORAL Sync, ORAL Step и ORAL Strategy [7]. Во всех этих исследованиях тофацитиниб оказывал быстрое действие (в течение 2-4 недель), а его присоединение к метотрексату или другим стандартным БПВП по сравнению с плацебо приводило к значительному увеличению частоты ответа на лечение, улучшению качества жизни и функциональной активности и задерживало прогрессирование рентгенологических изменений суставов. В рандомизированном исследовании ORAL Standard у 717 больных РА, у которых сохранялась умеренная или высокая активность заболевания на фоне терапии метотрексатом в стабильной дозе, частота ответа по критериям Американской коллегии ревматологов (АКР20) через 6 мес после присоединения тофацитиниба в дозах 5 или 10 мг два раза в день (51,5% и 52,6%, соответственно) почти в два раза превышала таковую в группе плацебо (28,3%, p<0,001) и была сходной с таковой в группе адалимумаба. Достоверное превосходство тофацитиниба в обеих дозах над плацебо было подтверждено и при анализе двух других первичных конечных точек, в том числе динамики счета нетрудоспособности (HAQ-DI) и частоты достижения ремиссии РА, которую оценивали на основании счета DAS28-4(СОЭ) [8].
Исследование ORAL-Step проводилось по сходному протоколу, однако в него были включены 399 больных РА, не ответивших на лечение ингибиторами ФНО-α [9]. Через 3 мес после начала лечения частота ответа по критериям АКР20 у больных, получавших тофацитиниб в дозах 5 или 10 мг два раза в сутки в сочетании с метотрексатом, составила 41,7% и 48,1%, соответственно, и достоверно превышала частоту ответа у пациентов, продолжавших прием метотрексата в комбинации с плацебо (24,4%). Динамика счета HAQ-DI и частота ремиссии РА также были достоверно выше в обеих группах тофацитиниба.
В целом результатых этих и других исследований в рамках программы ORAL показали, что при недостаточной эффективности стандартных БПВП присоединение тофацитиниба позволяет значительно уменьшить активность РА, в том числе у больных, не ответивших на лечение ГИБП.
Сходные результаты были получены при изучении эффективности барицитиниба у пациентов с РА, не ответивших на лечение стандартными БПВП (исследования RA BEAM и RA BUILD) и/или ГИБП (RA BEACON) [10,11]. В исследовании RA-BEAM, в которое были включены 1307 больных РА, не отвечавших на метотрексат, через 12 недель частота ответа по критериям АКР20 при лечении барицитинибом в дозе 4 мг один раз в сутки и метотрексатом (70%) достоверно превышала таковую при применении метотрексата в сочетании не только с плацебо (40%, p<0,001), но и адалимумабом (61%, p=0,01). Частота ремиссии РА, которую оценивали на основании счета SDAI через 12 недель, в группе барицитиниба также была выше, чем в группе плацебо, и сопоставимой с таковой в группе адалимумаба.
Недавно были опубликованы результаты клинических исследований 3 фазы, подтвердивших эффектив ность упадацитиниба в лечении активного РА у пациентов, не ответивших на стандартные БПВП (исследование SELECT NEXT) или ГИБП (исследование SELECT BEYOND) [12,13]. В обоих исследованиях комбинированная терапия ингибитором янус-киназ и стандартным БПВП по эффективности превосходила плацебо в сочетании с БПВП. Например, в исследовании SELECT BEYOND через 12 недель частота ответа по критериям АКР20 в группах упадацитиниба в дозах 15 и 30 мг/сут составила 65% и 56%, соответственно, а в группе плацебо – 28%.
Таким образом, результаты рандомизированных клинических исследований свидетельствуют о том, что у больных РА умеренной или высокой активности ингибиторы янус-киназ могут рассматриваться как препараты второй и третьей линии и использоваться при недостаточной эффективности или плохой переносимости как метотрексата или других стандартных БПВП, так и ГИБП.
Монотерапия ингибиторами янус-киназ при РА
ГИБП и таргетные БПВП рекомендуется применять в сочетании с метотрексатом или другими стандартными БПВП. Однако результаты различных регистров, которые проводятся в Европе и США, свидетельствуют о том, что около трети больных РА получают ГИБП в виде монотерапии, что может быть связано с плохой переносимостью БПВП, наличием противопоказаний к их назначению или сопутствующих заболеваний [1416]. По данным регистра Swiss RA (SCQM-RA), в который были включены более 3000 пациентов с РА, факторами, ассоциировавшимися с назначением монотерапии ГИБП, были пожилой возраст, сопутствующие заболевания, длительность РА и более высокая его активность, низкий индекс массы тела, а также опыт применения ГИБП в анамнезе [14]. Сходные данные были получены и в регистре Британского общества ревматологов [17]. Создается впечатление, что врачи назначают монотерапию ГИБП больным РА, лечение которых представляет собой более сложную задачу.
Данные наблюдательных исследований, проводившихся в обычной клинической практике, свидетельствуют о том, что от 10 до 77% больных РА прекращают прием метотрексата из-за нежелательных эффектов [18]. Основным фактором риска развития нежелательных явлений при лечении метотрексатом является низкая скорость клубочковой фильтрации, которая приводит к снижению клиренса метотрексата и повышению его концентрации в сыворотке. Не все пациенты сообщают врачу о том, что они не принимают метотрексат в комбинации с ГИБП, например, из-за легких нежелательных явлений или нежелания отказываться от приема алкоголя. По данным исследования, проводившегося в Канаде на основании анализа аптечных баз данных, около трети больных РА не приобретали выписанные им БПВП, в том числе метотрексат, в течение 6 мес после назначения ГИБП [19]. С одной стороны, приведенные данные свидетельствуют о том, что в клинической практике ревматологам следует строже контролировать сделанные назначения, но с другой стороны, очевидно существование группы больных РА, у которых применение препаратов второй-третьей линии возможно только в виде монотерапии.
Как тофацитиниб, так и барицитиниб разрешено назначать в виде монотерапии. Эффективность монотерапии тофацитинибом изучалась в трех исследованиях, в том числе ORAL Strategy, ORAL Start и ORAL Solo. В двойное слепое, плацебо-контролируемое исследование ORAL Solo были включены 611 больных РА, у которых сохранялась активность заболевания несмотря на лечение стандартными БПВП или ГИБП [20]. Через 3 мес после начала монотерапии тофацитинибом в дозах 5 или 10 мг два раза в сутки частота ответа по критериям АКР20 (59,8% и 65,7%, соответственно) была достоверно выше, чем в контрольных группах больных, получавших плацебо (26,7%; p<0,001). Кроме того, лечение тофацитинибом по сравнению с плацебо привело к более значительному снижению счета HAQ-DI и увеличению частоты достижения низкой активности РА. Через 3 мес частота ремиссии РА достоверно не отличалась между группами сравнения, однако через 6 мес (после 3 мес всех пациентов групп плацебо переводили на прием тофацитиниба) она достигла 14,2% в группе тофацитиниба 10 мг.
В исследовании ORAL Strategy у 1146 больных РА, не ответивших на метотрексат, сравнивали эффективность монотерапии тофацитинибом и комбинированной терапии метотрексатом с тофацитинибом или адалимумабом [21]. В этом исследовании частота ответа по критериям АКР50 через 6 мес в группе больных, получавших монотерапию тофацитинибом в дозе 10 мг два раза в сутки, была несколько ниже, чем в группах сравнения (38% против 46% и 44%, соответственно), хотя разница между ними не достигла статистической значимости.
В исследовании RA BEGIN была сопоставлена эф фективность монотерапии барицитинибом или меторексатом и комбинированной терапии барицитинибом и метотрексатом у 588 больных РА [22]. Через 24 недели монотерапия ингибитором янус-киназ по эффективности, которую оценивали на основании частоты ответа по критериям АКР20, превосходила монотерапию метотрексатом (77% и 62%, соответственно; p<0,01) и вызывала значительное снижение активности заболе вания и улучшение физической функции, а также задерживала прогрессирование рентгенологических изменений суставов. Следует отметить, что в это исследование включали первичных пациентов с РА, которые не получали ранее БПВП. В настоящее время применение ингибиторов янус-киназ, как и ГИБП, в качестве препаратов линии не рекомендуется.
Эффективность монотерапии упадацитинибом в дозе 15 или 30 мг/сут изучалась в плацебо-контролируемом исследовании SELECT MONOTHERAPY у 648 больных РА, у которых сохранялась активность болезни несмотря на лечение метотрексатом [23]. Через 14 недель после начала лечения ингибитором янус-киназ частота ответа по критериям АКР20 (68-71%) достоверно превышала таковую у пациентов, продолжавших прием метотрексата (41%; p<0,0001). Частота достижения низкой активности РА при монотерапии упадацитибином также была достоверно выше, чем при лечении метотрексатом (45-53% против 19%; p<0,0001).
В целом приведенные данные свидетельствуют о том, что монотерапия ингибиторами янус-киназ может проводиться у пациентов с активным РА, не ответивших на лечение стандартными БПВП или ГИБП, если применение метотрексата или других БПВП невозможно изза побочных эффектов или противопоказаний. Более того, в рекомендациях EULAR указано, что монотерапия ингибиторами янус-киназ может иметь преимущества перед монотерапией ГИБП (за исключением тоцилизумаба) [3].
Исследование ORAL-Shift
У части больных РА применение современных антиревматических препаратов в сочетании со стандартными БПВП позволяет достичь стойкой ремиссии, что позволяет обсуждать возможность уменьшения интенсивности иммуносупрессивной терапии. Очевидные достоинства такого подхода включают в себя снижение риска нежелательных явлений и затрат и улучшение приверженности к терапии [25]. Из экономических соображений эксперты EULAR в таких случаях рекомендуют отменять ГИБП и продолжать монотерапию стандартными БПВП [4]. Следует отметить, что полная отмена ГИБП более чем у половины пациентов приводит к развитию обострения РА [25-27], поэтому на первом этапе можно попытаться снизить дозу препарата или увеличить интервалы между его введениями. Факторы, позволяющие предсказать сохранение достигнутого ответа на лечение после прекращения введения ГИБП, включают в себя ранний РА, глубину и длительность ремиссии [28].
Высокая частота рецидивов РА после отмены ГИБП позволяет обсуждать целесообразность альтернативного подхода к ослаблению интенсивности иммуносупрессивной терапии путем отмены БПВП. Доводом в пользу подобной практики может служить и тот факт, что ГИБП или таргетные БПВП чаще всего назначают пациентам, у которых стандартные БПВП оказываются недостаточно эффективными. В рандомизированном исследовании TARA были сопоставлены результаты постепенной отмены (в течение 6 мес) стандартных БПВП или ингибиторов ФНО-α у 189 больных РА, у которых была достигнута ремиссия заболевания на фоне комбинированной терапии двумя препаратами [29]. Полной отмене БПВП предшествовало последовательное двукратное снижение дозы в два раза под контролем активности РА, в то время как ингибитор ФНО-α отменяли после увеличения интервала между введениями в два раза и последующего снижения дозы. Через 1 год кумулятивная частота рецидивов РА (33% и 43% после отмены БПВП и ингибиторов ФНО-α, соответ ственно) и значения счета DAS, HAQ-DI и EQ-5D достоверно не отличались между группами, хотя обращала на себя внимание тенденция к увеличению риска развития рецидива после отмены ГИБП по сравнению с БПВП. В отдельных исследованиях изучали результаты отмены стандартных БПВП у пациентов, получавших их в комбинации с ингибиторами ФНО-α или ИЛ-6. Например, в исследованиях COMP-ACT и JUST-ACT монотерапия тоцилизумабом после отмены метотрексата по эффективности не уступала продолжающейся комбинированной терапии тоцилизумабом и метотрексатом у пациентов с РА, достигших низкой активности заболевания [30,31].
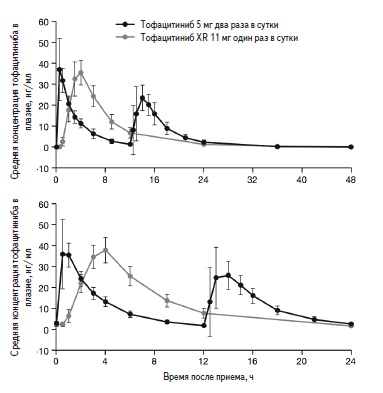
Недавно были опубликованы результаты исследования ORAL Shift, в котором изучалась возможность отмены метотрексата у больных РА, достигших низкой активности заболевания на фоне комбинированной терапии тофацитинибом и метотрексатом [32]. В этом исследования применялась новая форма тофацитиниба, которую можно назначать один раз в день. В фармакокинетическом исследовании установлена биоэквивалентность тофацитиниба модифицированного высвобождения в дозе 11 мг один раз в день и стандартной формы тофацитиниба в дозе 5 мг два раза в день (рис. 1) [33]. В открытую 24-недельную фазу исследования были включены 694 больных РА, у которых сохранялась активность заболевания несмотря на лечение метотрексатом в дозе 15-25 мг/нед в течение по крайней мере 4 мес. Во время первой фазы все пациенты получали тофацитиниб модифицированного высвобождения в дозе 11 мг один раз в сутки и метотрексат. У 533 из 623 больных, продолжавших комбинированную терапию в течение 24 недель, была достигнута низкая активность РА, которую оценивали на основании счета CDAI (≤10). Во вторую 24-недельную двойную слепую фазу исследования были включены 533 больных с низкой активностью РА, которых рандомизировали на две группы: у 267 пациентов основной группы метотрексат был заменен на плацебо, т.е. они продолжили монотерапию тофацитинибом, в то время как у 266 больных группы сравнения во время второй фазы проводилась комбинированная терапия тофацитинибом и метотрексатом. Первичный анализ эффективности двух схем терапии предполагал сравнение изменений счета DAS28-4(СОЭ).
Две группы были сопоставимы по демографическим и клиническим показателям. Во время двойной слепой фазы активность РА в обеих группах оставалась низкой, а достоверной разницы изменения счета DAS28-4(СОЭ) между двумя группами выявлено не было. Это позволило сделать вывод о том, что монотерапия тофацитинибом после отмены метотрексата у больных РА, достигших низкой активности заболевания на фоне комбинированной терапии, по эффективности не уступала продолжению комбинированной терапии. В конце исследования частота ответа по критериям АКР20 и АКР70 была сходной в группах больных, получавших монотерапию тофацитинибом и комбинированную терапию, в то время как частота ответа по критериям АКР50 была ниже на фоне монотерапии (55% и 67%, соответственно). У большинства больных двух групп во время двойной слепой фазы не были зарегистрированы обострения РА (нарастание счета DAS28-4(СОЭ)≥1,2 по сравнению с таковым перед рандомизацией). Доля больных, у которых отмечались обострения РА, в двух группах была сопоставимой как через 36 недель (16% и 13%, соответственно), так и через 48 недель (14% и 9%).
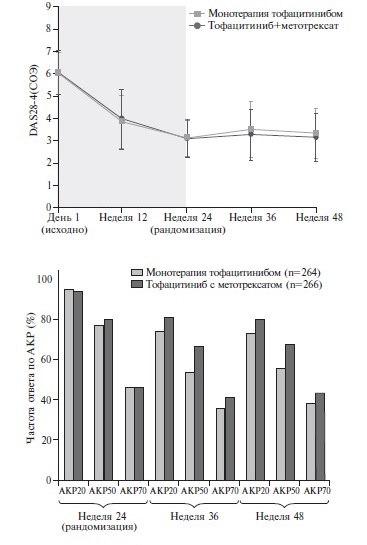
Таким образом, первичный и большинство вторичных показателей активности РА оставались стабиль ными после отмены метотрексата у больных, продолжавших монотерапию тофацитинибом, которая по эффективности не уступала комбинированной терапии тофацитинибом и метотрексатом. Переносимость двух схем была сопоставимой. Это не было неожиданным, так как больные, которые плохо переносили тофацитиниб или метотрексат, были исключены из исследования во время открытой фазы. Результаты исследования ORAL-Shift показали, что у больных РА, достигших низкой активности заболевания на фоне комбинированной терапии тофацитинибом и метотрексатом, отмена стандартного БПВП не приводит к ухудшению эффективности лечения. Следует обратить внимание на то, что более чем у 85% больных, получавших монотерапию ингибитором янус-киназ, не были зарегистрированы обострения РА, частота которых была сходной с таковой на фоне комбинированной терапии.
Эффективность тофацитиниба в лечении псориатического артрита
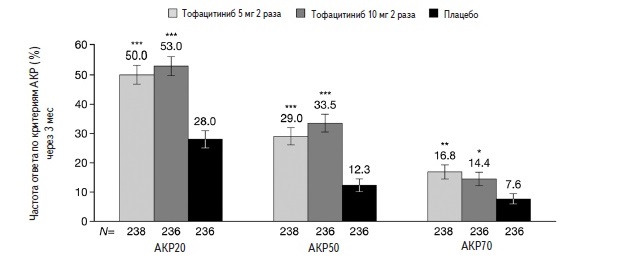
Тофацитиниб стал первым ингибитором янус-киназ, зарегистрированным для лечения бляшечного псориаза и ПсА. Эффективность и безопасность тофацитиниба в дозах 5 и 10 мг два раза в сутки в лечении ПсА изучались в двух плацебо-контролируемых исследованиях в целом у 710 больных, не ответивших на лечение стандартными БПВП (ORAL Broaden) или комбинированную терапию БПВП и ингибиторами ФНО-α (ORAL Beyond) [34-36]. В обоих исследованиях ингибитор янус-киназ применяли в сочетании со стандартными БПВП, чаще всего метотрексатом. В исследовании ORAL Broaden была выделена также группа больных, которые получали адалимумаб. Через 3 мес частота ответа по критериям АКР20 в группах тофацитиниба (50,0-53,0%) достоверно превышала таковую в группе плацебо (28,0%) (рис. 3). Сходные результаты были получены при анализе ответа по критериям АКР50 и АКР70. Кроме того, лечение тофацитинибом привело к более значительному улучшению функциональной активности больных, которую оценивали на основании счета HAQ-DI, и снижению числа болезненных и опухших суставов. Преимущество тофацитиниба перед плацебо было отмечено и при оценке эффективности лечения псориаза (частота улучшения по критериям PASI75), энтезита и дактилита, а также спондилита (счет BASDAI). В исследовании ORAL Broaden тофацитиниб по эффективности существенно не отличался от адалимумаба.
Перспективы применения ингибиторов янус-киназ при анкилозирующем спондилите
Ингибиторы янус-киназ модулируют активность ИЛ17, ИЛ-21, ИЛ-23 и ФНО-α, которые играют ключевую роль в патогенезе анкилозирующего спондилита (АС), что открывает перспективы их применения при этом заболевании. Эффективность тофацитиниба в различных дозах (2, 5 и 10 мг два раза в сутки) в лечении АС изучалась в плацебо-контролируемом 16-недельном исследовании 2 фазы у 206 больных, не ответивших на нестероидные противовоспалительные препараты или плохо переносивших эти препараты [37]. По частоте ответа по критериям ASAS20 через 12 недель (первичный показатель эффективности) тофацитиниб в дозе 5 мг два раза в сутки достоверно превосходил плацебо (80,8% и 41,2%, соответственно, p<0,01). В группах тофацитиниба 2 и 10 мг два раза в сутки частота ответа по критериям ASAS20 также была выше (51,9% и 55,8%, соответственно), чем в группе плацебо, однако разница между ними не достигла статистической значимости. Преимущество тофацитиниба перед плацебо было подтверждено при анализе различных вторичных показателей эффективности, таких как частота ответа по критериям ASAS40, ASAS5/6, BASDAI50 и др. Лечение тофацитинибом было более эффективным у больных с высоким содержанием С-реактивного белка. Спектр нежелательных эффектов оказался сходным с таковым при применении тофацитиниба по другим показаниям. Результаты исследования обосновывают дальнейшее изучение эффективности тофацитиниба в лечении АС в исследованиях 3 фазы.
Заключение
Пероральные ингибиторы янус-киназ, которые представляют собой малые молекулы, не обладающие иммуногенностью, все чаще применяют как альтернативу ГИБП у больных РА, не отвечающих на лечение метотрексатом или другими БПВП. В клинических исследованиях эффективность ингибиторов янус-киназ установлена и у больных РА, у которых терапия ингибиторами ФНО-α не позволила достичь необходимого ответа. Как правило, ингибиторы янус-киназ целесообразно назначать в комбинации со стандартными БПВП, однако при необходимости, например, при плохой переносимости БПВП или при наличии противопоказаний к их применению, возможна и монотерапия тофацитинибом или барицитинибом. В исследовании ORAL Shift у больных РА, достигших низкой активности заболевания в результате терапии тофацитинибом с метотрексатом, отмена последнего не приводила к ухудшению результатов лечения, в частности повышению частоты обострений, по сравнению с продолжением комбинированной терапии. Тофацитиниб стал первым ингибитором янус-киназ, зарегистрированным для лечения ПсА, псориаза и язвенного колита. В настоящее время изучаются новые показания к применению препаратов этой группы, в частности в клиническом исследовании 2 фазы была показана эффективность тофацитиниба у больных АС, что обосновывает дальнейшей изучение его в клинических исследованиях 3 фазы.
Используемые источники
- Насонов Е.Л. Новые подходы к фармакотерапии ревматоидного артрита:тофацитиниб. Научно-практическая ревматология 2014;52(2):209–21 [Naso -nov EL. New approaches to the treatment of rheumatoid arthritis. Nauchno-prak-ticheskaya revmatologiya = Rheumatology Science and Practice. 2014;52(2):209-21 (In Russ.)].
- Новиков П.И., Моисеев С.В. Тофацитиниб – первый пероральный ингиби-тор янус-киназ в лечении ревматоидного артрита. Клин фармакол тер2015;24(5):29-37 [Novikov PI, Moiseev SV. Tofacitinib, the first oral Janus-kinase inhibitor, in the treatment of rheumatoid arthritis. Klinicheskaya far-makologiya i terapiya = Clin Pharmacol Ther 2015;24(5):29-37 (In Russ.)].
- Новиков П.И., Моисеев С.В. Ингибиторы янус-киназ в лечении ревматоид-ного артрита. Клин фармакол тер 2017;26(4):26-32 [Novikov PI, Moiseev SV.Janus kinase inhibitors in the treatment of rheumatoid arthritis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2017;26(4):26-32 (In Russ.)].
- Virtanen A, Haikarainen T, Raivola J, Silvennoinen O. Selective JAKinibs: pro-spects in inflammatory and autoimmune diseases. BioDrugs 2019;33:15–32.
- Smolen JS, Landew R, Bijlsma J, et al. EULAR recommendations for the mana-gement of rheumatoid arthritis with synthetic and biological disease-modifyingantirheumatic drugs: 2016 update. Ann Rheum Dis 2017;76(6):960-77.
- Smolen JS, LandewéRBM, Bijlsma JWJ, et al. EULAR recommendations for themanagement of rheumatoid arthritis with synthetic and biological disease-modify-ing antirheumatic drugs: 2019 update. Ann Rheum Dis 2020, Published OnlineFirst: 22 January 2020. doi: 10.1136/annrheumdis-2019-216655.
- Dhillon S. Tofacitinib: A review in rheumatoid arthritis. Drugs 2017;77:1987-2001.
- van Vollenhoven RF, Fleischmann R, Cohen S, et al. Tofacitinib or adalimumabversus placebo in rheumatoid arthritis. N Engl J Med. 2012;367(6):508–19.
- Burmester GR, Blanco R, Charles-Schoeman C, et al. Tofacitinib (CP-690,550)in combination with methotrexate in patients with active rheumatoid arthritis withan inadequate response to tumour necrosis factor inhibitors: a randomised phase 3trial. Lancet 2013;381(9865):451–60.
- Genovese MC, Kremer J, Zamani O, et al. Baricitinib in patients with refractoryrheumatoid arthritis. N Engl J Med. 2016;374(13):1243–1252.
- Taylor PC, Keystone EC, van der Heijde D, et al. Baricitinib versus placebo oradalimumab in rheumatoid arthritis. N Engl J Med. 2017;376(7):652–662.
- Burmester GR, Kremer JM, Van den Bosch F, et al. Safety and efficacy of upa-dacitinib in patients with rheumatoid arthritis and inadequate response to conven-tional synthetic diseasemodifying anti-rheumatic drugs (SELECT-NEXT): arandomised, double-blind, placebo-controlled phase 3 trial. Lancet 2018;391(10139):2503–12.
- Genovese MC, Fleischmann R, Combe B, et al. Safety and efficacy of upadaciti-nib in patients with active rheumatoid arthritis refractory to biologic disease-modi-fying antirheumatic drugs (SELECT-BEYOND): a double-blind, randomisedcontrolled phase 3 trial. Lancet 2018;391(10139):2513–24.
- Gabay C, Riek M, Scherer A, Finckh A. Effectiveness of biologic DMARDs inmonotherapy versus in combination with synthetic DMARDs in rheumatoid art-hritis: data from the Swiss Clinical Quality Management Registry. Rheumatology2015;54(9):1664–72.
- Mariette X, Gottenberg JE, Ravaud P, Combe B. Registries in rheumatoid arthri-tis and autoimmune diseases: data from the French registries. Rheumatology(Oxford) 2011;50(1):222-9.
- Listing J, Strangfeld A, Rau R, et al. Clinical and functional remission: even tho-ugh biologics are superior to conventional DMARDs overall success rates remainlow - results from RABBIT, the German biologics register. Arthritis Res Ther.2006;8(3):R66.
- Soliman MM, Ashcroft DM, Watson KD et al. Impact of concomitant use ofDMARDs on the persistence with anti-TNF therapies in patients with rheumatoidarthritis: results from the British Society for Rheumatology Biologics Register.Ann Rheum Dis 2011;70:583-9.
- Emery P, Sebba A, Huizinga T. Biologic and oral disease-modifying antirheuma-tic drug monotherapy in rheumatoid arthritis. Ann Rheum Dis 2013;72(12):1897–904.
- Choquette D, Thomas O, Arundine M. Lower than expected levels of DMARDacquisition immediately preand post biologic initiation in rheumatoid arthritispatients. Arthr Rheumatol 2012;64 (suppl 10):1841.
- Fleischmann R, Kremer J, Cush J, et al; ORAL Solo Investigators. Placebo-cont-rolled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med2012;367(6):495-507.
- Fleischmann R, Mysler E, Hall S, et al; ORAL Strategy investigators. Efficacyand safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimu-mab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): aphase 3b/4, double-blind, head-to-head, randomised controlled trial. Lancet2017;390(10093):457-68.
- Fleischmann R, Schiff M, van der Heijde D, et al. Baricitinib, methotrexate, orcombination in patients with rheumatoid arthritis and no or limited prior disease-modifying antirheumatic drug treatment. Arthritis Rheumatol 2017;69(3):506-17.
- Smolen JS, Pangan AL, Emery P, et al. Upadacitinib as monotherapy in patientswith active rheumatoid arthritis and inadequate response to methotrexate(SELECT-MONOTHERAPY): a randomised, placebo-controlled, double-blindphase 3 study. Lancet 2019;393(10188):2303-11.
- Fautrel B, Den Broeder AA. De-intensifying treatment in established rheumatoidarthritis (rA): why, how, when and in whom can DMARDs be tapered? Best PractRes Clin Rheumatol 2015;29:550–65.
- Ghiti Moghadam M, Vonkeman HE, Ten Klooster PM, et al. Stopping tumornecrosis factor inhibitor treatment in patients with established rheumatoid arthritisin remission or with stable low disease activity: a pragmatic multicenter, open-label randomized controlled trial. Arthritis Rheumatol 2016;68:1810–7.
- van Herwaarden N, van der Maas A, Minten MJM, et al. Disease activity guideddose reduction and withdrawal of adalimumab or etanercept compared with usualcare in rheumatoid arthritis: open label, randomised controlled, non-inferioritytrial. BMJ 2015;350:h1389.
- Fautrel B, Pham T, Alfaiate T, et al. Step-down strategy of spacing TNF-blockerinjections for established rheumatoid arthritis in remission: results of the multi-centre non-inferiority randomised open-label controlled trial (STRASS: spacing ofTNF-blocker injections in rheumatoid arthritis study). Ann Rheum Dis2016;75:59–67.
- Schett G, Emery P, Tanaka Y, et al. Tapering biologic and conventional DMARDtherapy in rheumatoid arthritis: current evidence and future directions. AnnRheum Dis 2016;75:1428–37.
- van Mulligen E, de Jong PHP, Kuijper TM, et al. Gradual tapering TNF inhibi-tors versus conventional synthetic DMARDs after achieving controlled disease inpatients with rheumatoid arthritis: first-year results of the randomised controlledTARA study. Ann Rheum Dis 2019;78:746–53.
- Pablos JL, Navarro F, Blanco FJ, et al. Efficacy of tocilizumab monotherapy afterresponse to combined tocilizumab and methotrexate in patients with rheumatoidarthritis: the randomised JUST-ACT study. Clin Exp Rheumatol 2019; 37:437–44.
- Kremer JM, Rigby W, Singer NG, et al. Sustained response following disconti-nuation of methotrexate in patients with rheumatoid arthritis treated with subcu-taneous tocilizumab: results from a randomized, controlled trial. ArthritisRheumatol 2018;70:1200–08.
- Cohen SB, Pope J, Haraoui B, et al. Methotrexate withdrawal in patients withrheumatoid arthritis who achieve low disease activity with tofacitinib modified-release 11 mg once daily plus methotrexate (ORAL Shift): a randomised, phase3b/4, non-inferiority trial. Lancet Rheumatol 2019 Published Online August 6,2019 http://dx.doi.org/10.1016/S2665-9913(19)30005-0,
- Lamba M, Wang R, Fletcher T, Alvey C, Kushner J, Stock TC. Extended-releaseonce-daily formulation of tofacitinib: evaluation of pharmacokinetics comparedwith immediate-release tofacitinib and impact of food. J Clin Pharmacol2016;56:1362–71.
- Mease P, Hall S, FitzGerald O, et al. Tofacitinib or adalimumab versus placebofor psoriatic arthritis. N Engl J Med 2017;377 (16):1537–50.
- Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for psoriatic arthritis inpatients with an inadequate response to TNF inhibitors. N Engl J Med.2017;377(16):1525–36.
- Nash P, Coates LC, Fleischmann R, et al. Efficacy of tofacitinib for the treatmentof psoriatic arthritis: Pooled analysis of two phase 3 studies. Rheumatol Ther2018;5(2):567–82.
- van der Heijde D, Deodhar A, Wei JC, et al. Tofacitinib in patients with ankylo-sing spondylitis: a phase II, 16-week, randomised, placebo-controlled, dose-ran-ging study. Ann Rheum Dis 2017;76(8):13
