Внесуставные (системные) проявления ревматоидного артрита
В клиническом разборе обсуждаются системные, или внесуставные проявления (ревматоидные узелки, интерстициальное заболевание легких, поражение почек, ревматоидный васкулит и др.), которые встречаются по крайней мере у трети больных РА и должны учитываться при выборе тактики лечения. От системных проявлений РА следует отличать ассоциированные заболевания (сердечно-сосудистые осложнения на фоне ускоренного прогрессирования атеросклероза, венозные тромбоэмболические осложнения, анемия, психические расстройства), в основе которых лежит персистирующее воспаление, и осложнения медикаментозной терапии, например, интерстициальное поражение легких, вызванное метотрексатом, или различные варианты лекарственной нефропатии
С.В.Моисеев. В отличие от системной красной волчанки (СКВ), системной склеродермии, системных васкулитов и многих других аутоиммунных ревматических болезней, ревматоидный артрит (РА) считают заболеванием, преимущественно поражающим суставы. При этом внесуставные, или системные проявления РА в определенной степени игнорируются или по крайней мере недооцениваются [1]. Например, в рекомендациях Американской коллегии ревматологов (ACR) и Европейской антиревматической лиги (EULAR) 2010 года указано, что РА – это хроническое воспалительное заболевание, характеризующееся опуханием, болезненностью и деструкцией синовиальных суставов, а предложенные классификационные критерии РА включают в себя только признаки поражения суставов, длительность заболевания, наличие аутоантител и лабораторных признаков воспаления [2]. Конечно, можно согласиться с экспертами, что системные проявления РА не повышают точность диагноза, а скорее затрудняют его, требуя исключения многих других аутоиммунных заболеваний. Однако системные проявления не обсуждаются и в рекомендациях EULAR 2016 г. по лечению РА, которые предполагают выбор стратегии терапии только на основании динамики "суставных" индексов [3]. Более того, неблагоприятные прогностические факторы, приведенные в данных рекомендациях (высокие уровни острофазных белков и значения счета опухших суставов, наличие ревматоидного фактора и/или антител к цитруллинированным белкам, ранние эрозии, неэффективность по крайней мере двух базисных противовоспалительных препаратов), не включают в себя какие-либо системные проявления, такие как поражение легких, периферическую невропатию, амилоидоз почек или ревматоидный васкулит, которые, несомненно, ухудшают прогноз и влияют на тактику лечения [4].
Еще в середине прошлого века академик Е.М. Тареев писал: "участие внесуставных систем при ревматоидном артрите может быть даже более значительным, чем при ревматизме, поэтому нельзя представлять рев матоид как заболевание будто бы только суставов", а "изучение этого заболевания, несомненно, задерживалось необоснованным узким взглядом на болезнь как на местное заболевание суставов" [5,6]. Несколько позднее Е.М. Тареев и В.А. Насонова первыми в нашей стране описали поражение легких при РА в виде "своеобразно протекавшей интерстициальной пневмонии и гранулематоза". В клинике Е.М. Тареева активно изучались и другие внесуставные проявления РА, в частности поражение почек и амилоидоз (академик Н.А. Мухин, В.В. Сура).
П.И. Новиков. В литературе нет четкого определения внесуставных проявлений РА. Обычно к ним относят только поражение различных органов и тканей в рамках основного аутоиммунного процесса. Например, в российских клинических рекомендациях по ревматологии под редакцией академика Е.Л. Насонова 2017 г. выделены следующие внесуставные проявления РА [7]:
- ревматоидные узелки;
- кожный васкулит (язвенно-некротический васкулит, инфаркты ногтевого ложа, дигитальный артериит, ливедо-ангиит);
- васкулит других органов;
- невропатия (мононеврит, полиневропатия);
- плеврит (сухой, выпотной), перикардит (сухой, выпотной);
- синдром Шегрена;
- поражение глаз (склерит, эписклерит).
- интерстициальное заболевание легких (ИЗЛ).
Хотя этот список представляется достаточно исчерпывающим, он не включает в себя поражение почек, которое может наблюдаться не только в рамках ревматоидного васкулита. Серьезным осложнением РА остается АА-амилоидоз, хотя сегодня он встречается значительно реже в результате современной базисной противовоспалительной терапии, которую рекомендуют назначать всем больным РА. Отдельную проблему представляют различные заболевания, ассоциированные с РА, такие как ишемическая болезнь сердца, связанная с ускоренным развитием атеросклероза, тромбоэмболические осложнения, анемия, депрессия и другие психоневрологические нарушения. В зарубежной литературе эти состояния нередко относят к системным проявлениям РА, хотя они не являются специфичными для РА и связаны с хроническим персистирующим воспалением, наблюдающемся при любом аутоиммунном заболевании [8]. Это не снижает важность их изучения, так как сегодня больные РА чаще умирают не от прямых последствий заболевания, а от сердечно-сосудистых осложнений [9]. Особо следует выделить осложнения лекарственной терапии, которые иногда бывает трудно дифференцировать от внесуставных проявлений РА, например, интерстициальное поражение легких, вызванное метотрексатом, или лекарственную нефропатию. Многочисленные осложнения (остеопороз, катаракта, атрофия мышц, гипергликемия и др.) вызывают глюкокортикостероиды, которые к тому же обладают и атерогенным действием. Применение любых иммуносу прессивных препаратов сопровождается увеличением риска развития инфекционных осложнений.
В.В. Рамеев. Развитие АА-амилоидоза (вторичного, реактивного) при РА отражает персистирование воспаления на фоне недостаточно эффективной терапии, что патогенетически сближает его с сердечно-сосудистыми исходами или анемией, риск которых, как указано выше, при иммуновоспалительных заболеваниях также повышен. Отложения амилоида при АА-амилоидозе состоят в основном из сывороточного амилоидного белка (SАА), который является одним из основных белков острой фазы воспаления. SAA синтезируется гепатоцитами под действием провоспалительных цитокинов, в частности интерлейкина (ИЛ)-6 [10]. В прошлом AA-амилоидоз занимал первое место в структуре амилоидоза, однако сегодня он уступает AL-амилоидозу, что в значительной степени связано с успехами в лечении РА и других ревматических заболеваний.
С.В. Моисеев. Как часто встречаются внесуставные проявления у больных РА? Какое влияние они оказывают на прогноз?
Н.М. Буланов. Внесуставные проявления наблюдаются у 20-40% больных РА, в том числе тяжелые – у 1-20% [11,12]. По данным когортного исследования ERAS, в рамках которого 1429 больных РА наблюдали в течение в среднем 9 лет, наиболее частыми внесуставными проявлениями заболевания были ревматоидные узелки (32%), синдром Шегрена (10%), феномен Рейно (10%) и поражение легких (5%), реже встречались васкулит (3%), нейромиопатии (1%) и синдром Фелти (<1%) [13]. Сходные данные были получены в ретроспективном исследовании у 609 больных РА, медиана длительности наблюдения которых составила около 11 лет. Кумулятивная частота внесуставных проявлений достигла 40,6%, в том числе ревматоидных узелков – 34,0%, синдрома Шегрена – 11,4%, фиброза легких – 6,8% [14]. У 12,8% пациентов были выявлены тяжелые внесуставные проявления в соответствии с критериями, предложенными исследователями из Мальме (Швеция) [15]: перикардит/плеврит, синдром Фелти, "большой" кожный васкулит, невропатия, поражение органа зрения (склерит, эписклерит или васкулит сетчатки), гломерулонефрит или васкулит с поражением других органов. Следует учитывать, что любые данные о частоте внесуставных проявлений РА относительны, так как они зависят от длительности наблюдения пациентов, критериев оценки и методов исследования. Например, очевидно, что частота диагностики ИЗЛ при компьютерной томографии высокого разрешения будет выше, чем при обычной рентгенографии легких, а небольшой выпот в полости перикарда может быть выявлен только с помощью эхокардиографии, которую проводят далеко не всем больным РА.
Во многих исследованиях была отмечена ассоциация между внесуставными проявлениями РА и неблагоприятными исходами, в частностью смертностью [16]. Например, в одном исследовании наличие любого внесуставного проявления сопровождалось более чем двукратным увеличением риска смерти [12], хотя, вероятно, эта ассоциация характерна только для тяжелых внесуставных проявлений [17]. В исследовании ERAS значительное увеличение риска смерти было выявлено у пациентов с ИЗЛ и нейромиопатиями, в то время как ревматоидные узелки и синдром Шегрена ассоциировались с ухудшением функциональных исходов, а ревматоидные узелки – с эрозиями суставных поверхностей [13]. Присоединение новых внесуставных проявлений приводит к дальнейшему ухудшению выживаемости [18]. Увеличение риска смерти может быть следствием как самих внесуставных проявлений, например, поражения легких или амилоидоза почек, так и сопутствующих заболеваний, прежде всего сердечно-сосудистых исходов, которые чаще наблюдаются при тяжелом и неконтролируемом течении РА [18]. В целом приведенные данные свидетельствуют о том, что внесуставные проявления могут служить маркером более тяжелого течения РА, что необходимо учитывать при выборе тактики лечения.
Л.А. Акулкина. Поражение бронхолегочной системы при РА проявляется интерстициальными изменениями легочной ткани, бронхиолитом, бронхоэктазами, васкулитом легочных сосудов, интрапаренхиматозными ревматоидными узлами [19]. ИЗЛ – это наиболее распространенный вариант поражения легких, ассоциированный с повышенной смертностью. Клинически явное ИЗЛ отмечается у 2-10% пациентов с РА, тогда как у 33-61% больных выявляют признаки ИЗЛ при отсутствии респираторной симптоматики [20,21]. В отдельных случаях поражение легких может предшествовать появлению симптомов артрита. К факторам, ассоциировавшимся с развитием РА-ИЗЛ, относят старший возраст, мужской пол, курение, антитела к цитруллинированным пептидам (АЦЦП) и IgM-ревматоидный фактор (РФ), а также активность суставного процесса [22,23]. Cимптомы РА-ИЗЛ неспецифичны и включают в себя одышку при физической нагрузке, повышенную утомляемость и малопродуктивный кашель [24]. При наличии выраженного суставного синдрома, ограничивающего физическую активность пациента, клинические проявления заболевания легких могут отсутствовать вплоть до развития тяжелых вентиляционных нарушений. В связи с преимущественным поражением нижних долей легких наиболее частым аускультативным феноменом (72-100%) является симметричная двусторонняя крепитация в базальных отделах [21]. При функциональном исследовании характерен рестриктивный паттерн вентиляционных нарушений (5-25% пациентов с РА) и снижение диффузионной способности легких (20-45%) [25]. Главный метод диагностики РА-ИЗЛ – компьютерная томография высокого разрешения (КТВР) органов грудной клетки, которую следует всегда проводить при подозрении на наличие поражения легких. Наиболее частыми пат тернами РА-ИЗЛ (до 70%) являются обычная интерстициальная пневмония (ОИП) и неспецифическая интерстициальная пневмония (НСИП) [19]. Для ОИП типично наличие двусторонних ретикулярных изменений, зон "сотового легкого" в периферических субплевральных отделах легких с преобладанием в нижних долях (рис. 1). НСИП характеризуется наличием симметричных уплотнений по типу "матового стекла", умеренных ретикулярных изменений, расположенных на периферии, с относительной сохранностью субплевральных отделов, также с преобладанием в нижних долях. Реже при РА-ИЗЛ выявляют организующую (ОП) и лимфоцитарную пневмонии (ЛИП) [26]. Дифференциальный диагноз РА-ИЗЛ проводят с инфекционными осложнениями, лекарственным поражением легких, застойными явлениями в малом круге при левожелудочковой сердечной недостаточности. Метотрексат-индуцированное поражение легких отмечается у 1% пациентов, получающих терапию данным препаратом, и может имитировать НСИП, но, в отличие от РА-ИЗЛ, чаще имеет острое либо подострое течение и хронологическую связь с началом лекарственной терапии [27].
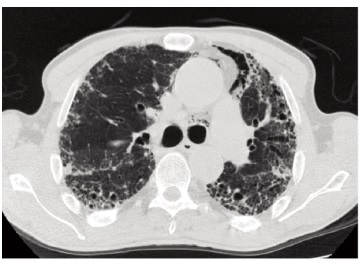
М.Ю. Бровко. Иммуносупрессивная терапия глюкокортикостероидами и цитоста тическими препаратами (микофенолата мофетилом, лефлуномидом, метотрексатом) составляет основу лечения РА-ИЗЛ. ГИБП, в частности ритуксимаб или ингибиторы ФНО-α, могут быть использованы в случае рефрактерного течения заболевания [19]. В целом, эффективность иммуносупрессивной терапии выше у пациентов с воспалительными паттернами ИЗЛ, такими как клеточный вариант НСИП и ОП. И наоборот, фиброзирующие подтипы ИЗЛ, особенно ОИП, могут иметь непрерывно прогрессирующее течение, сходное с идиопатическим легочным фиброзом, и средней продолжительностью жизни 3-4 года [28]. В настоящее время активно изучается эффективность антифибротической терапии в лечении прогрессирующих фиброзирующих форм РА-ИЗЛ. Завершенное в 2019 г. многоцентровое рандомизиро ванное клиническое исследование INBUILD показало, что нинтеданиб по сравнению с плацебо замедляет прогрессирование легочного поражения в данной группе пациентов [29].
Н.В. Чеботарева. Возможные варианты поражения почек при РА включают в себя гломерулонефрит, ААамилоидоз, ревматоидный васкулит и различные формы лекарственной нефропатии (табл. 1) [30]. В отличие от СКВ, хронический гломерулонефрит при РА встречается редко, в то время как частота АА-амилоидоза при этом заболевании, наоборот, выше, чем при СКВ. В прошлом важную роль в этиологии поражения почек у больных РА играли нефротоксичные лекарственные средства, такие как D-пеницилламин, циклоспорин, препараты золота, нестероидные противовоспалительные препараты (НПВП). В последние годы широкое применение более безопасных БПВП, в том числе метотрексата, лефлуномида и сульфасалазина, а также ГИБП привело к снижению доли лекарственной нефропатии в структуре поражения почек у больных РА. Тем не менее, многие пациенты с РА по-прежнему нередко принимают НПВП, которые могут вызвать интерстициальный нефрит. Кроме того, более ранняя и агрессивная базисная терапия привела к снижению частоты АА-амилоидоза у пациентов с РА, хотя он остается одним из основных вариантов нефропатии при этом заболевании. Например, в клинике им. Е.М. Тареева АА-амилоидоз при гистологическом исследовании почечных биоптатов был диагностирован у 41% больных РА с нефропатией. Сходные данные приводят и некоторые другие авторы [31]. Развитие АА-амилоидоза ассоциировалось с большей длительностью заболевания (>15 лет) и недостаточным контролем воспаления, характеризовавшимся стойким повышением уровня СРБ (>15 мг/л) [32]. Другим частым вариантом поражения почек при РА является мезангиопролиферативный гломерулонефрит, реже встречаются другие формы нефропатии, в том числе мембранозный гломерулонефрит, болезнь минимальных изменений, фокальный сегментарный гломерулосклероз.
| Гломерулонефрит |
| - Мезангиопролиферативный гломерулонефрит |
| - IgA-нефропатия |
| - Мембранозный гломерулонефрит (медикаментозный и немедикаментозный |
| - Болезнь минимальных изменений |
| - Фокальный сегментарный гломерулосклероз |
| Интерстициальный нефрит |
| - НПВП |
| Папиллярный некроз |
| - Лекарства |
| Ревматоидный васкулит |
| ХБП, обусловленная сердечно-сосудистыми заболеваниями |
| - Пожилой возраст |
| - Артериальная гипертония |
| - Сахарный диабет |
Клинические проявления поражения почек включают в себя протеинурию, изменения мочевого осадка и/или снижение расчетной скорости клубочковой фильтрации. Нарастающая протеинурия с развитием нефротического синдрома, не сопровождающаяся изменениями мочевого осадка и артериальной гипертонией, наблюдается при амилоидозе почек, а также при мембранозной нефропатии, в то время как мезангиопролиферативный гломерулонефрит при РА обычно характеризуется легким течением и редким развитием нефротического синдрома и хронической почечной недостаточности [30]. Следует отметить, что изменения в моче и клинические симптомы не позволяют надежно предсказать тип поражения почек при РА, поэтому пациентам с необъяснимыми протеинурией и хронической болезнью почек показана биопсия почки.
Несмотря на относительную редкость развития хронического гломерулонефрита и АА-амилоидоза, ХБП встречается более чем у половины больных РА, а частота ее превышает таковую в общей популяции [33]. Например, в недавно опубликованном ретроспективном исследовании, проведенном в Японии, исходно ХБП была выявлена у 24,5% из 1077 больных РА, в том числе снижение расчетной скорости клубочковой фильтрации (рСКФ) <60 мл/мин/1,73 м2 – у 20,6%, протеинурия – у 8,0%, снижение рСКФ и протеинурия – у 4,1% [34]. Кумулятивная частота развития ХБП и дисфункции почек в течение 10 лет достигла 62,5% и 49,9%, соответственно. Hickson и соавт. наблюдали развитие дисфункции почек в течение 20 лет у 25,1% из 739 больных РА без исходного снижения рСКФ<60 мл/мин/1,73 м2 [35]. Важную роль в развитии ХБП при РА играют сердечно-сосудистые заболевания и сахарный диабет, а также возраст. По данным United States Renal Data System (USRDS), причинами поражения почек у 3754 больных РА с терминальной хронической почечной недостаточностью в 33,5% случаев был сахарный диабет, а в 30,6% – артериальная гипертония, в то время как совокупная доля амилоидоза, васкулита и анальгетической нефропатии составляла всего 10,0% [36]. Как и в общей популяции, ХБП у больных РА ассоциируется с увеличением риска сердечно-сосудистых исходов и смерти [37].
Важное значение для профилактики развития и прогрессирования АА-амилоидоза и хронического гломерулонефрита у больных РА имеет адекватная базисная терапия, обеспечивающая стойкое подавление воспалительной активности. В когортном исследовании у 20757 американских ветеранов войн с РА терапия ГИБП, начатая у 4617 пациентов, ассоциировалась с достоверным снижением риска развития ХБП и замедлением снижения рСКФ [38]. При лекарственной нефропатии в первую очередь следует отменить лекарственный препарат, вызвавший поражений почек. Наличие ХБП следует учитывать при выборе противовоспалительных препаратов и их доз. Например, метотрексат и НПВП противопоказаны больным с клиренсом креатинина ≤30 мл/мин, а дозу тофацитиниба следует снизить до 5 мг один раз в день у пациентов с клиренсом креатинина ≤50 мл/мин [30]. В то же время коррекция доз ГИБП, в том числе ингибиторов ФНО-α, ритуксимаба, абатацепта, тоцилизумаба и сарилумаба, у пациентов с ХБП не требуется.
П.И. Новиков. Ревматоидный васкулит, который поражает сосуды небольшого и среднего диаметра практически любых органов, – это нечастое внесуставное проявление РА, которое наблюдается у 2-3% больных [39,40]. В последние годы частота ревматоидного васкулита снизилась, по-видимому, на фоне более ранней и агрессивной терапии РА [12]. К факторам риска развития ревматоидного васкулита относят мужской пол, серопозитивность, длительное и более тяжелое течение РА, в том числе наличие ревматоидных узелков и эрозий суставных поверхностей, а также оперативные вмешательства на суставах [19]. У 90% больных ревматоидным васкулитом развивается поражение кожи: дигитальные инфаркты, незаживающие язвы, пальпируемая пурпура, гангренозная пиодермия. К характерным проявлениям васкулита относят также поражение периферической нервной системы (сенсорная и/или двигательная полиневропатия, множественный мононеврит) и органа зрения (склерит, эписклерит, язвенный кератит, васкулит сосудов сетчатки), реже встречается поражение других органов, в том числе легких, почек, желудочно-кишечного тракта, сердца. Примером ревматоидного васкулита у мужчины с тяжелым серопозитивным РА может служить следующее наблюдение.
Т.П. Шевцова. Пациент Б., 44 лет, госпитализирован в клинику им. Е.М. Тареева в июне 2016 года. В течение 4 лет страдает серопозитивным РА с поражением суставов кистей, коленных и голеностопных суставов. Перенес эписклерит. В течение короткого времени принимал метилпреднизолон в дозе 24 мг. Предпри ни м а лись попытки лечения метотрексатом и лефлуномидом, однако оба БПВП были отменены из-за плохой переносимости. В течение 3 мес лихорадка, нарастающая слабость и онемение в дистальных отделах конечностей. При обследовании в клинике резкое снижение силы в конечностях, ревматоидный узелок в области левого локтевого сустава, опухание и деформация суставов кистей, сетчатое ливедо. СОЭ 84 мм/ч, СРБ 47 мг/л, резкоположительные РФ и АЦЦП. Криоглобулины не определялись. Отмечалась небольшая протеинурия (0,5 г/сут) при отсутствии изменений мочевого осадка. При рентгенографии кистей выявлены выраженный склероз, снижение высоты суставных щелей, максимально выраженное в проксимальных межфаланговых суставах, остеопороз в диафизах, вывихи пястно-фаланговых суставов с признаками разрушения суставных поверхностей. На компьютерных томограммах легких определялись немногочисленные очаги размером до 6 мм и небольшой левосторонний выпот. Пациент консультирован неврологом, который расценил имеющиеся неврологические нарушения как проявления множественного неврита в рамках основного заболевания. Диагно стирован серопозитивный РА высокой степени активности с системными проявлениями в виде ревматоидного васкулита (множественные невриты, плеврит, эписклерит, сетчатое ливедо), поражения легких, ревматоидных узелков. Больному проводилась терапия метилпреднизолоном в сверх-высоких дозах внутривенно (3 г) и внутрь (40 мг) и циклофосфамидом внутривенно, которая привела к значительному уменьшению воспалительной активности и увеличению силы в конечностях.
Несмотря на отсутствие типичного поражения кожи и гистологического подтверждения, диагноз ревматоидного васкулита не вызывал сомнения, учитывая наличие характерных неврологических нарушений (множественного мононеврита) и эписклерита в анамнезе. Другие причины васкулита, в частности криоглобулинемия, выявлены не были. Обращали на себя внимание высокие титры аутоантител, тяжелое и неконтролируемое (пациент фактически не получал БПВП) течение заболевания с выраженными деструктивными изменениями суставов, которые, как указано выше, являются факторами риска развития ревматоидного васкулита. У пациентов с изолированным поражением кожи, проявляющимся небольшими инфарктами околоногтевого ложа, возможна терапия стандартными БПВП, однако в более тяжелых случаях, особенно при наличии поражения периферической нервной системы, почек и других органов, пациентам с ревматоидным васкулитом показана терапия высокими дозами глюкокортикостероидов и циклофосфамидом. Возможно также назначение ритуксимаба, учитывая положительный опыт его применения при АНЦА-ассоциированных и криоглобулинемическом васкулитах. По данным французского регистра AIR, лечение ритуксимабом позволило достичь полной ремиссии ревматоидного васкулита у 71% из 17 пациентов через 6 мес и у 82% через 12 мес [41]. Описаны также случаи успешного применения абатацепта и тоцилизумаба при этом состоянии [42-44].
С.В. Моисеев. Яркие системные проявления (лихорадка, кожная сыпь, миалгии и др.) в сочетании с серонегативным артритом наблюдаются при болезни Стилла взрослых, которая в Международной классификации болезней Х пересмотра отнесена к "другим ревматоидным артритам". В чем сходство и отличия между этим заболеванием и "классическим" РА?
П.И. Новиков. Основные клинические проявления болезни Стилла взрослых включают в себя высокую лихорадку (60-100% больных), артралгии и артриты с поражением мелких и крупных суставов (70-100%) и преходящие розовые макулопапулярные высыпания на проксимальных частях конечностей и туловище, возникающие на высоте лихорадки (60-80%) [45,46]. Реже встречаются миалгии, периферическая лимфаденопатия, увеличение печени и селезенки, плеврит, перикардит, снижение массы тела, боль в животе. Появлению первых симптомов может предшествовать боль в горле. В анализах крови определяются повышение СОЭ и концентрации СРБ, нейтрофильный лейкоцитоз, а также анемия и тромбоцитоз, повышение активности аминотрансфераз, однако РФ, АЦЦП и другие ауто антитела отсутствуют. Классификационные критерии болезни Стилла, предложенные М. Yamaguchi и соавт. еще в 1992 г., приведены в табл. 2 [47]. В части случаев болезнь Стилла взрослых заканчивается выздоровлением или, наоборот, характеризуется рецидивирующим течением, однако у 40% пациентов наблюдается персистирующий полиартрит, в том числе эрозивный, который клинически трудно дифференцировать от РА. Важную роль в патогенезе болезни Стилла играет аутовоспаление, пусковым механизмом которого считают образование инфламмасомы, в состав которой входят криопирин или другие родственные белки, вспомогательный белок ASC и прокаспаза-1, превращающаяся в активную каспазу-1. Последняя вызывает активацию провоспалительных цитокинов ИЛ-1b и ИЛ-18, индуцирующих выделение других цитокинов, в том числе ИЛ-6, ИЛ-8 и фактора некроза опухоли (ФНО)-α. В отличие от наследственных аутовоспалительных заболеваний, таких как криопирин-ассоциированный периодический синдром, у пациентов с болезнью Стилла не обнаружены какие-либо специфические мутации генов. Бóльшая длительность обострений и возможность деструктивных изменений суставов также сближают болезнь Стилла взрослых с аутоиммунными заболеваниями, прежде всего РА [45]. Основа лечения болезни Стилла взрослых – глюкокортикостероиды, которые обычно сочетают со стандартными БПВП, оказывающими стероидосберегающее действие [48]. При неэф фективности глюкокортикостероидов или развитии стероидозависимости могут быть использованы ГИБП, в частности ингибиторы рецепторов ИЛ-6 [49]. Эффективность нового препарата этой группы – сарилумаба в лечении болезни Стилла взрослых иллюстрирует следующее наблюдение.
| Большие критерии | Малые критерии | Критерии исключения |
|---|---|---|
| Примечание: необходимо наличие по крайней мере 5 критериев, в том числе по крайней мере 2 больших | ||
| Лихорадка (39°С и более) ≥1 недели Артралгии или артрит ≥2 недель Типичная сыпь Лейкоцитоз ≥10000 в мм3и ≥80% полиморфноядерных лейкоцитов | Боль в горле Периферическая лимфаденопатия Увеличение печени или селезенки Повышение активности аминотрансфераз Отсутствие антинуклеарных антител и ревматоидного фактора | Инфекции Злокачественные опухоли (в основном лимфома) Другие ревматические заболевания, в частности системные васкулиты |
Н.Е. Никуленкова. Пациент П., 27 лет. В мае 2016 года после укуса пчелы появились лихорадка до 39оС, боли в горле, боли в суставах кистей, локтевых и голеностопных суставах, миалгии, увеличение селезенки. При обследовании во Владимирской областной клинической больнице выявлены нейтрофильный лейкоцитоз (16 × 109/л), увеличение СОЭ (42 мм/ч) и содержания СРБ (76 мг/л). Активность аминотрансфераз была в пределах нормы. Антитела к ДНК, антинуклеарный фактор, антитела к цитоплазме нейтрофилов, РФ и АЦЦП не обнаружены. Диагно стирован серонегативный ревматоидный артрит с системными проявлениями (болезнь Стилла). На фоне терапии преднизолоном в стартовой дозе 60 мг/сут состояние быстро нормализовалось.
В октябре 2017 года через 5 мес после отмены глюкокортикостероидов развился рецидив заболевания, проявлявшийся лихорадкой, полиартритом, макулопапулезной сыпью, миалгиями, болями в горле. При обследовании обращали на себя внимание выраженный лейкоцитоз (34 × 109/л) со сдвигом лейкоцитарной формулы влево, увеличение СОЭ и содержания СРБ. При трепанобиопсии костного мозга данных за гематологическое заболевание нет. Аутоантитела не обнаружены. Возобновлена терапия метилпреднизолоном в дозе 24 мг/сут, назначен метотрексат в дозе 10 мг/нед, который вскоре пришлось отменить из-за развития пневмонии. В течение нескольких месяцев состояние оставалось удовлетворительным, однако с апреля 2018 год вновь ухудшение состояния, в связи с чем проводилась терапия метилпреднизолоном в дозе 24 мг/сут и метотрексатом в дозе 25 мг/нед. Неоднократные попытки снижения доз иммуносупрессивных препаратов сопровождались возобновлением лихорадки, кожных высыпаний, полиартрита, повышением СОЭ и уровня СРБ, в связи с чем в августе 2019 года начато лечение сарилумабом в дозе 200 мг подкожно каждые 2 недели, которое привело к быстрому улучшению состояния. В течение 4 мес состояние удовлетворительное, лихорадки нет, боли в суставах не беспокоят, СОЭ и концентрация СРБ нормализовались. Доза метилпреднизолона снижена до 4 мг/сут, а метотрексата – до 10 мг/нед.
В представленном наблюдении диагноз болезни Стилла не вызывал сомнения, учитывая наличие практически всех больших и малых классификационных критериев, включая серонегативный полиартрит, и отсутствие других ревматических и гематологических заболеваний или инфекций. Хотя первоначально лечение глюкокортикостероидами было эффективным и позволяло достичь достаточно длительных ремиссий, тем не менее, в последующем на протяжении примерно одного года наблюдалось непрерывно рецидивирующее течение заболевания несмотря на постоянную терапию глюкокортикостероидами и метотрексатом в терапевтической дозе. Применение сарилумаба быстро привело к улучшению состояния пациента и нормализации лабораторных показателей воспаления и позволило снизить дозы иммуносупрессивных препаратов. Выбор сарилумаба для лечения пациента определялся установленной ролью ИЛ-6 в развитии воспалительного ответа при ревматических заболеваниях. ИЛ-6 вызывает продукцию печенью различных острофазных белков, которые усиливают иммунный ответ путем выделения провоспалительных цитокинов, активации комплемента и стимуляции хемотаксиса нейтрофилов [50]. Персисти рование воспаления, сопровождающегося увеличением секреции SAA, создавало угрозу развития АА-амилоидоза. Кроме того, ИЛ-6 вызывает лихорадку и секрецию гепцидина, участвующего в регуляции обмена железа. Повышенную продукцию этого белка считают причиной развития анемии при хронических заболеваниях.
П.И. Новиков. Сарилумаб – это человеческое IgG1 моноклональное антитело, которое взаимодействует с растворимыми и мембранными рецепторами ИЛ-6 [51]. Эффективность и благоприятный профиль безопасности сарилумаба в комбинации со стандартными БПВП или в виде монотерапии подтверждены в двойных слепых, рандомизированных, плацебо-контролируемых исследованиях MOBILITY, TARGET и MONARCH у пациентов с активным РА, не ответивших на стандартные БПВП и/или ингибиторы ФНО-α [5254]. В этих исследованиях применение сарилумаба по сравнению с плацебо привело к уменьшению симптомов, улучшению физической функции и замедлению прогрессирования структурных изменений суставов у больных РА высокой или умеренной степени активности. В исследовании MOBILITY лечение сарилумабом вызывало значительное снижение уровней биомаркеров тканевой деструкции, деградации хряща и синовиального воспаления (p<0,05 по сравнению с плацебо) [55]. В последние годы обсуждается роль ИЛ-6 в развитии не только АА-амилоидоза, сердечно-сосудистых заболеваний и анемии, но и депрессивных расстройств, которые наблюдаются примерно у 40% пациентов с РА [56]. Связь депрессии с хроническим воспалением подтверждается экспериментальными, клиническими и эпидемиологическими исследованиями [57]. Депрессия сопровождается снижением ответа на лечение и является одной из причин хронической усталости, которая также характерна для больных РА. В исследовании MOBILITY лечение сарилумабом вызывало значительное уменьшение усталости, которую оценивали по шкале FACIT-F, уже через 2 недели после начала лечения, а достигнутый эффект сохранялся в течение 52 недель [58].
С.В. Моисеев. Системные, или внесуставные проявления (ревматоидные узелки, интерстициальное заболевание легких, поражение почек, ревматоидный васкулит и др.) часто встречаются у больных РА, могут быть причиной ухудшения функциональной активности и инвалидизации, а иногда и смерти пациентов и, соответственно, должны учитываться при выборе тактики лечения. От системных проявлений РА следует отличать ассоциированные заболевания (сердечно-сосудистые осложнения на фоне ускоренного прогрессирования атеросклероза, венозные тромбоэмболические осложнения, анемия, психические расстройства), в основе которых лежит персистирующее воспаление, и осложнения медикаментозной терапии, например, интерстициальное поражение легких, вызванное метотрексатом, или различные варианты лекарственной нефропатии.
Используемые источники
- Муравьев Ю.В. Внесуставные проявления ревматоидного артрита. Научно-практическая ревматология 2018;56(3):356-62 [Muravyev YuV. Extra-articularmanifestations of rheumatoid arthritis. Nauchno-Prakticheskaya Revmatologiya =Rheumatology Science and Practice. 2018;56(3):356-62 (In Russ.)].
- Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classificationcri-teria: an American College of Rheumatology/European League AgainstRheumatism collaborative initiative. Ann Rheum Dis 2010;69:1580–8.
- Smolen JS, Landew R, Bijlsma J, et al. EULAR recommendations for the mana-gement of rheumatoid arthritis with synthetic and biological disease-modifyingantirheumatic drugs: 2016 update. Ann Rheum Dis 2017;76(6):960-77.
- Бестаев ДВ, Каратеев ДЕ, Насонов ЕЛ. Системные проявления ревматоид-ного артрита. Научно-практическая ревматология 2013;51(1):76-80 [BestaevDV, Karateev DE, Nasonov EL. Systemic manifestations of rheumatoid arthritis.Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice.2013;51(1):76-80 (In Russ.)].
- Тареев Е.М. К учению о так называемом неспецифическом инфекционномартрите. Советская медицина 1953;(6):15-21 [Tareev EM. To the doctrine ofthe so-called nonspecific infectious arthritis. Sovetskaya Meditsina 1953;(6):15-21(In Russ.)].
- Тареев Е.М. Висцеральные поражения при системных васкулитах и ревма-тоидном артрите. Советская медицина 1956;(5):10-8 [Tareev EM. Viscerallesions in systemic vasculitis and rheumatoid arthritis. Sovetskaya Meditsina1956;(5):10-8 (In Russ.)].
- Насонов Е.Л. (ред.). Российские клинические рекомендации. Ревматология.Москва: ГЭОТАР-Медиа; 2017. 464 с. [Nasonov EL, editor. Rossiyskie klinic-heskie rekomendatsii. Revmatologiya (Russian clinical guidelines. Rheumatology).Moscow: GEOTAR-Media; 2017:464 p. (In Russ.)].
- Moreland LW, Curtis JR. Systemic nonarticular manifestations of rheumatoid art-hritis: focus on inflammatory mechanisms. Semin Arthritis Rheum 2009;39:132-43.
- Young A, Koduri G, Batley M et al. Mortality in rheumatoid arthritis. Increasedin the early course of disease, in ischaemic heart disease and in pulmonary fibro-sis. Rheumatology (Oxford) 2006;45:350–7.
- Urieli-Shoval S, Linke RP, Matzner Y. Expression and function of serum amyloidA, a major acute-phase protein, in normal and disease states. Curr Opin Hematol2000;7(1):64–9.
- Prete M, Racanelli V, Digiglio L, Vacca A, Dammacco F, Perosa F. Extra-arti-cular manifestations of rheumatoid arthritis: an update. Autoimmun Rev 2011;11:123-31.
- Myasoedova E, Crowson CS, Turesson C, et al. Incidence of extraarticular rheu-matoid arthritis in Olmsted County, Minnesota, in 1995-2007 versus 1985-1994: apopulation-based study. J Rheumatol 2011;38:983-9.
- Young A, Koduri G. Extra-articular manifestations and complications of rheuma-toid arthritis. Best Pract Res Clin Rheumatol 2007;21(5):907-27.
- Turesson C, O'Fallon WM, Crowson CS, Gabriel SE, Matteson EL. Extra-articu-lar disease manifestations in rheumatoid arthritis: incidence trends and risk factorsover 46 years. Ann Rheum Dis 2003;62(8):722-7.
- Turesson C, Jacobsson L, Bergstrom U. Extra-articular rheumatoid arthritis; pre-valence and mortality. Rheumatology (Oxford) 1999;38:668–74.
- Gabriel SE, Crowson CS, Kremers HM, et al. Survival in rheumatoid arthritis: apopulation-based analysis of trends over 40 years. Arthritis Rheum 2003;48:54-8.
- Turesson C, O'Fallon WM, Crowson CS, et al. Occurrence of extraarticular disea-se manifestations is associated with excess mortality in a community based cohortof patients with rheumatoid arthritis. J Rheumatol 2002;29:62-7.
- Turesson C, McClelland RL, Christianson TJ, Matteson EL. Multiple extraarticu-lar manifestations are associated with poor survival in patients with rheumatoidarthritis. Ann Rheum Dis 2006;65:1533–4.
- Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid art-hritis. Clin Chest Med 2019;40(3):545-60.
- Hyldgaar, C, Hilberg O, Pedersen AB, et al. A population-based cohort study ofrheumatoid arthritis-associated interstitial lung disease: Comorbidity and mortali-ty. Ann Rheum Dis 2017;76:1700–6.
- Gochuico BR, Avil, NA, Chow CK, et al. Progressive preclinical interstitial lungdisease in rheumatoid arthritis. Arch Intern Med 2008;168:159–66.
- Restrepo JF, del Rincn I, Battafarano DF, et al. Clinical and laboratory factorsassociated with interstitial lung disease in rheumatoid arthritis. Clin Rheumatol2015;34:1529–36.
- Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality ofinterstitial lung disease in rheumatoid arthritis: A population-based study. ArthritisRheum 2010;62:1583–91.
- Dawson JK, Fewins HE, Desmond J, et al. Fibrosing alveolitis in patients withrheumatoid arthritis as assessed by high resolution computed tomography, chestradiography, and pulmonary function tests. Thorax 2001:56:622–7
- Avnon LS, Manzur F, Bolotin A, et al. Pulmonary functions testing in patientswith rheumatoid arthritis. Isr Med Assoc J 2009;11:83–7.
- Juge PA, Lee JS, Ebstein E, et al. MUC5B promoter variant and rheumatoid art-hritis with interstitial lung disease. N Engl J Med 2018;379:2209–19.
- Fragoulis GE, Nikiphorou E, Larsen J, et al. Methotrexate-associated pneumoni-tis and rheumatoid arthritis-interstitial lung disease: current concepts for the diag-nosis and treatment. Front Med 2019;6:238.
- Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lungdiseases: Current practice in diagnosis and management. Curr Med Res Opin2019;35:2015–24.
- Flaherty KR, Wells AU, Cottin V. Nintedanib in progressive fibrosing interstitiallung diseases. N Engl J Med 2019;381(18):1718-27.
- Kapoor T, Bathon J. Renal Manifestations of Rheumatoid Arthritis. Rheum DisClin North Am 2018;44(4):571-84.
- G is М, Carvalho А, Sousa Р et al. Renal involvement in rheumatoid arthritis: analysis of 53 renal biopsies. Port J Nephrol Hypert 2017;31(1):25-30.
- Саркисова И.А., Рамеев В.В., Козловская Л.В. Факторы риска развития ипрогрессирования АА-амилоидоза у больных ревматоидным артритом.Нефрология и диализ 2007; 9( 3):346.
- Chiu HY, Huang HL, Li CH, et al. Increased risk of chronic kidney disease inrheumatoid arthritis associated with cardiovascular complications - A nationalpopulation-based cohort study. PLoS One 2015;10(9):e0136508.
- Tokoroyama T, Ando M, Setoguchi K, et al. Prevalence, incidence and prognosisof chronic kidney disease classified according to current guidelines: a large retro-spective cohort study of rheumatoid arthritis patients. Nephrol Dial Transplant2017;32(12):2035-42.
- Hickson LJ, Crowson CS, Gabriel SE, et al. Development of reduced kidneyfunction in rheumatoid arthritis. Am J Kidney Dis 2014;63(2):206-13.
- Paudyal S, Yang FM, Rice C, et al. End-stage renal disease in patients with rheu-matoid arthritis. Semin Arthritis Rheum 2017;46(4):418-22.
- Sihvonen S, Korpela M, Mustonen J, et al. Renal disease as a predictor of increa-sed mortality among patients with RA. Nephron Clin Pract 2004;96(4):107–14.
- Sumida K, Molnar MZ, Potukuchi PK, et al. Treatment of rheumatoid arthritiswith biologic agents lowers the risk of incident chronic kidney disease. Kidney Int.2018;93(5):1207-16.
- Kishore S, Maher L, Vikas M. Rheumatoid vasculitis: a diminishing yet devasta-ting menace. Curr Rheumatol Rep 2017;19:39.
- Makola A, Mattesona EL, Warrington KJ. Rheumatoid vasculitis: an update. CurrOpin Rheumatol 2015;27:63-70.
- Puechal X, Gottenberg JE, Berthelot JM, et al. Rituximab therapy for systemicvasculitis associated with rheumatoid arthritis: results from the AutoImmunity andRituximab Registry. Arthritis Care Res (Hoboken) 2012;64(3):331–9.
- Fujii W, Kohno M, Ishino H, et al. The rapid efficacy of abatacept in a patientwith rheumatoid vasculitis. Mod Rheumatol. 2012;22(4):630–4.
- Iijima T, Suwabe T, Sumida K, et al. Tocilizumab improves systemic rheumatoidvasculitis with necrotizing crescentic glomerulonephritis. Mod Rheumatol 2015;25(1):138–42.
- Sumida K, Ubara Y, Takemoto F, et al. Successful treatment with humanizedanti-interleukin 6 receptor antibody for multidrug refractory and anti-tumournecrosis factor-resistant systemic rheumatoid vasculitis. Clin Exp Rheumatol2011;29(1 Suppl 64):S133
- Gerfaud-Valentin M, Jamilloux Y, Iwaz J, Seve P. Adult-onset Still's disease.Auto immun Rev 2014;13(7):708-22.
- Моисеев С.В., Новиков П.И., В.В. Рамеев В.В. Болезнь Стилла у детей ивзрослых: новые представления о патогенезе и современные методы лече-ния. Клин фармакол тер 2017;26(4):15-20 [Moiseev S, Novikov P, Rameev V.Still’s disease in children and adults: new insights in the pathogenesis and currenttreatment. Кlinicheskaya farmakologiya i terapiya Clin Pharmacol Ther 2017;26(4):15-20 (In Russ.)].
- Yamaguchi M, Ohta A, Tsunematsu T, et al. Preliminary criteria for classificationof adult Still's disease. J Rheumatol 1992;19:424–30.
- Franchini S, Dagna L, Salvo F, et al. Efficacy of traditional and biologic agents indifferent clinical phenotypes of adult-onset Still's disease. Arthritis Rheum 2010;62:2530–5.
- Kaneko Y, Kameda H, Ikeda K, et al. Tocilizumab in patients with adult-onsetstill's disease refractory to glucocorticoid treatment: a randomised, double-blind,placebo-controlled phase III trial. Ann Rheum Dis 2018;77:1720-9.
- Narazaki M, Tanaka T, Kishimoto T. The role and therapeutic targeting of IL-6in rheumatoid arthritis. Expert Rev Clin Immunol 2017;13:535-51
- Новиков П.И., Моисеев С.В. Сарилумаб – новый блокатор рецепторов кинтерлейкину-6: фармакологические свойства, клиническая эффективностьи безопасность у больных ревматоидным артритом. Клин фармакол тер2019;28(4):37-42 [Novikov PI, Moiseev SV. Sarilumab, a new interleukin-6receptor blocker: pharmacological properties, clinical efficacy, and safety in pati-ents with rheumatoid arthritis. Klinicheskaya farmakologiya i terapiya = ClinPharmacol Ther 2019;28(4):37-42 (In Russ.)]
- Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus methotrexate inpatients with active rheumatoid arthritis and inadequate response to methotrexate:Results of a phase III study. Arthritis Rheumatol 2015;67(6):1424-37.
- Fleischmann R, van Adelsberg J, Lin Y, et al. Sarilumab and nonbiologic diseasemodifying antirheumatic drugs in patients with active rheumatoid arthritis andinadequate response or intolerance to tumor necrosis factor inhibitors. ArthritisRheumatol 2017;69(2):277–90.
- Burmester GR, Lin Y, Patel R, et al. Efficacy and safety of sarilumab monothera-py versus adalimumab monotherapy for the treatment of patients with active rheu-matoid arthritis (MONARCH): a randomised, double-blind, parallel-group phaseIII trial. Ann Rheum Dis 2017;76(5):840–7.
- Boyapati A, Msihid J, Fiore S, et al. Sarilumab plus methotrexate suppresses cir-culating biomarkers of bone resorption and synoviald amage in patients with rheu-matoid arthritis and inadequate Sarilumab: A Review response to methotrexate: abiomarker study of MOBILITY. Arthritis Res Ther. 2016;18(1):225.
- Matcham F, Rayner L, Steer S, Hotopf M. The prevalence of depression in rheu-matoid arthritis: a systematic review and metaanalysis. Rheumatology (Oxford)2014;53(3):578-9
- Лисицына ТА, Вельтищев ДЮ, Лила АМ, Насонов ЕЛ. Интерлейкин 6 какпатогенетический фактор, опосредующий формирование клинических про-явлений, и мишень для терапии ревматических заболеваний и депрессив-ных расстройств. Научно-практическая ревматология 2019;57(3):318-27.Lisitsyna TA, Veltishchev DYu, Lila AM, Nasonov EL. Interleukin 6 as a patho-genic factor mediating clinical manifestations and a therapeutic target for rheuma-tic diseases and depressive disorders. Nauchno-Prakticheskaya Revmatologiya =Rheumatology Science and Practice. 2019;57(3):318-27 (In Russ.)].
- Strand V, Kosinski M, Chen C-I, et al. Sarilumab plus methotrexate improvespatient-reported outcomes in patients with active rheumatoid arthritis and inade-quate responses to methotrexate: results of a phase III trial. Arthritis Res Ther2016;18:198
