Терминальная хроническая почечная недостаточность у пациентов с болезнью Фабри
Сравнение клинических проявлений и исходов болезни Фабри (БФ) у пациентов, получающих и не получающих почечную заместительную терапию, и определение факторов, ассоциирующихся с развитием терминальной хронической болезни почек.
В ретроспективное исследование включали взрослых пациентов (старше 18 лет) с определенным диагнозом БФ, подтвержденным при молекулярно-генетическом исследовании. У пациентов, получавших и не получавших почечную заместительную терапию, сравнивали частоту ранних симптомов БФ, поражения сердца и головного мозга, типы мутаций гена GLA, содержание глоботриаозилсфингозина (LysoGL3) в высушенных каплях крови и клинические исходы, включая смерть от любых причин, сердечно-сосудистые события (сердечная недостаточность, инфаркт миокарда, клинически значимые аритмии) и цереброваскулярные осложнения (инсульт). Клинически значимыми считали фибрилляцию предсердий и желудочковую тахикардию, в том числе требовавшие инвазивного вмешательства.
В исследование были включены 132 взрослых (медиана возраста 38 лет) пациента с БФ, в том числе 87 мужчин, преимущественно с классическим вариантом заболевания. Терминальная хроническая почечная недостаточность (ХПН) была диагностирована у 43 (32,6%) из 132 больных, в том числе у 41 (47,1%) из 87 мужчин и 2 (4,4%) из 45 женщин. Четырем из 43 больных была выполнена трансплантация почки, а остальные 39 пациентов получали лечение программным гемодиализом. У 36 (83,7%) пациентов болезнь Фабри диагностировали после начала лечения программным гемодиализом при скрининге в диализных отделениях. Частота классических проявлений БФ (нейропатической боли, ангиокератом, снижения потоотделения и вихревидной кератопатии), типы мутаций гена GLA и содержание LysoGL3 не отличались между группами мужчин, страдавших и не страдавших терминальной ХПН. Умерли 12 (9,1%) из 132 пациентов с БФ, в том числе 11 (25,6%) из 43 больных, получавших почечную заместительную терапию, и только 1 (1,1%) из 89 пациентов без терминальной ХПН. Шанс развития летального исхода с поправкой на возраст у мужчин с терминальной ХПН был значительно, выше, чем у мужчин, не нуждавшихся в почечной заместительной терапии (ОШ 16,930; 95% ДИ 2,002-143,155; р=0,009), в то время как риск развития нефатальных сердечно-сосудистых и цереброваскулярных осложнений не отличался между двумя группами.
Терминальная ХПН достоверно чаще встречалась у мужчин с БФ и ассоциировалась со значительным увеличением смертности больных. Клинические проявления БФ, типы мутаций и/или содержание LysoGL3 не были ассоциированы с развитием тяжелого поражения почек.
Болезнь Фабри (БФ) – это редкое (орфанное) наследственное заболевание, сцепленное с Х-хромосомой, которое характеризуется снижением активности лизосомного фермента α-галактозидазы А и накоплением гликофосфолипидов в различных органах и тканях, прежде всего почках, сердце, центральной и периферической нервной системе [1]. К наиболее грозным осложнениям БФ относятся сердечно-сосудистые исходы, инсульт и терминальная хроническая почечная недостаточность (ХПН), которые обычно развиваются в возрасте 30-50 лет и приводят к инвалидизации или смерти. Для профилактики прогрессирующего поражения внутренних органов при БФ применяют рекомбинантные препараты α-галактозидазы А – агалсидазу альфа 0,2 мг/кг или агалсидазу бета 1 мг/кг, которые вводят внутривенно каждые 2 недели. Важное значение для улуч шения результатов лечения имеет своевременная диагностика БФ, которая позволяет начать ферментозаместительную терапию (ФЗТ) до развития необратимых изменений во внутренних органах.
Поражение почек при БФ проявляется протеинурией, обычно не более 1-2 г/сут, и/или прогрессирующим снижением функции почек. Протеинурия при БФ появляется после 20 лет (в детском и подростковом возрасте может определяться альбуминурия) и редко достигает нефротического уровня. Иногда протеинурия отсутствует, а единственным признаком поражения почек является постепенное снижение расчетной скорости клубочковой фильтрации (СКФ). Например, в исследовании у 1262 взрослых пациентов с БФ протеинурия не определялась у 11% мужчин и 28% женщин с хронической болезнью почек (ХБП) 3-5 стадии [2]. Изменения мочевого осадка, типичные для хронического гломерулонефрита, обычно отсутствуют, хотя может наблюдаться микрогематурия, связанная с длительным лечением анальгетиками, которые многие пациенты принимают на протяжении многих лет для уменьшения нейропатической боли. Нефропатия Фабри в конечном итоге приводит к развитию терминальной ХПН. По данным Fabry Registry, среди 2712 пациентов с БФ в почечной заместительной терапии нуждались 213 больных (медиана возраста 38 лет), в том числе 14% из 1359 мужчин и 2% из 1353 женщин [3]. Как у мужчин, так и у женщин развитие терминальной стадии ХБП ассоциировалось с увеличением частоты сердечно-сосудистых осложнений и инсульта.
Целью исследования было сравнение клинических проявлений и исходов БФ у пациентов, получающих и не получающих почечную заместительную терапию, и определение факторов, ассоциирующихся с развитием терминальной ХБП.
Материал и методы
В ретроспективное исследование включали взрослых пациентов (старше 18 лет) с БФ, обследованных в клинике им. Е.М. Тареева. Диагноз болезни Фабри устанавливали на основании наличия мутации гена GLA (у мужчин и женщин) и снижения активности α-галактозидазы А в высушенных каплях крови (у мужчин) при наличии одного из следующих признаков: типичное проявление болезни Фабри (нейропатическая боль, ангиокератомы, вихревидная кератопатия), повышение концентрации LysoGL3 в высушенных каплях крови и/или наличие у родственника определенного диагноза болезни Фабри и такой же мутации гена GLA [4]. Нейропатическая боль (акропарестезии) при БФ обычно начинается в детском или подростковом возрасте и характеризуется эпизодами жгучей боли в кистях и стопах различной интенсивности, возникающей в жаркую погоду или при быстрой смене температуры окружающей среды, при физической нагрузке и/или повышении температуры тела. Ангиокератомы представляют собой скопления мелких темно-красных мягких узелков на передней брюшной стенке, в частности внутри или вокруг пупка, в паховой области, на ягодицах, верхних конечностях, губах. Высыпания могут быть как распространенными, так и единичными, например, внутри пупка, на слизистой оболочке полости рта или половых губах. Наличие вихревидной кератопатии оценивал офтальмолог путем осмотра с помощью щелевой лампы. При отсутствии у пациента критериев определенного диагноза болезни Фабри и наличии ХБП для подтверждения диагноза проводили исследование биоптата почки с применением электронной микроскопии.
Молекулярно-генетическое исследование проводилось в лабораториях Медико-генетического научного центра имени академика Н.П. Бочкова и/или Национального медицинского исследовательского Центра Здоровья Детей. Активность α-галактозидазы А и LysoGL3 измеряли в высушенных пятнах крови с помощью валидированной жидкостной хроматографии – тандемной масс-спектрометрии. Исследования проводились в лабораториях Centogene AG (Росток, Германия), ARCHIMED Life Science GmbH (Вена, Австрия), Медико-генетического научного центра имени академика Н.П. Бочкова и/или Национального медицинского исследовательского Центра Здоровья Детей.
Магнитно-резонансную томографию (МРТ) сердца выполняли на магнитно-резонансных томографах с напряженностью поля 1,5 Тл Магнетом Аванто (Siemens Healthcare, Germany) и Оптима 450 (GE Healthcare, USA) c использованием поверхностных радиочастотных катушек (16-канальных) и синхронизацией с ЭКГ. Для определения отсроченного контрастирования миокарда использовали гадолиний-содержащий контрастный препарат, который вводили внутривенно болюсно в дозе 0,15 ммоль/кг. Критерием гипертрофии миокарда было увеличение толщины стенки и/или межжелудочковой перегородки ≥12 мм. При диагностике гипертрофии левого желудочка учитывали также индекс массы миокарда (верхняя граница нормы 85 г/м22 у мужчин и 81 г/м22 у женщин) [5].
Терминальную почечную недостаточность диагностировали в соответствии с рекомендациями KDIGO 2012 года и Научного общества нефрологов России 2016 года [6,7]. Скорость клубочковой фильтрации (СКФ) рассчитывали по формуле CKD-EPI. Оценивали следующие клинические исходы: смерть от любых причин, сердечно-сосудистые события (сердечная недостаточность, инфаркт миокарда, клинически значимые аритмии) и цереброваскулярные осложнения (инсульт). Клинически значимыми считали фибрилляцию предсердий и желудочковую тахикардию, в том числе требовавшие вмешательства, такого как абляция или имплантация водителя ритма или кардиовертерадефибриллятора. Желудочковую экстрасистолию не относили к клиническим исходам.
Статистический анализ проводился с использованием программы IBM SPSS Statistics 22. Нормальность распределения определяли с помощью критерия КолмогороваСмирнова. Данные для количественных показателей с распределением, отличавшимся от нормального, приведены в виде медианы и межквартильного размаха. Данные для качественных переменных представлены в виде абсолютных частот и доли в процентах. Медианы количественных показателей сравнивали с помощью U-критерия МаннаУитни. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Анализ выживаемости проводили с использованием метода Каплана-Майера, расчет отношения шансов (ОШ) – с помощью логистической регрессионной модели. Различия считали достоверными при величине p<0,05.
Результаты
Клиническая характеристика больных. За период с 2010 по 2020 год в Клинике им. Е.М. Тареева были обследованы 132 взрослых (медиана возраста 38 лет) пациента с БФ, в том числе 87 мужчин. У большинства пациентов наблюдался классический вариант БФ, характеризовав шийся появлением первых типичных симптомов, таких как нейропатическая боль или ангиокератомы, в детском возрасте. У всех пациентов при молекулярно-генетическом исследовании была выявлена патогенная мутация гена GLA. Частота нейропатической боли, желудочно-кишечных нарушений и вихревидной кератопатии достоверно не отличалась у мужчин и женщин, в то время как ангиокератомы и сниженное потоотделение значительно чаще встречались у мужчин. Поражение внутренних органов, в том числе почек (протеинурия и/или снижение СКФ <60 мл/мин/1,73 м22), сердца (гипертрофия миокарда) и головного мозга (инсульт/транзиторная ишемическая атака – ТИА), также чаще отмечались у мужчин, хотя разница частоты инсульта/ТИА между мужчинами и женщинами не достигла статистической значимости (табл. 1).
| Показатели | Все (n=132) | Мужчины (n=87) | Женщины (n=45) | p |
|---|---|---|---|---|
| Примечание: *по данным эхокардиографии и/или МРТ сердца. ТИА - транзиторная ишемическая атака | ||||
| Возраст, лет | 38 (30;49) | 37 (30;48) | 38 (29;54) | 0,277 |
| Классический фенотип, n (%) | 117 (88,6) | 77 (88,5) | 40 (88,9) | 1,000 |
| Ранние симптомы, n (%) | ||||
| Нейропатическая боль | 97 (73,5) | 67 (77,0) | 30 (66,7) | 0,218 |
| Ангиокератомы | 54 (40,9) | 47 (54,0) | 7 (15,6) | <0,0001 |
| Гипо-/ангидроз | 73 (55,3) | 58 (66,7) | 15 (33,3) | <0,0001 |
| Желудочно-кишечные нарушения | 29 (22,0) | 23 (26,4) | 6 (13,3) | 0,120 |
| Поражение органа зрения, n (%) | ||||
| Вихревидная кератопатия | 66/108 (61,1) | 36/65 (55,4) | 30/43 (69,8) | 0,160 |
| Катаракта Фабри | 15/108 (13,9) | 14/65 (21,5) | 1/43 (2,3) | 0,004 |
| Поражение почек, n (%) | ||||
| Протеинурия >0,3 г/л | 24/98 (24,5) | 18/54 (33,3) | 6/44 (13,6) | 0,033 |
| СКФ <60 мл/мин/1,73 м2 | 53 (40,2) | 45 (51,7) | 8 (18,2) | <0,0001 |
| Терминальная ХПН | 43 (32,6) | 41 (47,1) | 2 (4,4) | <0,0001 |
| Поражение сердца, n (%) | ||||
| Гипертрофия миокарда* | 82/128 (64,1) | 62/84 (73,8) | 20/44 (45,5) | 0,002 |
| Очаги фиброза по МРТ | 23/102 (22,5) | 16/62 (25,8) | 7/40 (17,5) | 0,467 |
| Клинически значимые аритмии | 16 (12,1) | 11 (12,6) | 5 (11,1) | 1,000 |
| Поражение ЦНС, n (%) | ||||
| Очаговые изменения по МРТ | 68/121 (56,2) | 48/78 (61,5) | 20/43 (46,5) | 0,128 |
| Инсульт/ТИА | 24 (18,2) | 20 (23,0) | 4 (8,9) | 0,057 |
| Нейросенсорная тугоухость | 22 (16,7) | 17 (19,5) | 5 (11,1) | 0,324 |
| Артралгии, n (%) | 10 (7,6) | 8 (9,2) | 2 (4,4) | 0,493 |
| Эпизоды лихорадки, n (%) | 12 (9,1) | 12 (13,8) | 0 | 0,008 |
| Повышение в крови острофазовых показателей, n (%) | 12 (9,1) | 10 (11,5) | 2 (4,4) | 0,220 |
Терминальная хроническая почечная недостаточность. Терминальная ХПН была диагностирована у 43 (32,6%) из 132 больных, в том числе у 41 (47,1%) из 87 мужчин и 2 (4,4%) из 45 женщин. Медиана возраста начала почечной заместительной терапии составила 39 (34; 47) лет. Четырем из 43 больных была выполнена трансплантация почки, а остальные 39 пациентов получали лечение программным гемодиализом. У 36 (83,7%) пациентов БФ диагностировали после начала лечения программным гемодиализом, у 3 (7,0%) – в результате семейного скрининга, у 4 (9,3%) – диагноз был заподозрен на основании клинических проявлений. У 6 пациентов до развития терминальной ХПН была выполнена биопсия почки. У 2 из них был установлен диагноз БФ, подтвержденный при электронной микроскопии, в то время как в остальных случаях нефробиопсия оказалась неинформативной.
У 38 (88,4%) из 43 пациентов почечный исход наступил раньше других тяжелых органных проявлений, таких как инсульт или клинически значимое нарушение ритма сердца. У остальных 5 (11,6%) из 43 пациентов первым зарегистрированным исходом был инсульт. Умерли 12 (9,1%) из 132 пациентов с БФ, в том числе 11 (25,6%) из 43 больных, получавших почечную заместительную терапию, и только 1 (1,1%) из 89 пациентов без терминальной ХПН. Все умершие больные были мужчинами, а 11 (91,7%) из 12 пациентов получали почечную заместительную терапию.
| Показатели | Терминальная ХПН (n=41) | Без терминальной ХПН (n=46) | p |
|---|---|---|---|
| Возраст, лет | 43 (35; 50) | 33 (23; 43) | 0,001 |
| ФЗТ на момент обследования, n (%) | 4 (9,8) | 10 (21,7) | 0,154 |
| Уровень LysoGL3, нг/мл | 81,2 (52,8;111,3) | 83,9 (26,9;113,5) | 0,712 |
| Классический фенотип, n (%) | 38 (92,7) | 39 (84,8) | 0,323 |
| Ранние симптомы, n (%) | |||
| Нейропатическая боль | 32 (78,0) | 35 (76,1) | 1,000 |
| Ангиокератомы | 18 (43,9) | 29 (63,0) | 0,074 |
| Гипо-/ангидроз | 33 (80,5) | 25 (54,3) | 0,012 |
| Поражение органа зрения, n (%) | |||
| Вихревидная кератопатия | 12/27 (44,4) | 24/38 (63,2) | 0,135 |
| Катаракта Фабри | 7/27 (25,9) | 7/38 (18,4) | 0,547 |
| Поражение сердца и ЦНС, n (%) | |||
| Гипертрофия миокарда | 29/35 (82,9) | 19/43 (44,2) | <0,001 |
| Очаги на МРТ головного мозга | 37/39 (94,9) | 25 (55,6) | <0,001 |
| Типы мутаций гена GLA, n (%) | |||
| Миссенс | 28 (68,3) | 32 (69,6) | 0,898 |
| Нонсенс | 9 (22,0) | 4 (8,7) | 0,131 |
| Дупликации | 0 | 1 (2,2) | 1,000 |
| Делеции | 4 (9,8) | 9 (19,6) | 0,240 |
| Сердечно-сосудистые исходы, n (%) | 6 (14,6) | 6 (13,0) | 1,000 |
| Радиочастотная абляция | 1 (2,4) | 1 (2,2) | 1,000 |
| Искусственный водитель ритма | 1 (2,4) | 1 (2,2) | 1,000 |
| Миоэктомия | 0 | 1 (2,2) | 1,000 |
| Цереброваскулярные исходы, n (%) | 11 (26,8) | 9 (19,6) | 0,454 |
| Транзиторная ишемическая атака | 4 (9,8) | 3 (6,5) | 0,696 |
| Инсульт | 11 (26,8) | 9 (19,6) | 0,454 |
| Повторный инсульт | 3 (7,3) | 2 (4,3) | 0,663 |
| Смерть от любых причин, n (%) | 12 (29,3) | 1 (2,2) | <0,0001 |
Сравнение пациентов с терминальной ХПН и без терминальной ХПН. Подавляющие большинство (95,3%) пациентов с терминальной ХПН были мужчинами, поэтому сравнительный анализ проводился только среди пациентов мужского пола (табл. 2). Пациенты с терминальной ХПН были значительно старше больных без терминальной ХПН (медианы возраста 44 и 35 лет, соответственно; p<0,001). В обеих группах у большинства больных наблюдался классический фенотип БФ, а частота ранних симптомов заболевания, за исключением сниженного потоотделения, достоверно не отличалась между ними. Доля больных, получавших ферментозаместительную терапию (ФЗТ) на момент обследования, среди пациентов с терминальной ХПН была примерно в два раза ниже, чем среди пациентов без терминальной ХПН, однако разница не достигла статистической значимости. По данным МРТ сердца с контрастированием гадолинием, у мужчин с терминальной ХПН гипертрофия и фиброз миокарда встречались значительно чаще, чем у больных, не нуждавшихся в почечной заместительной терапии, а медиана индекса массы миокарда левого желудочка была в два раза выше, чем в группе сравнения (табл. 3). В обеих группах примерно у 2/3 больных были выявлены миссенс мутации гена GLA. Разницы частоты мутаций других типов между двумя группами выявлено не было. Уровень LysoGL3 также был сопоставимым у пациентов, получавших и не получавших почечную заместительную терапию.
| Показатели | Терминальная ХПН (n=22) | Без терминальной ХПН (n=37) | p |
|---|---|---|---|
| Возраст, лет | 39,0 (32,0;49,0) | 30,0 (21,0;38,0) | 0,003 |
| Гипертрофия миокарда, n (%) | 21 (95,5) | 14 (37,8) | <0,001 |
| Очаги фиброза, n (%) | 8 (36,4) | 6 (16,2) | 0,076 |
| Индекс массы миокарда левого желудочка, г/м2 | 136,5 (107,0;190,0) | 67,0 (60,0;83,0) | <0,001 |
| Толщина стенки левого желудочка, мм | 11,5 (10,0;14,0) | 8,0 (7,0;10,0) | <0,001 |
| Толщина межжелудочковой перегородки, мм | 15,5 (13,0;18,0) | 10,5 (9,0;13,5) | <0,001 |
| Конечный диастолический размер левого желудочка, см | 5,6 (5,0;5,8) | 5,2 (4,9;5,5) | 0,049 |
| Конечный систолический размер левого желудочка, см | 3,4 (3,2;3,8) | 3,4 (3,2;3,7) | 0,764 |
| Фракция выброса левого желудочка, % | 67 (61,0;70,0) | 64 (57,5;70,5) | 0,510 |
| Конечный систолический размер правого желудочка, см | 3,2 (2,8;3,5) | 3,3 (3,0;3,7) | 0,467 |
| Конечный диастолический размер правого желудочка, см | 4,2 (3,9;5,0) | 4,1 (3,6;4,6) | 0,482 |
| Левое предсердие, см | 4,0 (3,9;4,7) | 3,5 (3,1;4,0) | <0,001 |
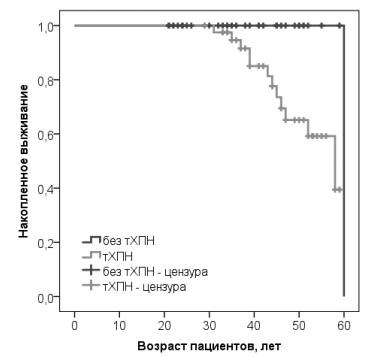
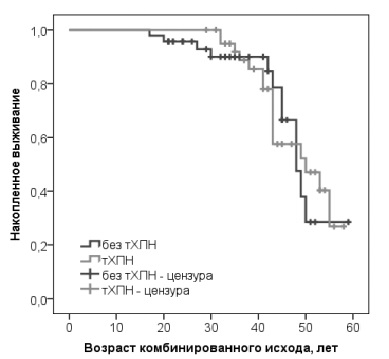
В логистическом регрессионном анализе шанс развития летального исхода был значительно выше у мужчин с терминальной ХПН (ОШ 18,621; 95% ДИ 2,297-150,954; р=0,006), в том числе после коррекции исходной модели по возрасту (ОШ 16,930; 95% ДИ 2,002-143,155; р=0,009). При оценке методом КапланаМайера срок до развития летального исхода был достоверно ниже в группе пациентов с терминальной ХПН (рис. 1). Ожидаемый возраст наступления летального исхода в группе пациентов с терминальной ХПН составил 52,3 (49,1; 55,4) года, а у единственного умершего пациента из группы без терминальной ХПН летальный исход был зарегистрирован в возрасте 60 лет. Срок до развития сердечно-сосудистых исходов или инсульта не различался в группах пациентов, страдавших и не страдавших терминальной ХПН (рис. 2). Ожидаемый возраст развития осложнений в двух группах составил 46,6 (43,6; 49,7) и 48,0 (44,0; 52,1) лет, соответственно.
Обсуждение
В нашем исследовании терминальная ХПН была выявлена у 32,6% из 132 пациентов с БФ, в том числе у 47,1% мужчин и 4,4% женщин. Терминальная ХПН является неизбежным исходом прогрессирующего поражения почек, которое наблюдается у большинства пациентов с БФ. Тем не менее, высокая частота терминальной ХПН у обследованных нами больных частично объяснялась тем, что у 83,7% из 43 пациентов диагноз БФ был установлен в процессе скрининга, проводившегося в российских диализных отделениях [8]. Несмотря на высокие затраты, скрининг в группах риска, в частности среди больных с терминальной ХПН, является общепринятым подходом к диагностике БФ. К настоящему времени в разных странах, включая Россию, проведено 67 скрининговых исследований, целью которых было выявление больных с БФ среди пациентов диализных отделений (n=51363), реципиентов почечного трансплантата (n=3074), больных с гипертрофией левого желудочка неясного генеза (n=5491) или инсультом, развившимся в молодом возрасте (n=5978) [9]. Средняя частота патогенных мутаций гена GLA, вызывающих БФ, варьировалась от 0,13-0,14% среди больных с инсультом в анамнезе до 0,90-0,94% среди пациентов с гипертрофией левого желудочка неясного происхождения. В российской программе у 5572 пациентов, находящихся на лечении программным гемодиализом, частота БФ составила 0,64% среди мужчин и 0,06% среди женщин, однако она была существенно выше в возрастной группе 40-49 лет [8].
Наше исследование показало низкую информированность нефрологов о БФ. У 83,7% из 43 пациентов с терминальной ТПН диагноз БФ был установлен в возрасте от 28 до 62 лет уже после начала почечной заместительной терапии во время скрининга, проводившегося в российских диализных отделениях. Только у 9,3% больных диагноз БФ был заподозрен врачами на основании типичных клинических проявлений или результатов нефробиопсии до развития терминального поражения почек и подтвержден при молекулярногенетическом исследовании. При этом у большинства пациентов с БФ и терминальной ХПН, выявленных во время скрининга, с детского или подросткового возраста отмечались ранние симптомы заболевания, такие как нейропатическая боль, ангиокератомы и/или снижение потоотделения, которые позволяли предположить правильный диагноз. Кроме того, пациентам с нефропатией неясного генеза, проявлявшейся небольшой протеинурией и прогрессирующим ухудшением функции почек, нередко не проводили нефробиопсию, в том числе перед началом иммуносупрессивной терапии по поводу предполагаемого гломерулонефрита [10]. Гистоло гичес кое исследование биоптата почки позволяет предположить диагноз нефропатии Фабри на основании вакуолизации подоцитов и мезангиальных клеток. Для подтверждения диагноза необходима электронная микроскопия, позволяющая выявить типичные "зебровидные" включения в цитоплазме клеток [11]. Следует отметить, что в российских нефрологических отделениях электронная микроскопия нефробиоптатов проводится далеко не всегда, а гистологические изменения в ткани почек при БФ часто трактуются как фокально-сегментарный гломерулосклероз.
Целесообразность скрининга в группах высокого риска определяется не только возможностью выявления относительно небольшого количества пациентов с БФ, сопровождающейся тяжелым и необратимым или мало обратимым поражением внутренних органов. Необ ходимый следующий этап – семейный скрининг, который позволяет установить диагноз у родственников больных, в том числе детей, и своевременно начать ФЗТ. Обследование родственников повышает также эффективность затрат на скрининг в группах риска. В Российской Федерации БФ была диагностирована почти у половины из 292 обследованных членов семей пробандов, включая 28 детей, а среднее число пациентов с БФ на одного пробанда составило 2,2±0,3 [12]. По данным других авторов, среднее число родственников с БФ на одного пробанда может достигать 5 [13]. Препятствиями к семейному скринингу могут быть незаинтересованность врачей, финансовые затраты, культурологические проблемы, отсутствие контактов между родственниками, отсутствие необходимой инфраструктуры и т.д. Тем не менее, в российской популяции удалось протестировать около 60% родственников пробандов. Чаще всего скрининг не проводился из-за отсутствия связей между членами семьи, проживающими в разных городах или странах [12].
Преобладание мужчин среди пациентов с терминальной ХПН в нашем исследовании было ожидаемым результатом. Наследование БФ сцеплено с Х-хромосомой, поэтому у мужчин мутантный ген всегда находится в гемизиготном состоянии, а у женщин – в гетерозиготном [14]. Соответственно, у мужчин поражение внутренних органов, включая почки, развивается в более молодом возрасте и прогрессирует быстрее, чем у женщин. Это подтверждают и полученные нами данные. Хотя во всей когорте медиана возраста мужчин и женщин была сопоставимой, тем не менее, у мужчин значительно чаще встречались протеинурия, снижение СКФ<60 мл/мин/1,73 м2, гипертрофия миокарда и инсульт. Тем не менее, женщин не следует считать здоровыми носительницами мутантного гена. В исследованной нами когорте у пациенток с БФ нередко отмечались не только ранние проявления заболевания, но и поражение внутренних органов, в том числе сердца, почек и головного мозга. Например, развитие инсульта мы наблюдали примерно у 9% обследованных женщин, медиана возраста которых составляла всего 38 лет. Небольшое количество женщин с БФ среди обследованных пациенток диализных отделений могло быть частично связано и с методологией скрининга, который предполагал определение активности α-галактози дазы и проведение молекулярно-генетического исследования только в случае низкой активности этого фермента [8]. У 30-50% женщин с определенным диагнозом болезни Фабри активность α-галактозидазы не снижена, поэтому частота заболевания у диализных пациенток была заниженной. Более надежным скрининговым тестом сегодня считают определение в высушенных каплях крови LysoGL3 – гликосфинголипида, который разрушается α-галактозидазой и при ее дефиците накапливается в органах и тканях [15]. Клиническое значение уровня LysoGL3 в плазме как первичного скринингового биомаркера недавно было показано в японском исследовании у 2360 пациентов с различными симптомами, указывавшими на возможный диагноз БФ [16]. Снижение активности α-галактозидазы и/или повышение содержания LysoGL3 не отменяет необходимость в молекулярно-генетическом исследовании, которое необходимо для подтверждения диагноза. Следует учитывать, что сегодня известно уже более 1000 мутаций гена GLA, причем не все они являются патогенными, поэтому результаты генетических тестов следует анализировать с учетом клинических проявлений и семейного анамнеза. Дополнительные сложности связаны с тем, что некоторые мутации гена GLA ассоциируются с поздним (атипичным) вариантом БФ, который характеризуется отсутствием классических ранних симптомов и развитием поражения внутренних органов, часто одного, например, сердца, в зрелом возрасте (после 40-50 лет). У таких пациентов, в том числе мужчин, активность α-галактозиды может быть близкой к норме, а содержание LysoGL3 повышается в меньшей степени, чем у больных с классическим вариантом БФ.
Накопление гликосфинголипидов в тканях при дефиците α-галактозидазы происходит постепенно и продолжается на протяжении всей жизни, поэтому, помимо пола пациентов, основным фактором, определяющим частоту и тяжесть поражения внутренних органов при БФ, является возраст. Клинические признаки поражения почек, сердца и головного мозга, в отличие от кожи и периферической нервной системы, фактически всегда отсутствуют у детей и подростков и появляются только в более зрелом возрасте. В нашем исследовании медиана возраста пациентов с терминальной ХПН значительно превышала таковую больных без терминальной болезни почек (44 и 35 лет, соответственно). Однако у большинства пациентов скрининг проводился через несколько лет после начала лечения гемодиализом, а медиана возраста больных на момент начала почечной заместительной терапии составила 39 лет. Эти данные позволяют предположить, что не только возраст и пол, но и другие факторы могут оказывать влияние на риск развития более тяжелого поражения почек или других органов при БФ. Мы не выявили разницы частоты классических симптомов БФ, в том числе нейропатической боли, ангиокератом, сниженного потоотделения и вихревидной кератопатии, между группами мужчин, нуждавшихся и не нуждавшихся в почечной заместительной терапии. В обеих группах больных примерно в 70% случаев определялись различные миссенс мутации гена GLA, в результате которых измененный кодон начинает кодировать другую аминокислоту. Другие мутации, в том числе нонсенс и делеции, встречались реже, а частота их достоверно не отличалась между двумя группами. Как указано выше, уровень LysoGL3 у женщин и пациентов с атипичным вариантом БФ, характеризующимся поздним развитием поражения внутренних органов, повышается в меньшей степени, чем у мужчин с классическим фенотипом БФ. А. Nowak и соавт. у 69 пациентов с БФ выявили независимую ассоциацию содержания LysoGL3 с сывороточным уровнем креатинина и наличием кардиомиопатии и сделали вывод, что концентрация этого биомаркера ассоциируется с тяжестью течения БФ [17]. Однако в нашем исследовании медианы содержания LysoGL3 были сопоставимыми в группах мужчин с терминальной ХПН и без терминальной ХПН. Таким образом, ни клинический фенотип БФ в детском или подростковом возрасте, ни тип мутации или содержание LysoGL3 не позволяли предсказать развитие тяжелого поражения почек у обследованных нами пациентов.
Мы не оценивали эффективность ФЗТ в профилактике развития терминальной ХПН, так как доля пациентов, получавших патогенетическое лечение, и его длительность в российской выборке пациентов с БФ были небольшими. Кроме того, более чем у 80% больных с терминальной ХПН диагноз БФ был установления уже после начала почечной заместительной терапии. Однако благоприятное влияние ФЗТ на функцию почек у пациентов с БФ подтверждено как в двойных слепых рандомизированных, так и в длительных наблюдательных исследованиях [18]. В плацебо-контролируемом исследовании, предполагавшем повторный анализ почечных биоптатов, доля пациентов, у которых был достигнут клиренс гликосфинголипидов из эндотелиальных клеток почечных капилляров и других клеток почек, при лечении агалсидазой бета в дозе 1 мг/кг значительно превышала таковую в группе плацебо [19], а достигнутый эффект сохранялся через 54 недели [20]. В многочисленных исследованиях, в том числе длительных, лечение этим препаратом оказывало также стабилизирующее действие на функцию почек [19].
D. Germain и соавт. проанализировали частоту неблагоприятных исходов БФ, в том числе терминальной ХПН, у 52 пациентов, получавших ФЗТ агалсидазой бета в течение 10 лет. В этом исследовании выживаемость составила 94%, а у 81% больных в течение указанного срока не были зарегистрированы какие-либо тяжелые клинические исходы [21]. Эффективность ФЗТ в значительной степени зависит от срока ее назначения после появления первых симптомов и исходного состояния почек. Более поздняя терапия, особенно у пациентов с протеинурией и/или снижением СКФ, в меньшей степени влияет на течение нефропатии Фабри [22].
Хотя частота нефатальных исходов, таких как инсульт/ТИА или клинически значимые аритмии, не отличалась у мужчин, получавших и не получавших почечную заместительную терапию, развитие терминальной ХПН ассоциировалось с достоверным увеличением риска смерти от любых причин. Кроме того, примерно у 90% больных, находившихся на лечении программным гемодиализом, фатальные и нефатальные исходы были зарегистрированы после начала почечной заместительной терапии.
Может ли ФЗТ рекомбинантными препаратами αгалактозидазы улучшить прогноз у диализных пациентов с БФ? Судить об этом сложно, так как эффективность патогенетической терапии в этой популяции пациентов не изучалась. Необходимо отметить, что лечение гемодиализом не является противопоказанием к назначению рекомбинантных препаратов α-галактозидазы, так как их фармакокинетика не меняется у диализ-зависимых пациентов [23,24]. По мнению зарубежных экспертов, наличие терминальной ХПН не может служить основанием для отказа от ФЗТ у пациентов с БФ [25]. В российских рекомендациях по диагностике и лечению БФ, одобренных Минздравом РФ в 2019 г., указано, что ФЗТ следует назначать всем мужчинам с БФ после подтверждения диагноза лабораторными методами [26]. При этом тактика ведения пациентов с терминальной ХПН специально не оговаривается, хотя указано, что отменять лечение у больных, находящихся на диализе, не следует, даже если они не подходят для трансплантации почки, которую считают методом выбора почечной заместительной терапии у пациентов с БФ. Результаты некоторых исследований свидетельствуют о том, что эффективность ФЗТ в профилактике сердечно-сосудистых исходов может быть выше после трансплантации почки. Например, R. Mignani и соавт. оценивали результаты ФЗТ в течение около 4 лет у 34 больных, получавших лечение гемодиализом или перенесших трансплантацию почки [27]. Индекс массы миокарда левого желудочка увеличился у диализ-зависимых пациентов, но оставался стабильным после трансплантации почки.
Одним из самых серьезных осложнений БФ является инсульт. Эффективность ФЗТ в профилактике цереброваскулярных осложнений считают недостаточно доказанной. Однако недавно были опубликованы результаты мета-анализа 7 когортных исследований и 2 рандомизированных контролируемых исследований в целом у 7513 пациентов с БФ. Авторы выявили достоверное снижение частоты повторного инсульта с 16,0% в контрольной группе до 8,2% у больных, получавших препараты α-галактозидазы (p=0,03) [28].
Наше исследование имеет ограничения. Полученные данные не позволяют судить об истинной частоте ХБП 5Д стадии в российской популяции пациентов с БФ, так как в исследованной когорте распространенность терминальной ХПН была завышена за счет включения пациентов, выявленных при скрининге в диализных отделениях. Тем не менее, мы изучили особенности течения и исходы нефропатии Фабри у достаточно большого числа пациентов с этим орфанным заболеванием.
Заключение
Терминальная ХПН наблюдалась примерно у трети обследованных взрослых пациентов с подтвержденным диагнозом БФ. Она достоверно чаще встречалась у мужчин и ассоциировалась со значительным увеличением смертности больных. У большинства больных с терминальной ХПН имелся классический вариант БФ, характеризовавшийся наличием типичных проявлений, таких как ангиокератомы, нейропатическая боль и/или сниженное потоотделение с детского или подросткового возраста. Тем не менее, примерно у 80% пациентов диагноз БФ был установлен только при скрининге, проводившемся в российских диализных отделениях, через 10-20 лет и более после появления первых симптомов. Клинические проявления БФ, типы мутаций и/или содержание LysoGL3 не были ассоциированы с развитием тяжелого поражения почек.
Используемые источники
- Мухин Н.А., Моисеев В.С., Моисеев С.В. и др. Диагностика и лечение болезни Фабри. Клин фармакол тер 2013;22(2):11-20 [Mukhin NA, Moiseev VS, Moiseev SV, et al. Diagnosis and treatment of Fabry disease. Clin Pharmacol Ther = Klinicheskaya farmakologiya i terapiya 2013;22(2):11-20 (In Russ.)].
- Ortiz A, Oliveira JP, Waldek S, et al on behalf of the Fabry Registry. Nephropathy in males and females with Fabry disease: cross-sectional description of patients before treatment with enzyme replacement therapy. Nephrol Dial Transplant 2008;23:1600-7.
- Ortiz A, Cianciaruso B, Cizmarik M, et al. End-stage renal disease in patients with Fabry disease: natural history data from the Fabry Registry. Nephrol Dial Transplant 2010;25(3):769-75.
- Smid BE, van der Tol L, Cecchi F, et al. Uncertain diagnosis of Fabry disease: Consensus recommendation on diagnosis in adults with left ventricular hypertrophy and genetic variants of unknown significance. Int J Cardiol 2014;177(2):400-8.
- Kawel-Boehm N, Maceira A, Valsangiacomo-Buechel ER, et al. Normal values for cardiovascular magnetic resonance in adults and children. J Cardiovasc Magn Reson 2015;17:29.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Intern Suppl 2012;3(1):1-150.
- Нефрология. Клинические рекомендации. Под ред. Е.М. Шилова, А.В. Смирнова, Н.Л. Козловской. М.: ГЭОТАР-Медиа, 2016. 808 c.
- Moiseev S, Fomin V, Savostyanov K, et al. The prevalence and clinical features of Fabry disease in hemodialysis patients: Russian Nationwide Fabry Dialysis Screening Program. Nephron 2019;141(4):249-55.
- Doheny D, Srinivasan R, Pagant S, et al. Fabry Disease: prevalence of affected males and heterozygotes with pathogenic GLA mutations identified by screening renal, cardiac and stroke clinics, 1995-2017. J Med Genet 2018;55(4):261-8.
- Каровайкина Е.А., Моисеев С.В., Буланов Н.М. и др. Распространенность и основные проявления поражения почек у пациентов с болезнью Фабри. Клин фармакол тер 2018;27(4):46-52 [Karovaikina E, Moiseev S, Bulanov N, et al. Prevalence and clinical manifestations of nephropathy in Fabry patients. Clin Pharmacol Ther = Klinicheskaya farmakologiya i terapiya 2018;27(4):46-52 (In Russ.)].
- Глыбочко П.В., Мухин Н.А., Свистунов А.А. и др. Морфологическая верификация почечного поражения как обязательный этап диагностики болезни Фабри. Терапевтический архив 2014;86(12-2):31-4 [Glybochko PV, Mukhin NA, Svistunov AA, et al. Morphological verification of renal lesion as a compulsory stage in the diagnosis of Fabry disease. Terapevticheskii arkhiv 2014;86(12- 2):31-4 (In Russ.)].
- Тао Е.А., Моисеев А.С., Новиков П.И. и др. Эффективность семейного скрининга при болезни Фабри в Российской популяции. Клин фармакол тер 2020;29(2):34-39 [Tao E, Moiseev A, Novikov P, et al. Efficacy of family screening in Fabry disease in the Russian population. Clin Pharmacol Ther = Klinicheskaya farmakologiya i terapiya 2020;29(2):34-39 (In Russ.)].
- Laney DA, Fernhoff PM. Diagnosis of Fabry disease via analysis of family history. J Genet Couns 2008;17(1):79-83.
- Germain DP. Fabry disease. Orphanet J Rare Dis 2010;5:30.
- Moiseev S, Karovaikina E, Moiseev A, et al. Strategies of screening for Fabry disease in patients with unexplained left ventricular hypertrophy. Mayo Clin Proc 2019;94(8):1644-6.
- Maruyama H, Miyata K, Mikame M, et al. Effectiveness of plasma lyso-Gb3 as a biomarker for selecting high-risk patients with Fabry disease from multispecialty clinics for genetic analysis. Genet Med 2019;21(1):44-52.
- Nowak A, Mechtler TP, Hornemann T, et al. Genotype, phenotype and disease severity reflected by serum LysoGb3 levels in patients with Fabry disease. Mol Genet Metab 2018;123(2):148-53.
- Germain DP, Elliott PM, Falissard B, et al. The effect of enzyme replacement therapy on clinical outcomes in male patients with Fabry disease: A systematic literature review by a European panel of experts. Mol Genet Metab Rep 2019;19:100454.
- Eng CM, Guffon N, Wilcox WR, et al. Safety and efficacy of recombinant human alpha-galactosidase A replacement therapy in Fabry's disease. N Engl J Med. 2001;345(1):9-16.
- Germain DP, Waldek S, Banikazemi M, et al. Sustained, long-term renal stabilization after 54 months of agalsidase beta therapy in patients with Fabry disease. J Am Soc Nephrol 2007;18:1547–57.
- Germain DP, Charrow J, Desnick RJ, et al. Ten-year outcome of enzyme replacement therapy with agalsidase beta in patients with Fabry disease. J Med Genet 2015;52(5):353-8.
- Warnock DG, Ortiz A, Mauer M, et al. Renal outcomes of agalsidase beta treatment for Fabry disease: role of proteinuria and timing of treatment initiation. Nephrol Dial Transplant 2012;27(3):1042-9.
- Pastores GM, Boyd E, Crandall K, et al. Safety and pharmacokinetics of agalsidase alfa in patients with Fabry disease and end-stage renal disease. Nephrol Dial Transplant 2007;22:1920–25.
- Kosch M, Koch HG, Oliveira JP, et al. Enzyme replacement therapy administered during hemodialysis in patients with Fabry disease. Kidney Int 2004;66: 1279–82.
- Biegstraaten M, Arngrímsson R, Barbey F, et al. Recommendations for initiation and cessation of enzyme replacement therapy in patients with Fabry disease: the European Fabry Working Group consensus document. Orphanet J Rare Dis 2015;10:36.
- Куцев С.И., Баранов А.А., Намазова-Баранова Л.С. и др. Клинические рекомендации. Болезнь Фабри. 2019. https://www.pediatr-russia.ru/information/klin-rek/deystvuyushchie-klinicheskie-rekomendatsii//Болезнь Фабри КР 2020.pdf.
- Mignani R, Feriozzi S, Pisani A, et al. Agalsidase therapy in patients with Fabry disease on renal replacement therapy: a nationwide study in Italy. Nephrol Dial Transplant 2008;23(5):1628-35.
- Sheng S, Wu L, Nalleballe K, et al. Fabry's disease and stroke: Effectiveness of enzyme replacement therapy (ERT) in stroke prevention, a review with meta-analysis. J Clin Neurosci 2019;65:83-6.
