Патогенетические аспекты и подходы к терапии спастичности
В обзорной статье рассматриваются механизмы спастичности, которая в сочетании с парезом является наиболее частым проявлениям инсульта, а также встречается при ряде других заболеваний. Перечислены основные патогенетические звенья, особенности клиники и направления терапии спастичности при инсульте, включая применение миорелаксантов центрального (толперизон, баклофен, тизанидин) и периферического (ботулотоксин А) действия, а также немедикаментозные и хирургические методы лечения.
Спастичность в сочетании с парезом является одним из наиболее частых неврологических синдромов. Спастичность может быть следствием инсульта, черепно-мозговой и спинальной травмы, нейроинфекции, опухоли, рассеянного склероза, бокового амиотрофического склероза, детского церебрального паралича (ДЦП), нейродегенеративных заболеваний. Самой частой причиной спастичности является ДЦП, реже – инсульт и спинальная травма. Показатели распространенности постинсультной спастичности варьируются в широких пределах – 30-500 человек на 100000 населения. Разброс показателей обусловлен различиями в системах оценки и сроках ее проведения. По данным эпидемиологических исследований, проведенных в Российской Федерации, распространенность постинсультной спастичности составляет 32 человека на 100000 населения. Чаще всего отмечается формирование постинсультной спастичности в руке и ноге (68%), реже – только в руке (15%) или только в ноге (18%). В большинстве работ указывается, что спастичность развивается через 3-12 мес после инсульта, однако формирование повышенного тонуса начинается уже в первые недели после перенесенного острого нарушения мозгового кровообращения. Так, через 1–4 недели после инсульта спастичность развивается у 4–27% пациентов, через 1–3 мес – у 19–26,7%, а через 3–6 мес – у 17–42,6% .
Механизмы развития спастичности
Существует несколько определений спастичности. Чаще всего ее определяют как зависимое от скорости увеличение сопротивления (тонуса) мышцы при ее пассивном растяжении. Спастичность рассматривается как ведущее проявление синдрома верхнего мотонейрона, наряду с мышечной слабостью, повышением сухожильных рефлексов и развитием патологических рефлексов. Вопросы патогенеза постинсультной спастичности многогранны и во многом остаются неясными. На сегодняшний день очевидно, что спастичность не является следствием поражения какой-либо определенной структуры или отдельного двигательного тракта. При постинсультной спастичности наряду с повреждением пирамидных путей отмечается обязательное вовлечение проходящих рядом с ними на всем протяжении головного и спинного мозга экстрапирамидных проводников (дорзальный и медиальный ретикулоспинальный, вестибулоспинальный, руброспинальный, тектоспинальный). Наибольшее значение в формировании спастичности принадлежит ретикулоспинальному тракту. При изолированном повреждении пирамидных путей, что наблюдается при поражении продолговатого мозга в области пирамид, отмечается низкий мышечный тонусс развитием пареза дистальных отделов конечностей и преимущественной утратой тонких движений кисти.
Повреждение супраспинальных структур, пирамидных и экстрапирамидных проводников сопровождается изменением баланса тормозных и возбуждающих влияний на сегментарном уровне. Блокада над сегментарных влияний приводит к денервации a- и g-мотонейронов и запускает процесс перестройки работы сегментарного аппарата. Развивается гипервозбудимость мотонейронов, меняются синаптические связи с денервированными интернейронами, в результате чего механизмы реципрокного торможения через вставочные клеткиРеншоу становятся неэффективными, что еще больше увеличивает возбудимость мотонейронов. Меняется обработка афферентного сигнала к a-мотонейронам, развивается избыточная афферентация по Iа-волокнам,что также повышает рефлекторную возбудимость и сопровождается развитием болезненных мышечных спазмов. Мышечный спазм, в свою очередь, ведет к дальнейшему усилению болевых ощущений и формированию сегментарных “порочных кругов".Подтверждением повышения рефлекторной возбудимости является усиление Н-рефлекса, представляющего рефлекторный ответ мышцы на раздражение чувствительных волокон периферического нерва.Реализацией повышенной рефлекторной возбудимости являются клонусы и синкинезии. Таким образом, важнейшими звеньями развития спастичности являются изменения на сегментарном уровне с развитием гиперактивности мотонейронов спинного мозга, снижение пресинаптического торможения по Iа-афферентным волокнам, нарушение реципрокного и возвратного торможения.
В последние годы в механизмах развития спастичности большое значение уделяется функциональным иструктурным изменениям в головном и спинном мозге, происходящим после развития инсульта, – механизма мнейропластичности. Реорганизация функциональных связей играет значительную роль в восстановлении нарушенных функций, однако не всегда происходящие изменения имеют однозначно положительный характер. На фоне инсульта расширяется зона представительства паретичной части тела в моторной и сенсорной коре, приводящая к дисбалансу внутрикоркового возбуждения и торможения в сторону преобладания возбуждения, что сказывается на нисходящем супраспинальном контроле. Кроме того, функциональная перестройка происходит и на уровне сегментарного аппарата спинного мозга. Денервированные a-мотоней роны высвобождают факторы роста, стимулирующие процессы аксонального спраутинга и формирование новых патологических синапсов, что усиливает гипер возбудимость рефлекса растяжения и клинически проявляется клонусами и синкинезиями.Пластическая реорганизация мозговых структур занимает определенное время, зависит от возраста пациента, размеров и локализации очага. Именно этими особен ностями объясняют широко варьирующие временные рамки формирования спастичности после перенесенного инсульта. Считается, что наиболее активно перестройка супраспинальных и сегментарных структур происходит в первые 2-3 месяца, но может продолжаться и до 6 месяцев. Реабилитационные мероприятияи медикаментозная терапия позволяют продлить время пластических перестроек до года и более и, следовательно, замедлить формирование патологическихпаттернов [19]. После 3 месяцев в мышцах, находящих ся продолжительное время в укороченном состоянии,развиваются необратимые структурные изменения –уплотнение и фиброз, меняется сократительная способность. Структурные изменения скелетных мышц еще больше усиливают сопротивление, возникающее в мышце при ее растяжении. Развивающаяся ретракция сухожилий приводит к формированию контрактур.
Нарушение взаимодействия различных супраспинальных и спинальных взаимодействий реализуется через нейротрансмиттерные механизмы. Основной дисбаланс заключается в преобладании на сегментарном уровне возбуждающих глутаматергических влияний и недостаточности ингибиторных ГАМК-ергических тормозных систем. В последнее время активно изучается роль моноаминергических (норадренергических, серотонинергических) нейротрансмиттерных систем в развитии спастичности. Норадренергические проекции, берущие свое начало в области голубого пятна, заканчиваются в мотонейронах по всему длиннику спинного мозга и оказывают на них облегчающее влияние. Кроме того, норадреналин, оказывает модулирующее влияние на афферентную импульсацию, приходящую от мышечно-связочного аппарата. Активация a1-рецепторов стимулирует, а a2-рецепторов тормозит высвобождение возбуждающих нейротрансмиттеров из афферентных проводников и интернейронов спинного мозга [23,24]. Этот эффект лежит в основе антиспастического действия тизанидина. Обсуждается также роль серотонинергических проекций, что подтверждается клиническим эффектом применения селективных ингибиторов обратного захвата серотонина или антагонистов серотонина у пациентов со спастичностью [25,26].
Развивающуюся в паретичных мышцах спастичность первоначально можно рассматривать как адаптационный механизм, позволяющий сохранить опорную функцию, препятствующий развитию мышечных атрофий, отека мягких тканей, тромбоза глубоких вен конеч ностей. Однако, длительное повышение мышечного тонуса начинает затруднять реабилитационные мероприятия, ограничивает функцию конечности, мобильность, вызывает нарушения повседневной активности, ассоциируется с болью и развитием депрессии, повышает риск развития мышечных контрактур и деформаций [8,27-29].
Распределение спастичности при постинсультном гемипарезе неравномерно. Повышение тонуса преобладает в аддукторах плеча, сгибателях руки, пронаторах предплечья и разгибателях ноги. Такое распределение мышечной спастичности образует типичную для постинсультных двигательных нарушений позу Верни кеМана, особенно выраженную при ходьбе. По статистике спастичность чаще встречается в руке. Вместе с тем наблюдаются и другие варианты распределения спастичности. К настоящему времени выделено 12 клинических паттернов спастичности, в том числе 5 для верхней конечности и 7 для нижней [30,31]. Правильное определение паттерна спастичности важно для составления индивидуальной реабилитационной программы.
Выявляя значительное затруднение пассивных движений в конечности, важно различать спастичность и вторичные изменения в мышечно-связочном аппарате (контрактуры, ретракции сухожилий), что определяет подходы к лечению. В сомнительных случаях следует проводить электромиографическое исследование, выявляющее при спастичности высокоамплитудную биоэлектрическую активность в мышце. При развившихся контрактурах инъекции ботулотоксина А и центральные миорелаксанты становятся неэффективными и решается вопрос об ортопедических операциях. Следует отметить различие между спастичностью и ригидностью. Основной признак спастичности – увеличение (по сравнению с нормой) сопротивления мышц растяжению, которое зависит от скорости движения. У пациентов со спастичностью может наблюдаться клинический феномен – медленно производимое пассивное движение не приводит к сопротивлению, в то время как при быстром движении сопротивление отчетливо ощущается в начале движения (симптом “складного ножа"). При ригидности напряжение мышцы наблюдается всегда.
При оценке спастичности нужно учитывать, что она зависит от ряда факторов, таких как положение больного, поза, способность расслабиться. Для получения полной картины необходимо исследование мышечного тонуса в положении лежа, сидя и при ходьбе. Иногда в положении лежа отмечается умеренная степень спастичности, а при ходьбе она значительно усиливается. Подобная диссоциация мышечного тонуса чаще всего выявляется у больных рассеянным склерозом [32].
Прежде чем начинать лечение спастичности, необходимо оценить ее функциональную роль в каждом конкретном случае. Если у больного имеется выраженное снижение мышечной силы, то высокий тонус может облегчить стояние и ходьбу. Снижение мышечного тонуса в этом случае ухудшит двигательную функцию, увеличит риск падений и переломов. У пациента с выраженными двигательными нарушениями, прикованного к постели, снижение тонуса значимо не уменьшит выраженность его инвалидизации. Более того, побочные эффекты центральных миорелаксантов могут способствовать нарастанию когнитивного дефицита. В то же время выраженная спастичность у такого пациента может сильно затруднять уход за ним или быть причиной болевого синдрома.
Методы лечения спастичности
К основным методам лечения спастичности относят медикаментозную терапию, а также физические и хирургические методы. Физические методы включают в себя лечебную физкультуру, применение ортезов, кинезио- и эрготерапию, метод биологической обратной связи, электрическую и магнитную стимуляцию, тепловые процедуры (парафиновые или озокеритные аппликации). Физические методы наиболее эффективны в первые 3-6 месяцев от момента развития инсульта. Лучше всего сочетать физическую реабилитацию с назначением миорелаксантов центрального (баклофен, тизанидин, толперизон) и периферического действия (ботулотоксин А). Ботулинотерапия наиболее эффективна при фокальной и сегментарной спастичности, при отсутствии контрактур. Чаще всего введение ботулотоксина используют в случае эквиноварусной деформации стопы или при флексорной установке кисти. Наилучшие результаты отмечаются при назначении ботулотоксина в ранние сроки (до года) и при легкой степени пареза [13]. Обычно в течение года требуются 3-4 инъекции ботулотоксина. При генерализованных вариантах и мышечных спазмах рекомендовано назначение центральных миорелаксантов. При назначении миорелаксантов важно выбрать оптимальную схему терапии, которая позволяет улучшить функционирование пациента, снижая мышечный тонус, но не усугубляя мышечную слабость.
В настоящее время используются три миорелаксанта: толперизон, баклофен и тизанидин.
Баклофен реализует свое действие через пресинаптические ГАМК-В рецепторы, подавляя выброс в синаптическую щель возбуждающих нейротрансмиттеров (глутамата и аспартата). Баклофен действует преимущественно на уровне спинного мозга, оказывая угнетающее действие на моно- и полисинаптические рефлексы, снижает активность g-мотонейронов, что способствует уменьшению спастичности. Баклофен оказывает также умеренное анальгезирующее действие. Дозу препарата титруют, начиная с 10-15 мг/сут, и постепенно увеличивают каждые 4-5 дней до достижения эффекта. Средняя эффективная доза составляет 50-75 мг/сут. Побочные эффекты проявляются слабостью, в том числе и в паретичной ноге, сонливостью, головокружением, тошнотой, повышением АД. Возможное снижение силы в спастичной конечности и повышение АД требуют осторожного применения препарата у больных с перенесенным инсультом. Чаще всего баклофен используют для лечения спастичности на фоне рассеянного склероза, спинальной травмы, ДЦП. У пациентов с выраженной генерализованной спастичностью используется баклофеновая помпа с введением препарата в субарахноидальное пространство спинного мозга. Этот способ введения препарата относится к высокотехнологичной медицинской помощи и назначается на основании выделяемых федеральных квот (входит в состав квоты “Нейро-3"). Введение баклофена в субарахноидальное пространство сопряжено с риском осложнений на фоне нейрохирургического вмешательства, но с меньшим риском системных нежелательных эффектов баклофена [33].
Тизанидин относится к агонистам α2-адренорецепторов. Препарат реализует свое действие на спинальном и супраспинальном уровне. Стимулируя пресинаптические α2-адренорецепторы, подавляет выброс возбуждающих аминокислот. Посредством этого механизма тизанидин уменьшает активность спинальных интернейронов, угнетает полисинаптические рефлексы и облегчает ингибиторное действие глицина. Кроме того, тизанидин дает центральный умеренный анальгезирующий эффект за счет снижения выброса возбуждающих нейротрансмиттеров в голубом пятне [34]. Препарат используют для лечения спастичности любого генеза, а также при болезненных мышечных спазмах. Начальная доза составляет 2-6 мг/сут, разделенная на 2-3 приема. Дозу постепенно повышают. Средняя терапевтическая доза составляет 12-24 мг. Применение тизанидина ограничивают часто наблюдающаяся сонливость, слабость, тошнота, снижение АД, иногда весьма значительное [35]. При длительном приеме препарата необходимо постепенное снижение дозы, чтобы избежать развитие синдрома отмены, особенно при его совместном применении с гипотензивными средствами.
Толперизон гидрохлорид (Мидокалм) воздействует как на сегментарные, так и центральные механизмы спастичности. Толперизон обладает высокой аффинностью к нервной ткани, достигая наибольших концентраций в стволе головного мозга, спинном мозге и периферической нервной системе. Основной эффект толперизона опосредован торможением спинальных рефлекторных дуг. Толперизон дозозависимо тормозит активность потенциалзависимых натриевых и кальциевых каналов (мембраностабилизирующий эффект), тем самым снижая потенциал действия нейронов и оказывая угнетающее действие на моно и полисинаптические рефлексы на уровне спинного мозга. Кроме того, в экспериментальных исследованиях подтверждена способность толперизона подавлять выброс возбуждающих нейромедиаторов из центральных терминалей афферентных волокон. Центральный механизм антиспастического действия толперизона реализуется за счет н-холинолитического эффекта на каудальную часть ретикулярной формации, нормализуя нисходящую усиленную импульсацию. Торможение толперизоном потенциалзависимых натриевых каналов (лидокаинподобный эффект) обеспечивает наличие у препарата не только миорелаксирующих свойств, но и противоболевых. Дополнительным эффектом толперизона является его сосудорасширяющее действие и способность улучшать периферическое кровообращение. Данный эффект связывают с блокадой a-адренорецепторов, локализующихся в сосудистой стенке.
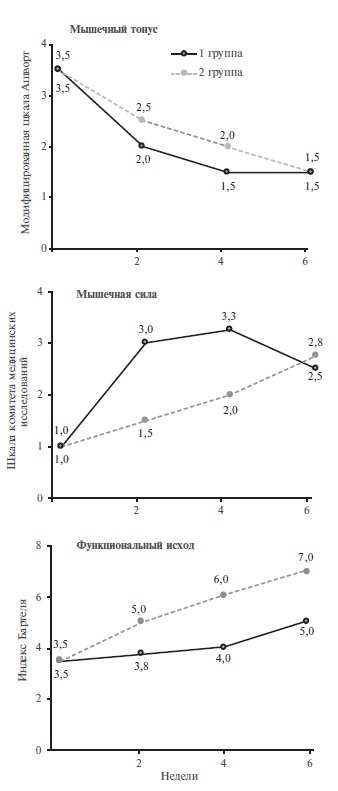
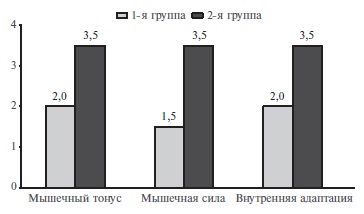
К числу преимуществ препарата по сравнению с другими центральными миорелаксантами следует отнести отсутствие влияния на FL, отсутствие седации и генерализованной мышечной слабости [39]. Подоб ные особенности позволяют широко использовать толперизон у больных с постинсультной спастичностью, пожилых людей, больных с артериальной гипертонией и когнитивной дисфункцией. Так, в сравнительное исследование S. Agarwal и соавт. были включены 150 пациентов с постинсульной спастичностью и ДЦП, которые были разделены на 2 группы [40]. Пациенты первой группы получали баклофен в средней дозе 24,3±12,2 мг/сут, второй – толперизон в средней дозе 378,2±102,1 мг/сут. Продолжительность терапии составила 4 недели. Клиническую эффективность оценивали через 2, 4 и 6 недель. В обеих группах отмечалось значимое снижение мышечного тонуса к концу терапии, однако мышечная сила была выше в группе больных, получавших толперизон. Кроме того, в группе толперизона был достоверно выше уровень функциональной активности по шкале Бартель (р>0,05), а также коэффициенты эффективности влияния на спастичность, мышечную силу и функциональную активность (рис. 1, 2) [40].
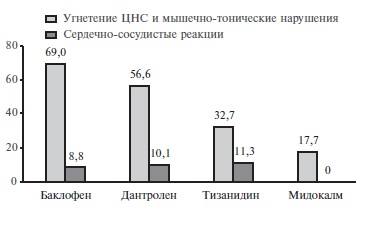
В.В. Ковальчук и соавт. оценивали эффективность и безопасность толперизона у пациентов со спастичностью после инсульта по сравнению не только с баклофеном, но и дантроленом и тизанидином [41]. В каждую группу было включено по 80 человек, сопоставимых по полу, возрасту и тяжести дефекта (3-4 балла по шкале Ашворта). Для оценки степени спастичности использовали шкалу Ашворта [42]. С целью определения влияния препаратов на силу мышц определяли способность к ходьбе по ровной горизонтальной поверхности в течение 2 мин. Степень восстановления разных функций пациентов определяли при помощи шкал Бартель [43], Линдмарк [44] и Скандинавской шкалы инсульта [45], уровень бытовой адаптации – по шкале самооценки бытовых возможностей повседневной жизни Мертон и Саттон [46]. Результаты сравнительного анализа показали наибольшую эффективность толперизона в отношении снижения мышечного тонуса. В группе пациентов, получавших этот препарат, был самым высоким процент (59,7%) пациентов, у которых спастичность отсутствовала или была минимальной (0-1 балл по шкале Ашворта). Толперизон оказывал также наиболее выраженное влияние на уровень бытовой адаптации и параметры ходьбы. Следует подчеркнуть, что в обоих сравнительных исследованиях частота побочных эффектов была самой низкой в группе толперизона (рис. 3). В многоцентровом обсервационном исследовании при лечении толперизоном пациентов со спастичностью в амбулаторной практике частота побочных эффектов не превышала 3%, а положительный эффект был достигнут у 65,9% больных [47]. Результаты ретроспективного анализа 10-летнего применения толперизона свидетельствуют о безопасности длительного лечения препаратом [48]. Максимальная длительность применения в этом исследовании составила почти 7 лет, а средняя длительность лечения превышала 1 год [48].
Толперизон – это единственный миорелаксант, выпускающийся как в инъекционной форме (ампулы, содержащие 100 мг толперизона и 2,5 мг лидокаина гидрохлорида), так и в виде таблеток (по 150 мг), что обеспечивает достижение клинического эффекта в более короткие сроки, а также преемственность парентеральной и пероральной форм терапии. В крупном сравнительном исследовании у 1700 пациентов в возрасте от 30 до 84 лет с постинсультной спастичностью отмечена высокая эффективность толперизона при последовательном назначении инъекционной формы в течение 1,5 месяца, а затем таблетированной формы (150 мг 3 раза в день) на 1,5 месяца. В группе толперизона минимальная выраженность спастичности или ее отсутствие (0-1 балл по шкале Ашворта) отмечались у 64,7% пациентов, в группе контроля – у 27,3% . В течение 1 недели после назначения толперизона 66,7% больных отметили значительное уменьшение выраженности болевого синдрома по визуальной аналоговой шкале. Достоверность различий с группой контроля составила р<0,0001. Подобный двойной эффект толперизона в отношении спастичности и сопутствующего ей болевого синдрома способствует более быстрому повышению уровня бытовой адаптации (р<0,0001), а также улучшению качества жизни [49].
Рекомен дованные дозы толперизона (Мидокалма) составляют 300-450 мг/сут. В отдельных работах предпринимались попытки постепенного титрования дозы препарата до более высоких значений. В исследовании P. Stamenova и соавт. у больных со спастичностью после инсульта длительностью 3,3±4,4 года доза препарата варьировалась от 300 до 900 мг/сут. При этом даже в случае использования высоких доз толперизона частота побочных эффектов была сопоставимой с таковой в группе плацебо [50].
Заключение
На сегодняшний день миорелаксанты являются важнейшей составляющей комплексной терапии постинсультных расстройств. Необходимо своевременно назначить антиспастическую терапию, чтобы предупредить формирование устойчивых функциональных и структурных изменений на сегментарном уровне и в головном мозге, создать условия для эффективной двигательной реабилитации, предупредить развитие контрактур.
Используемые источники
- Handley A, Medcalf P, Hellier K, Dutta D. Movement disorders after stroke. Age Ageing 2009;38(3):260-6.
- Martin A, Abogunrin S, Kurth H, Dinet J. Epidemiological, humanistic, and economic burden of illness of lower limb spasticity in adults: a systematic review.Neuropsychiatr Dis Treat 2014;10:111-22.
- Епифанов В.А., Епифанов А.В. Реабилитация больных, перенесших инсульт. МЕДпресс-информ. 2013;243. [Epifanov VA, Epifanov AV. Rehabilitation of patients with stroke. MEDpressinform; 2013;24 (In Russ.)].
- Sommerfeld DK, Eek EU, Svensson AK, et al. Spasticity after stroke: its occurrence and association with motor impairments and activity limitations. Stroke 2004;35(1):134-9.
- Urban PP, Wolf T, Uebele M, et al. Occurence and clinical predictors of spasticity after ischemic stroke. Stroke 2010;41(9):2016-20.
- Wissel J, Schelosky LD, Scott J, et al. Early development of spasticity following stroke: a prospective, observational trial. J Neurol 2010;257(7):1067-72.
- Wissel J, Manack A, Brainin M. Toward an epidemiology of poststroke spasticity. Neurology 2013;80:13-9.
- Lance JW. Symposium synopsis. In: Spasticity: Disordered Motor Control. Feldman RG, Young RR, Koella WP (eds). Chicago: Year Book Medical Publishers. 1980;485-94.
- Вейн А.М., Воробьева О.В. Болезненный мышечный спазм и спастичность. Алгоритм диагностики и терапии. Рус мед журнал 2003;11(8):438. [Vein AM, Vorobyova OV. Painful muscle spasm and spasticity. Diagnosis and therapy. Russ Med J 2003;11(8):438.(In Russ.)].
- Клюшников С.А., Иллариошкин С.Н., Иванова-Смоленская И.А. Спастичеcкий синдром в неврологии. Возможности толперизона (мидокалма) в терапии спастических проявлений нейроваскулярных синдромов. Атмcсфера 2009;3:39-41. [Klyushnikov SA, Illarioshkin SN, Ivanova-Smolenskaya IA. Spastic syndrome in neurology. Tolperisone (mydocalm) in the treatment of spastic manifestations of neurovascular syndromes. Atmosphere 2009;3:39-41 (In Russ.)].,
- Huang CY, Wang CH, Hwang IS. Characterization of the mechanical and neural components of spastic hypertonia with modified H reflex. J Electromyogr Kinesiol 2006;16(4):384-91.
- Lotze M, Markert J, Sauseng P, et al. The role of multiple contralesional motor areas for complex hand movements after internal capsular lesion. J Neuroscience 2006;26(22):6096-102.
- Зиновьева О.Е., Головачева В.А. Вопросы патогенеза и лечения постинсультной спастичности. Медицинский Совет 2016;8:63-7 [Zinovieva OE, Golovacheva VA. Questions of pathogenesis and treatment of post-stroke spasticity. Meditsinskiy sovet 2016;8:63-7(In Russ.)].
- Искра Д.А., Коваленко А.П., Кошкарев М.А., Дыскин Д.Е. Спастичность: от патофизиологии к лечению. Журнал неврологии и психиатрии им. С.С. Корсакова 2018;118(10):108-14 [Iskra DA, Kovalenko AP, Koshkarev MA, Dyskin DE. Spasticity: from pathophysiology to treatment. Journal of Neurology and Psychiatry S.S. Korsakov 2018;118(10):108-14 (In Russ.)].
- Weidner N, Ner A, Salimi N, Tuszynski MН. Spontaneous corticospinal axonal plasticity and functional recovery after adult central nervous system injury. Proceedings of the National Academy of Sciences of the USA 2001;98(6):3513-8.
- Raineteau O, Schwab MЕ. Plasticity of motor systems after incomplete spinal cord injury. Nature Rev Neuroscience 2001;2(4):263-73.
- Lamy JС, Wargon I, Mazevet D, et al. Impaired efficacy of spinal presynaptic mechanisms in spastic stroke patients. Brain 2009;132(3):734-48.
- Page SJ, Gater DR, Bach YRP. Reconsidering the motor recovery plateau in stroke rehabilitation. Arch Phys Med Rehabil 2004;85(8):1377-81.
- Li S, Francisco G. New insights into the pathophysiology of post-stroke spasticity. Front Hum Neurosci 2015;10(9):192.
- Gracies JM. Pathophysiology of spastic paresis. I: Paresis and soft tissue changes. Muscle Nerve 2005;31(5):535-51.
- O’Dwyer NJ, Ada L, Neilson PD. Spasticity and muscle contracture following stroke. Brain 1996;119:1737-49.
- Зиновьева О.Е., Катушкина Э.А., Яхно Н.Н., Шенкман Б.С. Изменения скелетных мышц при постинсультной спастичности. Неврологический журнал 2011;4:19-26 [Zinovyeva OE, Katushkina EA, Yakhno NN, Shenkman BS. Skeletal muscle changes in post-stroke spasticity. Neurological journal 2011;4:19-26 (In Russ.)].
- Бархатова В.П., Завалишин И.А., Переседова А.В. Спастичность: патогенез и современные подходы к лечению. Русский медицинский журнал 2005;13(22):1503 [Barkhatova VP, Zavalishin IA, Peresedova AV. Spasticity:pathogenesis and modern approaches to treatment. Russian Medical Journal 2005;13(22):1503 (In Russ.)].
- Oertel WH. Distribution of synaptic transmitters in motor centers with reference to spasticity. In: Emre M, Benecke R (eds). Spasticity. The current status of research and treatment 1989;27–44.
- Gourab K, Schmit BD, Hornby TG. Increased lower limb spasticity but not strength or function following a single-dose serotonin reuptake inhibitor in chronic stroke. Arch Phys Med Rehabil 2015;96(12):2112-19.
- Seo NJ, Fischer HW, Bogey RA, et al. Effect of a serotonin antagonist on delay in grip muscle relaxation for persons with chronic hemiparetic stroke. Clin Neurophysiol 2011;122(4):796-802.
- Bhimani R. Intrathecal baclofen therapy in adults and guideline for clinical nursing care. Rehabilitation Nursing 2008;33(3):110-6.
- Mayer NH. Clinicophysiologic concepts of spasticity and motor dysfunction in adults with an upper motoneuron lesion. Muscle Nerve Suppl 1997;6:1-13.
- Gracies JM. Pathophysiology of spastic paresis. II: Emergence of muscle overactivity. Muscle Nerve 2005;31(5):552-71.
- Хатькова С.Е., Орлова О.Р., Тимербаева С.Л. Оценка клинического профиля взрослых пациентов со спастичностью верхней конечности, которым показаны инъекции ботулинического токсина типа А (по данным международного исследования). Журнал неврологии и психиатрии им. С.С.Корсакова 2011;8:23–6 [Khat'kova SE, Orlova OR, Timerbaeva SL. Assessment of the clinical profile of adult patients with spasticity of the upper limb, wich shows the injection of botulinum toxin type A (according to international survey). Journal of neurology and psychiatry S.S. Korsakova 2011;8:23-6 (In Russ.)].
- Bakheit AM, Zakine B, Maisonobe P, et al. The profile of patients and current practice of treatment of upper limb muscle spasticity with botulinum toxin type a: an international survey. Int J Rehabil Res 2010;33(3):199-204.
- Завалишин И.А., Стойда Н.И., Шитикова И.Е. Клиническая характеристика синдрома верхнего мотонейрона. В кн.: Синдром верхнего мотонейрона.Под ред. Завалишина И.А., Осадчих А.И., Власова Я.В. Самарское отд. Литфонда. 2005;11–54. [Zavalishin IA, Stoga NI, Shiticova IE. Clinical characteristics of the syndrome of the upper motor neuron. In: Upper motor neuron syndrome. Edited by Zavalishin IA, Osadchikh AI, Vlsova Ya.V. Samara otd. LitFund2005;11–54 (In Russ.)]
- Завалишин И.А., Бархатова В.П. Спастичность. Журнал невропатологии и психиатрии 1997;3:68-70 [Zavalishin IA, Barkhatova VP. Spasticity. Journal neuropathology and psychiatry 1997;3:68-70 (In Russ.)].
- Coward DM. Tizanidine: Neuropharmacology and mechanism of action. Neurol 1994;44:6–11.
- Gelber DA, Good DC, Dromerick A, et al. Open-label dose-titration safety and efficacy study of Tizanidine hydrochloride in the treatment of spasticity associated with chronic stroke. Stroke 2001;32:1841–6.
- Hinck D., Koppenhofer E. Tolperisone – a novel modulator of ionic currents in myelinated axons. Gen Physiol Biophys 2001;20(4):413–29.
- Hofer D, Lohberger B, Steinecker B. A comparative study of the action of tolperisone on seven different voltage dependent sodium channel isoforms. Eur J Pharmacol 2006;538(1–3):5–14.
- Furuta Y, Yoshikawa A. Reversible adrenergic alpha-receptor blocking action of 2,48-dimethyl-3-piperidino-propiophenone (tolperisone). Jpn J Pharmacol 1976; 26(5):543–50.
- Dulin J, Kovacs L, Ramm S, et al. Evaluation of sedative effects of single and repeated doses of 50 mg and 150 mg tolperisone hydrochloride. Results of a prospective, randomized, double-blind, placebo-controlled trial. Pharmacopsychiatry 1998;31(4):137-42.
- Agarwala S, Patelb T, Shahc N, Patela BM. Comparative study of therapeutic response to baclofen vs tolperisone in spasticity. Biomed Pharmacother 2017;87:628-35.
- Ковальчук В.В., Скоромец А.А., Васильева И.В. Сравнительная характеристика эффективности разных миорелаксантов при реабилитации. Consilium medicum Неврология 2012;2:29-35 [Kovalchuk VV, Skoromets AA, Vasilyeva IV. Comparative characteristics of the effectiveness of different muscle relaxants in rehabilitation. Consilium medicum Neurology 2012;2:29-35 (In Russ.)].
- Ashworth B. Preliminary trial of carisoprodol in multiple sclerosis. Practitioner 1964;192:540–2.
- Machoney F, Barthel D. Functional evalution: the Barthel Index. Md State Med J 1965;14:61–5.
- Lindmark B. Evaluation of functional capacity after stroke with special emphasis on motor function and activities of daily living. Scand J Rehabil Med 1988;21:1–40.
- Scandinavian Stroke Study Group. Multicenter trial of hemodilution in ischemic stroke: background and study protocol. Stroke 1985;16:885–90.
- Kwantabisa N. Occupational therapy ADL checklist self maintenance. Merton and Sutton Community NHS Trust. Stroke Rehabilitation Team Protocol 1999;7–9.
- Dewan B, Philipose N. A post-marketing surveillance study of tolperisone [MYOTOP-150]: It's use in the general clinical practice in India. J Clin Diagn Res 2011; 5(3):561-5.
- Feher M, Lantos A, Denes Z, Vass M. Опыт длительного применения препарата Мидокалм. Провизор 2003;7.
- Ковальчук В.В. Оценка эффективности и безопасности мидокалма в раннем восстановительном периоде инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова 2013;113(4):35-40 [Kovalchuk VV. Evaluation of the effectiveness and safety of midocalm in the early recovery period of stroke. Journal of Neurology and Psychiatry S.S. Korsakov 2013;113(4):35-40 (In Russ.)].
- Stamenova P, Koytchev R, Kuhn K, et al. A randomized, double-blind, placebocontrolled study of the efficacy and safety of tolperisone in spasticity following cerebral stroke. Eur J Neurol 2005;12(6):453-61.
