Анкилозирующий спондилит: подходы к диагностике и клиническая эффективность упадацитиниба
Анкилозирующий спондилит (АС) – нередкое заболевание, развивающееся преимущественно у мужчин молодого возраста и характеризующееся медленно прогрессирующим поражением крестцовоподвздошных суставов (сакроилиит) и позвоночника. По современной классификации АС считают одним из вариантов аксиального спондилоартрита (СпА). Диагноз АС обычно устанавливают поздно – в среднем через 8-10 лет после появления симптомов. Предполагать аксиальный СпА следует как у мужчин, так и женщин при наличии хронической боли в спине (≥3 мес), появившейся в возрасте до 45 лет, и по крайней мере одного дополнительного фактора (воспалительный характер боли, HLA-B27, сакроилиит, артрит периферических суставов, энтезит, дактилит, псориаз, увеит, воспалительное заболевание кишечника, отягощенный семейный анамнез, повышение СОЭ и/или уровня С-реактивного белка, хороший ответ на нестероидные противовоспалительные препараты – НПВП). Таких пациентов следует направлять на консультацию к ревматологу. Помимо рентгенографии важную роль в диагностике АС играет магнитно-резонансная томография, которая позволяет выявить воспаление крестцово - подвздошных суставов на дорентгенологической стадии (нерентгенологический СпА). Лечение АС предполагает регулярные физические упражнения и прием НПВП. При их неэффективности назначают ингибиторы фактора некроза опухоли альфа и интерлейкина17. Упадацитиниб – это первый ингибитор янус-киназ, одобренный для лечения активного АС. Эффективность упадацитиниба у пациентов с АС, не ответивших на НПВП, была показана на основании результатов рандомизированного, двойного слепого, плацебо-контролируемого исследования SELECT-AXIS 1. Предварительные результаты исследований SELECT-AXIS 2 свидетельствуют об эффективности упадацитиниба и у пациентов с АС, не ответивших на генно-инженерные биологические препараты, и больных с нерентгенологическим СпА. В статье приведены клинические наблюдения, иллюстрирующие эффективность упадацитиниба у больных АС.
С.В. Моисеев. Анкилозирующий спондилит (АС) – это относительно нередкое заболевание, распространенность которого в общей популяции достигает 1,4%. АС относится к группе спондилоартритов (СпА) – системных воспалительных заболеваний, характеризующихся поражением позвоночника и крестцовоподвздошных сочленений, а также наличием периферического артрита, энтезита, дактилита и/или внесуставных проявлений (увеит, воспалительные заболевания кишечника и др.) [1]. В зависимости от преимущественной локализации поражения – аксиальный скелет или периферические суставы – выделяют два варианта СпА – аксиальный и периферический. Первый включает в себя АС и нерентгенологический СпА, второй – псориатический артрит, артрит при воспалительных заболеваниях кишечника, реактивный артрит и недифференцированный СпА.
Считается, что первыми классический АС описали более 120 лет назад А. Штрюмпель и П. Мари, однако фактически пальма первенства в описании этого заболевания принадлежит нескольким английским врачам. Большой вклад в изучение анкилозирующих заболеваний позвоночника внес известный русский психиатр и невролог В.М. Бехтерев, поэтому в российской литературе АС часто называют болезнью Бехтерева [2].
Хотя основные проявления АС, в частности боль в нижней части спины и ограничение подвижности позвоночника, хорошо известны, на практике это заболевание часто остается недиагностированным, а пациенты многие годы наблюдаются терапевтами или невропатологами с диагнозом “остеохондроза". Проблема поздней диагностики АС актуальна не только для России, но и других стран, а средний срок от появления первых симптомов до установления диагноза составляет 8-10 лет [3]. В значительной степени это объясняется недостаточной информированностью практических врачей об АС и ложном представлении о нем как об очень редком заболевании. На самом деле АС является достаточно частой причиной боли в нижней части спины у людей более молодого возраста. Например, в Голландии аксиальный СпА был диагностирован у 24% из 364 пациентов в возрасте 20-45 лет, обращавшихся к врачам общей практики с жалобами на боли в спине, причем медиана длительности симптомов в этом исследовании составляла 9 лет [4]. У женщин АС диагностируют еще позднее, чем у мужчин, так как многие врачи ошибочно считают, что это заболевание развивается исключительно у лиц мужского пола. В крупном европейском исследовании, в которое были включены более 2800 пациентов с аксиальным СпА, средний срок до установления диагноза составил 8,2±8,9 лет у женщин и 6,1±7,4 лет у мужчин (p<0,001) [5]. Хотя мужчины на самом деле заболевают АС в несколько раз чаще, чем женщины, тем не менее, доля последних в нескольких когортах пациентов с АС варьировалась от 19,4% до 36,0% [3]. По данным недавно опубликованного систематизированного обзора, поздний диагноз аксиального СпА ассоциировался с более высокой активностью заболевания, более выраженными нарушениями физической функции и структурными изменениями, повышенной вероятностью нетрудоспособности и депрессии, ухудшением качества жизни и более высокими прямыми и непрямыми затратами [6]. При этом более короткая длительность АС – это один из основных факторов, позволяющих предсказать более выраженный ответ на лечение [7].
Когда следует предполагать АС и на основании каких критериев можно диагностировать это заболевание?
Е.И. Кузнецова. Все эксперты сходятся во мнении, что вероятность более ранней диагностики АС увеличивается, если врач общей практики, например, терапевт или невропатолог, способен заподозрить АС и своевременно направляет пациента к ревматологу. Основное проявление АС – хроническая боль в нижней части спины, которая очень часто встречается в общей популяции. По данным общенационального исследования, проводившегося в США, 32% из 17334 опрошенных американцев жаловались на хроническую боль в нижней части спины. Большую часть пациентов, у которых имелся этот симптом, составили лица в возрасте от 41 до 64 лет (43,2%) и 65 лет и старше (25,4%) [8]. Очевидно, что направлять всех таких пациентов к ревматологам не имеет смысла, так как в общей популяции доля АС в структуре причин хронической боли в нижней части спины не так велика и не превышает 5%.
По мнению экспертов Международной ассоциации по изучению СпА (ASAS), консультация ревматолога обоснована у пациентов с хронической болью в спине, появившейся в возрасте до 45 лет и сохраняющейся в течение по крайней мере 3 мес, при наличии по крайней мере одного из следующих факторов [9]:
- воспалительная боль в спине;
- положительный тест на HLA-B27;
- признаки сакроилиита при рентгенографии или маг-нитно-резонансной томографии (МРТ) – только в том случае, если эти исследования проводились, однако их использование для скрининга не рекомендуется;
- “периферические" проявления, такие как артрит, энтезит и/или дактилит;
- внесуставные проявления, в том числе псориаз, воспалительные заболевания кишечника и/или увеит;
- наличие у близких родственников АС, псориаза, острого увеита, воспалительного заболевания кишечника или реактивного артрита;
- значительное уменьшение или купирование боли при приеме нестероидных противовоспалительных препаратов (НПВП);
- повышение СОЭ и/или концентрации С-реактивного белка (СРБ).
В первую очередь предполагать АС следует в тех случаях, когда боль в спине имеет воспалительный характер, о чем свидетельствует наличие по крайней мере 4 из следующих 5 параметров: (1) возраст на момент появления боли ≤40 лет; (2) постепенное начало; (3) уменьшение боли при физической нагрузке; (4) отсутствие улучшения в покое и (5) ночная боль, уменьшающаяся при вставании [10]. Диагностическое значение воспалительной боли в спине демонстрируют результаты международного исследования, в котором были проанализированы истории болезни 2517 пациентов с хронической болью в спине, направленных к ревматологам. Среди 974 больных, у которых имелись критерии воспалительной боли в спине, АС был диагностирован в 54% случаев, а нерентгенологический аксиальный СпА – в 29% [11]. Следует подчеркнуть, что воспалительная боль в спине не является обязательным признаком АС и наблюдается только у 70-80% таких больных, поэтому ее отсутствие не исключает диагноз АС [3]. По данным исследования D. Poddubnyy и соавт., чувствительность воспалительной боли в спине, которую выделяли на основании различных рекомендаций, в диагностике АС составила 74,4-81,1%, а специфичность – всего 25,1-43,9% [12]. Соответственно, при оценке целесообразности консультации ревматолога следует учитывать и другие возможные проявления АС, например, гастроэнтерологи или офтальмологи должны обсуждать этот диагноз у всех больных с воспалительными заболеваниями кишечника или острым передним увеитом, которые жалуются на хроническую боль в спине, появившуюся в возрасте до 45 лет. СпА тесно ассоциирован с HLA-B27, который определяется у 7590% больных АС и нерентгенологическим аксиальным СпА, но реже у пациентов с реактивным артритом (3060%), псориатическим артритом (20-50%) и артритом при воспалительных заболеваниях кишечника (10-40%) [13]. В качестве маркера воспалительной активности АС обычно используют концентрацию СРБ, хотя она может оказаться нормальной у значительной части пациентов, особенно при однократном измерении. В одном исследовании исходное содержание СРБ было нормальным у четверти пациентов с АС, однако в половине случаев в течение последующих 16 недель было отмечено по крайней мере однократное ее повышение [14]. В целом приведенные данные свидетельствуют о том, что отсутствие HLA-B27 или нормальное содержание СРБ не исключают возможное наличие АС.
![Классификационные критерии аксиального СпА, предложенные ASAS [17].](/wp-content/uploads/2021/12/ANKILO1.jpg)
С.В. Гуляев. Для диагностики АС обычно используют модифицированные нью-йоркские критерии, которые включают в себя клинические (хроническая боль в спине, уменьшающаяся при физической нагрузке, но не в покое, ограничение движений в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях и/или ограничение дыхательной экскурсии грудной клетки по сравнению с показателями у здоровых лиц с поправкой на пол и возраст) и рентгенологические (двусторонний сакроилиит ≥2 степени или односторонний сакроилиит 3-4 степени) признаки [15]. Диагноз считается определенным при наличии рентгенологического критерия и по крайней мере одного клинического критерия. На поздней стадии АС на рентгенограммах определяются не только сакроилиит, но и структурные изменения в позвоночнике (синдесмофиты). Рентгенологические признаки определенного сакроилиита характеризуются высокой специфичностью в диагностике аксиального СпА, однако они наблюдаются только у 30% пациентов с длительностью симптомов менее 1 года и примерно у 50% больных с длительностью симптомов 2-6 лет [16]. Учитывая низкую чувствительность приведенных критериев в ранней диагностике АС, т.е. на дорентгенологической стадии, различными профессиональными обществами были разработаны новые классификационные критерии, предполагающие выделение нерентгенологического аксиального СпА. Например, в соответствии с рекомендациями ASAS 2009 г. у пациента с хронической болью в спине, появившейся в возрасте до 45 лет и сохраняющейся ≥3 мес, критерием наличия сакроилиита могут быть не только достоверные рентгенологические изменения, но и МР-признаки активного воспаления [17]. Диагноз аксиального СпА возможен и при отсутствии изменений на МРТ, если у пациента определяется HLA-B27 и имеются еще по крайней мере 2 признака СпА (рис. 1). Экспертами ASAS разработаны также классификационные критерии периферического СпА для пациентов с преобладающими “периферическими" проявлениями заболевания, такими как артрит, энтезит и/или дактилит. Необходимо подчеркнуть, что критерии ASAS являются классификационными, а не диагностическими, т.е. они предназначены не для диагностики СпА в клинической практике, а для выделения однородных групп пациентов в клинических исследованиях [18]. При оценке результатов обследования целесообразно учитывать диагностическое значение (“вес") наличия или отсутствия определенных признаков СпА (рис. 2) [18]. Подобный анализ делает диагноз аксиального СпА более вероятным или мало вероятным, хотя он может оставаться неопределенным даже при использовании всех возможных тестов, учитывая медленное прогрессирования заболевания и возможность длительных ремиссий. В таких случаях диагноз может быть установлен только при динамическом наблюдении пациента.
![Диагностическое значения наличия и отсутствия различных признаков аксиального СпА [18].](/wp-content/uploads/2021/12/ANKILO2.jpg)
В рекомендациях Ассоциации ревматологов России для диагностики АС допускается применение МРТ при отсутствии достоверных рентгенологических признаков сакроилиита [19]. Основное диагностическое значение имеет выявляемый при МРТ отек костного мозга в прилежащих к суставу костях, в то время как наличие только синовита крестцово-подвздошных суставов, капсулита или энтезита без субхондрального отека костного мозга/остеита согласуется с диагнозом активного сакроилиита, но не является достаточным для его постановки [20]. При МРТ могут быть выявлены и структурные изменения, в том числе эрозии, жировая дистрофия и/или анкилоз, которые служат дополнительными диагностическими признаками даже при отсутствии активного воспаления. Субхондральный отек костного мозга наблюдается не только при СпА, но может быть последствием механического напряжения, например, у спортсменов [21]. Тем не менее, специфичность МРТ высокая и составляет 80-85% [18].
К числу классификационных критериев аксиального СпА отнесены артрит периферических суставов, энтезит и дактилит, а также системные проявления, такие как увеит, псориаз и воспалительные заболевания кишечника, которые одновременно являются и классификационными критериями периферического СпА. Доводом в пользу последнего диагноза служит преобладание указанных проявлений в клинической картине заболевания. Частота артрита с поражением периферических суставов, преимущественно неэрозивного, при СпА варьируется от 26 до 62% [18]. Обычно развивается моно- или олигоартрит суставов нижней конечностей. Более тяжелое течение характерно для коксита, который чаще отмечается у людей более молодого возраста с тяжелым аксиальным СпА. По данным мета-анализа большого числа исследований, частота увеита у пациентов с АС составила 25,8%, псориаза – 9,3%, воспалительных заболеваний кишечника – 6,8% [22].
Возможный алгоритм диагностики АС изображен на рис. 3 [23,24].
![Алгоритм диагностики аксиального СпА [23,24].](/wp-content/uploads/2021/12/ANKILO3.jpg)
С.В. Моисеев. В отличие от ревматоидного артрита, основа лечения АС – немедикаментозные методы, так как регулярные физические упражнения снижают активность болезни и улучшают функцию позвоночника и качество жизни [25,26]. Результаты некоторых исследований свидетельствуют о том, что механическое напряжение может оказывать и неблагоприятное влияние на течение АС, в частности вносит вклад в развитие воспаления и прогрессирование заболевания, однако этот вопрос остается спорным и нужда ет ся в дополнительном изучении [27]. Соот ветственно, в настоящее время нет достаточных оснований для ограничения физической активности у пациентов с АС. Еще одна особенность лечения АС заключается в том, что в качестве препаратов первой линии пациентам на длительный срок назначают неселективные НПВП или селективные ингибиторы циклооксигеназы-2, в то время как при ревматоидном артрите и других ревматических заболеваниях их используют только с симптоматической целью. По данным систематизированного обзора Cochrane [28], препараты обеих групп по эффективности достоверно превосходили плацебо и существенно не отличались друг от друга как по эффективности, так и безопасности. Более того, в отдельных исследованиях постоянный прием НПВП замедлял прогрессирование структурных изменений у пациентов с АС [29,30], хотя этот эффект не был подтвержден еще в одном исследовании [31]. В то же время стандартные БПВП, в том числе метотрексат, лефлуномид, сульфасалазин и гидроксихлорохин, оказались неэффективными при аксиальном СпА, хотя применение сульфасалазина возможно при поражении периферических суставов [32]. Применение системных глюкокортикостероидов при аксиальном СпА нецелесообразно. Для лечения аксиального СпА применяются генно-инженерные биологические препараты (ГИБП) (рис. 4). Какова их роль в современных схемах терапии?
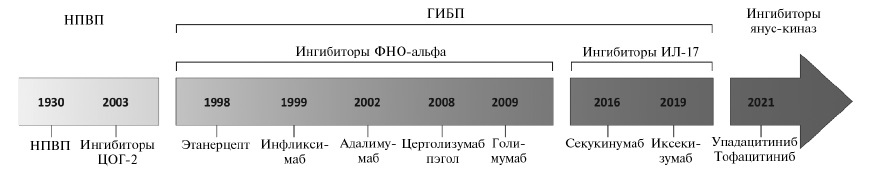
Т.П. Шевцова. ГИБП, в том числе ингибиторы ФНО-альфа (этанерцепт, инфликсимаб, адалимумаб, цертолизумаб-пэгол и голимумаб) и интерлейкина (ИЛ)-17 (секукинумаб и иксекизумаб) в настоящее время рассматривают как препараты второй линии в лечении аксиального СпА и назначают при неэффективности по крайней мере двух НПВП в течение 4 недель при наличии одного из следующих признаков: повышенная концентрация СРБ, признаки воспаления на МРТ или рентгенологические признаки определенного сакроилиита [25]. Все ингибиторы ФНО-альфа за исключением инфликсимаба и оба ингибитора ИЛ-17 одобрены для лечения не только АС, но и нерентгенологического СпА. Преимущества препаратов одного класса перед ГИБП другого класса не доказаны, однако на практике лечение чаще начинают с ингибиторов ФНО-альфа, учитывая больший опыт их изучения и применения в клинической практике. В случае наличия сопутствующего увеита или воспалительного заболевания кишечника рекомендуется применение моноклональных антител к рецепторам ФНО-альфа, а не этанерцепта.
Лечение первым ГИБП позволяет достичь ответа у 60-65% пациентов [23]. Более высокую эффективность лечения при назначении ингибиторов ФНО-альфа позволяют предсказать мужской пол, отсутствие курения, более короткая длительность болезни, повышенное содержание СРБ и МР-признаки воспаления [33]. В случае достижения стойкого ответа на лечение возможно постепенное уменьшение доз ГИБП, хотя полная их отмена в большинстве случаев приводит к обострению заболевания и, соответственно, нецелесообразна. Если первый препарат оказывается неэффективным, или пациент перестает отвечать на лечение, то его переводят на второй/третий ингибитор ФНО-альфа или ингибитор ИЛ-17. При неэффективности терапии ингибитором ФНО-альфа предпочтительным представляется назначение препарата другого класса, т.е. ингибитора ИЛ-17, однако этот вопрос нуждается в дальнейшей изучении.
С.В. Моисеев. Позволяют ли ГИБП задержать прогрессирование структурных изменений у больных аксимальным СпА?
Т.П. Шевцова. Однозначно ответить на этот вопрос сегодня невозможно. Для подтверждения подобного эффекта необходимы очень длительные исследования, учитывая медленное прогрессирование аксиального СпА. В регистрационных плацебо-контролируемых исследованиях ингибиторы ФНО-альфа не влияли на прогрессирование структурных изменений у пациентов с аксиальным СпА, однако результаты более длительного наблюдения (≥4 лет) свидетельствуют о том, что они могут давать такой эффект [34,35]. Убедительных данных, подтверждающих эффективность ингибиторов ИЛ-17 в профилактике прогрессирования аксиального СпА, также нет, хотя это, конечно, не снижает их клиническую ценность.
С.В. Моисеев. Для лечения ревматоидного артрита все чаще применяют неселективные (тофацитиниб, барицитиниб) и селективные (упадацитиниб) ингибиторы янус-киназ, которые, в отличие от ГИБП, не являются моноклональными антителами или другими белковыми молекулами и предназначены для приема внутрь. Недавно упадацитиниб стал первым препаратом этой группы, одобренным для лечения АС, в том числе в Российской Федерации. Каковы результаты исследований упадацитиниба у пациентов с аксиальным СпА?
П.И. Новиков. Эффективность и безопасность упадацитиниба в дозе 15 мг один раз в сутки у взрослых пациентов с активным АС изучали в многоцентровом, рандомизированном, двойном слепом, плацебо-контролируемом исследовании 2/3 фазы SELECT-AXIS 1, которое проводилось в 62 центрах в 20 странах мира [36]. Диагноз АС устанавливали на основании модифицированных нью-йоркских критериев. В исследование включали только пациентов, не получавших ГИБП и не ответивших на лечение по крайней мере двумя НПВП. Критериями сохраняющейся активности АС были значение счета BASDAI≥4 и интенсивность боли в спине по визуальной аналоговой шкале ≥4 на визите скрининга и исходном визите. Пациентов рандомизировали (1:1) на группы упадацитиниба и плацебо и продолжали лечение в течение 14 недель. Больным, завершившим двойной слепой период, предлагали принять участие в 90-недельном открытом исследовании с целью изучения эффективности и безопасности длительной терапии упадацитинибом в дозе 15 мг/сут. Первичной конечной точкой двойного слепого исследования была частота ответа по критериям ASAS40 через 14 недель. Особенностью протокола SELECTAXIS 1 был анализ многочисленных вторичных показателей эффективности, которые включали себя динамику различных индексов и частоту ответа, оцениваемого на основании разных показателей.
В исследование были включены 187 взрослых пациентов (средний возраст 45,4 года) с активным АС, которые были распределены на две сопоставимые группы. Около 70% из них были мужчинами, средняя длительность заболевания составляла около 14 лет, а средний срок после установления диагноза – 7 лет. HLA-B27 определялся у 76% пациентов. Все пациенты не ответили на предыдущую терапию НПВП. Часть больных (16%) принимали стандартные БПВП, в основном сульфасалазин, лечение которыми разрешалось продолжить во время исследования. Средний счет боли в спине по шкале от 0 до 10 составлял 6,7 и 6,8 в группах плацебо и упадацитиниба, соответственно, индекс ASDAS – 3,7 и 3,5, индекс BASDAI – 6,5 и 6,3. Приведенные значения указывали на наличие высокой активности АС.
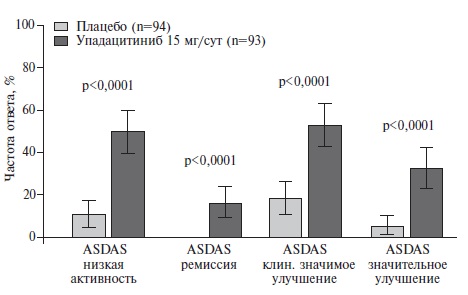
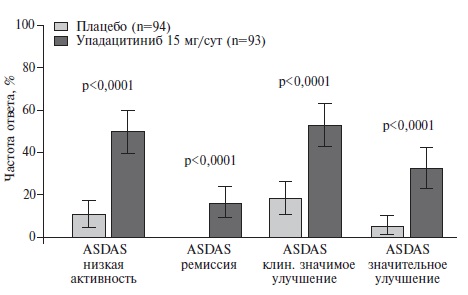
Первичная конечная точка исследования была достигнута: частота ответа по критериям ASAS40 через 14 недель в группе упадацитиниба достоверно превосходила таковую в группе плацебо (52% и 26%, соответственно; p=0,0003). Улучшение показателей активности АС при лечении ингибитором янус-киназ было отмечено уже через 2 недели после начала лечения, что указывало на быстрый эффект препарата. Эффективность упадацитиниба подтверждалась статистически значимым улучшением и других показателей, отражающих активность болезни (BASDAI50, ASDAS), функцию (BASFI) и динамику МР изменений в позвоночнике (SPARCC MRI) (рис. 5). Некоторые показатели (ASQoL, BASMI, MASES и ASAS Health Index) улучшились в группе упадацитиниба по сравнению с контролем, хотя разница между группами не достигла статистической значимости при внесении поправки на множественные сравнения. Преимущество упадацитиниба перед плацебо наблюдалось и при анализе частоты достижения ремиссии или низкой активности АС, которые являются основными целями лечения (во всех случаях различия между группами были высоко статистически значимыми). Так, низкая активность АС по критериям ASDAS была достигнута у 49% пациентов основной группы и только у 11% больных группы плацебо (рис. 6).
Переносимость упадацитиниба у больных АС была хорошей. Частота нежелательных явлений была сопоставимой в двух группах. При лечении упадацитинибом несколько чаще встречалось небольшое и бессимптомное повышение активности КФК, которое не требовало прекращения лечения. Срок лечения упадацитинибом во время двойного слепого периода исследования SELECT-AXIS 1 и количество включенных пациентов были явно недостаточными для анализа профиля безопасности, однако он тщательно изучен в клинических исследованиях, в том числе длительных, у пациентов с ревматоидным артритом [37].
О.В. Бугрова. Примером успешного применения упадацитиниба для лечения АС может служить следующее наблюдение. Больной C., 37 лет, впервые госпитализирован в ревматологическое отделение областной клинической больницы Оренбурга в июле 2021 г. В течение 7 лет беспокоят боли в коленных суставах и в поясничнокрестцовом, а затем и в грудном отделе позвоночника. Учитывая наличие рентгенологических признаков сакроилиита, диагностирован анкилозирующий спондилит. Получал терапию различными НПВП, однако боли полностью не проходили, а также отмечалось постепенное нарастание ограничений движений в позвоночнике. В течение нескольких месяцев принимал сульфасалазин без эффекта. При поступлении выявлены признаки высокой активности анкилозирующего спондилита (индекс BASFI – 6,5), резкое ограничение движений в позвоночнике, выраженное нарушение функциональной активности (индекс BASFI – 6,5) и энтезит (индекс MASES – 3). Счет боли по шкале от 0 до 10 составлял 10, ночной боли – 10, число болезненных суставов – 4/66, число припухших суставов – 2/66. СОЭ 26 мм/ч, содержание СРБ 7,8 мг/л. Начато лечение упадацитинибом в дозе 15 мг/сут. В течение 1,5 мес наблюдалось практически полное купирование боли и скованности в позвоночнике и болей в суставах, значительно улучшился сон. При повторном обследовании в ноябре 2021 г. отмечено значительное снижение активности заболевания (индекс BASDAI – 3,2, СРБ – 1,4 мг/л), уменьшение боли в позвоночнике (счет боли – 2, ночной боли – 1) и признаков энтезита (индекс MASES – 1), отсутствие боли и припухлости в коленных суставах. Кроме того, выявлено увеличение объема движений в позвоночнике, в частности боковое сгибание увеличилось с 13-14 до 19-20 см, тест Шобера – с 1,5 до 2,8 см, расстояние от козелка до стены уменьшилось с 12 до 10 см, увеличилась ротация в шейном отделе позвочночника. Индекс BASFI снизился до 2,2, что указывало на улучшение функциональности активности пациента.
Конечно, срок лечения упадацитинибом в данном наблюдении слишком короткий, чтобы в полной мере оценить эффективность и безопасность препарата. Тем не менее, этот случай демонстрирует быстрое действие упадацитиниба у пациента с высокой активностью АС.
С.В. Моисеев. Можно ли сопоставить эффективность упадацитиниба и ГИБП при лечении АС?
П.И. Новиков. В рандомизированных контролируемых исследованиях эффективность этих препаратов у больных АС не сравнивали. Как указано выше, в исследовании SELECT-AXIS 1 частота ответа по критериям ASAS40 через 14 недель в группах упадацитиниба и плацебо составила 52% и 26%. Этот показатель был одним из критериев эффективности и в регистрационных клинических исследованиях ингибиторов ФНО-альфа и ИЛ-17 у пациентов с АС, не ответивших на НПВП. Например, в исследовании MEASURE 2 на лечение секукинумабом в двух дозах или плацебо через 16 недель ответили 40,5-42,1% и 21,1% пациентов c АС, соответственно [38]. В исследовании COAST V частота ответа по критериям ASAS40 через 16 недель составила 48-52% при применении иксекизумаба каждые 2 или 4 недели, 36% в группе адалимумаба и 18% в группе плацебо [39]. Сходные преимущества активных препаратов перед плацебо были отмечены и при изучении эффективности ингибиторов ФНО-альфа [40,41]. Приве денные данные указывают на то, что упадацитиниб по крайней мере не уступает по эффективности ингибиторами ФНО-альфа и ИЛ-17 у пациентов с АС, не получавших ранее ГИБП. Однако необходимо подчеркнуть, что анализ результатов разных исследований позволяет составить только самое общее представление о сравнительной эффективности упадацитиниба и ГИБП, учитывая различия выборок пациентов, сроков оценки ответа на лечение и т.п.
С.В. Моисеев. Результаты исследования SELECTAXIS 1 не оставляют сомнений в эффективности упадацитиниба у пациентов с АС. Однако в это исследование не включали больных, не ответивших на ГИБП, и пациентов с нерентгенологическим аксиальным СпА. Каковы перспективы изучения препарата в таких случаях?
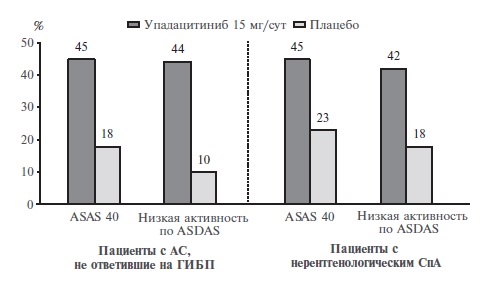
П.И. Новиков. В настоящее время проводится рандомизированное, двойное слепое, плацебо-контролируемое исследование 3 фазы SELECT-AXIS 2 с целью дальнейшего изучения эффективности и безопасности упадацитиниба в дозе 15 мг/сут у пациентов с аксиальным СпА. Фактически оно состоит из двух параллельных исследований (NCT04169373). В первое из них включены 420 пациентов с активным АС несмотря на лечение ГИБП, а во второе – 313 больных с нерентгенологическим аксиальным СпА. Общая длительность обоих исследований составит 104 недели, а длительность двойного слепого периода – 14 недель у пациентов с активным АС и 52 недели у больных с нерентгенологическим аксиальным СпА. Исследования SELECT-AXIS 2 пока не завершены, однако недавно в пресс-релизах компании AbbVie были приведены результаты анализа первичного показателя эффективности через 14 недель [42,43]. В обоих исследованиях по частоте ответа по критериям ASAS40 упадацитиниб ста- тистически значимо превосходил плацебо (рис. 7). Кроме того, при лечении ингибитором янус-киназ была достоверно выше частота достижения низкой активно- сти по критериям ASDAS. Преимущество упадацитини- ба перед плацебо подтверждалось и при анализе ряда вторичных показателей эффективности.
И.А. Шафиева. Мы имеем первый опыт применения упадацитиниба у больных, не ответивших на ГИБП. Пациент Ш., 54 лет, поступил в клинику Самарского государственного медицинского университета в апреле 2021 г. С 16-летнего возраста беспокоят боли в спине, а также боли в суставах нижних конечностей, которые расценивали как проявления реактивного артрита. С 26 лет рецидивирующий иридоциклит. При обследовании выявлен двусторонний сакроилиит. Диагностирован анкилозирующий спондилит. В течение более 20 лет получал терапию НПВП, а также сульфасалазином. Четыре года назад было начато лечение адалимумабом, на фоне которого увеит не рецидивировал, а боли в спине и суставах значительно уменьшились. Однако со временем эффективность терапии снизилась, в связи с чем адалимумаб был отменен несколько месяцев назад. При поступлении в клинику сильные боли (8 по визуальной аналоговой шкале) и ограничение движений во всех отделах позвоночника. При обследовании отмечалось увеличение СОЭ до 56 мм/ч и содержания СРБ до 52,9 мг/л. Диагноз: анкилозирующий спондилит высокой степени активности (ASDAS 5,3, BASDAI 7,5), двусторонний сакроилиит 3 стадии, HLA-B27. С 10 апреля 2021 года было начато лечение упадацитинибом в дозе 15 мг/сут. При повторном осмотре через 2 месяца наблюдалось значительное уменьшение болей в позвоночнике (до 2 по визуальной аналоговой шкале) и периферических суставах, нормализация СОЭ (18 мм/ч) и содержания СРБ (1,0 мг/л) и значительное снижение индексов воспалительной активности, в том числе ASDAS до 1,6 и BASDAI до 3,1.
Таким образом, у пациента с многолетним анамнезом АС и высокой активностью заболевания, которую не удавалось контролировать адалимумабом, лечение упадацитинибом в течение короткого срока привело к значительному улучшению состояния, в том числе практически полному купированию болевого синдрома.
С.В. Моисеев. Возможности лечения аксиального СпА за последние два десятилетия значительно расширились за счет разработки ингибиторов ФНО-альфа, а затем ингибиторов ИЛ-17. Место упадацитиниба в лечении АС в клинических рекомендациях пока не определено, так как они были опубликованы несколько лет назад. Если проводить аналогию с ревматоидным артритом, то при этом заболевании ингибиторы янускиназ первоначально рассматривали как препараты третьей линии и использовали в основном при неэффективности ингибиторов ФНО-альфа. Однако по мере накопления опыта изучения эффективности и безопасности таргетных синтетических БПВП в клинической практике их роль в лечении ревматоидного артрита была пересмотрена, и в настоящее время препараты этой группы считаются средствами второй линии и применяются наравне с различными ГИБП при отсутствии ответа на метотрексат и другие стандартные БПВП. В отличие от ГИБП, ингибиторы янускиназ не являются белковыми молекулами и, соответственно, не вызывают образование антител и применяются внутрь, что может иметь значение для пациентов, которым по тем или иным причинам отказываются от парентерального введения лекарственных средств. Применение упадацитиниба одобрено для лечения больных активным АС. Однако учитывая предварительные результаты исследования SELECT-AXIS 2, в ближайшее время можно ожидать расширения показаний к назначению упадацитиниба, в частности пациентам с нерентгенологическим аксиальным спондилоартритом.
Используемые источники
- Эрдес ШФ. Развитие концепции спондилоартритов. Научно-практическая ревматология. 2014;52(5):47 –6 [Erdes ShF. Spondyloarthritis: Evolution of a concept. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice 2014;52(5):474–6 (In Russ.)].
- Бунчук Н.В. В.М. Бехтерев и история описания анкилозирующего спондилита. Научно-практическая ревматология 2001;4:94-103.
- Barnett R, Ingram T, Sengupta R. Axial spondyloarthritis 10 years on: still looking for the lost tribe. Rheumatology (Oxford) 2020;59(Suppl4):iv25-37.
- van Hoeven L, Luime J, Han H, et al. Identifying axial spondyloarthritis in Dutch primary care patients, ages 20-45 years, with chronic low back pain. Arthritis Care Res (Hoboken) 2014;66(3):446-53.
- Garrido-Cumbrera M, Poddubnyy D, et al; EMAS Working Group. Gender differences in patient journey to diagnosis and disease outcomes: results from the European Map of Axial Spondyloarthritis. Clin Rheumatol 2021;40: 2753-61.
- Yi E, Ahuja A, Rajput T, et al. Clinical, economic, and humanistic burden associated with delayed diagnosis of axial spondyloarthritis: a systematic review. Rheumatol Ther 2020;7:65–87.
- Rudwaleit M, Listing J, Brandt J, et al. Prediction of a major clinical response (BASDAI 50) to tumour necrosis factor alpha blockers in ankylosing spondylitis. Ann Rheum Dis 2004;63(6):665-70.
- Kesiena O, Ajayi KV, Rene A, Benden M. Sociodemographic and work-related predictors of chronic lower back pain in the United States: the 2018 National Health Interview Survey data. Public Health 2021;198:30-34.
- Poddubnyy D, van Tubergen A, LandeweЂ R, et al. Development of an ASASendorsed recommendation for the early referral of patients with a suspicion of axial spondyloarthritis. Ann Rheum Dis 2015;74:1483–7.
- Sieper J, van der Heijde D, Landewe R, et al. New criteria for inflammatory back pain in patients with chronic back pain: a real patient exercise by experts from the Assessment of SpondyloArthritis international Society (ASAS). Ann Rheum Dis 2009;68:784–8.
- Burgos-Varga R, Wei JC, Rahman MU, et al. The prevalence and clinical characteristics of nonradiographic axial spondyloarthritis among patients with inflammatory back pain in rheumatology practices: a multinational, multicenter study. Arthritis Res Ther 2016;18(1):132.
- Poddubnyy D, Callhoff J, Spiller I, et al. Diagnostic accuracy of inflammatory back pain for axial spondyloarthritis in rheumatological care. RMD Open 2018; 4(2):e000825.
- Kavadichanda CG, Geng J, Bulusu SN, Negi VS, Raghavan M. Spondyloarthritis and the human leukocyte antigen (HLA)-B*27 connection. Front Immunol 2021;12:601518.
- Landewe R, Nurminen T, Davies O, Baeten D. A single determination of C-reactive protein does not suffice to declare a patient with a diagnosis of axial spondyloarthritis ‘CRP-negative’. Arthritis Res Ther 2018;20:209.
- van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum1984;27:361–8.
- Poddubnyy D, Brandt H, Vahldiek J, et al. The frequency of non-radiographic axial spondyloarthritis in relation to symptom duration in patients referred because of chronic back pain: results from the Berlin early spondyloarthritis clinic. Ann Rheum Dis 2012;71:1998–2001.
- Rudwaleit M, van der Heijde D, Landewe Ret al. The Assessment of Spondylo - Arthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25–31.
- Poddubnyy D. Classification vs diagnostic criteria: the challenge of diagnosing axial spondyloarthritis. Rheumatology (Oxford) 2020;59(Suppl4):iv6-iv17.
- Общероссийская общественная организация Ассоциация ревматологов России. Федеральные клинические рекомендации по диагностике и лечению анкилозирующего спондилита (болезнь Бехтерева). Москва, 2013 г.
- Смирнов А.В., Эрдес Ш.Ф. Диагностика воспалительных изменений осевого скелета при анкилозирующем спондилите по данным магнитно-резонансной томографии. Научно-практическая ревматология 2016;54(1):53-9 [Smirnov AV, Erdes ShF. Magnetic resonance imaging diagnosis of inflammatory changes of the axial skeleton in ankylosing spondylitis. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice 2016;54(1):53-9 (In Russ.)]
- Lambert RG, Bakker PA, van der Heijde D et al. Defining active sacroiliitis on MRI for classification of axial spondyloarthritis: update by the ASAS MRI working group. Ann Rheum Dis 2016;75:1958–63.
- Stolwijk C, van Tubergen A, Castillo-Ortiz JD, Boonen A. Prevalence of extraarticular manifestations in patients with ankylosing spondylitis: a systematic review and meta-analysis. Ann Rheum Dis 2015;74(1):65-73.
- Navarro-Compán V, Sepriano A, El-Zorkany B, van der Heijde D. Axial spondyloarthritis. Ann Rheum Dis 2021 Oct 6:annrheumdis-2021-221035.
- Berg R, de Hooge M, Rudwaleit M, et al. ASAS modification of the Berlin algorithm for diagnosing axial spondyloarthritis: results from the SpondyloArthritis Caught Early (SPACE)-cohort and from the Assessment of SpondyloArthritis international Society (ASAS)-cohort. Ann Rheum Dis 2013; 72:1646–53.
- van der Heijde D, Ramiro S, Landew ОR, et al. 2016 update of the ASASEULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76:978–91.
- Ward MM, Deodhar A, Gensler LS, et al. 2019 update of the American College of Rheumatology/Spondylitis association of America/Spondyloarthritis research and treatment network recommendations for the treatment of ankylosing spondylitis and Nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2019;71:1599–613.
- Perrotta FM, Lories R, Lubrano E. To move or not to move: the paradoxical effect of physical exercise in axial spondyloarthritis. RMD Open 2021;7:e001480.
- Kroon FP, van der Burg L, Ramiro S, et al. Nonsteroidal antiinflammatory drugs for axial spondyloarthritis: A Cochrane review. J Rheumatol 2016;43:607-17.
- Wanders A, Heijde D, Landew R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005;52:1756–65.
- Kroon F, LandewО R, Dougados M, et al. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012;71:1623–9.
- Sieper J, Listing J, Poddubnyy D, et al. Effect of continuous versus on-demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine: results from a randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016;75:1438–43.
- Regel A, Sepriano A, Baraliakos X, et al. Efficacy and safety of non-pharmacological and non-biological pharmacological treatment: a systematic literature review Informing the 2016 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. RMD Open 2017;3:e000397.
- Navarro-Compán V, Plasencia-Rodríguez C, de Miguel E, et al. Switching biological disease-modifying antirheumatic drugs in patients with axial spondyloarthritis: results from a systematic literature review. RMD Open 2017;3:e000524.
- Callhoff J, Sieper J, Wei A, et al. Efficacy of TNFα blockers in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis: a meta-analysis. Ann Rheum Dis 2015;74:1241–8.
- Karmacharya P, Duarte-Garcia A, Dubreuil M, et al. Effect of therapy on radiographic progression in axial spondyloarthritis: a systematic review and metaanalysis. Arthritis Rheumatol 2020;72:733–49.
- van der Heijde D, Song IH, Pangan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet 2019;394:2108-17.
- Новиков П.И., Шевцова Т.П., Щеголева Е.М., Моисеев С.В. Ингибиторы янус-киназ: фармакологические свойства и сравнительные клиническая эффективность и безопасность. Клин фармакол тер 2021;30(1):51-60 [Novikov P, Shevtsova T, Shchegoleva E, Moiseev S. JAK-inhibitors: pharmacological properties and comparative clinical efficacy and safety. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(1):51-60 (In Russ.)].
- Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, doubleblind phase 3 study, MEASURE 3. Arthritis Res Ther 2017;19(1):285.
- van der Heijde D, Cheng-Chung Wei J, Dougados M, et al; COAST-V study group. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet 2018;392:2441-51.
- van der Heijde D, Dijkmans B, Geusens P, et al. Efficacy and safety of infliximab in patients with ankylosing spondylitis: results of a randomized, placebo-controlled trial (ASSERT). Arthritis Rheum 2005;52(2):582-91.
- van der Heijde D, Kivitz A, Schiff MH, et al; ATLAS Study Group. Efficacy and safety of adalimumab in patients with ankylosing spondylitis: results of a multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 2006; 54(7):2136-46.
- https://news.abbvie.com/news/press-releases/abbvies-rinvoq-upadacitinib-metprimary-and-all-ranked-secondary-endpoints-in-phase-3-study-in-ankylosingspondylitis.htm?view_id=6259.
- https://news.abbvie.com/news/press-releases/abbvies-upadacitinib-rinvoq-metprimary-and-most-ranked-secondary-endpoints-in-phase-3-study-for-non-radiographic-axial-spondyloarthritis.htm?view_id=6259.
