Применение ацеклофенака в сочетании с толперизоном у больной с начальными стадиями остеоартрита коленных суставов
На примере клинического наблюдения рассматриваются обоснованность и эффективность терапии нестероидным противовоспалительным препаратом (НПВП) преимущественно селективного действия ацеклофенаком (Аэртал местно и внутрь) и миорелаксантом центрального действия толперизоном (Мидокалм внутрь) у больной с начальными стадиями остеоартрита (ОА) коленных суставов (I-II степени по классификации КеллгренаЛоуренса). Длительность лечения составляла 14 дней. В анамнезе отмечались нежелательные лекарственные реакции при повторном применении наиболее распространенных НПВП, в том числе контактный дерматит при местном назначении ибупрофена и умеренно выраженный бронхообструктивный синдром при приеме внутрь диклофенака. Производные гиалуроновой кислоты, как и другие SYSADOAs, не применяли ввиду опасности развития аллергических реакций, а от применения глюкокортикостероидов больная отказалась с учетом наличия эндокринных нарушений. У пациентки с наличием артритического компонента заболевания к концу курса терапии все исследуемые показатели продемонстрировали позитивные изменения.
Основателями теории воспаления являются Илья Ильич Мечников и Пауль Эрлих, которые получили в 1908 г. Нобелевскую премию за работы в этой области. Однако до этого оба исследователя вступали в острую полемику друг с другом. И.И. Мечников в своем цикле “Лекций о сравнительной патологии воспаления" [1] на многочисленных примерах от простейших до позвоночных доказывал, что самый “…существенный источник, “primum movens" (движущая сила – от. ред.), воспаления состоит в фагоцитной реакции животного организма", в то время как сосудистая реакция (dolor, calor, rubor, tumor, function laesa) призвана лишь обеспечить эффективную миграцию клеток фагоцитоза в зону повреждения. П. Эрлих оппонировал ему, утверждая, что главная роль в защите от инфекций принадлежит антителам крови, а фагоцитоз и в большей мере дегрануляция фагоцитов являются лишь вспомогательными эффекторными механизмами. Теория П. Эрлиха была поддержана и приобрела большой авторитет благодаря успехам вакцинации от опасных инфекций.
Механизмы развития аутовоспалительных заболеваний
Практически на протяжении всего ХХ столетия доминировало мнение, что главным механизмом иммунитета является специфический иммунитет, обеспечиваемый продукцией антител или цитотоксическими эффектами Т-лимфоцитов, в то время как фагоцитозу отводилась лишь вспомогательная роль. Считалось, что главной задачей фагоцита является презентация антигенных детерминант патогена лимфоцитам, хотя многочисленные примеры указывали на то, что специфический иммунитет выполняет преимущественно информационную роль, координирует реакции по уничтожению внешних или внутренних патогенов, в то время как основные эффекторные реакции по уничтожению патогена возложены на механизмы врожденного иммунитета, прежде всего фагоциты. Так, образование иммунных комплексов в системе специфического иммунитета ведет к активации комплемента по классическому пути с образованием мембраноатакующего комплекса, инициирующего осмотический лизис клетки. Следует отметить, что система комплемента известна уже на ранних этапах эволюции, включая беспозвоночных животных, когда специфического иммунитета еще не было [2]. В системе врожденного иммунитета комплемент, в особенности его наиболее древний альтернативный каскад активации, функционирует преимущественно как система опсонизации патогена с последующей фиксацией на этом комплексе фагоцитов. У фагоцитов разных классов широко представлены три типа рецепторов к С3b-компоненту комплемента, активированному С3конвертазой: CD35, CD11b/CD18, CD11c/CD18. Два последних рецептора относятся к семейству нейтрофильных, эозинофильных и макрофагальных интегринов, молекулярная эволюция которых началась задолго до формирования суперсемейства иммуноглобулинов и, более того, была основой для формирования самого иммуноглобулинового суперсемейства, включающего, помимо гаммаглобулинов сыворотки, также Т-клеточный рецептор, В-клеточный рецептор, главный комплекс гистосовместимости, CD4, CD8 и другие молекулярные системы специфического иммунитета [2]. Кроме того, в последние годы стало известно, что фагоциты способны инициировать активацию прообраза мембраноатакущего комплекса – газдермина D, олигомеры которого мигрируют в сторону мембраны клетки и формируют в ней широкие поры диаметром 10-15 нм с последующим набуханием и разрушением клетки (осмотический лизис клетки). Этот вариант клеточной смерти, получивший название пироптоза, индуцируется гиперэкспрессией интерлейкина (ИЛ)-1. Следует также отметить, что рецепторы к Fc-фрагменту иммуноглобулинов возникают у миелоидных клеток на очень ранних этапах миелопоэза, в то время как В-лимфоциты приобретают способность к синтезу иммуноглобулинов лишь на последних этапах созревания.
Важно также обратить внимание, что в системе врожденного иммунитета имеется также прообраз цитотоксических Т-лимфоцитов в виде естественных киллеров, которые, в отличие от специфического иммунитета, работают также, как и вся система врожденного иммунитета – на основе генетически закрепленных типовых механизмов распознавания патогена. Таким образом, имеется достаточно косвенных данных, позволяющих предполагать, что система специфического иммунитета эволюционировала на основе уже имеющихся систем врожденного иммунитета не столько в направлении генерации новых эффекторных механизмов, сколько по пути более эффективного распознавания патогенов, причем преимущественно внутренних патогенов, мутировавших в процессе жизнедеятельности организма. А основную работу по элиминации патогена из внутренней среды организма по-прежнему выполняет система фагоцитов.
Наконец, в течение последних десятилетий были накоплены данные, указывающие на то, что существует целый класс заболеваний, развитие которых трудно объяснить классическими аутоиммунными механизмами, так как при этих заболеваниях не было обнаружено достаточных доказательств участия В- или Т-лимфоцитов. Аутоагрессия при этих заболеваниях обеспечивается исключительно на основе активации фагоцитов различных классов и на принципах функционирования системы врожденного иммунитета: восприимчивость к типовым молекулярным паттернам патогенов, генетическая закрепленность реакций, отсутствие иммунологической памяти о патогене. В 2000 г. такие заболевания было предложено называть аутовоспалительными (АВЗ).
В 1948 г. H. Reimann [3] описал 6 наблюдений воспалительных синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию, которые объединил общим термином “периодическая болезнь" (ПБ). Основными критериями ее считали периодичность приступов и доброкачественность течения. В дальнейшем под ПБ стали подразумевать наследственное заболевание с аутосомно-рецессивной передачей, распространенное преимущественно среди народов, проживающих в бассейне Средиземного моря, главным образом среди армян, евреев-сефардов, а также арабов и турков [4-7]. По этой причине это заболевание в англоязычной литературе чаще именуют семейной средиземноморской лихорадкой.
Важным этапом, подтверждающим ранее сложившуюся генетическую концепцию, стал 1997 г., когда был клонирован ответственный за ПБ ген MEFV (MEditerranean FeVer) [8,9]. В том же году были идентифицированы 8 основных мутаций этого гена, который располагается в коротком плече 16 хромосомы [9-11]. Среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [12]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Доля носителей среди американских армян составляет 1:7 [13].
Еще до открытия гена, ответственного за развитие ПБ, стали накапливаться данные о том, что в патогенезе воспаления при этом заболевании не задействованы механизмы адаптивного иммунитета, а основным субъектом воспаления является нейтрофил. Так, в 1974 г. Л.В. Козловская [14] показала, что во время воспалительной атаки внутри нейтрофила резко снижается концентрация миелопероксидазы, и одновременно повышается ее концентрация в сыворотке крови. Эффективность лечения ПБ колхицином, который блокирует микротубулярный аппарат фагоцитов, также косвенно подтверждает принципиальное значение фагоцитов и, в первую очередь, нейтрофилов в реализации воспаления при этом заболевании. Окончательно эти представления были обоснованы после обнаружения гена MEFV, кодирующего белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [8,9]. Пирин взаимодействует с белками ASC и CARD и контролирует формирование ядра инфламмасомы – устойчивого к ферментативному расщеплению макромолекулярного белкового комплекса в цитоплазме клеток, необходимого для активации провоспалительных цитокинов. В настоящее время выделяют 8 основных типов инфламмасом, которые обычно представляют собой конгломерат сенсора, адапторной и эффекторной молекул. В качестве эффектора выступают различные типы каспаз, адапторной молекулой во всех случаях является ASC (apoptosis associated speck-like protein – протеин подобный пятну, ассоциированный с апоптозом). Многообразие и номенклатура инфламмасом определяется различиями сенсорных молекул [15]. Активация инфламмасом, в том числе пириновой, приводит к гиперэкспрессии ИЛ-1β за счет активации каспазы-1 [16,17].
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [8]. Не обнаруживают экспрессии гена и в других тканях. Согласно основной гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Таким образом, воспаление при ПБ реализуется без участия лимфоцитов, только за счет вовлечения фагоцитов (в основном нейтрофилов) системы врожденного иммунитета.
Клинические проявления ПБ наиболее четко очерчены по сравнению с другими периодическими синдромами и были подробно проанализированы уже в работах E. Sohar и соавт. (1967) [18], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [19]. Клиническая картина болезни складывается из периодических приступов лихорадки в сочетании с абдоминалгиями (у 91% больных), торакалгиями (у 57%), артралгиями (у 45%) и другими, более редкими, проявлениями [20,21]. У большинства пациентов возникают симптомы раздражения брюшины, сочетание которых с лихорадкой, нейтрофильным лейкоцитозом и повышением маркеров острой фазы воспаления делает перитонит трудно отличимым от бактериального перитонита, поэтому многим пациентам выполняют неоправданные лапаротомии. Характерным признаком болезни, имеющим диагностическое значение, является стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза. Вследствие четко очерченных клинических проявлений ПБ ее диагностика, особенно при получении противоречивых результатов генетического исследования (гетерозиготное носительство или мутации неопределенного значения), возможна по клиническим критериям [22].
В настоящее время существуют эффективные методы лечения ПБ. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику АА-амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина связывают с торможением активности нейтрофилов вследствие блокады актино-миозинового цитоскелета – базовой транспортной системы фагоцитов, являющейся ведущей движущей силой при образовании фагосом и последующей дегрануляции. Вслед ствие этого уменьшается продукция ИЛ-1β. Ежедневный прием 1-1,5 мг колхицина позволяет проводить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже сформировавшемся амилоидозе составляет 2 мг/сут. По данным исследований, проводившихся в клинике им. Е.М. Тареева, колхицин эффективен даже у большинства больных с нефротическим синдромом [20].
Однако колхицин изначально неэффективен приблизительно у 15-20% больных ПБ. Преодолеть колхицинорезистентность в таких случаях позволяет применение ингибиторов ИЛ-1β, в частности канакинумаба, которые обеспечивают полный контроль скрытого субклинического воспаления и предотвращают развитие и прогрессирование АА-амилоидоза. Эти препараты способны также улучшить течение сопутствующих заболеваний и снизить риск сердечно-сосудистых осложнений, который повышен у пациентов с хроническими воспалительными заболеваниями.
Подробный анализ клинической картины ПБ, модельного заболевания для всей группы АВЗ, позволяет выделить ряд общих для аутовоспаления клинических черт. Все АВЗ являются наследственными (моногенные заболевания) либо имеют очевидные генетические предпосылки (полигенные заболевания), что обосновывает так или иначе применение методов молекулярно-генетической диагностики для подтверждения диагноза. Клиническая картина этих заболеваний демонстрирует очевидный воспалительный комплекс, как правило включающий в себя лихорадку, кожные воспалительные элементы, артрит, боли в животе и другие серозиты [23]. Учитывая периодичность клинических проявлений, скрытая воспалительная реакция в межприступный период может быть пропущена, что, наряду с эпизодами выраженного экссудативного артрита, является главной предпосылкой развития ААамилоидоза. По этой причине важной клинической задачей ведения таких пациентов является тщательный мониторинг маркеров хронического воспаления, что позволяет своевременно изменить терапию и назначить современные антицитокиновые средства для контроля воспаления. Среди таких биомаркеров следует выделить С-реактивный белок, ферритин и фибриноген. Более чувствительными, но менее доступными маркерами являются белок-предшественник амилоида SAA и маркер активации нейтрофилов S100A12. Учитывая, что существует множество причин для повышения уровня этих маркеров, следует подчеркнуть необходимость динамической оценки их уровня в крови. Указанием на персистирующий характер воспаления может быть анемия хронического воспаления.
ПБ возглавляет группу моногенных аутовоспалительных заболеваний, сопровождающихся гиперпродукцией ИЛ-1β вследствие активации разных вариантов инфламмасом. Мутации могут затрагивать структуру самих компонентов инфламмасом – так называемые внутренние инфламмасомопатии. Помимо ПБ к этой подгруппе относятся пирин-ассоциированный нейтрофильный дерматоз, криопиринопатии, NLRC4-гемофагоцитарный синдром.
Криопиринопатии (или криопирин-ассоциированный периодический синдром) под названием синдрома Макла-Уэллса были впервые описаны в 1962 г. английскими исследователями T. Muckle и M. Wells [24]. Болезнь передается по аутосомно-доминантному пути и начинается в детском или подростковом возрасте. Основные проявления криопиринопатий – приступы лихорадки, крапивница или отек Квинке, прогрессирующая глухота, впоследствии к этим симптомам нередко присоединяется амилоидоз почек. Описания синдрома Макла-Уэллса имелись и в отечественной литературе тех лет [25]. Впоследствии J. Black обнаружил связь эпизодов крапивницы с действием холода [26]. Это наблюдение продемонстрировало определенное сходство крапивницы при синдроме Макла-Уэллса с другим наследственным заболеванием – семейной холодовой крапивницей, также наследуемой по аутосомно-доминантному пути. В 1999 г. L. Cuisset и соавт. выявили ген, вызывающий развитие синдрома МаклаУэллса и локализующийся в длинном плече 1 хромосомы (1q44) [27]. Этот ген, по данным H. Hoffman и соавт. [28], был повинен также в развитии наследственной холодовой крапивницы. Результаты генетических исследований показали, что помимо синдрома Макла-Уэллса и наследственной холодовой крапивницы существует еще один клинический вариант криопиринопатии – NOMID (Neonatal Onset Multisystem Inflammatory Disease) [29]. Этот наиболее тяжелый вариант криопиринопатии проявляется продолжительными приступами лихорадки, нейтрофильной уртикарной сыпью, артропатией, нейросенсорной тугоухостью, а также асептическим менингитом, который приводит к повышению внутричерепного давления и, как следствие, к гидроцефалии, хроническому отеку зрительного нерва и его атрофии, атрофии мозга. Больные с гидроцефалией часто имеют “типичное лицо" с выступающими лобными буграми, увеличенным объемом мозгового отдела черепной коробки и седловидным носом [30]. Типична задержка умственного развития, которая обусловлена несколькими причинами: перинатальным инсультом, воспалением головного мозга и его атрофией. У 30-40% больных NOMID развивается деформирующая артропатия из-за нарушения кальцификации эпифизов и чрезмерного роста хряща [30].
Белок NLRP3 (криопирин), как и пирин, образует инфламмасому и является ее основным сенсорным компонентом, который участвует в распознавании бактериальных и других внутриклеточных активирующих сигналов. Мутации криопирина делают возможной спонтанную самоактивацию с формированием инфламмасомы [31]. Мононуклеарные клетки больных NOMID или синдромом Макла-Уэллса при стимуляции липополисахаридом секретируют ИЛ-1β в более высокой концентрации, чем клетки здоровых людей [32-34].
В отличие от ПБ, при криопиринопатиях реализация аутовоспаления, вероятно, в меньшей степени связана с функционированием микротубулярного аппарата, так как колхицин при криопиринопатиях обычно не дает эффекта. Основой лечения криопиринопатий является применение ингибиторов ИЛ-1β, которые оказывают быстрое и выраженное действие.
Активация инфламмасом может отмечаться при нарушении ее регуляции под влиянием внешних факторов – внешние инфламмасомопатии. Это могут быть потеря функции супрессора инфламмасом (DIRA-синдром) или гиперактивация инфламмасом под влиянием сигналов внутриклеточного стресса – синдром Маджида, дефицит мевалонаткиназы (гипериммуноглобулинемия D, HIDS), TRAPS, PAPA, PFIT. Характерными признаками DIRA, PAPA и синдрома Маджида являются рецидивирующий остеомиелит и кожные нагноения, которые хорошо поддаются терапии блокаторами ИЛ-1β.
Среди внешних инфламмасомопатий следует обратить внимание на TRAPS (ранее именовался семейной ирландской лихорадкой), который характеризуется приступами лихорадки в сочетании с болями в животе (у 77% больных), сходными с таковыми при ПБ и в трети случаев приводящими к неоправданному хирургическому вмешательству [35]. Нередко отмечаются также миалгии [36], рожеподобная или уртикарно-макулярная сыпь, рецидивирующий конъюнктивит или передний увеит [37], суставной синдром и неврологические проявления, такие как головная боль, асептический менингит, неврит глазного нерва, нарушение поведения. Серьезным осложнением является АА-амилоидоз [38].
На первый взгляд воспаление при TRAPS не связано с активацией инфламмасом и гиперпродукцией ИЛ-1β. Причиной развития этого синдрома является аутосомно-доминантная мутация в гене TNFRSF1A, который кодирует p55 субъединицу рецептора фактора некроза опухоли (ФНО)-α [39], что и послужило причиной переименования семейной ирландской лихорадки в TRAPS. К настоящему времени выявлено около 100 мутаций, вызывающих этот синдром. Вариант, при котором происходит замена цистеина в аминокислотной последовательности рецептора, отличается наиболее тяжелым течением и высоким риском развития АА-амилоидоза [40]. При мутации в рецепторе ФНО-α нарушается расщепление металлопротеазами его внеклеточного фрагмента. В результате происходит постоянная стимуляция через мембранный рецептор и снижается внеклеточный пул растворимого рецептора, обладающего ингибиторным действием [41]. В то же время установлено, что при мутации рецептора ФНО-α снижается его сродство к ФНО-α [42,43], что приводит к спонтанной активации МАРК-JNK и p38 и делает клетку более восприимчивой к низким дозам воспалительных стимулов [44] Повышение активности МАРК также инициирует высвобождение активных форм кислорода. Сами мутантные рецепторы к ФНО-a, не подвергаясь шеддингу (смыванию) после взаимодействия с лигандом, задерживаются на мембранах эндоплазматического ретикулума. Накопление аномального белкового комплекса служит сигналом для активации внутриклеточной системы деградации белка (аутофагии). Перенапряжение этой системы проявляется дисфункцией протеасом и также, наряду с активностью MAPK, запускает оксидативный стресс и становится мощным фактором воспалительной стимуляции. Это стимулирует образование инфламмасомы и гиперпродукцию ИЛ-1β. Поэтому, несмотря на эффективность применения блокаторов ФНО-a [45], по результатам исследований последних лет сделан вывод, что более устойчивый и долговременный эффект у больных TRAPS дают ингибиторы ИЛ-1β [46,47]. Высокая эффективность препаратов этой группы показана у пациентов с большинством инфламмасомопатий [4650].
Особую группу моногенных АВЗ составляют синдромы с выраженной продукцией ИЛ-18. Несмотря на сходство физиологических эффектов ИЛ-18 и ИЛ-1β, при АВЗ эти цитокины проявляют себя по-разному. Если гиперпродукция ИЛ-1β при АВЗ проявляется преимущественно по модели криопиринопатий, то синдромы, сопровождающиеся избыточной экспрессией ИЛ-18, способны индуцировать синдром активации макрофагов с развитием тяжелой коагулопатии и панцитопении.
Еще одна группа моногенных АВЗ характеризуетсядефицитом или дисфункцией рецепторов к ИЛ-36, относящемуся к семейству ИЛ-1. Такие АВЗ проявляются псориазом, нередко генерализованным. Это связано с тем, что рецепторы к ИЛ-36 экспрессированы главным образом на кератиноцитах. В реализации воспаления в этой группе АВЗ существенное значение имеет активость ИЛ-17 и ИЛ-23.
Инфламмасомопатиям и синдромам с гиперпродук цией цитокинов могут быть противопоставлены интер феронопатии. Прототипом интерферонопатий I типаявляется синдром Айкарди-Гутиера (врожденная энце фалопатия, напоминающая проявления врожденныхвирусных инфекций), который характеризуется ано мальной активностью внутриклеточных сенсоров MDA 5, предназначенных для распознавания чужеродных(вирусных) двуспиральных РНК. Мутации этих сенсо ров приводят к их спонтанной активации под влияниемсобственных РНК организма и последующей гиперпро дукции интерферонов I типа [51]. Характерной чертойэтой группы АВЗ являются расстройства убиквитиниро вания белков (протеасомные расстройства), что отража ет сбой в системе деградации аномальныхвнутриклеточных белков. Примерами таких АВЗявляются хронический атипичный нейтрофильный дер матоз с липодистрофией и повышением температурытела (CANDLE), синдром контрактур суставов, мышеч ной атрофии, микроцитарной анемии, панникулита(JMP), болезнь Паркинсона и др. Накопление в цито плазме аномальных белков при этих заболеванияхсопровождается гиперпродукцией интерферонов I типа,оксидативным стрессом с последующей активациейвоспаления, в том числе через гиперпродукцию ИЛ-6[15]. Для интерферонопатий характерно наличие васку лопатий вследствие системной эндотелиальной дис функции.
Активация продукции интерферонов I типа можетсопровождать также процессы активации NF-κB(NDAS, ORAS), однако наиболее характерным след ствием модификации сигнальной системы NF-κBявляется гиперпродукция ФНО-α, реже ИЛ-1β (HA-20).Для этой подгруппы АВЗ характерна, с одной стороны,симптоматика по типу синдрома Бехчета (НА-20 – язвыи эрозии во рту, на половых органах, эритематозныепапулы, псевдофолликулит, патергия), а, с другой сто роны, признаки васкулопатии с развитием лимфоги стиоцитоза, панникулита (NDAS, ORAS)
Активация NF-κB может быть результатом аномаль ной активности макромолекулярного комплекса наоснове внутриклеточного рецептора NOD2 (белка, эво люционно родственного пирину и криопирину).Мутации гена NOD2 приводят в дендритных клетках кнарушению секвестрации белков цитоплазмы с ано мальной структурой в фаголизосомы и их последующейдеградации. Дефектные аутофагосомы цитоплазмыблокируют систему деградации отработавших белков вфагоцитах (неполный фагоцитоз), что сопровождаетсяобразованием гранулем [52,53]. Так, при синдроме Блау(саркоидоз детей) развиваются увеит, сыпь и артрит,вызванные неказеозными эпителиоидными гранулема ми.
Анализ молекулярно-биологических нарушений при различных вариантах аутовоспаления показывает, что практически все АВЗ сопровождаются нарушениями в системе внутриклеточного гомеостаза белка, при кото рых протеасомные механизмы не справляются с возрос шим потоком аномальных белков, подлежащих деградации. Таким образом, изучение механизмов ауто фагии имеет ключевое значение для понимания сути аутовоспаления и дальнейшего поиска подходов к лече нию АВЗ.
Нарушения аутофагии, по-видимому, являются одним из факторов сопряжения АВЗ и амилоидогенеза, так как неэффективная аутофагия белка-предшественника амилоида SAA способствует его накоплению внутри макрофагов и последующему формированию амилоидускоряющей субстанции (конгломерат амилоидогенных белков, не подвергшихся аутофагии, которые становятся затравочным ядром для образования амилоида в интерстиции после гибели макрофага). По всей видимости, наиболее адекватным терапевтическим ответом на нарушения процессов аутофагии при АВЗ является назначение ингибиторов ИЛ-1β или янускиназ (преимущественно при интерферонопатиях).
Результаты молекулярно-генетических исследований последних лет позволили выделить 36 АВЗ, а число этих заболеваний продолжает расти [15]. Названия АВЗ в первую очередь отражают названия генов/белков, мутации которых индуцируют развитие заболевания. При этом патологические изменения наблюдаются на разных уровнях, в одних случаях страдает функция рецепции провоспалительных стимулов, в других – передача сигнала, в третьих – мутации непосредственно нарушают эффекторные механизмы реализации провоспалительных стимулов, например, проявляются спонтанной гиперпродукцией провоспалительных цитокинов и т.д.
Очевидно, что обязательным элементом верификации диагноза АВЗ является проведение молекулярногенетического исследования, однако многочисленность моногенных АВЗ оправдывает применение также клинических критериев для сужения спектра дифференциального диагноза. Следует также иметь ввиду, что мутации гена не всегда проявляются клинически вследствие вариабельной пенетрантности. В этом случае носительство может быть признано бессимптомным или является предпосылкой для развития иного заболевания. Так, обнаружение гетерозиготного носительства мутаций гена ПБ может быть недостаточным для развития клинических проявлений заболеваний, однако в совокупности с носительством других мутаций, предрасполагающих к аутовоспалению, нередко выявляется при синдроме Стилла взрослых. Среди клинических проявлений АВЗ для их разграничения наибольшее значение придают характеру поражения кожи и слизистых оболочек: уртикарно-макулярная сыпь, псориаз, нагноения, язвенно-эрозивное поражение.
По всей видимости, число АВЗ существенно больше, более того аутовоспалительные реакции играют важную роль и в патогенезе таких широко распространенных, ранее считавшихся идиопатическими заболеваний, как спондилоартрит, воспалительные заболевания кишечника, интерстициальные болезни легких и другие. Так, при анкилозирующем спондилите носительство аллеля HLA-B27 характеризуется повышенным сродством рецептора к интерферону-γ. Процессинг этого комплекса непосредственно связан с использованием аппарата протеасом и аутофагии. Нарушение аутофагии становится фактором мощной воспалительной стимуляции и причиной внутриклеточного стресса.
Классическим приобретенным вариантом внешней инфламмасомопатии является подагра, так как кристаллы мочевой кислоты вызывают внутриклеточный стресс и воспринимаются криопириновым сенсором.
Аутовоспалительные реакции принимают участие в патогенезе таких классических аутоиммунных заболеваний, как ревматоидный артрит и системная красная волчанка [15]. По сути дела, можно говорить об аутовоспалительном компоненте при любом воспалении. В этом случае важнейшей клинической задачей диагностики воспалительного заболевания становится оценка степени доминирования аутовоспалительных механизмов, которое может служить основанием для назначения современных антицитокиновых средств.
АА-амилоидоз при аутовоспалительных заболеваниях
АА-амилоидоз – это один из вариантов амилоидоза, который, в отличие от других типов заболевания (AL, ATTR и др.), является вторичным и развивается при хронических воспалительных заболеваниях различной природы, хотя выделяют и идиопатический АА-амилоидоз. Предшественником АА-амилоида является SAA – белок острой фазы, содержание которого в крови повышается при воспалении [54]. SAA во многом сходен с Среактивным белком (СРБ), который широко используют для оценки активности воспалительных ревматических заболеваний. Концентрации обоих белков в сыворотке тесно коррелируют друг с другом и быстро увеличивается под влиянием воспалительных стимулов, преимущественно в результате усиления синтеза в гепатоцитах под действием ИЛ-6 и ИЛ-1b. Измерение сывороточной концентрации СРБ доступно для любой биохимической лаборатории, в то время как определение сывороточного уровня SAA сопряжено с определенными техническими трудностями, поэтому этот биомаркер фактически не используется в обычной клинической практике. Тем не менее, существуют аргументы в пользу более широкого применения SAA для оценки активности воспаления при АВЗ и других заболеваниях [54]. В частности, при субклиническом воспалении концентрация SAA обычно повышена несмотря на нормальные значения СРБ и СОЭ, в то время как обратная картина, т.е. повышение уровня СРБ и СОЭ при отсутствии изменений содержания SAA, наблюдается исключительно редко. При этом персистирующее воспаление, сопровождающееся повышением концентрации SAA, приводит к увеличению риска развития AAамилоидоза.
Роль SAA как маркера субклинического воспаления убедительно показана при ПБ. Например, H. Lachmann и соавт. выявили значительное увеличение содержания SAA (>3 мг/л) в межприступный период более чем у 70% больных ПБ, хотя все эти пациенты получали терапию колхицином [55]. Полученные данные заставили авторов усомниться в приверженности к терапии, причем это предположение было подтверждено в части случаев. H. Lofty и соавт. наблюдали повышение содержания SAA (>30 мг/л) через 2 недели после последнего приступа у 79% детей с ПБ, в то время как концентрация СРБ в те же сроки оставалась повышенной только в 31% случаев [56]. A. Duzova и соавт. отметили повышение содержания СРБ в межприступный период у 95% детей с ПБ, хотя у половины из них отсутствовали приступы в течение последних 12 мес [57]. Увеличение дозы колхицина привело к резкому снижению уровня SAA. По данным этого исследования, SAA по информативности в диагностике субклинического воспаления превосходил СРБ, СОЭ, ферритин и фибриноген.
Повышение содержания SAA является необходимым условием, но, по-видимому, недостаточно для развития АА-амилоидоза. В ряде клинических исследованиях не выявлена корреляция между уровнями SAA и наличием отложений амилоида [54]. Определенный вклад в амилоидогенез может вносить полиморфизм гена SAA. Например, у японцев с ревматоидным артритом была выявлена тесная корреляция между развитием амилоидоза и наличием аллеля SAA1g [58]. Еще одним фактором амилоидогенеза может быть повышенное протеолитическое расщепление SAA [54]. В то же время содержание SAA считают ключевым фактором, определяющим прогрессирование АА-амилоидоза и выживаемость больных. В проспективном когортном исследовании у пациентов с низкой или нормальной концентрацией SAA (<4 мг/дл) амилоидоз характеризовался благоприятным течением, в то время как персистирующее повышение биомаркера ассоциировалось со значительным увеличением риска прогрессирования хронической почечной недостаточности и смерти [59]. У пациентов с содержанием SAA >155 мг/л риск смерти был в 17,7 раза выше, чем у пациентов с нормальным уровнем этого биомаркера, в то время как снижение содержания SAA <10 мг/л сопровождалось регрессом отложений амилоида. Приведенные данные свидетельствуют о том, что лекарственные препараты, снижающие уровень SAA, могут стабилизировать течение АА-амилоидоза или даже вызвать его обратное развитие. Соответственно, мониторирование концентрации SAA при воспалительных заболеваниях может иметь практическое значение и использоваться для оценки эффективности терапии, в частности генноинженерными биологическими препаратами.
Основными причинами АА-амилоидоза являются хронические инфекционные заболевания (туберкулез, остеомиелит, бронхэктазы, аспергиллез, муковисцидоз и др.), иммуновоспалительные ревматические болезни (ревматоидный артрит, псориатический артрит, спондилоартрит, подагра, артериит Такаясу, болезнь Бехчета), АВЗ (ПБ, криопирин-ассоциированный периодический синдром, TRAPS, гипериммуноглобулинемия D с периодическим лихорадочным синдромом и др.) и злокачественные опухоли (лимфогранулематоз, лимфома, макроглобулинемия Вальденстрема, солидные опухоли различной локализации) [60]. Эпиде мио логия АА-амилоидоза за последние десятилетия значительно изменилась. S. Ravichandran и соавт. недавно проанализировали около 11000 больных различными типами амилоидоза, которые обращались в Британский национальный центр по изучению этого заболевания с 1987 по 2019 г. [61]. В течение последних 10 лет общее количество случаев амилоидоза увеличилось почти в 7 раз по сравнению с таковым в 1987-1999 гг. На протяжении всего указанного периода системный AL-амилоидоз оставался наиболее распространенным типом заболевания, а его доля в структуре зарегистрированных случаев составляла 55%. В то же время доля AA-амилоидоза снизилась с 13% в период до 2010 г. до 3% в 2016-2019 гг. Одновременно изменилась и структура причин AA-амилоидоза, в частности доля инфекций снизилась с 50% в исследованиях до 2000 г. до 20% [62]. Снижение частоты АА-амилоидоза отмечается также при ревматоидном артрите и других иммуновоспалительных ревматических заболеваниях. Указанные изменения отражают успехи в лечении хронических воспалительных заболеваний, в том числе связанные с применением антибиотиков при инфекциях и базисных противовоспалительных препаратов и генно-инженерных биологических препаратов при ревматических болезнях. В нашей когорте только у 9% из 110 больных АА-амилоидозом причиной развития заболевания были инфекции, прежде всего бронхоэктазы и остеомиелит [63]. Одной из ведущих причин АА-амилоидоза остается ревматоидный артрит, хотя его доля в структуре причин заболевания снизилась с 48% в период до 2002 г. до 34% в последние годы. При этом доля АВЗ в те же сроки увеличилась с 46% до 59%, в основном за счет полигенных заболеваний, таких как анкилозирующий спондилит, псориатический артрит, болезнь Стилла взрослых, воспалительные заболевания кишечника. Следует отметить, что последние показатели представляются завышенными и в определенной степени отражают интерес клиники им. Е.М. Тареева к изучению как амилоидоза, так и АВЗ. Тем не менее, приведенные данные, вероятно, связаны с общей тенденцией к увеличению роли как моногенных, так и полигенных АВЗ в развитии АА-амилоидоза.
При АА-амилоидозе основной орган-мишень – это почки, а нефропатия обычно представляет собой единственное проявления заболевания. Поражение почек при АА-амилоидозе проявляется протеинурией, которая постепенно нарастает и достигает нефротического уровня. Позднее развивается хроническая почечная недостаточность, хотя в нашем исследовании она иногда опережала формирование нефротического синдрома. Мы связывали это с возможным лекарственным тубулоинтерстициальным нефритом, который наблюдается при многолетнем применении нестероидных противовоспалительных препаратов для уменьшения болей в суставах [63].
Развитие AA-амилоидоза описано при любых АВЗ, в частности при ПБ частота вторичного амилоидоза в разных исследованиях достигала 20-40% [20,21]. Как указано выше, ключевую роль в амилоидогенезе при ПБ играет субклиническое воспаление, которое может сохраняться несмотря на лечение колхицином. H. Babaoglu и соавт. в крупном исследовании выявили признаки персистирующего субклинического воспаления (увеличение содержания СРБ выше нормы в межприступный период с интервалом более 2 недель, определявшееся при более 75% визитов) у 15% из 917 больных ПБ [64]. Сохранение воспалительной активности сопровождалось увеличением риска развития амилоидоза в 3,59 раза (p<0,001). Предикторами персистирования воспаления в этом исследовании были мужской пол, сопутствующие воспалительные заболевания, мутация M694V в гомозиготном состоянии, резистентность к колхицину и рецидивирующий артрит. В нашем исследовании у 170 больных ПБ среди указанных факторов только рецидивирующий артрит позволял предсказать развитие АА-амилоидоза (отношение шансов 2,28; 95% доверительный интервал 1,174,42), в то время как роль наличия мутации M694V в гомо- или гетерозиготном состоянии не достигла статистической значимости [65]. Следует отметить, что частота АА-амилоидоза в приведенном выше турецком исследовании была невысокой и составила около 6%. Еще в одном исследовании, проводившемся в Турции у детей с ПБ, было выявлено достоверное снижение частоты диагностики АА-амилоидоза с 12% в 1978-1990 гг. до 2% после 2000 г. (p<0,001) [66]. Очевидно, что эти благоприятные изменения стали результатом внедрения в клиническую практику колхицина для лечения ПБ.
Частота АА-амилоидоза при TRAPS составляет около 11%, т.е. примерно соответствует таковой при ПБ. J. Delaleu и соавт. обобщили 41 случай AA-амилоидоза у пациентов с TRAPS [67]. 47% больных нуждались в заместительной почечной терапии, а в течение в среднем 23 мес умерли 14% пациентов. Интересно отметить, что в 96% случаев диагноз АА-амилоидоза предшествовал диагнозу основного заболевания, в то время как при ПБ подобная ситуация наблюдается крайне редко. Частота АА-амилоидоза при криопиринопатиях также равнялась 10% [68], хотя в более крупном исследовании это осложнение было выявлено только у 5 (4%) из 136 больных [69]. Вероятно, это объяснялось тем, что медиана возраста пациентов в последнем исследовании составляла 15 лет, в то время как АА-амилоидоз считают относительно поздним осложнением криопиринопатий (медиана возраста около 30 лет). По мнению авторов, низкая частота АА-амилоидоза могла также объясняться своевременно начатой терапией. При болезни Стилла взрослых АА-амилоидоз является достаточно редким осложнением и встречается не более, чем у 1% больных [70]. Как правило, развитие АА-амилоидоза отмечается в возрасте 35-40 лет у пациентов с длительным течением заболевания, плохо контролируемой активностью заболевания и деструктивным поражением суставов. Как указано выше, рецидивирующий артрит увеличивает риск развития АА-амилоидоза и у пациентов с ПБ.
T. Laney и соавт. проанализировали течение АА-ами лоидоза у 46 больных с семейными периодическими лихорадками, в том числе ПБ (у 24), TRAPS (у 12), криопиринопатиями (у 6) и гипериммуноглобулинеми ей D (у 4) [68]. Медиана возраста на момент развития основного заболевания составила 5 лет, а на момент появления клинических признаков АА-амилоидоза – 38 лет. У половины пациентов диагноз семейной периоди ческой лихорадки до развития АА-амилоидоза не обсуждался. Медиана срока до начала заместительной почечной терапии после появления первых признаков поражения почек составила всего 3,3 года. У 84% из 37 пациентов, у которых удалось добиться подавления вос палительной активности, при повторной сцинтиграфии с сывороточным амилоидом Р, меченным 123I, было отмечено уменьшение отложений амилоида или по крайней мере отсутствие их нарастания.
Ключевое значение для профилактики развития илипрогрессирования АА-амилоидоза имеет подавлениевоспаления, в том числе субклинического. У пациентовс АА-амилоидозом эффективное лечение АВЗ, начатоедо развития терминальной хронической почечной недостаточности, позволяет улучшить функцию почек и вчасти случаев вызывает регресс отложений амилоида[68]. Адекватная противовоспалительная терапияобоснована и у пациентов, уже начавших лечение диализом, для подготовки их к трансплантации почки.Спектр препаратов, которые могут использоваться длялечения АВЗ, варьируется в широких пределах в зависимости от особенностей их патогенеза, в том числероли аутоиммунных нарушений. Например, лечениеболезни Стилла взрослых начинают с глюкокортикостероидов, однако они не эффективны при семейныхпериодических лихорадках или анкилозирующем спондилите. Колхицин с успехом используют для леченияПБ и подагрического артрита, однако его применениеприносит мало пользы пациентам с криопиринопатиями или TRAPS. Основным медиатором аутовоспаления,прежде всего при инфласоммопатиях, является ИЛ-1b,что послужило основанием для изучения эффективности ингибиторов этого цитокина при различных АВЗ.Среди препаратов этой группы в РоссийскойФедерации зарегистрирован канакинумаб – моноклональные антитела, взаимодействующие с ИЛ-1b.Высокая эффективность и безопасность канакинумабаустановлены в двойных слепых, плацебо-контролируемых исследованиях, которые проводились у больныхподагрическим артритом (исследованияb-RELIEVED и b-RELIEVED-II) [71], колхицинрезистентной ПБ, гипериммуноглобулинемией D и TRAPS(исследование CLUSTER) [72], криопиринопатиями[73] и болезнью Стилла взрослых (исследование CONSIDER)[74]. В этих исследованиях лечение канакинумабом вызывало не только купирование основныхпроявлений АВЗ, но и снижение содержания SAA, чтоимеет важное значение для профилактики АА-амилоидоза.
Заключение
АА-амилоидоз относится к числу грозных осложнений любых АВЗ, при которых возможно стойкое сохранение субклинического воспаления, ассоциирующегося с повышенным риска амилоидогенеза. Для профилактики развития и прогрессирования АА-амилоидоза необходимо применение эффективных противовоспалительных препаратов, в том числе генно-инженерных, выбор которых зависит от особенностей патогенеза АВЗ и ключевых медиаторов аутовоспаления.
С.В. Моисеев. Анкилозирующий спондилит (АС) – это относительно нередкое заболевание, распространенность которого в общей популяции достигает 1,4%. АС относится к группе спондилоартритов (СпА) – системных воспалительных заболеваний, характеризующихся поражением позвоночника и крестцовоподвздошных сочленений, а также наличием периферического артрита, энтезита, дактилита и/или внесуставных проявлений (увеит, воспалительные заболевания кишечника и др.) [1]. В зависимости от преимущественной локализации поражения – аксиальный скелет или периферические суставы – выделяют два варианта СпА – аксиальный и периферический. Первый включает в себя АС и нерентгенологический СпА, второй – псориатический артрит, артрит при воспалительных заболеваниях кишечника, реактивный артрит и недифференцированный СпА.
Считается, что первыми классический АС описали более 120 лет назад А. Штрюмпель и П. Мари, однако фактически пальма первенства в описании этого заболевания принадлежит нескольким английским врачам. Большой вклад в изучение анкилозирующих заболеваний позвоночника внес известный русский психиатр и невролог В.М. Бехтерев, поэтому в российской литературе АС часто называют болезнью Бехтерева [2].
Хотя основные проявления АС, в частности боль в нижней части спины и ограничение подвижности позвоночника, хорошо известны, на практике это заболевание часто остается недиагностированным, а пациенты многие годы наблюдаются терапевтами или невропатологами с диагнозом “остеохондроза". Проблема поздней диагностики АС актуальна не только для России, но и других стран, а средний срок от появления первых симптомов до установления диагноза составляет 8-10 лет [3]. В значительной степени это объясняется недостаточной информированностью практических врачей об АС и ложном представлении о нем как об очень редком заболевании. На самом деле АС является достаточно частой причиной боли в нижней части спины у людей более молодого возраста. Например, в Голландии аксиальный СпА был диагностирован у 24% из 364 пациентов в возрасте 20-45 лет, обращавшихся к врачам общей практики с жалобами на боли в спине, причем медиана длительности симптомов в этом исследовании составляла 9 лет [4]. У женщин АС диагностируют еще позднее, чем у мужчин, так как многие врачи ошибочно считают, что это заболевание развивается исключительно у лиц мужского пола. В крупном европейском исследовании, в которое были включены более 2800 пациентов с аксиальным СпА, средний срок до установления диагноза составил 8,2±8,9 лет у женщин и 6,1±7,4 лет у мужчин (p<0,001) [5]. Хотя мужчины на самом деле заболевают АС в несколько раз чаще, чем женщины, тем не менее, доля последних в нескольких когортах пациентов с АС варьировалась от 19,4% до 36,0% [3]. По данным недавно опубликованного систематизированного обзора, поздний диагноз аксиального СпА ассоциировался с более высокой активностью заболевания, более выраженными нарушениями физической функции и структурными изменениями, повышенной вероятностью нетрудоспособности и депрессии, ухудшением качества жизни и более высокими прямыми и непрямыми затратами [6]. При этом более короткая длительность АС – это один из основных факторов, позволяющих предсказать более выраженный ответ на лечение [7].
Когда следует предполагать АС и на основании каких критериев можно диагностировать это заболевание?
Е.И. Кузнецова. Все эксперты сходятся во мнении, что вероятность более ранней диагностики АС увеличивается, если врач общей практики, например, терапевт или невропатолог, способен заподозрить АС и своевременно направляет пациента к ревматологу. Основное проявление АС – хроническая боль в нижней части спины, которая очень часто встречается в общей популяции. По данным общенационального исследования, проводившегося в США, 32% из 17334 опрошенных американцев жаловались на хроническую боль в нижней части спины. Большую часть пациентов, у которых имелся этот симптом, составили лица в возрасте от 41 до 64 лет (43,2%) и 65 лет и старше (25,4%) [8]. Очевидно, что направлять всех таких пациентов к ревматологам не имеет смысла, так как в общей популяции доля АС в структуре причин хронической боли в нижней части спины не так велика и не превышает 5%.
По мнению экспертов Международной ассоциации по изучению СпА (ASAS), консультация ревматолога обоснована у пациентов с хронической болью в спине, появившейся в возрасте до 45 лет и сохраняющейся в течение по крайней мере 3 мес, при наличии по крайней мере одного из следующих факторов [9]:
- воспалительная боль в спине;
- положительный тест на HLA-B27;
- признаки сакроилиита при рентгенографии или маг-нитно-резонансной томографии (МРТ) – только в том случае, если эти исследования проводились, однако их использование для скрининга не рекомендуется;
- “периферические" проявления, такие как артрит, энтезит и/или дактилит;
- внесуставные проявления, в том числе псориаз, воспалительные заболевания кишечника и/или увеит;
- наличие у близких родственников АС, псориаза, острого увеита, воспалительного заболевания кишечника или реактивного артрита;
- значительное уменьшение или купирование боли при приеме нестероидных противовоспалительных препаратов (НПВП);
- повышение СОЭ и/или концентрации С-реактивного белка (СРБ).
В первую очередь предполагать АС следует в тех случаях, когда боль в спине имеет воспалительный характер, о чем свидетельствует наличие по крайней мере 4 из следующих 5 параметров: (1) возраст на момент появления боли ≤40 лет; (2) постепенное начало; (3) уменьшение боли при физической нагрузке; (4) отсутствие улучшения в покое и (5) ночная боль, уменьшающаяся при вставании [10]. Диагностическое значение воспалительной боли в спине демонстрируют результаты международного исследования, в котором были проанализированы истории болезни 2517 пациентов с хронической болью в спине, направленных к ревматологам. Среди 974 больных, у которых имелись критерии воспалительной боли в спине, АС был диагностирован в 54% случаев, а нерентгенологический аксиальный СпА – в 29% [11]. Следует подчеркнуть, что воспалительная боль в спине не является обязательным признаком АС и наблюдается только у 70-80% таких больных, поэтому ее отсутствие не исключает диагноз АС [3]. По данным исследования D. Poddubnyy и соавт., чувствительность воспалительной боли в спине, которую выделяли на основании различных рекомендаций, в диагностике АС составила 74,4-81,1%, а специфичность – всего 25,1-43,9% [12]. Соответственно, при оценке целесообразности консультации ревматолога следует учитывать и другие возможные проявления АС, например, гастроэнтерологи или офтальмологи должны обсуждать этот диагноз у всех больных с воспалительными заболеваниями кишечника или острым передним увеитом, которые жалуются на хроническую боль в спине, появившуюся в возрасте до 45 лет. СпА тесно ассоциирован с HLA-B27, который определяется у 7590% больных АС и нерентгенологическим аксиальным СпА, но реже у пациентов с реактивным артритом (3060%), псориатическим артритом (20-50%) и артритом при воспалительных заболеваниях кишечника (10-40%) [13]. В качестве маркера воспалительной активности АС обычно используют концентрацию СРБ, хотя она может оказаться нормальной у значительной части пациентов, особенно при однократном измерении. В одном исследовании исходное содержание СРБ было нормальным у четверти пациентов с АС, однако в половине случаев в течение последующих 16 недель было отмечено по крайней мере однократное ее повышение [14]. В целом приведенные данные свидетельствуют о том, что отсутствие HLA-B27 или нормальное содержание СРБ не исключают возможное наличие АС.
![Классификационные критерии аксиального СпА, предложенные ASAS [17].](/wp-content/uploads/2021/12/ANKILO1.jpg)
С.В. Гуляев. Для диагностики АС обычно используют модифицированные нью-йоркские критерии, которые включают в себя клинические (хроническая боль в спине, уменьшающаяся при физической нагрузке, но не в покое, ограничение движений в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях и/или ограничение дыхательной экскурсии грудной клетки по сравнению с показателями у здоровых лиц с поправкой на пол и возраст) и рентгенологические (двусторонний сакроилиит ≥2 степени или односторонний сакроилиит 3-4 степени) признаки [15]. Диагноз считается определенным при наличии рентгенологического критерия и по крайней мере одного клинического критерия. На поздней стадии АС на рентгенограммах определяются не только сакроилиит, но и структурные изменения в позвоночнике (синдесмофиты). Рентгенологические признаки определенного сакроилиита характеризуются высокой специфичностью в диагностике аксиального СпА, однако они наблюдаются только у 30% пациентов с длительностью симптомов менее 1 года и примерно у 50% больных с длительностью симптомов 2-6 лет [16]. Учитывая низкую чувствительность приведенных критериев в ранней диагностике АС, т.е. на дорентгенологической стадии, различными профессиональными обществами были разработаны новые классификационные критерии, предполагающие выделение нерентгенологического аксиального СпА. Например, в соответствии с рекомендациями ASAS 2009 г. у пациента с хронической болью в спине, появившейся в возрасте до 45 лет и сохраняющейся ≥3 мес, критерием наличия сакроилиита могут быть не только достоверные рентгенологические изменения, но и МР-признаки активного воспаления [17]. Диагноз аксиального СпА возможен и при отсутствии изменений на МРТ, если у пациента определяется HLA-B27 и имеются еще по крайней мере 2 признака СпА (рис. 1). Экспертами ASAS разработаны также классификационные критерии периферического СпА для пациентов с преобладающими “периферическими" проявлениями заболевания, такими как артрит, энтезит и/или дактилит. Необходимо подчеркнуть, что критерии ASAS являются классификационными, а не диагностическими, т.е. они предназначены не для диагностики СпА в клинической практике, а для выделения однородных групп пациентов в клинических исследованиях [18]. При оценке результатов обследования целесообразно учитывать диагностическое значение (“вес") наличия или отсутствия определенных признаков СпА (рис. 2) [18]. Подобный анализ делает диагноз аксиального СпА более вероятным или мало вероятным, хотя он может оставаться неопределенным даже при использовании всех возможных тестов, учитывая медленное прогрессирования заболевания и возможность длительных ремиссий. В таких случаях диагноз может быть установлен только при динамическом наблюдении пациента.
![Диагностическое значения наличия и отсутствия различных признаков аксиального СпА [18].](/wp-content/uploads/2021/12/ANKILO2.jpg)
В рекомендациях Ассоциации ревматологов России для диагностики АС допускается применение МРТ при отсутствии достоверных рентгенологических признаков сакроилиита [19]. Основное диагностическое значение имеет выявляемый при МРТ отек костного мозга в прилежащих к суставу костях, в то время как наличие только синовита крестцово-подвздошных суставов, капсулита или энтезита без субхондрального отека костного мозга/остеита согласуется с диагнозом активного сакроилиита, но не является достаточным для его постановки [20]. При МРТ могут быть выявлены и структурные изменения, в том числе эрозии, жировая дистрофия и/или анкилоз, которые служат дополнительными диагностическими признаками даже при отсутствии активного воспаления. Субхондральный отек костного мозга наблюдается не только при СпА, но может быть последствием механического напряжения, например, у спортсменов [21]. Тем не менее, специфичность МРТ высокая и составляет 80-85% [18].
К числу классификационных критериев аксиального СпА отнесены артрит периферических суставов, энтезит и дактилит, а также системные проявления, такие как увеит, псориаз и воспалительные заболевания кишечника, которые одновременно являются и классификационными критериями периферического СпА. Доводом в пользу последнего диагноза служит преобладание указанных проявлений в клинической картине заболевания. Частота артрита с поражением периферических суставов, преимущественно неэрозивного, при СпА варьируется от 26 до 62% [18]. Обычно развивается моно- или олигоартрит суставов нижней конечностей. Более тяжелое течение характерно для коксита, который чаще отмечается у людей более молодого возраста с тяжелым аксиальным СпА. По данным мета-анализа большого числа исследований, частота увеита у пациентов с АС составила 25,8%, псориаза – 9,3%, воспалительных заболеваний кишечника – 6,8% [22].
Возможный алгоритм диагностики АС изображен на рис. 3 [23,24].
![Алгоритм диагностики аксиального СпА [23,24].](/wp-content/uploads/2021/12/ANKILO3.jpg)
С.В. Моисеев. В отличие от ревматоидного артрита, основа лечения АС – немедикаментозные методы, так как регулярные физические упражнения снижают активность болезни и улучшают функцию позвоночника и качество жизни [25,26]. Результаты некоторых исследований свидетельствуют о том, что механическое напряжение может оказывать и неблагоприятное влияние на течение АС, в частности вносит вклад в развитие воспаления и прогрессирование заболевания, однако этот вопрос остается спорным и нужда ет ся в дополнительном изучении [27]. Соот ветственно, в настоящее время нет достаточных оснований для ограничения физической активности у пациентов с АС. Еще одна особенность лечения АС заключается в том, что в качестве препаратов первой линии пациентам на длительный срок назначают неселективные НПВП или селективные ингибиторы циклооксигеназы-2, в то время как при ревматоидном артрите и других ревматических заболеваниях их используют только с симптоматической целью. По данным систематизированного обзора Cochrane [28], препараты обеих групп по эффективности достоверно превосходили плацебо и существенно не отличались друг от друга как по эффективности, так и безопасности. Более того, в отдельных исследованиях постоянный прием НПВП замедлял прогрессирование структурных изменений у пациентов с АС [29,30], хотя этот эффект не был подтвержден еще в одном исследовании [31]. В то же время стандартные БПВП, в том числе метотрексат, лефлуномид, сульфасалазин и гидроксихлорохин, оказались неэффективными при аксиальном СпА, хотя применение сульфасалазина возможно при поражении периферических суставов [32]. Применение системных глюкокортикостероидов при аксиальном СпА нецелесообразно. Для лечения аксиального СпА применяются генно-инженерные биологические препараты (ГИБП) (рис. 4). Какова их роль в современных схемах терапии?
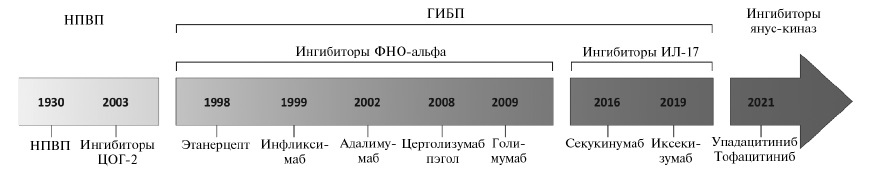
Т.П. Шевцова. ГИБП, в том числе ингибиторы ФНО-альфа (этанерцепт, инфликсимаб, адалимумаб, цертолизумаб-пэгол и голимумаб) и интерлейкина (ИЛ)-17 (секукинумаб и иксекизумаб) в настоящее время рассматривают как препараты второй линии в лечении аксиального СпА и назначают при неэффективности по крайней мере двух НПВП в течение 4 недель при наличии одного из следующих признаков: повышенная концентрация СРБ, признаки воспаления на МРТ или рентгенологические признаки определенного сакроилиита [25]. Все ингибиторы ФНО-альфа за исключением инфликсимаба и оба ингибитора ИЛ-17 одобрены для лечения не только АС, но и нерентгенологического СпА. Преимущества препаратов одного класса перед ГИБП другого класса не доказаны, однако на практике лечение чаще начинают с ингибиторов ФНО-альфа, учитывая больший опыт их изучения и применения в клинической практике. В случае наличия сопутствующего увеита или воспалительного заболевания кишечника рекомендуется применение моноклональных антител к рецепторам ФНО-альфа, а не этанерцепта.
Лечение первым ГИБП позволяет достичь ответа у 60-65% пациентов [23]. Более высокую эффективность лечения при назначении ингибиторов ФНО-альфа позволяют предсказать мужской пол, отсутствие курения, более короткая длительность болезни, повышенное содержание СРБ и МР-признаки воспаления [33]. В случае достижения стойкого ответа на лечение возможно постепенное уменьшение доз ГИБП, хотя полная их отмена в большинстве случаев приводит к обострению заболевания и, соответственно, нецелесообразна. Если первый препарат оказывается неэффективным, или пациент перестает отвечать на лечение, то его переводят на второй/третий ингибитор ФНО-альфа или ингибитор ИЛ-17. При неэффективности терапии ингибитором ФНО-альфа предпочтительным представляется назначение препарата другого класса, т.е. ингибитора ИЛ-17, однако этот вопрос нуждается в дальнейшей изучении.
С.В. Моисеев. Позволяют ли ГИБП задержать прогрессирование структурных изменений у больных аксимальным СпА?
Т.П. Шевцова. Однозначно ответить на этот вопрос сегодня невозможно. Для подтверждения подобного эффекта необходимы очень длительные исследования, учитывая медленное прогрессирование аксиального СпА. В регистрационных плацебо-контролируемых исследованиях ингибиторы ФНО-альфа не влияли на прогрессирование структурных изменений у пациентов с аксиальным СпА, однако результаты более длительного наблюдения (≥4 лет) свидетельствуют о том, что они могут давать такой эффект [34,35]. Убедительных данных, подтверждающих эффективность ингибиторов ИЛ-17 в профилактике прогрессирования аксиального СпА, также нет, хотя это, конечно, не снижает их клиническую ценность.
С.В. Моисеев. Для лечения ревматоидного артрита все чаще применяют неселективные (тофацитиниб, барицитиниб) и селективные (упадацитиниб) ингибиторы янус-киназ, которые, в отличие от ГИБП, не являются моноклональными антителами или другими белковыми молекулами и предназначены для приема внутрь. Недавно упадацитиниб стал первым препаратом этой группы, одобренным для лечения АС, в том числе в Российской Федерации. Каковы результаты исследований упадацитиниба у пациентов с аксиальным СпА?
П.И. Новиков. Эффективность и безопасность упадацитиниба в дозе 15 мг один раз в сутки у взрослых пациентов с активным АС изучали в многоцентровом, рандомизированном, двойном слепом, плацебо-контролируемом исследовании 2/3 фазы SELECT-AXIS 1, которое проводилось в 62 центрах в 20 странах мира [36]. Диагноз АС устанавливали на основании модифицированных нью-йоркских критериев. В исследование включали только пациентов, не получавших ГИБП и не ответивших на лечение по крайней мере двумя НПВП. Критериями сохраняющейся активности АС были значение счета BASDAI≥4 и интенсивность боли в спине по визуальной аналоговой шкале ≥4 на визите скрининга и исходном визите. Пациентов рандомизировали (1:1) на группы упадацитиниба и плацебо и продолжали лечение в течение 14 недель. Больным, завершившим двойной слепой период, предлагали принять участие в 90-недельном открытом исследовании с целью изучения эффективности и безопасности длительной терапии упадацитинибом в дозе 15 мг/сут. Первичной конечной точкой двойного слепого исследования была частота ответа по критериям ASAS40 через 14 недель. Особенностью протокола SELECTAXIS 1 был анализ многочисленных вторичных показателей эффективности, которые включали себя динамику различных индексов и частоту ответа, оцениваемого на основании разных показателей.
В исследование были включены 187 взрослых пациентов (средний возраст 45,4 года) с активным АС, которые были распределены на две сопоставимые группы. Около 70% из них были мужчинами, средняя длительность заболевания составляла около 14 лет, а средний срок после установления диагноза – 7 лет. HLA-B27 определялся у 76% пациентов. Все пациенты не ответили на предыдущую терапию НПВП. Часть больных (16%) принимали стандартные БПВП, в основном сульфасалазин, лечение которыми разрешалось продолжить во время исследования. Средний счет боли в спине по шкале от 0 до 10 составлял 6,7 и 6,8 в группах плацебо и упадацитиниба, соответственно, индекс ASDAS – 3,7 и 3,5, индекс BASDAI – 6,5 и 6,3. Приведенные значения указывали на наличие высокой активности АС.
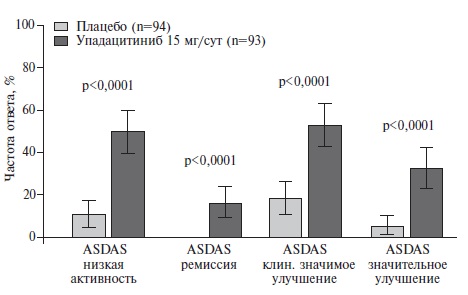
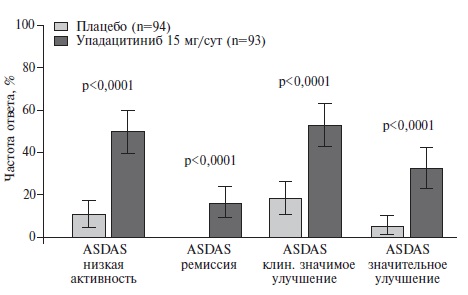
Первичная конечная точка исследования была достигнута: частота ответа по критериям ASAS40 через 14 недель в группе упадацитиниба достоверно превосходила таковую в группе плацебо (52% и 26%, соответственно; p=0,0003). Улучшение показателей активности АС при лечении ингибитором янус-киназ было отмечено уже через 2 недели после начала лечения, что указывало на быстрый эффект препарата. Эффективность упадацитиниба подтверждалась статистически значимым улучшением и других показателей, отражающих активность болезни (BASDAI50, ASDAS), функцию (BASFI) и динамику МР изменений в позвоночнике (SPARCC MRI) (рис. 5). Некоторые показатели (ASQoL, BASMI, MASES и ASAS Health Index) улучшились в группе упадацитиниба по сравнению с контролем, хотя разница между группами не достигла статистической значимости при внесении поправки на множественные сравнения. Преимущество упадацитиниба перед плацебо наблюдалось и при анализе частоты достижения ремиссии или низкой активности АС, которые являются основными целями лечения (во всех случаях различия между группами были высоко статистически значимыми). Так, низкая активность АС по критериям ASDAS была достигнута у 49% пациентов основной группы и только у 11% больных группы плацебо (рис. 6).
Переносимость упадацитиниба у больных АС была хорошей. Частота нежелательных явлений была сопоставимой в двух группах. При лечении упадацитинибом несколько чаще встречалось небольшое и бессимптомное повышение активности КФК, которое не требовало прекращения лечения. Срок лечения упадацитинибом во время двойного слепого периода исследования SELECT-AXIS 1 и количество включенных пациентов были явно недостаточными для анализа профиля безопасности, однако он тщательно изучен в клинических исследованиях, в том числе длительных, у пациентов с ревматоидным артритом [37].
О.В. Бугрова. Примером успешного применения упадацитиниба для лечения АС может служить следующее наблюдение. Больной C., 37 лет, впервые госпитализирован в ревматологическое отделение областной клинической больницы Оренбурга в июле 2021 г. В течение 7 лет беспокоят боли в коленных суставах и в поясничнокрестцовом, а затем и в грудном отделе позвоночника. Учитывая наличие рентгенологических признаков сакроилиита, диагностирован анкилозирующий спондилит. Получал терапию различными НПВП, однако боли полностью не проходили, а также отмечалось постепенное нарастание ограничений движений в позвоночнике. В течение нескольких месяцев принимал сульфасалазин без эффекта. При поступлении выявлены признаки высокой активности анкилозирующего спондилита (индекс BASFI – 6,5), резкое ограничение движений в позвоночнике, выраженное нарушение функциональной активности (индекс BASFI – 6,5) и энтезит (индекс MASES – 3). Счет боли по шкале от 0 до 10 составлял 10, ночной боли – 10, число болезненных суставов – 4/66, число припухших суставов – 2/66. СОЭ 26 мм/ч, содержание СРБ 7,8 мг/л. Начато лечение упадацитинибом в дозе 15 мг/сут. В течение 1,5 мес наблюдалось практически полное купирование боли и скованности в позвоночнике и болей в суставах, значительно улучшился сон. При повторном обследовании в ноябре 2021 г. отмечено значительное снижение активности заболевания (индекс BASDAI – 3,2, СРБ – 1,4 мг/л), уменьшение боли в позвоночнике (счет боли – 2, ночной боли – 1) и признаков энтезита (индекс MASES – 1), отсутствие боли и припухлости в коленных суставах. Кроме того, выявлено увеличение объема движений в позвоночнике, в частности боковое сгибание увеличилось с 13-14 до 19-20 см, тест Шобера – с 1,5 до 2,8 см, расстояние от козелка до стены уменьшилось с 12 до 10 см, увеличилась ротация в шейном отделе позвочночника. Индекс BASFI снизился до 2,2, что указывало на улучшение функциональности активности пациента.
Конечно, срок лечения упадацитинибом в данном наблюдении слишком короткий, чтобы в полной мере оценить эффективность и безопасность препарата. Тем не менее, этот случай демонстрирует быстрое действие упадацитиниба у пациента с высокой активностью АС.
С.В. Моисеев. Можно ли сопоставить эффективность упадацитиниба и ГИБП при лечении АС?
П.И. Новиков. В рандомизированных контролируемых исследованиях эффективность этих препаратов у больных АС не сравнивали. Как указано выше, в исследовании SELECT-AXIS 1 частота ответа по критериям ASAS40 через 14 недель в группах упадацитиниба и плацебо составила 52% и 26%. Этот показатель был одним из критериев эффективности и в регистрационных клинических исследованиях ингибиторов ФНО-альфа и ИЛ-17 у пациентов с АС, не ответивших на НПВП. Например, в исследовании MEASURE 2 на лечение секукинумабом в двух дозах или плацебо через 16 недель ответили 40,5-42,1% и 21,1% пациентов c АС, соответственно [38]. В исследовании COAST V частота ответа по критериям ASAS40 через 16 недель составила 48-52% при применении иксекизумаба каждые 2 или 4 недели, 36% в группе адалимумаба и 18% в группе плацебо [39]. Сходные преимущества активных препаратов перед плацебо были отмечены и при изучении эффективности ингибиторов ФНО-альфа [40,41]. Приве денные данные указывают на то, что упадацитиниб по крайней мере не уступает по эффективности ингибиторами ФНО-альфа и ИЛ-17 у пациентов с АС, не получавших ранее ГИБП. Однако необходимо подчеркнуть, что анализ результатов разных исследований позволяет составить только самое общее представление о сравнительной эффективности упадацитиниба и ГИБП, учитывая различия выборок пациентов, сроков оценки ответа на лечение и т.п.
С.В. Моисеев. Результаты исследования SELECTAXIS 1 не оставляют сомнений в эффективности упадацитиниба у пациентов с АС. Однако в это исследование не включали больных, не ответивших на ГИБП, и пациентов с нерентгенологическим аксиальным СпА. Каковы перспективы изучения препарата в таких случаях?
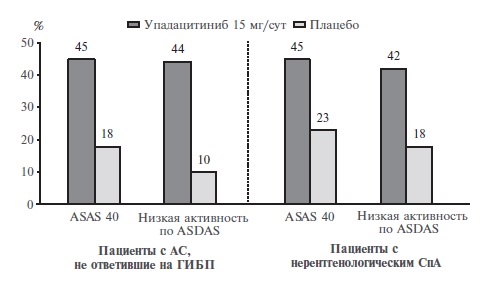
П.И. Новиков. В настоящее время проводится рандомизированное, двойное слепое, плацебо-контролируемое исследование 3 фазы SELECT-AXIS 2 с целью дальнейшего изучения эффективности и безопасности упадацитиниба в дозе 15 мг/сут у пациентов с аксиальным СпА. Фактически оно состоит из двух параллельных исследований (NCT04169373). В первое из них включены 420 пациентов с активным АС несмотря на лечение ГИБП, а во второе – 313 больных с нерентгенологическим аксиальным СпА. Общая длительность обоих исследований составит 104 недели, а длительность двойного слепого периода – 14 недель у пациентов с активным АС и 52 недели у больных с нерентгенологическим аксиальным СпА. Исследования SELECT-AXIS 2 пока не завершены, однако недавно в пресс-релизах компании AbbVie были приведены результаты анализа первичного показателя эффективности через 14 недель [42,43]. В обоих исследованиях по частоте ответа по критериям ASAS40 упадацитиниб ста- тистически значимо превосходил плацебо (рис. 7). Кроме того, при лечении ингибитором янус-киназ была достоверно выше частота достижения низкой активно- сти по критериям ASDAS. Преимущество упадацитини- ба перед плацебо подтверждалось и при анализе ряда вторичных показателей эффективности.
И.А. Шафиева. Мы имеем первый опыт применения упадацитиниба у больных, не ответивших на ГИБП. Пациент Ш., 54 лет, поступил в клинику Самарского государственного медицинского университета в апреле 2021 г. С 16-летнего возраста беспокоят боли в спине, а также боли в суставах нижних конечностей, которые расценивали как проявления реактивного артрита. С 26 лет рецидивирующий иридоциклит. При обследовании выявлен двусторонний сакроилиит. Диагностирован анкилозирующий спондилит. В течение более 20 лет получал терапию НПВП, а также сульфасалазином. Четыре года назад было начато лечение адалимумабом, на фоне которого увеит не рецидивировал, а боли в спине и суставах значительно уменьшились. Однако со временем эффективность терапии снизилась, в связи с чем адалимумаб был отменен несколько месяцев назад. При поступлении в клинику сильные боли (8 по визуальной аналоговой шкале) и ограничение движений во всех отделах позвоночника. При обследовании отмечалось увеличение СОЭ до 56 мм/ч и содержания СРБ до 52,9 мг/л. Диагноз: анкилозирующий спондилит высокой степени активности (ASDAS 5,3, BASDAI 7,5), двусторонний сакроилиит 3 стадии, HLA-B27. С 10 апреля 2021 года было начато лечение упадацитинибом в дозе 15 мг/сут. При повторном осмотре через 2 месяца наблюдалось значительное уменьшение болей в позвоночнике (до 2 по визуальной аналоговой шкале) и периферических суставах, нормализация СОЭ (18 мм/ч) и содержания СРБ (1,0 мг/л) и значительное снижение индексов воспалительной активности, в том числе ASDAS до 1,6 и BASDAI до 3,1.
Таким образом, у пациента с многолетним анамнезом АС и высокой активностью заболевания, которую не удавалось контролировать адалимумабом, лечение упадацитинибом в течение короткого срока привело к значительному улучшению состояния, в том числе практически полному купированию болевого синдрома.
С.В. Моисеев.
Среди болезней опорно-двигательной системы заболевания коленного сустава стабильно занимают лидирующее место наряду с коксартрозом, соперничая с ним по срокам временной и стойкой нетрудоспособности [1]. Доля пациентов, утративших трудоспособность по причине гонартроза различного генеза составляет 20-30% от числа нетрудоспособных пациентов с болезнями суставов [2,3]. Эксперты Европейской антиревматической лиги (EULAR) рассматривают остеоартрит (ОА) как повреждение суставного хряща с гипертрофической реакцией субхондральной кости, краевым и центральным формированием новой костной ткани (остеофитов).
Несмотря на растущую актуальность проблемы, в Российской Федерации пока не разработана согласованная стратегия оказания медицинской помощи данной категории пациентов [4-6]. Вместе с тем некоторые международные профессиональные сообщества последовательно разрабатывают стратификацию вариантов лечения [7-9]. Среди наиболее авторитетных документ Европей ского общества по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательной системы (ESCEO, 2019), предлагающий наряду с физическими методами пошаговую схему медикаментозного лечения. На первом этапе эксперты рекомендуют использовать SYSADOA в качестве базисной терапии, а также топические нестероидные противовоспалительные препараты (НПВП). При их неэффективности предлагается применение пероральных форм НПВП с дальнейшей пошаговой эскалацией фармакотерапии: соли гиалуроновой кислоты (ГК) и/или глюкокортикостероиды (ГКС).
Однако нарастание сенсибилизации и коморбидности популяции вносит существенные коррективы в тактику и стратегию фармакологической терапии у части пациентов с ОА. Так, даже у молодых больных с аллергологическим анамнезом и сопутствующей соматической патологией рекомендуемая схема не всегда возможна в полном объеме. Для этой категории больных требуются новые, менее аллергенные лекарственные средства. В рекомендациях по терапии ОА крупных суставов пока не представлены миорелаксанты центрального действия, такие как толперизон, хотя первые симптомы, в том числе боль и ограничение объема движений, появляются еще на дорентгенологической стадии заболевания и обусловлены, вероятнее всего, мышечным спазмом [10]. Назначение толперизона после ортопедических и травматологических операций, а также при спондилезе, спондилоартрозе и ОА крупных суставов представляется патогенетически оправданным и рациональным дополнением к общепринятой схеме лечения и заслуживает пристального исследования.
Иллюстрацией эффективности сочетанного применения оригинальных препаратов ацеклофенака (Аэртал) и толперизона (Мидокалм) для лечения начальных стадий ОА коленных суставов с целью купирования боли и улучшения функционального статуса пораженного сустава, а также профилактики прогрессирования патологического процесса может служить следующее наблюдение. Эффективность терапии оценивали на основании клинических, параклинических и лабораторных критериев, в том числе определяли динамику болевого синдрома по визуальной аналоговой шкале (ВАШ), изменение амплитуды движений в пораженных суставах в градусах, синовита по данным ультразвукового исследования, СОЭ и содержания С-реактивного белка (СРБ). Все показатели измеряли исходно и на 14-й день от начала терапии.
Пациентка М., 48 лет, при первичном обращении жаловалась на боль и скованность в обоих коленных суставах, а также умеренное ограничение движений в них. Болевой синдром имел стартовый характер и усиливался при физической нагрузке. Боль в суставах появилась около 5 лет назад, в связи с чем обращалась к хирургу и была обследована в амбулаторных условиях. При рентгенографии диагностирован идиопатический двусторонний ОА коленных суставов I степени по классификации Келлгрена-Лоуренса. Первоначально применяла диклофенак в виде мази, однако препарат был отменен из-за развития контактного дерматита. При приеме ибупрофена в дозе 200 мг внутрь на вторые сутки появились частый продуктивный кашель и экспираторная одышка, которые были купированы несколькими ингаляциями сальбутамола. От дальнейшей терапии ибупрофеном пациентка отказалась.
Больная страдает поллинозом. Отмечает нечастые острые респираторные винусные инфекции. Не перено- сит бета-лактамные антибиотики, местные анестетики, диклофенак, кетопрофен и ибупрофен.
Примерно через 3 года от начала заболевания отметила усиление болей в обоих коленных суставах и более выраженное ограничение амплитуды движений. При рентгенографии наблюдалось прогрессирование дегенеративного процесса и определялись признаки двустороннего ОА II степени по классификации КеллгренаЛоуренса. При объективном исследовании состояние удовлетворительное. Кожные покровы бледные, сыпи не было, видимые слизистые оболочки интактны, отмечалась нормотермия. При аускультации во всех отделах выслушивалось везикулярное дыхание. Тоны сердца ясные, ритмичные, шумы не выслушивались. Частота сердечных сокращений 76 в минуту, АД 125/85 мм рт. ст. Живот мягкий, безболезненный при пальпации. Печень и селезенка не увеличены.
Учитывая предшествующий опыт лечения, мы предприняли попытку местной монотерапии кремом Аэртал на область коленных суставов три раза в день в течение 6-7 дней, в том числе с целью выяснения и, по возможности, минимизации иммунного ответа на препарат. Дериваты гиалуроновой кислоты, как и другие SYSADOAs, учитывая анамнестические данные, не применяли ввиду опасности развития аллергических реакций немедленного типа. От применения ГКС больная, имевшая гинекологические эндокринные расстройства, отказалась. После повторного нанесения крема Аэртал никаких нежелательных лекарственных реакций не последовало. Через 6 дней после начала местной терапии ацеклофенаком больная отметила некоторое уменьшение болевого синдрома без существенной динамики амплитуды движений в суставе, в связи с чем было начато лечение ацеклофенаком внутрь в дозе 200 мг/сут в два приема в сочетании с толперизоном в дозе 150 мг/сут в три приема. С целью гастропротекции больная принимала перорально омепразол по 20 мг два раза в сутки в течение всего курса терапии. Длительность лечения составила 14 дней.
Исходные клинические и лабораторные показатели приведены в табл. 1. Через 2 недели амплитуда сгибания и разгибания голени увеличилась на 25о и 5о, а индекс боли по ВАШ уменьшился на 2,1 см. При ультразвуковом исследовании до лечения определялся умеренный синовит, после лечения – незначительный. СОЭ и содержание СРБ снизились до верхних границ референсных значений.
| Показатели | Исходно | 14-й день |
|---|---|---|
| Амплитуда движений в коленных суставах, о | ||
| Сгибание | 85 | 60 |
| Разгибание | 170 | 175 |
| Боль по ВАШ, см | 7,4 | 5,4 |
| Синовит (по данным УЗИ) | Умеренный | Незначительный |
| Лабораторные показатели | ||
| СОЭ, мм/ч | 17 | 10 |
| СРБ, мг/л | 10 | 5 |
Таким образом, к концу наблюдения все исследуемые критерии имели позитивную динамику по сравнению с исходными значениями. Наилучшие клинические результаты достигнуты при оценке амплитуды сгибания голени, а также субъективного восприятия боли. Указанные результаты были получены без применения SYSADOAs и ГКС. Ацеклофенак (Аэртал), обладающий противовоспалительным, обезболивающим и жаропонижающим действием, применяется в Российской Феденации с 2002 г. Являясь производным фенилуксусной кислоты, ацеклофенак ингибирует обе изоформы циклооксигеназы (ЦОГ), но преимущественно подавляет экспрессию ЦОГ-2. Слабое угнетение простагландинов слизистой оболочки желудка определяет улучшенную переносимость препарата [11], а его эффективность доказана в многочисленных клинических исследованиях. Толперизон (Мидокалм) оказывает мембраностабилизирующее и местное анестезирующее действие, тормозит проводимость импульсов в первичных афферентных волокнах и двигательных нейронах, что приводит к блокированию спинномозговых моно- и полисинаптических рефлексов. Также вторично тормозит выделение медиаторов путем торможения поступления Ca2+ по каналам в синапсы. В стволе мозга тормозит проведение возбуждения по ретикулоспинальному пути, усиливает периферический кровоток независимо от влияния ЦНС. Одним из показаний к назначению толперизона является лечение повышенного тонуса и мышечных спазмов, сопровождающих заболевания опорно-двигательного аппарата, в том числе артрозы крупных суставов.
Заключение
В представленном наблюдении у пациентки с двусторонним ОА коленных суставов II степени удалось добиться эффекта на фоне терапии НПВП ацеклофенаком и миорелаксантом толперизоном. SYSADOAs и ГКС не применялись. При выборе тактики консервативной терапии пациентов с начальными стадиями ОА коленных суставов на амбулаторном этапе следует выделять категорию больных с преобладанием в клинической картине фазы обострения по типу артрита, характеризующегося умеренным синовитом и воспалительными лабораторными изменениями. При невыраженных стадиях дегенеративного процесса в пораженных суставах допустимо временно отказаться от применения SYSADOAs и ГКС, учитывая клиническую эффективность предложенной схемы терапии, которая оправдана и с фармакоэкономической точки зрения.
Возможности лечения аксиального СпА за последние два десятилетия значительно расширились за счет разработки ингибиторов ФНО-альфа, а затем ингибиторов ИЛ-17. Место упадацитиниба в лечении АС в клинических рекомендациях пока не определено, так как они были опубликованы несколько лет назад. Если проводить аналогию с ревматоидным артритом, то при этом заболевании ингибиторы янускиназ первоначально рассматривали как препараты третьей линии и использовали в основном при неэффективности ингибиторов ФНО-альфа. Однако по мере накопления опыта изучения эффективности и безопасности таргетных синтетических БПВП в клинической практике их роль в лечении ревматоидного артрита была пересмотрена, и в настоящее время препараты этой группы считаются средствами второй линии и применяются наравне с различными ГИБП при отсутствии ответа на метотрексат и другие стандартные БПВП. В отличие от ГИБП, ингибиторы янускиназ не являются белковыми молекулами и, соответственно, не вызывают образование антител и применяются внутрь, что может иметь значение для пациентов, которым по тем или иным причинам отказываются от парентерального введения лекарственных средств. Применение упадацитиниба одобрено для лечения больных активным АС. Однако учитывая предварительные результаты исследования SELECT-AXIS 2, в ближайшее время можно ожидать расширения показаний к назначению упадацитиниба, в частности пациентам с нерентгенологическим аксиальным спондилоартритом.
Используемые источники
- Сазонова Н.В., Мальцева Л.В., Лунева С.Н. и др. Опыт локального направленного введения препаратов-хондропротекторов в зону патологических изменений суставной губы вертлужной впадины при коксартрозе. Лечащий врач 2021;24(1):46-9 [Sazonova NV, Maltseva LV, Luneva SN et al. Experience of local targeted administration of chondroprotective drugs into the zone of pathological changes in the labrum of the acetabulum in coxarthrosis. Lechaschy Vrach 2021;24(1):46-9 (in Russ.)].
- Поворознюк В.В. Заболевания костно-мышечной системы и возраст. Проблемы старения и долголетия 2008;17(4):399-412 [Povoroznyuk VV. Diseases of the musculoskeletal system and age. Problemy stareniya i dolgoletiya 2008;17(4):399-412 (in Russ.)].
- Корьяк В.А., Сороковиков В.А., Свистунов В.В. и др. Эпидемиология коксартроза. Сибирский медицинский журнал 2013;8:36-9 [Koryak VA, Sorokovikov VA, Svistunov VV, et al. Epidemiology of coxarthrosis. Sibirskiy meditsinskiy zhurnal 2013;8:36-9 (in Russ.).
- Приказ Министерства здравоохранения и социального развития Российской Федерации от 11 февраля 2005 года №123 “Об утверждении стандарта медицинской помощи больным артрозами” (дата обращения 10.12.2020).
- Приказ Министерства здравоохранения и социального развития РФ от 11 августа 2005 года №508 “Об утверждении стандарта медицинской помощи больным гонартрозом” (дата обращения 10.12.2020).
- Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. №1132н “Об утверждении стандарта первичной медикосанитарной помощи при первичном коксартрозе, ревматоидном артрите, подагре с поражением тазобедренных суставов, остеонекрозе и кистах головки бедренной кости” (дата обращения 10.12.2020).
- Алексеева Л.И. Обновление клинических рекомендаций по лечению больных остеоартритом 2019 года. РМЖ 2019;4:2-6 [Alekseeva LI. Сlinical guidelines update on the treatment of patients with osteoarthritis in 2019. RMZH 2019;4:2-6 (In Russ.)].
- Головач И.Ю., Егудина Е.Д., Тер-Вартанян С.Х. Тактика ведения пациентов с остеоартритом коленного сустава в соответствии с рекомендациями современных медицинских обществ: акцент на ESCEO-2019. Травма 2019; 20(4):23-38 [Golovach IY, Egudina ED, Ter-Vartanyan SH. Management of patients with knee osteoarthritis in accordance with the recommendations of the modern medical societies: focus on ESCEO 2019. Travma 2019;20(4):23-38 (In Russ.)].
- Sharma V, Anuvat K, John L, Davis M. Scientific American Pain Management - Arthritis of the knee. Decker: Pain related disease states. 2017, 276 p.
- Каплунов О.А., Каплунов К.О., Некрасов Е.Ю. Опыт применения толперизона в комплексной консервативной терапии остеоартроза тазобедренного сустава. Хирургия. Журнал им. Н.И. Пирогова 2017;11:51-5 [Kaplunov OA, Kaplunov KO, Nekrasov EYu. The use of aceclofenac (Aertal) in the outpatient practice of thraumatologist. Khirurgiya. Zhurnal im. N.I. Pirogova 2017;12:103-6 (In Russ.)].
- Каплунов О.А., Каплунов К.О., Некрасов Е.Ю. Применение ацеклофенака (аэртала) в амбулаторной практике травматолога-ортопеда. Хирургия. Журнал им. Н.И. Пирогова 2017;12:103-6 [Kaplunov OA, Kaplunov KO, Nekrasov EYu. The experience of using tolperisone in a complex conservative treatment of osteoarthritis of the hip joint. Khirurgiya. Zhurnal im. N.I. Pirogova 2017;11:51-5 (In Russ.)].
