Гигантоклеточный артериит в сочетании с ревматической полимиалгией: клинические проявления, диагностика и лечение
Гигантоклеточный артериит (ГКА) – это системный васкулит, поражающий сосуды крупного и среднего калибра и наиболее часто встречающийся у людей пожилого и старческого возраста. Клиническая картина характеризуется широким спектром симптомов – от “хромоты” нижней челюсти, головных болей до лихорадки неясного генеза. ГКА часто сочетается с ревматической полимиалгией (РПМ). Ранее существенную роль в диагностике ГКА играла биопсия височной артерии, при которой выявляли инфильтрацию стенки воспалительными клетками. В настоящее время большее значение имеют неинвазивные методы диагностики, в том числе ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная томография. Лечение ГКА зависит от варианта и степени тяжести заболевания. “Золотым” стандартом остается терапия глюкокортикостероидами, которые обычно используют в сочетании с иммуносупрессивными препаратами, а также тоцилизумабом. В статье на примере клинического наблюдения обсуждаются клинические симптомы, методы диагностики и лечения ГКА.
С.В. Моисеев. Гигантоклеточный артериит (ГКА) – это системный васкулит, развивающийся у лиц старше 50 лет и характеризующийся воспалительным поражением артерий крупного и среднего калибра. Пик заболеваемости ГКА приходится на возраст 70-79 лет [1]. Раннее выявление и своевременно начатая иммуносупрессивная терапия ГКА имеют важное значение для профилактики ишемических осложнений, прежде всего потери зрения [2]. Предполагать ГКА следует, если у пациента пожилого и старческого возраста внезапно появляются боль в височной области, особенно односторонняя, "хромота" нижней челюсти (боль при жевании), острое нарушение зрения в сочетании клиническими (лихорадка, боли в суставах и мышцах) и лабораторными (повышение СОЭ и содержания С-реактивного белка [СРБ]) признаками воспаления [3]. ГКА нередко сочетается с ревматической полимиалгией (РПМ), которая характеризуется болью и скованностью в мышцах шеи, плечевого и/или тазового пояса. При наличии типичных проявлений и определенной настороженности заподозрить ГКА не так сложно, хотя у людей пожилого и старческого возраста головную боль или ухудшение зрения обычно трактуют как проявления атеросклеротического поражения сосудов, в то время как лихорадка и другие проявления воспаления обычно служат основанием для исключения новообразований. Объективные диагностические трудности возникают при так называемом "такаясу-подобном" варианте ГКА, при котором отсутствуют проявления поражения черепных артерий, что иллюстрирует следующее клиническое на блю дение.
Е.В. Чачило. Пациентка М., 66 лет, заболела в апреле 2017 г., когда появилась лихорадка до 38,2оС с потрясающими ознобами и проливными потами, затем присоединился непродуктивный кашель. По поводу предполагаемого трахеита проводилось лечение коамоксициллином, на фоне которого кашель уменьшился, однако лихорадка сохранялась. При обследовании отмечались гипохромная анемия (гемоглобин 106 г/л), повышение СОЭ (53 мм/ч) и содержания СРБ (82,5 мг/л). Общий анализ мочи без изменений. При эхокардиографии данных за инфекционный эндокардит не выявлено. При посеве крови рост микрофлоры отсутствовал. При компьютерной томографии (КТ) органов грудной клетки без патологии. При мультиспиральной КТ органов брюшной полости определялись небольшие кисты в печени и незначительная диффузная гиперплазия надпочечников.
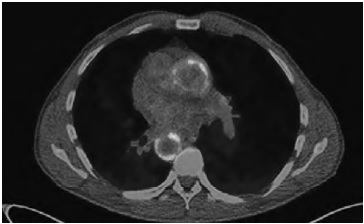
В августе 2017 г. госпитализирована в клинику им. Е.М. Тареева. При обследовании данных за инфекционные или опухолевые заболевания не получено. При КТ выявлено утолщение стенки грудной части аорты (аортит?). Высказано предположение о наличии васкулита с поражением крупных сосудов, в связи с чем проведена позитронно-эмиссионная томография/компьютерная томография (ПЭТ/КТ). Отмечено накопление 18F-фтордезоксиглюкозы в стенках аорты на всем ее протяжении, всех ветвей дуги аорты, подключичных, подмышечных и сонных артерий (рис. 1), что позволило диагностировать такаясу-подобный вариант ГКА. Начата терапия преднизолоном в дозе 30 мг/сут, которая быстро привела к стойкой нормализация температуры тела и снижению содержания СРБ (42,7 мг/л) и СОЭ (40 мм/ч). В октябре 2017 г. лабораторные признаки воспаления отсутствовали, в связи с чем начато постепенное снижение дозы преднизолона до 5 мг/сут. До апреля 2018 г. сохранялась ремиссия заболевания на фоне приема преднизолона в дозе 5 мг/сут. В феврале 2018 г. при ультразвуковом исследовании определялись стеноз левой каротидной бифуркации и устья внутренней сонной артерии до 35% и стеноз устья правой внутренней сонной артерии до 25%.
В середине апреля 2018 г. отметила появление ноющих болей в мышцах бедер, усиливающихся в ночное время, болей в мелких суставах стоп, общей слабости и потливости. Обращало на себя внимание повышение концентрации СРБ до 16,7 мг/л. Состояние расценено как обострение ГКА с присоединением РПМ. К лечению добавлен метотрексат в дозе 10 мг/нед, однако сохранялись слабость, потливость, появились боли в области сердца, сердцебиение, головокружение, боли в стопах, плечах, кистях с утренней скованностью до 30 мин. Содержание СРБ увеличилось до 32,4 мг/л. Учитывая сохраняющуюся активность процесса, доза метотрексата увеличена до 20 мг/нед в сочетании с приемом преднизолона в дозе 5 мг/сут, что позволило вновь добиться клинико-лабораторной ремиссии.
При обследовании в феврале 2019 г. определялись стеноз общей сонной артерии справа до 30%, устья внутренней сонной артерии до 75% справа и до 30% слева. При КТ-ангиографии выявлена аневризма восходящего отдела аорты без признаков расслоения, атеросклероз и локальное расширение инфраренального отдела аорты. Консультирована ангиохирургами и кардиохирургами, показаний к оперативному лечению не выявлено. Учитывая отсутствие активности заболевания, начато медленное снижение дозы преднизолона, что сопровождалось нарастанием слабости, повышением концентрации СРБ до 7,8 мг/л, в связи с чем в июне 2019 г. доза препарата увеличена до 15 мг/сут, метотрексат отменен в связи с неэффективностью, присоединен гидроксихлорохин в дозе 400 мг/сут.
До декабря 2019 г. состояние оставалось без ухудшения, содержание СРБ, фибриногена и СОЭ в пределах нормальных значений. Однако при попытке снижения дозы преднизолона пациентка стала отмечать появление и постепенное нарастание болей в мышцах и суставах, двусторонних головных болей в височной области, припухлости височной артерии и отсутствие пульсации в ней, прогрессирующее ухудшение зрения с эпизодами выпадения/сужения полей, потливость. В мае 2020 г. появились и стали усиливаться загрудинные боли тупого характера. Содержание СРБ – 6 мг/л. При ультразвуковом исследований брахиоцефальных сосудов и артерий верхних конечностей в июне 2020 г. без отрицательной динамики. К июлю 2020 г. доза преднизолона составила 3,75 мг/сут. При КТ в августе 2020 г. отмечена отрицательная динамика в виде увеличения диаметра аневризмы восходящего отдела грудной аорты с 50-52 до 56-57 мм. В сентябре 2020 г. при ультразву ковой допплерографии выявлено поражение поверхностных височных артерий по типу артериита с формированием стеноза до 70% слева и до 50% справа, а также подмышечных артерий до 20%. Учитывая развитие рецидива основного заболевания на фоне комбинированной терапии преднизолоном, гидроксихлорохином и метотрексатом (анамнестически), начата терапия ингибитором рецепторов интерлейкина-6 тоцилизумабом в дозе 162 мг подкожно один раз в неделю, доза преднизолона повышена до 15 мг/сут. Позднее переведена на внутривенное введение тоцилизумаба в дозе 520 мг в месяц. В результате проводимой терапии наблюдались снижение лабораторных показателей воспаления (СРБ, СОЭ), улучшение общего самочувствия в виде уменьшения слабости, отсутствия потливости. Постепенно доза преднизолона снижена до 10 мг/сут.
В мае 2021 г. при мультиспиральной КТ аорты выявлено увеличение диаметра аневризмы на 6-7 мм. При эхокардиографии определялась недостаточность аортального клапана 2-3 степени. Выполнено протезирование аортального клапана и восходящего отдела и дуги аорты, шунтирование передней межжелудочковой артерии. В июле 2021 г. содержание СРБ – 1,1 мг/л, СОЭ – 3 мм/ч. Диагностирована ремиссия ГКА.
П.И. Новиков. Выделяют две группы симптомов ГКА: краниальные, связанные с поражением черепных артерий, и экстракраниальные, развивающиеся при повреждении аорты и ее ветвей. К первым относятся головная боль, перемежающая "хромота" нижней челюсти, боль при пальпации головы, снижение/потеря зрения, изменения височной артерии (боль при пальпации, уплотнение, узелки, отсутствие пульса), ко вторым – перемежающаяся "хромота" верхних и нижних конечностей, боль в спине и груди, связанная с воспалением или расслоением аорты [4]. Как и в нашем наблюдении, у большинства пациентов выявляют симптомы системного воспаления в виде лихорадки, повышения содержания СРБ и СОЭ [2]. Соответственно, условно выделяют два фенотипа заболевания: краниальный ГКА и экстракраниальный ГКА с поражением крупных сосудов. ГКА часто, в 40-60% случаев, сочетается с РПМ [4]. Длительная лихорадка, которая наблюдалась у нашей пациентки, развивается по данным отдельных исследований менее чем у половины пациентов [2,5,6]. Наличие лихорадки у пациентов с ГКА ассоциировано с более высокими уровнями воспалительных маркеров, большей частотой развития анемии и меньшей вероятностью ишемических проявлений [79]. Лихорадка неясного генеза во всех случаях требует проведения тщательного дифференциального диагноза, в том числе со злокачественными опухолями [10] .
А.Д. Мешков. В клинике им. Е.М. Тареева мы обследовали 115 больных ГКА, который сопровождался РПМ в 55 случаях. У 90 (78,3%) пациентов одним из первых симптомов была головная боль, которая чаще всего локализовалась в височной области. У большинства больных наблюдались слабость, снижение массы тела и повышение температуры тела. Примерно у четверти больных в начале заболевания отмечались изменения со стороны органа зрения, в том числе тяжелые (выпадение полей зрения, внезапная слепота на один глаз, диплопия). У каждого пятого больного определялась боль в нижней челюсти, усиливающаяся при жевании [11].
С.В. Моисеев. Какова роль лабораторных показателей в диагностике ГКА?
Е.Е. Филатова. Изменения лабораторных показателей при ГКА неспецифичны и отражают воспаление. Тем не менее, именно резкое повышение СОЭ и/или содержания СРБ обычно позволяет заподозрить системный васкулит у пожилого пациента, жалующегося на внезапно появившуюся головную боль, ухудшение зрения и т.п. Классификационным критерием ГКА считают увеличение СОЭ более 50 мм/ч. По данным недавно проведенного мета-анализа, у пациентов с ГКА чаще всего отмечают повышение СОЭ более 60 мм/ч и содержания СРБ более 25 мг/л [2], хотя в редких случаях эти показатели увеличиваются незначительно или остаются нормальными [5,12]. У нашей пациентки исходная СОЭ составляла 53 мм/ч, а содержание СРБ – 82 мг/л. У больных ГКА нередко встречается нормохромная или гипохромная нормоцитарная анемия [8,12], развитие которой обычно связано с высокой системной воспалительной активностью [8]. Может наблюдаться повышение активности печеночных ферментов и щелочной фосфатазы, которое может быть следствием артериита печеночной артерии или аутоиммунных нарушений [10,13].
А.Д. Мешков. В нашем исследовании СОЭ была повышена более 30 мм/ч у 91 (79,1%) из 115 больных ГКА, в том числе более 60 мм/ч – у 45 (39,1%). В среднем она составила 54,5 мм/ч. Повышение уровня СРБ более 5 мг/л мы выявили у 71 (61,7%) пациента. У большинства больных концентрация СРБ составляла от 10 до 50 мг/л. Анемия (гемоглобин <100 г/л) встречалась у 30 (26,1%) больных, тромбоцитоз (>350×109/л) – у 63 (54,7%) [11].
С.В. Моисеев. С какими заболеваниями может сочетаться ГКА?
Е.В. Чачило. Как указано выше, ГКА часто сочетается с РПМ [15], которая проявляется болями и скованностью в мышцах плечевого и/или тазового пояса. Могут наблюдаться артрит и теносиновит [4,15,16], а также RS3PE-синдром, характеризующийся симметричным полиартритом и выраженным двусторонним отеком кистей/стоп и отсутствием деструктивного процесса в суставе и повышенного ревматоидного фактора [4]. Развитие сердечно-сосудистых заболеваний у пациентов с ГКА может быть обусловлено как традиционными факторами риска (пожилой возраст, дислипидемия, курение), так и специфическими для ГКА факторами – выраженным системным воспалением, длительным лечением глюкокортикоидами [6]. У больных повышен риск формирования аневризмы и расслоения аорты. ГКА может приводить к повреждению коронарных сосудов и инфаркту миокарда [18].
С.В. Моисеев. Каковы современные классификационные критерии ГКА? Нужно ли всем больным проводить биопсию височной артерии? Какую роль играют неинвазивные визуализирующие методы в диагностике заболевания?
О.О. Бородин. Классификационные критерии ГКА были предложены Американской коллегией ревматологов в 1990 г. [19]:- Возраст на момент начала заболевания старше 50 лет.
- Развитие "новой" головной боли.
- Поражение височной артерии – болезненность при пальпации или снижение пульсации.
- СОЭ ≥50 мм/ч.
- Изменения, выявляемые при биопсии височной артерии: васкулит с мононуклеарными клетками или гранулематозное воспаление, обычно с гигантоклеточными инфильтратами.
Наличие 3 из 5 критериев позволяет классифицировать заболевание как ГКА. В оригинальном исследовании чувствительность предложенных критериев составила 93,5%, специфичность – 91,2% [20], а в недав но проведенном исследовании Seeliger и соавт. – 81,1% и 94,9%, соответственно [21]. Позднее были предложены пересмотренные критерии Американской коллегии ревматологов [22], а также критерии, разработанные на основе исследования DCVAS [23]. Следует отметить, что указанные критерии не применимы к такаясу-подобному варианту ГКА. Например, в представленном наблюдении у пациентки в начале заболевания имелись только 2 классификационных критерия – пожилой возраст и увеличение СОЭ. Долгое время "золотым стандартом" диагностики ГКА считали биопсию височной артерии, хотя этот метод имеет очевидные ограничения: инвазивное исследование, которое не всегда можно быстро провести по техническим причинам, возможность ложноотрицательных результатов при лечении иммуносупрессивными препаратами более 10 дней, отсутствие поражения височных артерий при экстракраниальных формах ГКА [24]. Следует отметить, что повторная биопсия височной артерии у пациентов с ГКА может указывать на сохранение воспалительных изменений несмотря на подавление клинических и лабораторных признаков активности [25]. Ранее было принято считать, что чем длиннее биопсийный участок, тем выше вероятность положительного результата [26]. Однако в настоящее время есть ряд исследований, доказывающих, что от размера биопсийного материала результат исследования существенно не зависит [26,27]. Тем не менее, рекомендуется иссекать не менее 10 мм височной артерии для последующего морфологического изучения.
А.Д. Мешков. В клинике Е.М. Тареева биопсия височной артерии была выполнена у 10 больных. Одна пациентка была направлена на биопсию с подозрением на ГКА в связи с утолщением височных артерий, однако при гистологическом исследовании обнаружено отложение амилоида, а впоследствии диагностирована множественная миелома. При гистологическом исследовании признаки ГКА имелись в 5 (50%) из 10 случаев. У 4 пациентов с отрицательными результатами биопсии диагноз ГКА был подтвержден при магнитно-резонансной томографии (МРТ) брахиоцефальных сосудов, а у 3 пациентов – на основании типичной клинической картины и отчетливой эффективности глюкокортикостероидов [11].
Е.Е. Филатова. Альтернативой биопсии височной ар терии считают ультразвуковое исследование височных артерий (ствол и ветви), а также подмышечных артерий (с двух сторон). В исследовании TABUL у 381 пациентов с ГКА были сопоставлены результаты биопсии височной артерии и ультразвукового исследования височных и подмышечных артерий. Чувствительность и специфичность биопсии составили 91% и 81%, соответственно, ультразвукового исследования – 93% и 77% [29]. Характерным признаком воспалительной инфиль трации стенки артерии при ультразвуковом исследовании является гипоэхогенное утолщение стенки сосуда, или так называемый "ореол" (halo), впервые описанный в 1995 г. [30]. При этом утолщенная вследствие воспаления стенка артерии не сжимается под давлением ультразвуковым датчиком [31]. Кроме того, отмечают увеличение толщины комплекса интима-медиа (КИМ) пораженной при ГКА артерии. У здоровых людей в возрасте в среднем 72 лет средняя толщина КИМ составила 0,6 мм для подмышечных артерий и 0,2 мм для височных, в то время как при ГКА эти показатели увеличиваются в 2-3 раза [32]. По данным мета-анализа 32 исследований, проводившихся с 1993 по 2017 г., чувствительность ультразвукового исследования височной артерии в диагностике ГКА составила 55-77% и была сопоставима с таковой биопсии (77%) [33]. Следует отметить, что чувствительность ультразвукового исследования, как и биопсии, снижается после начала терапии глюкокортикостероидами [33-36]. Таким образом, ультразвуковое исследование является эффективной, неинвазивной и недорогой альтернативой биопсии височных артерий. Метод может быть использован как для диагностики ГКА, так и оценки динамики поражения сосудов. Однако ультразвуковое исследование не позволяет оценить поражение сосудистого русла нетипичной локализации.
Н.М. Буланов. В нашем наблюдении у пожилой пациентки с лихорадкой неясного генеза, у которой отсутствовали клинические признаки поражения височной артерии, диагноз ГКА был заподозрен на основании утолщения стенки грудной части аорты, выявленного при КТ. Воспалительный характер этих изменений подтверждался накоплением 18F-фтор де зокси глюкозы в стенке аорты и других сосудов при ПЭТ/КТ. КТ позволяет обнаружить утолщение стенок аорты и ее основных ветвей у части больных ГКА, хотя на ранних стадиях васкулита крупных сосудов изменения могут отсутствовать [38]. Признаком васкулита при КТ считают концентрическое утолщение стенки сосуда, как правило, с поздним контрастированием и наличием отека сосудистой стенки [39]. Чувствительность и специфичность КТ-ангиографии в диагностике васкулита с поражением крупных сосудов составляют 73% и 78%, соответственно [40]. При экстракраниальной и смешанной формах заболевания КТ с контрастированием и МРТ позволяют также выявить аневризму аорту [41]. Так, у нашей пациентки имелась аневризма восходящего отдела аорты, которая увеличилась в динамике, что в сочетании с лабораторными признаками сохраняющегося воспаления указывало на активность заболевания и послужило основанием для усиления иммуносупрессивной терапии.
И.О. Смитиенко. В 2018 г. были опубликованы рекомендации Европейской антиревматической лиги (EULAR) по применению неинвазивных визуализирующих методов исследования, включая ультразвуковое исследование, МРТ, КТ и ПЭТ, при васкулитах крупных сосудов [42]. Основные положения этих рекомендаций приведены ниже:- Пациентам с подозрением на ГКА рекомендуется проведение визуализирующих исследований на ранних этапах, однако они не должны задерживать начало лечения.
- Если диагноз ГКА высоко вероятен на основании клинических данных и подтверждается результатами визуализирующего исследования, то ГКА может быть диагностирован без дополнительных исследований, в том числе биопсии височной артерии или других визуализирующих методов. Напротив, диагноз ГКА мало вероятен при отсутствии типичных клинических данных и отрицательном результате визуализирующего исследования. В остальных случаях необходимы дополнительные исследования для постановки диагноза.
- Ультразвуковое исследование височных и подмышечных артерий рекомендуется в качестве первого метода визуализации у пациентов с краниальной или смешанной формой ГКА. Наиболее характерный признак – наличие "ореола".
- Для визуализации черепных артерий и оценки воспаления стенок сосудов может использоваться МРТ высокого разрешения, особенно если результаты ультразвукового исследования оказываются неинформативными.
- КТ и ПЭТ не рекомендуются применять для оценки воспалительного процесса в краниальных артериях.
- Ультразвуковое исследование, ПЭТ, МРТ и/или КТ могут использоваться для обнаружения воспаления стенок и/или изменений просвета экстракраниальных артерий и подтверждения диагноза ГКА. Ультразвуковой метод имеет ограниченную ценность в диагностике аортита.
- Обычную ангиографию не рекомендуется применять для диагностики ГКА или артериита Такаясу, так как она может быть заменена указанными выше неинвазивными методами.
- У пациентов с предположительным обострением ГКА или артериита Такаясу визуализирующие методы помогают подтвердить или исключить его.
- У пациентов с васкулитом с поражением крупных сосудов MР- или КТ-ангиография и/или ультразвуковое исследование могут использоваться для мониторирования структурных повреждений, особенно для выявления стеноза, окклюзии, дилатации и/или аневризм. Частоту скрининга, а также метод визуализации выбирают индивидуально.
- Инструментальное обследование должно проводиться обученным специалистом с использованием соответствующего оборудования. Надежность визуализации может быть повышена путем специального обучения специалистов.
В целом приведенные рекомендации отражают повышение роли неинвазивных методов визуализации крупных артерий в диагностике ГКА в клинической практике (рис. 2). Биопсию височной артерии сегодня уже не считают обязательным методом исследования, необходимым для подтверждения этого диагноза. Тем не менее, она обоснована в сомнительных случаях, так как результаты любого современного метода, включая МР-ангиографию, могут оказаться ложноотрицательными [43,44].
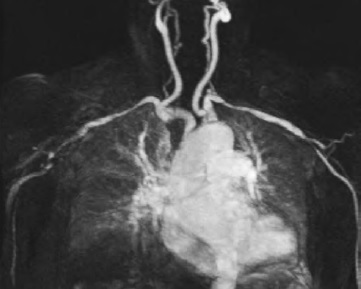
А.Д. Мешков. В рекомендациях EULAR 2018 г. в качестве одного из методов диагностики васкулита с поражением крупных сосудов включена ПЭТ/КТ с 18F-фтордезоксиглюкозой. Характерным для ГКА признаком является накопление радиоактивного препарата в стенке пораженных артерий [45]. В настоящее время обсуждается возможность применения ПЭТ/КТ не только для диагностики, но и оценки активности ГКА [46], хотя последний вопрос остается спорным [47]. Некоторые исследования свидетельствуют о том, что МР-ангиография позволяет лучше оценить распространенность поражения артерий при системном васкулите крупных сосудов, а ПЭТ/КТ более информативна в оценке воспалительной активности [48]. Ограничением ПЭТ/КТ является высокая стоимость, поэтому в нашей стране этот метод чаще используют для подтверждения диагноза, как в нашем наблюдении. В клинике Е.М. Та ре ева ПЭТ была выполнена 23 пациентам с ГКА, 6 из которых уже начали иммуносупрессивную терапию. У 14 из 17 больных, не получавших глюкокортикостероиды, отмечено интенсивное накопление радиофармпрепарата в пораженных сосудах, чаще всего в области грудного (90,9%) и брюшного отделов аорты (68,2%), подключичных артерий (77,3%), общих сонных артерий (77,3%), плечеголовного ствола (36,4%), общих подвздошных (27,3%) и подмышечных (27,3%) артерий. В оставшихся трех случаях интенсивность накопления была ниже [11]. Необходимо учитывать, что накопление 18F-фтордезоксиглюкозы в стенке артерий может наблюдаться не только при воспалении, но и атеросклерозе, что особенно актуально для пациентов с ГКА, который развивается в пожилом или старческом возрасте. Для ГКА характерно диффузное и более интенсивное накопление радиофармпрепарата в стенке крупных артерий, хотя ПЭТ/КТ остается недостаточно стандартизированным методом [49].
С.В. Моисеев. Каковы современные подходы к лечению ГКА?
П.И. Новиков. Для лечения ГКА в настоящее время используют глюкокортикостероиды, иммуносупрессивные препараты (метотрексат, азатиоприн, лефлуномид) и тоцилизумаб [50]. Схему лечения подбирают в зависимости от тяжести течения заболевания, наличия поражения органа зрения и ответа на предыдущую терапию [51]. Стартовая доза глюкокортикостероидов при ГКА составляет 40-60 мг/сут в пересчете на преднизолон [3]. У пациентов с поражением органа зрения лечение обычно начинают с внутривенного введения глюкокортикостероидов в высоких дозах (пульс-терапии) [52]. Длительная терапия глюкокортикостероидами, в том числе в относительно невысоких дозах, у пациентов пожилого и старческого возраста часто сопровождается различными нежелательными эффектами, поэтому глюкокортикостероиды обычно сочетают с иммуносупрессивными препаратами, оказывающими стероидо сберегающее действие. Препаратом выбора является метотрексат, который изучали в трех рандомизированных плацебо-контролируемых исследованиях [53-55]. По данным мета-анализа этих исследований, применение метотрексата в дозе от 7,5 до 15 мг/нед привело к снижению частоты рецидивов ГКА и позволило уменьшить кумулятивную дозу глюкокортикостероидов [56]. В нескольких неконтролируемых исследованиях показана эффективность лефлуномида у пациентов с ГКА [57-60], которая подтверждена также в одном открытом контролируемом исследовании [61]. Эффективность поддерживающей терапии азатиоприном в дозе 150 мг/сут изучалась в небольшом рандомизированном плацебо-контролируемом исследовании у 31 пациента с ГКА [62]. Разница доз глюкокортикостероидов между двумя группами отсутствовала через 36 недель, однако достигла статистической значимости через 52 недели, хотя и была умеренной. В представленном наблюдении мы применяли также гидроксихлорохин 400 мг/сут в дополнение к глюкокортикостероидам. Эффективность этого препарата не была подтверждена в небольшом плацебо-контролируемом исследовании [63], однако исключить возможную пользу гидроксихлорохина нельзя, в том числе учитывая положительный опыт его применения у пациентов с системной красной волчанкой.
При рефрактерном или рецидивирующем течении ГКА могут быть использованы ингибиторы рецепторов интерлейкина (ИЛ)-6, концентрация которого в сыворотке крови резко повышена при этом заболевании [64-66]. Впервые эффективность тоцилизумаба при ГКА была продемонстрирована в исследовании Villiger и соавт. [67]. В многоцентровом, двойном слепом, плацебо-контролируемом 52-недельном исследовании GiACTA была изучена эффективность тоцилизумаба в дозе 162 мг один раз в неделю или в две недели в сочетании с глюкокортикостероидами. Частота достижения полной ремиссии на 52-й неделе составила 53-56% в группах тоцилизумаба и 14-18% в группах плацебо [68]. В другом рандомизированном плацебо-контролируемом исследовании у 161 пациента с ГКА изучали эффективность сирукумаба, однако это исследование было прекращено досрочно [69].
О.О. Бородин. У пациентов с ГКА изучается эффективность и других генно-инженерных препаратов. В частности, у таких больных выявлено увеличение количества регуляторных Т-клеток, продуцирующих ИЛ-17 [70], что послужило основанием для проведения рандомизированного двойного слепого, плацебо-контролируемого исследования секукинумаба, блокирующего действие ИЛ-17А (NCT03765788) [71]. В двойном слепом рандомизированном исследовании у 49 пациентов с ГКА изучали эффективность абатацепта, блокирующего костимуляцию Т-лимфоцитов. Через 12 мес безрецидивная выживаемость составила 48% в группе абатацепта и 31% в группе плацебо (p=0,049) [72]. Полученные данные указывают на перспективность дальнейшего изучения эффективности этого препарата у больных ГКА. Hernandez-Rodriguez и соавт. выявили увеличение тканевой экспрессии мРНК ИЛ-1β, фактора некроза опухоли-альфа (ФНО-α) и ИЛ-6 в образцах височной артерии у 36 пациентов с ГКА [73], однако попытки применения ингибиторов ФНО-α (инфликсимаба, этанерцепта и адалимумаба) для лечения этого заболевания в клинических исследованиях оказались безуспешными [74-77]. Важную роль в патогенезе ГКА играют CD4+ Т-клетки [78], которые дифференцируются в Тх1 и Тх17 клетки, продуцирующие ИФН-γ и ИЛ17, соответственно [79]. Эти цитокины активируют макрофаги, гигантские клетки и гладкомышечные клетки, тем самым способствуя ремоделированию сосудов и развитию ишемических проявлений ГКА [80]. В дифференцировке Тх1 и Тх17 участвуют ИЛ-12 и ИЛ-23, имеющие одну общую субъединицу (p40) [81]. Усте кинумаб – это гуманизированное моноклональное антитело к p40, которое блокирует действие как ИЛ-12, так и ИЛ-23 [82]. В открытом неконтролируемом исследовании показана эффективность устекинумаба в лечении 14 пациентов с рефрактерным течением ГКА [83], что указывает на целесообразность проведения более крупных контролируемых исследований этого препарата. Описаны случаи успешного применения анакинры, блокирующей рецепторы ИЛ-1, у пациентов с рефрактерным ГКА [84]. В плацебо-контролируемом исследовании изучались эффективность и безопасность гевокизумаба – рекомбинантного гуманизированного антитела против ИЛ-1β, однако это исследование не было завершено.
С.В. Моисеев. ГКА – это относительно нередко встре чающийся системный васкулит, развивающийся у людей пожилого и старческого возраста. Типичные проявления ГКА – внезапно развившаяся головная боль, обычно односторонняя, в сочетании с уплотнением и болезненностью височной артерии и лабораторными признаками воспаления (повышением СОЭ и/или содержания СРБ). Реже встречается такаясу-подобный вариант ГКА, характеризующийся преимущественным поражением аорты и крупных ее ветвей. В прошлом для подтверждения диагноза ГКА считали необходимой биопсию височной артерий, однако в настоящее время с этой целью чаще применяют неинвазивные методы визуализации сосудов, в том числе МР- и КТ-ангиографию и ПЭТ/КТ. Основой лечения ГКА остаются глюкокортикостероиды, которые обычно сочетают с иммуносупрессивными препаратами, оказывающими стероидосберегающее действие. В исследовании GiACTA были показаны эффективность и безопасность тоцилизумаба, который стал первым генно-инженерным биологическим препаратом, одобренным для лечения ГКА.
Используемые источники
- Dinkin M, Johnson E. One giant step for giant cell arteritis: Updates in diagnosis and treatment. Curr Treat Options Neurol 2021;23(2):6.
- van der Geest KSM, Sandovici M, Brouwer E, et al. Diagnostic accuracy of symptoms, physical signs, and laboratory tests for giant cell arteritis: A systematic review and meta-analysis. JAMA Intern Med 2020;180(10):1295-304.
- Hellmich B, Agueda A, Monti S, et al. 2018 Update of the EULAR recommendations for the management of large vessel vasculitis. Ann Rheum Dis 2020;79(1):19-30.
- Dejaco C, Duftner C, Buttgereit F, et al. The spectrum of giant cell arteritis and polymyalgia rheumatica: revisiting the concept of the disease. Rheumatology 2017;56(4):506-15.
- Salehi Abari I. 2016 ACR Revised Criteria for Early Diagnosis of Giant Cell (Temporal) Arteritis. Autoimmune Dis 2016;3:119-22.
- İnce B, Artan S, Yalcinkaya Y, et al. Long-term follow-up of 89 patients with giant cell arteritis: a retrospective observational study on disease characteristics, flares and organ damage. Rheumatol Int 2021;41:1-10.
- Gonzalez-Gay MA, Garcia-Porrua C, Amor-Dorado JC, Llorca J. Fever in biopsy-proven giant cell arteritis: Clinical implications in a defined population. Arthritis Care Res (Hoboken) 2004;51(4):652-55.
- Gonzalez-Gay MA, Lopez-Diaz MJ, Barros S, et al. Giant cell arteritis: Laboratory tests at the time of diagnosis in a series of 240 patients. Medicine (Baltimore) 2005;84(5):277-90.
- Czihal M, Tatò F, Förster S, et al. Fever of unknown origin as initial manifestation of large vessel giant cell arteritis: Diagnosis by colour-coded sonography and 18-FDG-PET. Clin Exp Rheumatol 2010;28:549-552.
- Hysa E, Castagna A, Manzo C. Liver involvement in polymyalgia rheumatica and giant cell arteritis. Reumatologia 2020;58(6):444–5.
- Мухин Н.А., Мешков А.Д., Новиков П.И. и др. Гигантоклеточный артериит: клинические проявления и методы ранней диагностики. Клин фармаколтер 2015;24(3):79-85 [Mukhin NA, Meshkov AD, Novikov PI, et al. Giant cell arteritis: clinical manifestations and methods of early diagnosis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2015; 24 (3): 79-85 (In Russ.)].
- Bosnić D, Barešić M, Padjen I, et al. Fever of unknown origin: large vessel vasculitis diagnosed by PET/CT. Rheumatol Int 2013;33(9):2417-21.
- Martins P, Teixeira V, Teixeira FJ, et al. Giant cell arteritis with normal inflammatory markers: case report and review of the literature. Clin Rheumatol 2020;39(10):3115-25.
- Kyle V. Laboratory investigations including liver in polymyalgia rheumatica/giant cell arteritis. Baillieres Clin Rheumatol 1991;5(3):475-84.
- Alba MA, García-Martínez A, Prieto-González S, et al. Relapses in patients with giant cell arteritis: prevalence, characteristics, and associated clinical findings in a longitudinally followed cohort of 106 patients. Medicine (Baltimore) 2014;93(5):194-201.
- Buttgereit F, Dejaco C, Matteson EL, Dasgupta B. Polymyalgia rheumatica and giant cell arteritis: a systematic review. JAMA 2016;315(22):2442-58.
- Gonzalez-Gay M, Ortego-Jurado M, Ercole L, Ortego Centeno N. Giant cell arteritis: is the clinical spectrum of the disease changing? BMC Geriatr 2019;19:200.
- Knockaert DC. Cardiac involvement in systemic inflammatory diseases. Eur Heart J 2007;28(15):1797-804.
- Hunder GG, Bloch DA, Michel BA, et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum 1990;33(8):1122-8.
- Fries JF, Hunder GG, Bloch DA, et al. The American College of Rheumatology 1990 criteria for the classification of vasculitis: Summary. Arthritis Rheum 1990;33(8):1135-6.
- Seeliger B, Sznajd J, Robson JC, et al. Are the 1990 American College of Rheumatology vasculitis classification criteria still valid? Rheumatology (Oxford) 2017;56(7):1154-61.
- Sait M, Lepore M, Kwasnicki R, et al. The 2016 revised ACR criteria for diagnosis of giant cell arteritis – Our case series: Can this avoid unnecessary temporal artery biopsies? Int J Surg 2017;9: 19-23.
- Ponte C, Grayson P, Suppiah R, et al. Classification criteria for large-vessel vasculitis. Rheumatology 2019;58(Suppl 2):1.
- Moiseev S V, Smitienko I, Bulanov N, Novikov PI. The role of temporal artery biopsy in patients with giant-cell arteritis is debated. Ann Rheum Dis 2019;78(4):31.
- Maleszewski JJ, Younge BR, Fritzlen JT, et al. Clinical and pathological evolution of giant cell arteritis: a prospective study of follow-up temporal artery biopsies in 40 treated patients. Mod Pathol 2017;30(6):788-96.
- Ypsilantis E, Courtney ED, Chopra N, et al. Importance of specimen length during temporal artery biopsy. Br J Surg 2011;98:1556-60.
- Grossman C, Ben-Zvi I, Barshack I, Bornstein G. Association between specimen length and diagnostic yield of temporal artery biopsy. Scand J Rheumatol 2017;46(3):222-5.
- Papadakis M, Kaptanis S, Kokkori-Steinbrecher A, et al. Temporal artery biopsy in the diagnosis of giant cell arteritis: Bigger is not always better. Am J Surg 2018;215(4):647-50.
- Luqmani R, Lee E, Singh S, et al. The role of ultrasound compared to biopsy of temporal arteries in the diagnosis and treatment of giant cell arteritis (TABUL): a diagnostic accuracy and cost-effectiveness study. Healh Technol Assess 2016;20(90):313.
- Schmidt WA, Kraft HE, VЪlker L, et al. Colour Doppler sonography to diagnose temporal arteritis. Lancet 1995;345(8953):866.
- Chrysidis S, Duftner C, Dejaco C, et al. Definitions and reliability assessment of elementary ultrasound lesions in giant cell arteritis: a study from the OMERACT Large Vessel Vasculitis Ultrasound Working Group. RMD open 2018;4(1):598.
- SchКfer VS, Juche A, Ramiro S, et al. Ultrasound cut-off values for intima-media thickness of temporal, facial and axillary arteries in giant cell arteritis. Rheumatology 2017;56(9):1479-83.
- Rubenstein E, Maldini C, Gonzalez-Chiappe S, et al. Sensitivity of temporal artery biopsy in the diagnosis of giant cell arteritis: a systematic literature review and meta-analysis. Rheumatology 2020;59(5):1011-20.
- Nielsen BD, Gormsen LC, Hansen IT, et al. Three days of high-dose glucocorticoid treatment attenuates large-vessel 18F-FDG uptake in large-vessel giant cell arteritis but with a limited impact on diagnostic accuracy. Eur J Nucl Med Mol Imaging 2018;45(7):1119-28.
- Schmidt WA, Kraft HE, Vorpahl K, et al. Color duplex ultrasonography in the diagnosis of temporal arteritis. N Engl J Med 1997;337:1336-42.
- Muto G, Yamashita H, Takahashi Y, et al. Large vessel vasculitis in elderly patients: early diagnosis and steroid-response evaluation with FDG-PET/CT and contrast-enhanced CT. Rheumatol Int 2014;34(11):1545-54.
- Fuchs M, Briel M, Daikeler T, et al. The impact of 18F-FDG PET on the management of patients with suspected large vessel vasculitis. Eur J Nucl Med Mol Imaging 2012;39(2):344-53.
- Khan A, Dasgupta B. Imaging in giant cell arteritis. Curr Rheumatol Rep 2015;17(8):52.
- Prieto-González S, Arguis P, García-Martínez A, et al. Large vessel involvement in biopsy-proven giant cell arteritis: prospective study in 40 newly diagnosed patients using CT angiography. Ann Rheum Dis 2012;71:1170-76.
- Lariviere D, Benali K, Coustet B, et al. Positron emission tomography and computed tomography angiography for the diagnosis of giant cell arteritis: A real-life prospective study. Medicine (Baltimore) 2016;95(30):4146.
- Mackie SL, Hensor EMA, Morgan AW, Pease CT. Should I send my patient with previous giant cell arteritis for imaging of the thoracic aorta? A systematic literature review and meta-analysis. Ann Rheum Dis 2014;73(1):143-8.
- Dejaco C, Ramiro S, Duftner C, et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann Rheum Dis 2018;77(5):636-43.
- Seitz L, Wagner F, Christ L, et al. No blood for dark-blood: false-negative MRI in a patient with giant cell arteritis and occluded left temporal artery. Rheumatology 2021;60(4):2025-6.
- Christoph BT, Gregor S, Markus A, et al. The clinical benefit of imaging in the diagnosis and treatment of giant cell arteritis. SWISS Med Wkly 2018;148:46-61.
- Puppo C, Massollo M, Paparo F, et al. Giant cell arteritis: a systematic review of the qualitative and semiquantitative methods to assess vasculitis with 18F-fluorodeoxyglucose positron emission tomography. 2014;57:42-48.
- Novikov PI, Meshkov AD, Moiseev SV. Positron emission tomography in giant cell arteritis: a new diagnostic tool? Ann Rheum Dis. 2014;73(11):70.
- Grayson PC, Alehashemi S, Bagheri AA, et al. (18)F-fluorodeoxyglucose-positron emission tomography as an imaging biomarker in a prospective, longitudinal cohort of patients with large vessel vasculitis. Arthritis Rheumatol (Hoboken) 2018;70(3):439-49.
- Quinn KA, Ahlman MA, Malayeri AA, et al. Comparison of magnetic resonance angiography and (18)F-fluorodeoxyglucose positron emission tomography in large-vessel vasculitis. Ann Rheum Dis 2018;77(8):1165-71.
- Nienhuis PH, van Praagh GD, Glaudemans AWJM, et al. A review on the value of imaging in differentiating between large vessel vasculitis and atherosclerosis. J Pers Med 2021;11(3):236.
- Новиков П.И., Зыкова А.С., Моисеев С.В. Современная терапия системных васкулитов: достижения и перспективы. Терапевтический архив 2018;90(1):76-85. [Novikov PI, Zykova AS, Moiseev SV. The modern therapy of systemic vasculitides: perspectives and challenges. Therapevticheskii archiv 2018;90(1):76-85 (In Russ.)].
- Смитиенко ИО, Новиков ПИ, Мешков АД, Моисеев СВ. Рекомендации по лечению гигантоклеточного артериита французской группы по изучению васкулитов крупных сосудов. Клин фармакол тер 2017;26(5):57-64. [Smitienko IO, Novikov PI, Meshkov AD, Moiseev SV. Management of giant cell arteritis: recommendations of the french study group for large vessel vasculitis. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2017;26(5):57-64 (In Russ.)].
- Mazlumzadeh M, Hunder GG, Easley KA, et al. Treatment of giant cell arteritis using induction therapy with high-dose glucocorticoids: A double-blind, placebocontrolled, randomized prospective clinical trial. Arthritis Rheum 2006;54(10):3310-8.
- Jover JA, Hernandez-García C, Morado IC, et al. Combined treatment of giantcell arteritis with methotrexate and prednisone: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 2001;134(2):106-14.
- Hoffman GS, Cid MC, Hellmann DB, et al. A multicenter, randomized, double-blind, placebo-controlled trial of adjuvant methotrexate treatment for giant cell arteritis. Arthritis Rheum 2002;46(5):1309-18.
- Spiera RF, Mitnick HJ, Kupersmith M, et al. A prospective, double-blind, randomized, placebo controlled trial of methotrexate in the treatment of giant cell arteritis (GCA). Clin Exp Rheumatol 2001;19(5):495-502.
- Mahr AD, Jover JA, Spiera RF, et al. Adjunctive methotrexate for treatment of giant cell arteritis: an individual patient data meta-analysis. Arthritis Rheum 2007;56(8):2789-97.
- Tomelleri A, Coath F, Sebastian A, et al. Long-term efficacy and safety of leflunomide in large-vessel giant cell arteritis: A single-center, 10-year experience. J Clin Rheumatol 2022;28(1):297-300.
- Tengesdal S, Diamantopoulos AP, Myklebust G. Leflunomide versus methotrexate in treatment of giant cell arteritis: comparison of efficacy, safety, and drug survival. Scand J Rheumatol 2019;48(4):333-5.
- Adizie T, Christidis D, Dharmapaliah C, et al. Efficacy and tolerability of leflunomide in difficult-to-treat polymyalgia rheumatica and giant cell arteritis: a case series. Int J Clin Pract 2012;66(9):906-9.
- Diamantopoulos AP, Hetland H, Myklebust G. Leflunomide as a corticosteroidsparing agent in giant cell arteritis and polymyalgia rheumatica: a case series. Biomed Res Int 2013;2013:120638.
- Ho A. Does leflunomide have a role in giant cell arteritis? An open-label study. Clin Rheumatol 2019;38(2):291-6.
- De Silva M, Hazleman BL. Azathioprine in giant cell arteritis/polymyalgia rheumatica: a double-blind study. Ann Rheum Dis 1986;45(2):136-8.
- Sailler L, Lapeyre-Mestre M, Geffray L, et al. Adding hydroxychloroquine to prednisone does not improve the outcome in giant cell arteritis: a double blind randomized controlled trial. Arthritis Rheum 2009;60(Suppl 10):1972.
- Roche NE, Fulbright JW, Wagner AD, et al. Correlation of interleukin-6 production and disease activity in polymyalgia rheumatica and giant cell arteritis. Arthritis Rheum 1993;36(9):1286-94.
- Samson M, Audia S, Fraszczak J, et al. Th1 and Th17 lymphocytes expressing CD161 are implicated in giant cell arteritis and polymyalgia rheumatica pathogenesis. Arthritis Rheum 2012;64(11):3788-98.
- van der Geest KSM, Abdulahad WH, Rutgers A, et al. Serum markers associated with disease activity in giant cell arteritis and polymyalgia rheumatica. Rheumatology 2015;54(8):1397-402.
- Villiger PM, Adler S, Kuchen S, et al. Tocilizumab for induction and maintenance of remission in giant cell arteritis: a phase 2, randomised, double-blind, placebo-controlled trial. Lancet 2016;387:1921-7.
- Stone JH, Tuckwell K, Dimonaco S, et al. Trial of tocilizumab in giant-cell arteritis. N Engl J Med 2017;377(4):317-28.
- Schmidt WA, Dasgupta B, Luqmani R, et al. A multicentre, randomised, doubleblind, placebo-controlled, parallel-group study to evaluate the efficacy and safety of sirukumab in the treatment of giant cell arteritis. Rheumatol Ther 2020;7(4):793-810.
- Miyabe C, Miyabe Y, Strle K, et al. An expanded population of pathogenic regulatory T cells in giant cell arteritis is abrogated by IL-6 blockade therapy. Ann Rheum Dis 2017;76(5):898-905.
- Venhoff N, Schmidt WA, Lamprecht P, et al. Efficacy and safety of secukinumab in patients with giant cell arteritis: study protocol for a randomized, parallel group, double-blind, placebo-controlled phase II trial. Trials 2021;22(1):543.
- Langford CA, Cuthbertson D, Ytterberg SR, et al. A randomized, double-blind trial of abatacept (CTLA-4Ig) for the treatment of giant cell arteritis. Arthritis Rheumatol (Hoboken). 2017;69(4):837-45.
- Hernandez-Rodriguez J, Segarra M, Vilardell C, et al. Tissue production of proinflammatory cytokines (IL-1β, TNFα and IL-6) correlates with the intensity of the systemic inflammatory response and with corticosteroid requirements in giantcell arteritis. Rheumatology 2004;43(3):294-301.
- Salvarani C, Cantini F, Niccoli L, et al. Treatment of refractory polymyalgia rheumatica with infliximab: a pilot study. J Rheumatol 2003;30(4):760-3.
- Cantini F, Niccoli L, Salvarani C, et al. Treatment of longstanding active giant cell arteritis with infliximab: report of four cases. Arthritis Rheum 2001;44(12):2933-35.
- Martinez-Taboada VM, RodrТguez-Valverde V, CarreЦo L, et al. A double-blind placebo controlled trial of etanercept in patients with giant cell arteritis and corticosteroid side effects. Ann Rheum Dis 2008;67(5):625-30.
- Seror R, Baron G, Hachulla E, et al. Adalimumab for steroid sparing in patients with giant-cell arteritis: results of a multicentre randomised controlled trial. Ann Rheum Dis 2014;73(12):2074-81.
- Ma-Krupa W, Jeon M-S, Spoerl S, et al. Activation of arterial wall dendritic cells and breakdown of self-tolerance in giant cell arteritis. J Exp Med 2004;199(2):173-83.
- Terrier B, Geri G, Chaara W, et al. Interleukin-21 modulates Th1 and Th17 responses in giant cell arteritis. Arthritis Rheum 2012;64(6):2001-11.
- Samson M, Corbera-Bellalta M, Audia S, et al. Recent advances in our understanding of giant cell arteritis pathogenesis. Autoimmun Rev 2017;16(8):833-44.
- Weyand CM, Younge BR, Goronzy JJ. IFN-γ and IL-17-the two faces of T cell pathology in giant cell arteritis. Curr Opin Rheumatol 2011;23(1):43.
- Samson M, GhesquiПre T, Berthier S, Bonnotte B. Ustekinumab inhibits Th1 and Th17 polarisation in a patient with giant cell arteritis. Ann Rheum Dis 2018;77(2):6.
- Conway R, O’Neill L, O’Flynn E, et al. Ustekinumab for the treatment of refractory giant cell arteritis. Ann Rheum Dis 2016;75(8):1578-9.
- Ly K-H, Stirnemann J, Liozon E, et al. Interleukin-1 blockade in refractory giant cell arteritis. J Bone Spine 2014;81(1):76-8.
