Поражение центральной нервной системы при болезни Фабри
Скелетно-мышечная боль (СМБ) относится к одной из самых распространенных причин обращения за медицинской помощью. СМБ несет значимое социальное экономическое бремя для системы здравоохранения и общества, так как приводит к снижению трудоспособности взрослого населения. В условиях пандемии COVID-19 у большинства людей снижается физическая активность и возникает стрессовая ситуация, что ассоциировано с повышением числа обострений и хронизации СМБ. В основе лечения СМБ лежит междисциплинарный подход, предполагающий применение немедикаментозных и медикаментозных методов. В статье рассматривается тактика лечения пациентов со СМБ, в частности обсуждаются возможности применения нестероидных противовоспалительных препаратов (НПВП) и результаты клинических исследований по безопасности и эффективности ацеклофенака, который широко используется в России и других странах.
Болезнь Фабри (БФ) – это орфанное заболевание, развивающееся в результате снижения или полного отсутствия активности лизосомного фермента α-галактозидазы А. Ген GLA, кодирующий синтез этого фермента, расположен на Х-хромосоме. Соответственно, у женщин мутантный ген находится в гетерозиготном состоянии, а у мужчин – в гемизиготном, поэтому у женщин активность α-галактозидазы А может быть нормальной, а симптомы заболевания появляются обычно позднее и менее выражены, чем у мужчин [1]. Дефицит активности лизосомного фермента приводит к накоплению гликосфинголипидов, которые вызывают структурное повреждение и нарушение функции клеток, а также развитие воспаления, ишемии, гипертрофии и фиброза. Эти изменения лежат в основе прогрессирующей дисфункции различных внутренних органов, прежде всего почек, сердца и головного мозга [2]. При классическом варианте БФ первые симптомы, такие как нейропатическая боль в кистях и стопах (акропарестезии), ангиокератомы, сниженное потоотделение, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, в то время как после 20 лет отмечается развитие протеинурии, нарастающей хронической почечной недостаточности, прогрессирующей гипертрофии левого желудочка и цереброваскулярных нарушений, которые могут быть причиной инвалидизации и смертности больных.
Поражение мелких сосудов головного мозга при БФ сопровождается появлением очаговых изменений белого вещества, которые могут быть выявлены при магнитно-резонансной томографии (МРТ), в то время как окклюзия более крупных артерий вызывает развитие транзиторных ишемических атак или ишемического инсульта [3]. В случае развития криптогенного инсульта в молодом возрасте необходимо во всех случаях исключать БФ, особенно при наличии типичных ранних симптомов, перечисленных выше, а также поражения почек и сердца. Для подтверждения диагноза БФ определяют активность α-галактозидазы А и глоботриао зилсфингозина (Lyso-GL3) в высушенных пятнах крови и проводят молекулярно-генетическое исследование (в России все эти тесты выполняются бесплатно). Наличие мутации гена GLA является обязательным критерием диагностики БФ, хотя само по себе недостаточно для установления диагноза, так как некоторые мутации этого гена являются непатогенными.
Целью ретроспективного когортного исследования было изучить частоту поражения белого вещества головного мозга по данным МРТ и риск развития инсульта у пациентов с БФ.
Материал и методы
В ретроспективное когортное исследование включали всех пациентов с подтвержденным диагнозом БФ, которые наблюдаются в клинике им. Е.М. Тареева. Критериями диагноза БФ были мутация гена GLA в сочетании со снижением или отсутствием активности α-галактозидазы А (у мужчин) и по крайней мере одним классическим симптомом (нейропатическая боль, ангиокератомы, cornea verticillata) БФ, повышением содержания Lyso-GL3 и/или наличием родственника с определенным диагнозом БФ [4]. Активность α-галактозидазы А и содержание Lyso-GL3 измеряли в высушенных пятнах крови в лабораториях Centogene AG (Росток, Германия), ARCHIMED Life Science GmbH (Вена, Австрия), Медико-генетического научного центра имени академика Н.П. Бочкова и/или Националь ного медицинского исследовательского Центра Здоровья Детей.
дили МРТ головного мозга (Siemens Magnetom Skyra 3 Тесла), при которой оценивали наличие очаговых изменений белого вещества и других признаков поражения. Критерием перенесенного инсульта было развитие в анамнезе очаговых неврологических симптомов, которые сохранялись по крайней мере 24 ч, в сочетании с характерными изменениями при компьютерной томографии или МРТ головного мозга. У всех больных оценивали наличие ранних симптомов БФ (нейропатическая боль, ангиокератомы, сниженное потоотделение, желудочно-кишечные нарушения), поражения почек (альбуминурия/протеинурия, определение сывороточного уровня креатинина с расчетом скорости клубочковой фильтрации [СКФ] по формуле CKD-EPI), сердца (гипертрофия левого желудочка по данным эхокардиографии и/или МРТ сердца) и органа зрения (вихревидная кератопатия). При анализе течения болезни, помимо инсульта, учитывали и другие исходы, включая хроническую почечную недостаточность, требующую лечения диализом или трансплантацию почки, клинически значимые аритмии, хроническую сердечную недостаточность, смерть.
При БФ накопление сфинголипидов в лизосомах клеток головного мозга и других органов начинается после рождения и продолжается на протяжении всей жизни, поэтому мы не рассчитывали частоту инсульта за период наблюдения, а фиксировали возраст, в котором развивалось острое нарушение мозгового кровообращения. По тем же причинам мы не анализировали срок от появления ранних симптомов БФ, т.е. “начала" болезни, до наступления неблагоприятного исхода. К тому же указанные симптомы могли отсутствовать у части больных, особенно женщин. Частоту инсульта и очаговых изменений белого вещества головного мозга изучали отдельно у мужчин и женщин, так как у последних БФ в целом характеризуется более легким течением, так как мутантный ген, сцепленный с Х-хромосомой, находится в гетерозиготном состоянии.
Для количественных переменных рассчитывали медиану и интерквартильный размах, для качественных – частоту в процентах. Количественные переменные сравнивали с помощью U-критерия Манна–Уитни, качественные – с помощью точного метода Фишера. Выживаемость пациентов без инсульта анализировали с помощью метода Каплана-Мейера. Анализ проводили с помощью программы IBM SPSS Statistics 22.
Результаты
Клиническая характеристика пациентов. В исследование были включены 150 взрослых пациентов с БФ, в том числе 98 мужчин и 52 женщины (табл. 1). Мужчины были несколько моложе женщин, однако разница медианы возраста была статистически незначимой. Активность α-галактозидазы А практически у всех мужчин была снижена или отсутствовала, в то время как почти у половины женщин она оказалась нормальной. Патогенные мутации гена GLA были выявлены у всех обследованных пациентов. Примерно в 2/3 случаев определялись миссенс-мутации, реже – нонсенс и другие мутации. Диагноз БФ во всех случаях подтверждался также повышением содержания Lyso-GL3.
| Показатели | Все (n=150) | Мужчины (n=98) | Женщины (n=52) |
|---|---|---|---|
| Возраст на момент обследования, лет | 42,4 (33,0;51,0) | Мужчины (n=98) | Женщины (n=52) |
| Снижение α-галактозидазы А, n (%) | 108/129 (83,7) | 86/89 (96,6) | 22/40 (55,0) |
| Типы мутаций гена GLA, n (%) | |||
| миссенс | 95 (63,3) | 66 (67,3) | 29 (55,7) |
| нонсенс | 25 (16,7) | 14 (14,3) | 11 (21,2) |
| другие | 30 (20,0) | 19 (19,4) | 11 (21,2) |
| Повышение Lyso-GL3, n (%) | 150 (100,0) | 98 (100,0) | 52 (100,0) |
| Ранние симптомы БФ, n (%) | |||
| нейропатическая боль | 111 (74,0) | 76 (77,6) | 35 (67,3) |
| ангиокератомы | 59 (39,3) | 50 (51,0) | 9 (17,3) |
| гипо-/ангидроз | 81 (54,0) | 63 (64,3) | 18 (34,6) |
| желудочно-кишечные нарушения | 42 (28,0) | 33 (33,7) | 9 (17,3) |
| вихревидная кератопатия | 80/126 (63,5) | 45/76 (59,2) | 35/50 (70,0) |
| Поражение внутренних органов, n (%) | |||
| умеренная альбуминурия/протеинурия (А2) | 60 (40,0) | 29 (29,6) | 31 (59,6) |
| выраженная протеинурия (А3) | 26 (17,3) | 19 (19,4) | 7 (13,5) |
| протеинурия нефротического уровня | 9 (6,3) | 6 (6,1) | 3 (5,8) |
| СКФ<60 мл/мин/1,73 м2 | 58 (38,7) | 47 (47,9) | 11 (21,2) |
| гипертрофия левого желудочка | 94 (62,7) | 70 (71,4) | 24 (46,2) |
| катаракта Фабри | 26/126 (20,6) | 25/76 (32,9) | 1/50 (2,0) |
| нейросенсорная тугоухость | 33 (22,0) | 28 (28,6) | 5 (6,1) |
У большинства больных наблюдался классический фенотип БФ, характеризующийся появлением ранних симптомов в детском или подростковом возрасте и более поздним присоединением поражения внутренних органов. Среди ранних симптомов чаще всего встречалась нейропатическая боль (74,0%), частота которой была сопоставимой у мужчин и женщин, хотя у первых акропарестезии были более выраженными и нередко требовали регулярного приема анальгетиков или противосудорожных препаратов (карбамазепина, габапентина). Реже наблюдались ангиокератомы (39,3%) и гипогидроз или ангидроз (54,0%), которые у мужчин отмечались значительно чаще, чем у женщин. Еще одним классическим симптомом БФ, имеющим важное диагностическое значение, является вихревидная кератопатия, которая определяется при осмотре с помощью щелевой лампы. Она была выявлена у 63,5% больных и практически с одинаковой частотой встречалась у мужчин и женщин. Вихревидная кератопатия во всех случаях была диагностирована впервые при поступлении пациентов в клинику, поэтому определить возраст на момент ее развития не представлялось возможным, учитывая бессимптомное течение. В то же время катаракта Фабри наблюдалась у каждого третьего мужчины и только у одной женщины. У большинства больных отмечено поражение почек, проявляющееся альбуминурией/протеинурией и/или снижением расчетной СКФ, и сердца в виде гипертрофии левого желудочка. У мужчин эти изменения была в целом более выраженными, чем у женщин.
| Показатели | Мужчины (n=90) | Женщины (n=48) | ||||
|---|---|---|---|---|---|---|
| Имеются (n=52) |
Отсутствуют (n=38) |
p | Имеются (n=24) |
Отсутствуют (n=24) |
p | |
| Возраст, лет | 45,0 (36,5;52,0) | 34,0 (25,0;39,0) | <0,05 | 54,5 (46,0;65,0) | 33,0 (31,5;39,5) | <0,05 |
| Типы мутаций гена GLA, n (%) | ||||||
| Миссенс | 36 (69,2) | 25 (65,8) | 0,45 | 0,45 | 12 (50,0) | 0,28 |
| Нонсенс | 7 (13,5) | 5 (13,2) | 0,61 | 2 (8,3) | 8 (33,3) | 0,04 |
| Другие | 9 (17,3) | 8 (21,1) | 0,43 | 7 (29,2) | 4 (16,7) | 0,25 |
| Медиана уровня Lyso-GL3 | 80,5 (29,9;97,2) | 69,8 (11,7;108,2) | 0,55 | 7,6 (4,9;12,2) | 6,4 (4,5;9,2) | 0,99 |
| Ранние симптомы БФ, n (%) | ||||||
| Нейропатическая боль | 40 (76,9) | 30 (78,9) | 0,51 | 16 (66,7) | 15 (62,5) | 0,50 |
| Ангиокератомы | 29 (55,8) | 16 (42,1) | 0,14 | 3 (12,5) | 6 (25,0) | 0,23 |
| Гипо-/ангидроз | 35 (67,3) | 23 (60,5) | 0,32 | 9 (37,5) | 7 (29,2) | 0,38 |
| Вихревидная кератопатия | 26 (50,0) | 18 (47,4) | 0,49 | 17 (70,8) | 17 (70,8) | 0,62 |
| Поражение других органов, n (%) | ||||||
| умеренная альбуминурия/протеинурия (А2) | 12 (23,1) | 16 (42,1) | 0,04 | 17 (70,8) | 12 (50,0) | 0,12 |
| выраженная протеинурия (А3) | 11 (21,2) | 7 (18,4) | 0,48 | 4 (16,7) | 3 (12,5) | 0,50 |
| СКФ<60 мл/мин/1,73 м2 | 33 (63,5) | 8 (21,1) | <0,05 | 6 (25,0) | 3 (12,5) | 0,23 |
| гипертрофия левого желудочка | 44 (84,6) | 19 (50,0) | <0,05 | 17 (70,8) | 6 (25,0) | <0,05 |
Частота очаговых изменений белого вещества головного мозга. МРТ головного мозга была выполнена 138 больным с БФ. Бессимптомные очаговые изменения головного мозга были выявлены в целом у 76 (55,1%) пациентов, в том числе у 52 (57,8%) из 90 мужчин и у 24 (50,0%) из 48 женщин (табл. 2). Как мужчины, так и женщины с очаговыми изменениями белого вещества были старше пациентов соответствующего пола, у которых МР-признаки поражения головного мозга отсутствовали. Типы мутаций гена GLA, медиана содержания Lyso-GL3 и частота и характер ранних проявлений БФ между этими подгруппами достоверно не отличались. У большинства мужчин с очаговыми изменениями белого вещества наблюдались гипертрофия левого желудочка и хроническая болезнь почек (ХБП) 3-5 стадии, частота которых была статистически значимо выше, чем у мужчин без МР-признаков поражения головного мозга. Сходные результаты были получены у женщин, хотя разница частоты ХБП 3-5 стадии между двумя подгруппами не достигла статистической значимости, вероятно, вследствие относительно небольшого числа случаев снижения СКФ<60 мл/мин/1,73 м2.
| Показатели | Все (n=150) |
Мужчины (n=98) |
Женщины (n=52) |
|---|---|---|---|
| Инсульт, n (%) | |||
| любой | 29 (19,3) | 24 (24,5) | 5 (9,6) |
| ишемический | 27 (18,0) | 23 (23,5) | 4 (7,7) |
| геморрагический | 1 (0,7) | 1 (1,0) | 0 |
| неуточненный | 1 (0,7) | 0 | 1 (1,9) |
| Повторный инсульт, n (%) | 8 (5,3) | 6 (6,1) | 2 (3,8) |
| Возраст на момент инсульта, | 42,0 | 39,0 | 42,0 |
| лет | (32,0;49,5) | (34,0;47,0) | (33,0;53,0) |
| Инсульт как первый исход, n (%) | 21 (14,0) | 17 (17,3) | 4 (7,7) |
| Инсульт на фоне ФЗТ, n (%) | 3 (2,0) | 3 (3,1) | 0 |
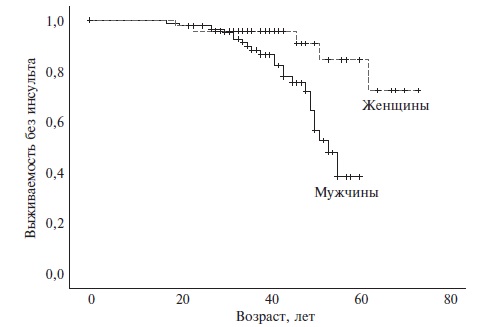
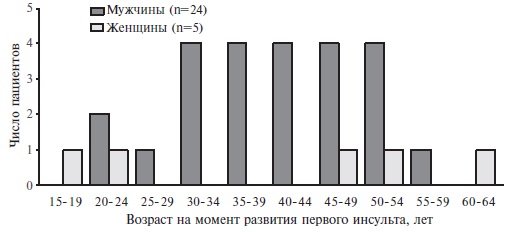
Частота инсульта. Развитие инсульта было отмечено у 29 (19,3%) из 152 больных, в том числе повторного – у 8 (5,3%) (табл. 3). У мужчин частота инсульта была в 2,5 раза выше, чем у женщин (24,5% и 9,6%, соответственно; p=0,02), хотя медиана возраста на момент развития первого острого нарушения мозгового кровообращения была сопоставимой у пациентов разного пола (39,0 и 42,0 лет, соответственно). Выживаемость без инсульта у мужчин и женщин приведена на рис. 1. У 20 (70,0%) из 29 мужчин инсульт развился в возрасте от 30 до 54 лет (рис. 2). В отдельных случаях как у мужчин, так и у женщин развитие острого нарушения мозгового кровообращения отмечалось в возрасте до 30 лет. Практически у всех больных был зарегистрирован ишемический инсульт. У 17 (70,8%) из 24 мужчин и 4 (80,0%) из 5 женщин инсульт был первым неблагоприятным исходом БФ. У 6 (25,0%) из 24 мужчин после перенесенного нарушения мозгового кровообращения сохранялись неврологические нарушения, а 1 (4,2%) пациент умер от инсульта. В то же время у всех 5 женщин какие-либо последствия перенесенного инсульта отсутствовали. Только 3 (10,3%) из 29 больных получали ферментозаместительную терапию на момент развития инсульта.
| Показатели | Перенесшие инсульт (n=29) |
Не перенесшие инсульт (n=121) |
p |
|---|---|---|---|
| Мужчины, n (%) | 24 (82,8) | 74 (61,2) | 0,02 |
| Типы мутаций гена GLA, n (%) | |||
| Миссенс | 18 (62,6) | 77 (63,6) | 0,52 |
| Нонсенс | 5 (17,2) | 20 (16,5) | 0,56 |
| Другие | 6 (20,7) | 24 (19,8) | 0,55 |
| Медиана уровня Lyso-GL3, нг/мл | 52,1 (14,1;116) | 13,5 (6,0;81,9) | <0,05 |
| Ранние симптомы БФ, n (%) | |||
| Нейропатическая боль | 23 (79,3) | 88 (72,7) | 0,32 |
| Ангиокератомы | 16 (55,2) | 43 (35,5) | 0,03 |
| Гипо-/ангидроз | 19 (65,5) | 62 (51,2) | 0,12 |
| Вихревидная кератопатия | 16 (55,2) | 64 (52,9) | 0,49 |
| Поражение других органов, n (%) | |||
| умеренная альбуминурия/протеинурия (А2) | 8 (27,6) | 52 (42,9) | 0,09 |
| выраженная протеинурия (А3) | 9 (31,0) | 17 (14,1) | 0,03 |
| СКФ<60 мл/мин/1,73 м2 | 15 (51,7) | 43 (35,5) | 0,08 |
| диализ/трансплантация почки | 12 (41,4) | 32 (25,4) | 0,09 |
| гипертрофия левого желудочка | 24 (79,3) | 70 (57,9) | <0,05 |
| очаговые изменения головного мозга на МРТ | 22 (75,9) | 54 (44,6) | <0,05 |
| клинически значимые аритмии | 5 (17,2) | 12 (9,9) | 0,21 |
| Смерть, n (%) | 5 (17,2) | 9 (7,4) | 0,11 |
Среди пациентов, перенесших инсульт, доля мужчин была выше, чем среди больных, у которых отсутствовало острое нарушение мозгового кровообращения в анамнезе (табл. 4). Распределение типов мутаций гена GLA существенно не отличалось у пациентов двух групп. Частота ранних симптомов БФ также была сходной, за исключением ангиокератом, которые достоверно чаще встречались у пациентов, перенесших инсульт. В группе пациентов с инсультом в анамнезе была достоверно выше медиана содержания Lyso-GL3, чаще встречались выраженная протеинурия (А3), гипертрофия левого желудочка и очаговые изменения белого вещества головного мозга, а также отмечена тенденция к увеличению частоты снижения СКФ<60 мл/мин/1,73 м2 и хронической почечной недостаточности, требующей заместительной почечной терапии, по сравнению с группой пациентов без инсульта. Смертность у больных инсультом была более чем в 2 раза выше, чем у пациентов без инсульта (17,2% и 7,4%, соответственно), однако разница не достигла статистической значимости.
Обсуждение
К числу самых серьезных неврологических проявлений БФ относится инсульт, чаще ишемический, который в нашей когорте развился у каждого пятого взрослого пациента с этим заболеванием и нередко рецидивировал. У мужчин частота инсульта была статистически значимо выше, чем у женщин (24,5% и 9,6%, соответственно; p=0,02). Практически во всех случаях инсульт развивался в возрасте до 60 лет, причем медиана возраста на момент развития острого нарушения мозгового кровообращения была сопоставимой у мужчин и женщин и составила около 40 лет. В отдельных случаях развитие инсульта было зарегистрировано в возрасте до 30 лет. Мы не анализировали частоту транзиторных ишемических атак у обследованных пациентов, учитывая сложность интерпретации преходящих неврологических расстройств в ретроспективном исследовании.
По данным международного регистра (Fabry Registry), среди 2446 пациентов с БФ частота инсульта была ниже и составила 6,9% у мужчин и 4,3% у женщин [5]. Однако медиана возраста на момент развития острого нарушения мозгового кровообращения была сходной с таковой в нашем исследовании – 39,0 лет у мужчин и 45,7 лет у женщин, причем у каждого пятого пациента инсульт развивался в возрасте до 30 лет. Как и в нашей когорте, у 80% мужчин и 77% женщин инсульт предшествовал развитию других неблагоприятных исходов БФ.
Более высокий риск развития острого нарушения мозгового кровообращения, как и других неблагоприятных исходов, таких как хроническая почечная недостаточность, требующая заместительной почечной терапии, у мужчин отражает более легкое течение БФ у женщин, у которых мутантный ген, расположенный на Х-хромосоме, находится в гетерозиготном состоянии [2]. Тем не менее, результаты нашего исследования подтверждают тот факт, что женщин не следует считать “здоровыми" носительницами мутантного гена, учитывая возможность поражения не только головного мозга, но и других органов. Так, среди обследованных нами пациенток у 67% наблюдалась нейропатическая боль, у 73% – умеренная или выраженная альбуминурия, а у 46% – гипертрофия левого желудочка. Сходные данные были получены и в других исследованиях. Например, среди 1077 женщин, включенных в Fabry Registry, симптомы БФ отмечались в 70% случаев, причем у 19% пациенток наблюдалось снижение СКФ<60 мл/мин/ 1,73 м2, а у 39% – протеинурия [5].
Количество установленных мутаций гена GLA, приводящих к развитию БФ, постоянно увеличивается и в настоящее время превышает 1000. В нашем исследовании практически у всех пробандов выявленные мутации не повторялись, а клинические проявления заболевания у членов одной семьи часто были вариабельными [7]. Соответственно, определенные мутации гена GLA не позволяют предсказать развитие инсульта или других исходов БФ, хотя некоторые мутации ассоциируются с поздним, или атипичным вариантом БФ, который характеризуется достаточно высокой активностью α-галактозидазы А, отсутствием ранних симптомов, поздним началом, обычно в возрасте 40-50 лет, и изолированным или преимущественным поражением одного органа, например, сердца. Примером может служить мутация IVS4+919G>A, которая часто встречается у жителей Тайваня и ассоциируется с развитием поражения сердца [8]. Определенное клиническое значение может иметь тип мутации гена GLA, некоторые из которых приводят к полной утрате функции этого гена, в то время как другие могут не затрагивать активную часть фермента. E. Schaefer и соавт. выявили статистически значимую корреляцию между наличием миссенс и других мутаций и тяжестью БФ [9]. Однако в нашем исследовании распределение типов мутаций было практически одинаковым у пациентов, перенесших и не перенесших инсульт, что указывало на отсутствие зависимости риска развития острого нарушения мозгового кровообращения от типа мутации гена GLA. Частота нейропатической боли, гипогидроза и вихревидной кератопатии достоверно не отличалась между этими группами, хотя ангиокератомы чаще встречались у пациентов с инсультом в анамнезе. Тем не менее, ангиокератомы не следует считать предиктором инсульта у пациентов с БФ, так как частота их была достоверно выше у мужчин, доля которых среди больных, перенесших острое нарушение мозгового кровообращения, превышала процент женщин.
В настоящее время у пациентов с БФ широко определяют содержание гликосфинголипида Lyso-GL3, который накапливается в тканях при снижении активности α-галактозидазы А. Этот биомаркер считают более надежным диагностическим признаком БФ, чем активность фермента, которая нередко остается нормальной у женщин и пациентов с поздним вариантом заболевания. В нашем исследовании активность α-галактозидазы А была нормальной примерно у половины пациенток с БФ, в то время как содержание LysoGL3 в высушенных каплях крови было повышено у всех больных (у мужчин значительно в большей степени, чем у женщин). Результаты некоторых исследований свидетельствуют о том, что более высокий уровень Lyso-GL3 может быть предиктором неблагоприятных исходов БФ. A. Nowak и соавт. анализировали прогностическое значение Lyso-GL3 у 66 больных с БФ [10]. В течение в среднем около 5 лет у 19 (29%) из них было зарегистрировано развитие по крайней мере одного неблагоприятного исхода, в том числе хронической почечной недостаточности, требовавшей заместительной почечной терапии, имплантации искусственного водителя ритма или кардиовертера-дефибриллятора, нарушения мозгового кровообращения или смерти. По данным многофакторного регрессионного анализа, более высокое содержание Lyso-GL3 сопровождалось увеличением риска комбинированной конечной точки в 4,62 раза (95% доверительный интервал 1,55-13,81). В нашем исследовании медиана содержания Lyso-GL3 у пациентов, перенесших инсульт, была в несколько раз выше, чем у больных без острых нарушений мозгового кровообращения в анамнезе. Однако эти данные не позволяют судить о прогностическом значении LysoGL3, учитывая ретроспективный дизайн нашего исследования. Кроме того, высокое содержание Lyso-GL3 у пациентов с инсультом в анамнезе могло частично отражать более высокую долю мужчин в этой группе.
Хотя у большинства обследованных нами больных имелись типичные симптомы БФ, в том числе нейропатическая боль, ангиокератомы и/или сниженное потоотделение, которые появлялись в детском или подростковом возрасте, медиана срока от первых симптомов до установления диагноза составила около 20 лет [7]. При этом примерно у половины пациентов диагноз был установлен в процессе семейного скрининга [11]. При обследовании родственников пробанда необходимо учитывать Х-сцепленный тип наследования БФ, однако отсутствие симптомов у потенциальных носителей мутантного гена, особенно детей и подростков, а также женщин, не является основанием для отказа от молекулярно-генетического исследования, учитывая возможность бессимптомного течения болезни [12]. Пациенты с недиагностированной БФ могут быть выявлены также путем скрининга в группах риска, в частности среди больных инсультом, развившимся в молодом возрасте. Как указано выше, острое нарушение мозгового кровообращения нередко оказывается первым неблагоприятным исходом БФ и является основанием для обследования, направленного на установление причины инсульта. D. Doheny и соавт. провели мета-анализ скрининговых исследований, в которые в целом были включены около 6000 пациентов с инсультом в анамнезе [13]. Частота патогенных мутаций гена GLA составила 0,13% у мужчин и 0,14% у женщин. Необходимо учитывать, что обследование родственников пробандов обычно позволяет выявить еще несколько случаев БФ в семье, что повышает эффективность скрининга в группах риска. Например, в России почти у 2/3 пациентов с БФ диагноз был установлен в результате скрининга, проводившегося в диализ ных отделениях, и последующего молекулярного-генетического обследования родственников выяв ленных больных с БФ [11].
Еще одним признаком поражения головного мозга при БФ являются бессимптомные мелкоочаговые изменения белого вещества головного мозга, которые могут быть выявлены при МРТ. В нашем исследовании они определялись примерно у половины пациентов, причем, в отличие от инсульта, частота очаговых изменений была сходной у мужчин и женщин. Как мужчины, так и женщины с МР-признаками поражения головного мозга были старше пациентов соответствующего пола, у которых очаговые изменения белого вещества отсутствовали. Кроме того, у первых чаще определялись гипертрофия левого желудочка и снижение СКФ<60 мл/мин/1,73 м2. Эти данные указывают на накопление поражения внутренних органов, которое у пациентов с БФ нарастает с возрастом.
По данным мета-анализа 46 исследований, частота очаговых изменений головного мозга в целом у 1276 пациентов с БФ в возрасте в среднем 39 лет была сходной с таковой в нашей когорте и составила 46% [14]. Частота и выраженность МР-изменений были сопоставимыми у мужчин и женщин, хотя пациенты мужского пола на момент обследования были значительно моложе женщин. У четверти пациентов в течение 3 лет наблюдалось прогрессирование поражения головного мозга, а в отдельных исследованиях была выявлена корреляция между наличием очаговых изменений в белом веществе головного мозга и развитием инсульта. В нашем исследовании частота подобных изменений у пациентов, перенесших инсульт, была примерно в 1,5 раза выше, чем у больных без острого нарушения мозгового кровообращения в анамнезе. Однако интерпретировать этот результат ретроспективного исследования сложно, так как МРТ проводилась в различные сроки после инсульта. Хотя очаговые изменения головного мозга, выявленные при МРТ, не сопровождаются явными неврологическими нарушениями, в некоторых исследованиях они коррелировали с ухудшением когнитивной функции [15,16].
Лечение БФ предполагает пожизненное применение рекомбинантных препаратов α-галактозидазы А – агалсидазы альфа (0,2 мг/кг каждые 2 недели) или агалсидазы бета (1 мг/кг каждые 2 недели), эффективность которых доказаны в рандомизированных контролируемых и наблюдательных исследованиях [17-19]. В соответствии с клиническими рекомендациями, одобренными Минздравом РФ в 2019 г., у лиц мужского пола с классическим вариантом БФ ферментозаместительную терапию (ФЗТ) следует начинать сразу после установления диагноза, в то время как у женщин она обоснована при наличии симптомов, ухудшающих качество жизни, или признаков поражения почек, сердца или головного мозга, в частности острого нарушения мозгового кровообращения или очаговых изменений белого вещества [20]. В клинических исследованиях ФЗТ предупреждала или задерживала ухудшение функции почек и нарастание массы миокарда левого желудочка, уменьшала нейропатическую боль и желудочно-кишечные расстройства и улучшала качество жизни пациентов.
Эффективность ФЗТ в профилактике инсульта в рандомизированных контролируемых исследованиях не доказана, что в определенной степени связано с трудностью оценки риска этого неблагоприятного исхода у пациентов с орфанным заболеванием. S. Sheng и соавт. провели мета-анализ 7 когортных исследований и 2 рандомизированных контролируемых исследований в целом у 7513 пациентов с БФ, 1471 из которых получали ФЗТ [21]. Авторы выявили достоверное снижение частоты инсульта у пациентов, получавших ФЗТ, по сравнению с таковой у больных, которым не проводилось патогенетическое лечение (8,2% и 16,0%, соответственно; р=0,03).
Наше исследование имеет определенные ограничения, связанные с его ретроспективным дизайном. В частности, у нас не было возможности оценить прогностическое значение мелкоочаговых изменений белого вещества головного мозга. Мы также не анализировали эффективность ФЗТ у пациентов с БФ, так как большинство из них поступали в клинику для решения вопроса о целесообразности патогенетического лечения. Тем не менее, мы впервые в России проанализировали частоту и характер поражения центральной нервной системы у достаточно большого количества мужчин и женщин с диагнозом БФ.
Заключение
Примерно у половины обследованных нами взрослых пациентов с БФ наблюдались мелкоочаговые изменения белого вещества головного мозга, а у каждого пятого больного было отмечено развитие инсульта в молодом возрасте. У мужчин с БФ частота инсульта была в 2,5 раза выше, чем у женщин, хотя медиана возраста на момент развития острого нарушения мозгового кровобращения у пациентов разного пола была сходной и составила около 40 лет. Результаты нашего исследования подтверждают целесообразность исключения БФ у всех пациентов с криптогенным инсультом, развивающимся в молодом возрасте, особенно в сочетании с поражением других органов, в частности сердца и почек, так как своевременно начатая ФЗТ позволяет улучшить прогноз заболевания.
Используемые источники
- Каратеев А.Е. Болезни костно-мышечной системы в практике 2102 врачей разных специальностей: структура патологии и мнение специалистов об эффективности НПВП (предварительные данные эпидемиологического исследования КОРОНА-2). Consilium medicum 2013;15(9):95-10 [Karateev AE. Diseases of musculoskeletal system in the practice of 2102 physicians: structure and opinion on efficacy of NSAIDs (preliminary results of epidemiological study CORONA-2). Consilium medicum 2013;15(9):95-10 (In Russ.)].
- Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты. Вестник РАМН 2012;(9):54-8 [Yakhno NN, Kukushkin ML. Chronic pain: medico-biologic and socio-economic aspects. Vestnik Rossiiskoi akademii meditsinskikh nauk – Annals of the Russian Academy of Medical Sciences 2012;9:54-8 (In Russ.)].
- Голубев В.Л. Боль – междисциплинарная проблема. Русский медицинский журнал 2008;16(cпец. выпуск):3-7 [Golubev VL. Pain as an interdisciplinary problem. RMJ 2008;16:3-7 (In Russ.)].
- Эрдес Ш.Ф., Дубинина Т.В., Галушко Е.А. Боли в нижней части спины в общеклинической практике. Терапевтический архив 2008;80(5):59-61 [Erdes ShF, Dubinina TV, Galushko EA. Lower back pain in the clinical practice. Terapevticheskii arkhiv 2008;80(5):59-61 (In Russ.)].
- Litwic A, Edwards M, Dennison E, Cooper C. Epidemiology and burden of osteoarthritis. Br Med Bull 2013;105:185-99.
- Millar NL, Murrell GA, McInnes IB. Alarmins in tendinopathy: unravelling new mechanisms in a common disease. Rheumatology (Oxford) 2013;52(5):769-79.
- Hartvigsen J, Hancock MJ, Kongsted A, et al. What low back pain is and why we need to pay attention. Lancet 2018;391:2356–67.
- Ахмеджанова Л.Т., Остроумова Т.М., Солоха О.А. Ведение пациентов с болевыми синдромами на фоне COVID-19. Неврология, нейропсихиатрия, психосоматика 2021;13(5):96–101 [Akhmedzhanova LT, Ostroumova TM, Solokha OA. Management of patients with pain syndromes associated with COVID-19. Neurology, Neuropsychiatry, Psychosomatics 2021;13(5):96-101 (In Russ.)].
- Wang CC, Chao JK, Chang YH, et al. Care for patients with musculoskeletal pain during the COVID-19 pandemic: Physical therapy and rehabilitation suggestions for pain management. J Chin Med Assoc 2020;83(9):822-4.
- Grech S, Borg JN, Cuschieri S. Back pain: An aftermath of Covid-19 pandemic? A Malta perspective. Musculoskeletal Care 2021;10.1002/msc.1574.
- Toprak Celenay S, Karaaslan Y, Mete O, Ozer Kaya D. Coronaphobia, musculoskeletal pain, and sleep quality in stay-at home and continued-working persons during the 3-month Covid-19 pandemic lockdown in Turkey. Chronobiol Int 2020;37(12):1778-85.
- Alshumrani R, Qanash S, Aldobyany A, et al. Sleep quality and mental health in coronavirus disease 2019 patients and general population during the pandemic. Ann Thorac Med 2022;17(1):21-27.
- BКuerle A, Teufel M, Musche V, et al. Increased generalized anxiety, depression and distress during the COVID-19 pandemic: a cross-sectional study in Germany. J Public Health (Oxford) 2020;42(4):672-8.
- Daly M, Robinson E. Depression and anxiety during COVID-19. Lancet 2022; 399(10324):518. 0.
- Насонов Е.Л., Яхно Н.Н., Каратеев А.Е. и др. Общие принципы лечения скелетно-мышечной боли: междисциплинарный консенсус. Научно-практическая ревматология 2016;54(3):247-65 [Nasonov EL, Yakhno NN, Karateev AE, et al. General principles of treatment for musculoskeletal pain: interdisciplinary consensus. Rheumatology Science and Practice 2016;54(3):247-65 (In Russ.)].
- Towheed T, Maxwell L, Judd M, et al. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev 2006;25(1):CD004257.
- Machado G, Maher C, Ferreira P, et al. Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomised placebo controlled trials. BMJ 2015;350:h1225.
- Garcia Rodriguez L, Hernandez-Diaz S. Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti-inflammatory drugs. Epidemiology 2001;12(5):570-6.
- Adams E, Breiner S, Cicero T, et al. A comparison of the abuse liability of tramadol, NSAIDs, and hydrocodone in patients withchronic pain. J Pain Symptom Manage 2006;31(5):465-76.
- Ritvo J, Koonce R, Thurstone C, Causey HL. Tramadol dependence: treatment with buprenorphine/naloxone. Am J Addict 2007;16(1):67-8.
- Trescot A, Helm S, Hansen H, et al. Opioids in the managementof chronic noncancer pain: An update of American Society of the Interventional Pain Physicians' (ASIPP) Guidelines. Pain Physician 2008;Opioids Special Issue 11:5-62.
- Гурак С.В., Парфенов В.А., Борисов К.Н. Мидокалм в комплексной терапии острой поясничной боли. Боль 2006;3:27-30 [Gurak SV, Parfenov VA, Borisov KN. Midocalm in the treatment for acute low back pain. Pain 2006;3:27-30 (In Russ.)].
- Ходинка Л., Меилингер М., Сабо Ж., Залавари И. Лечение острой поясничной боли Мидокалмом. Результаты международного мультицентрового рандомизированного двойного-слепого плацебо-контролируемого клинического исследования. Русский медицинский журнал 2003;(5):246-9 [Khodinka L, Meilinger M, Sabo Zh, Zalavari I. Treatment of acute low back pain with Midocalm: the results of the international, multicenter, randomized, doubleblind, placebo-controlled clinical trial. RMJ 2003;(5):246-9 (In Russ.)].
- Pratzel HG, Alken RG, Ramm S. Efficacy and tolerance of repeated doses of tolperisone hydrochloride in the treatment of painful reflex muscle spasm: results of a prospective placebo-controlled double-blind trial. Pain 1996;67(2-3):417-25.
- Кукушкин М.Л. Современный взгляд на механизм действия Мидокалма. Consilium medicum 2013;15(2):89-94 [Kukushkin ML. Current view on the mechanism of Midocalm action. Consilium medicum 2013;15(2):89-94 (In Russ.)].
- Coombes BK, Bisset L, Vicenzino B. Efficacy and safety of corticosteroid injections and other injections for management of tendinopathy: a systematic review of randomised controlled trials. Lancet 2010;376(9754):1751-67.
- Hameed F, Ihm J. Injectable medications for osteoarthritis. PM&R 2012;4(5Suppl):75-81.
- Oliveira CB, Maher CG, Pinto RZ, et al. Clinical practice guidelines for the management of non-specific low back pain in primary care: an updated overview. Eur Spine J 2018;27(11):2791-803.
- National Institute for Health and Care Excellence (UK). Low back pain and sciatica in over 16s: assessment and management. London; 2016 Nov. Clinical Guidelines. Available at: www.nice.org.uk/guidance/ng5.
- Парфенов В.А., Яхно Н.Н., Давыдов О.С. и др. Хроническая неспецифическая (скелетно-мышечная) поясничная боль. Рекомендации Российского общества по изучению боли (РОИБ). Неврология, нейропсихиатрия, психосоматика 2019;11(2S):7-16 [Parfenov VA, Yakhno NN, Davydov OS, et al. Chronic nonspecific (musculoskeletal) low back pain. Guidelines of the Russian Society for the Study of Pain (RSSP). Neurology, Neuropsychiatry, Psychoso - matics 2019;11(2S):7-16 (In Russ.)].
- Парфенов В.А., Яхно Н.Н., Кукушкин М.Л. и др. Острая неспецифическая (скелетно-мышечная) поясничная боль. Рекомендации Российского общества по изучению боли (РОИБ). Неврология, нейропсихиатрия, психосоматика. 2018;10(2):4-11 [Parfenov VA, Yakhno NN, Kukushkin ML, et al. Acute nonspecific (musculoskeletal) low back pain. Guidelines of the Russian Society for the Study of Pain (RSSP). Neurology, Neuropsychiatry, Psychosomatics 2019; 10(2):4-11 (In Russ.)].
- Хроническая боль и ее лечение в неврологии. В.А. Парфенов, В.А. Головачева. М.: ГЭОТАР-Медиа, 2018, 288 с.
- Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология 2018;56:1-29 [Karateev AE, Nasonov EL, Ivashkin VT, et al. Rational use of nonsteroidal anti-inflammatory drugs. Clinical guidelines. Rheumatology Science and Practice 2018;56:1-29.(In Russ.)].
- Каратеев А.Е. Ацеклофенак в ревматологии: “золотая середина”. Современная ревматология 2013;7(2):88-94 [Karateev AE. Aceclofenac in rheumatology: The golden mean. Modern Rheumatology Journal 2013;7(2):88-94 (In Russ.)].
- Roelofs PD, Deyo RA, Koes BW, et al. Non-steroidal anti-inflammatory drugs for low back pain. Cochrane Database Syst Rev 2008;(1):CD000396.
- Kuritzky L, Samraj GP. Nonsteroidal anti-inflammatory drugs in the treatment of low back pain. J Pain Res 2012;5:579-90.
- Chou R, Deyo R, Friedly J, et al. Systemic pharmacologic therapies for low back pain: a systematic review for an American College of Physicians Clinical Practice Guideline. Ann Intern Med 2017;166(7):480-92.
- Yanagawa A, Kudo T, Shimada J, et al. Endoscopic evaluation of Aceclofenacinduced gastroduodenal mucosal damage: a double-blind comparison with sodium diclofenac and placebo. Jap J Rheum 1998;8:249–59
- Peris F, Bird HA, Serni U et al., Treatment compliance and safety of aceclofenac versus standard NSAIDs in patients with common arthritic disorders: a metaanalysis. Eur J Rheum lnflam 1996;16:37-45.
- Grau M, Guasch J, Montero J, et al. Pharmacology of the potent new nonsteroidal anti-inflammatory agent aceclofenac. Arzneimittelforschung 1991;41(12):1265–76.
- Lanas A, García-RodrТguez LA, Arroyo MT, et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut 2006;55(12):1731-8.
- Reginster J, Paul I, Henrotin Y. What is the role of aceclofenac in the therapeutic arsenal against chronic osteoarthritis pathologies? Rev Med Liege 2001;56(7):484–8.
- Hinz B, Rau T, Auge1 D, et al. Aceclofenac spares cyclooxygenase 1 as a result of limited but sustained biotransformation to diclofenac. Clin Pharmacol Ther 2003;74:222–35.
- Legrand E. Aceclofenac in the management of inflammatory pain. Exp Opion Pharmacother 2004;5(6):1347–57.
- Saraf S. Aceclofenac: a potent non-steroidal anti-inflammatory drug in latest reviews. Latest Rev 2006;4(3).
- Dingle J. The effects of NSAID on the matrix of human articular cartilages. Z Rheum 1999;58(3):125–9.
- Blot L, Marcelis A, Devogelaer J, Manicourt D. Effects of diclofenac, aceclofenac and meloxicam on the metabolismof proteoglycans and hyaluronan inosteoarthritic human cartilage. Br J Pharmacol 2000;131(7):1413–21.
- Laporte JR, IbЗЦez L, Vidal X, et al. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Saf 2004;27(6):411-20.
- Castellsague J, Riera-Guardia N, Calingaert B, et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project). Drug Saf 2012;35(12):1127–46.
- Helin-Salmivaara A, Virtanen A, Vesalainen R, et al. NSAID use and the risk of hospitalization for first myocardial infarction in the general population: a nation wide case-control study from Finland. Eur Heart J 2006;27(14):1657–63.
- Каратеев А.Е., Денисов Л.Н., Маркелова Е.И. и др. Результаты клинического исследования АЭРОПЛАН (анализ эффективности и риска осложнений при лечении артрита ацеклофенаком и нимесулидом). Consilium Medicum 2013;15(2):52-7 [Karateev AE, Denisov LN, Markelova EI, et al. Results of AEROPLAN clinical trial. Consilium Medicum 2013;15(2):52-7 (In Russ.)].
- Гонтаренко Н.В., Цурган А.В., Каратеев А.Е. Лечение острой/подострой скелетно-мышечной боли с использованием алгоритма пошагового выбора назначения и контроля эффективности анальгетических средств. Предварительные данные программы АЛИСА (Анальгетическое лечение с использованием системного алгоритма). Современная ревматология 2016;10(4):35-40 [Gontarenko NV, Tsurgan AV, Karateev AE. Treatment for acute/subacute musculoskeleat pain using an algorithm for stepwise choice of analgesic drugs and for monitoring their efficacy. Modern Rheumatology Journal 2016;10(4):35-40. (In Russ.)].
- Каратеев А.Е., Цурган А.В. Ацеклофенак: опыт российских исследований. Современная ревматология 2017;11(4):89-94 [Karateev AE, Tsurgan AV. Ace - clofenac: the experience of Russian studies. Modern Rheumatology Journal. 2017;11(4):89-94 (In Russ.)].
- Yang JH, Suk KS, Lee BH, et al. Efficacy and safety of different aceclofenac treatments for chronic lower back pain: prospective, randomized, single center, open-label clinical trials. Yonsei Med J 2017;58(3):637-43.
- Schattenkirchner M, Milachowski KA. A double-blind, multicentre, randomised clinical trial comparing the efficacy and tolerability of aceclofenac with diclofenac resinate in patients with acute low back pain. Clin Rheumatol 2003;22(2):127-35.
- Dooley M, Spencer CM, Dunn CJ. Aceclofenac: a reappraisal of its use in the management of pain and rheumatic disease. Drugs 2001;61(9):1351-78.
- Lemmel EM, Leeb B, De Bast J, Aslanidis S. Patient and physician satisfaction with aceclofenac: results of the European Observational Cohort Study (experience with aceclofenac for inflammatory pain in daily practice). Aceclofenac is the treatment of choice for patients and physicians in the management of inflammatory pain. Curr Med Res Opin 2002;18(3):146-53.
- Насонова В.А. Ацеклофенак (аэртал) в ревматологической практике. Терапевтический архив 2005;77(5):87–90 [Nasonova VA. Aceclofenac (Aertal) in rheumatology practice. Terapevticheskii arkhiv 2005;77(3):87-90 (In Russ.)].
