Тофацитиниб в лечении анкилозирующего спондилита
Тофацитиниб относится к группе таргетных синтетических базисных противовоспалительных препаратов, которые применяют для лечения ревматоидного артрита и других ревматических заболеваний. Препараты этой группы блокируют сигнальную систему JAK/STAT, опосредующую действие различных цитокинов, в том числе интерлейкинов 17, 21 и 23, которые играют важную роль в патогенезе анкилозирующего спондилита (АС). В 48-недельном двойном слепом, рандомизированном, плацебо-контролируемом исследовании 3 фазы тофацитиниб в дозе 5 мг два раза в сутки у пациентов с активным АС по первичному показателю эффективности (частоте ответа по критериям ASAS 20) достоверно превосходил плацебо. Преимущества препарата перед плацебо были подтверждены и при анализе частоты более выраженного ответа по критериям ASAS (ASAS 40) и других вторичных показателей эффективности, отражающих активность АС, подвижность в позвоночнике и качество жизни. Действие тофацитиниба начиналось быстро и сохранялось до конца 48-недельного исследования. На основании полученных данных тофацитиниб был одобрен для лечения активного АС у взрослых пациентов при недостаточной эффективности нестероидных противовоспалительных препаратов.
Анкилозирующий спондилит (АС) – это хроническое воспалительное заболевание, характеризующееся преимущественным поражением позвоночника и крестцово-подвздошных сочленений [1,2]. Модифицированные нью-йоркские критерии диагностики АС, помимо типичных клинических проявлений (хроническая боль в спине, уменьшающаяся при физической нагрузке, ограничение движений в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях и/или ограничение дыхательной экскурсии грудной клетки), предполагают наличие рентгенологических признаков сакроилиита по крайней мере 2 степени при двустороннем поражении или 3-4 степени при вовлечении одного крестцово-подвздошного сустава [3]. На более поздних этапах развития заболевания определяются и структурные изменения в позвоночнике (синдесмофиты). В первые несколько лет после появления симптомов аксиального спондилоартрита (СпА) по крайней мере у половины пациентов рентгенологические признаки определенного сакроилиита отсутствуют [4], что послужило основанием для выделения нерентгенологического аксиального СпА, классификационные критерии которого включают в себя хроническую боль в спине, развившуюся в возрасте до 45 лет и сохраняющуюся ≥3 мес, и признаки активного воспаления крестцово-подвздошных суставах при магнитнорезонансной томографии – МРТ (отек костного мозга в прилежащих к суставу костях) [5]. Нерентгенологический аксиальный СпА может быть диагностирован и при отсутствии МР-признаков сакроилиита, если у пациента с хронической болью в спине определяется HLA-B27 и имеются еще по крайней мере два признака СпА, такие как воспалительный характер боли в спине, артрит периферических суставов, энтезит, дактилит, увеит, псориаз и др. Необходимо отметить, что в России для диагностики АС допускается применение МРТ при отсутствии достоверных рентгенологических признаков сакроилиита [6].
Основа лечения аксиального АС – физические упражнения и регулярный прием неселективных нестероидных противовоспалительных препаратов (НПВП) или селективных ингибиторов циклооксигеназы-2, которые обладают сопоставимыми эффективностью и безопасностью [7,8]. В отличие от ревматоидного артрита, стандартные базисные противовоспалительные препараты (БПВП), такие как метотрексат и лефлуномид, а также глюкокортикостероиды при аксиальном СпА не эффективны, хотя сульфасалазин может использоваться при наличии поражения периферических суставов [10]. В клинической практике больным АС с высокой активностью воспалительного процесса иногда назначают пульс-терапию высокими дозами глюкокортикостероидов, хотя в международных рекомендациях применение этих препаратов не рекомендуется. При недостаточной эффективности НПВП применяют ингибиторы фактора некроза опухоли-a (ФНО) или интерлейкина (ИЛ)-17 (секукинумаб, иксекизумаб), которые позволяют достичь ответа на лечение примерно у 60-65% больных АС.
Все генно-инженерные биологические препараты (ГИБП) представляют собой моноклональные антитела или растворимые рецепторы, т.е. белковые молекулы, которые предназначены для парентерального введения и могут вызывать образование антител, в том числе нейтрализующих, и инъекционные реакции. Альтернативой ГИБП могут служить ингибиторы янускиназ, в частности тофацитиниб, который зарегистрирован для лечения активного АС в Российской Федерации и других странах. Ингибиторы янус-киназ – это пероральные таргетные синтетические БПВП, которые подавляют внутриклеточную систему JAK/STAT, опосредующую эффекты различных цитокинов, в том числе ИЛ-17, и других молекул [10]. Тофацитиниб, ингибирующий JAK1, JAK2 и JAK3 и в меньшей степени тирозинкиназу 2 (TYK2), стал первым препаратом этой группы и в настоящее время применяется для лечения ревматоидного артрита, псориатического артрита, псориаза и язвенного колита. Ниже обсуждаются результаты рандомизированных контролируемых исследований, подтвердивших эффективность и благоприятный профиль безопасности тофацитиниба у больных АС.
Исследование 2 фазы
Целью 16-недельного многоцентрового, рандомизированного, двойного слепого, плацебо-контролируемого исследования 2 фазы было изучение эффективности и безопасности различных доз тофацитиниба (2, 5 и 10 мг два раза в сутки) у взрослых больных активным АС, диагностированным на основании модифицированных нью-йоркских критериев [11]. В исследование были включены 207 пациентов с АС, у которых определялись признаки активности заболевания (счет BASDAI ≥4 и счет боли в спине по визуальной аналоговой шкале ≥4) несмотря на лечение по крайней мере двумя НПВП. Более 2/3 больных составили мужчины в возрасте в среднем около 40 лет. Терапия любыми ГИБП, в том числе в анамнезе, была критерием исключения, в то время как прием метотрексата, сульфасалазина и глюкокортикостероидов в стабильных дозах (α10 мг/сут в пересчете на преднизолон) во время исследования допускался. Первичным показателем эффективности было улучшение на 20% по критериям Международной ассоциации по изучению СпА (ASAS 20). Кроме того, эффективность препарата изучали на основании различных вторичных критериев, в том числе ASAS 40, ASAS 5/6, ASDAS, BASDAI 50 и др., а также динамики качества жизни, которое оценивали с помощью опросников ASQoL, EQ-5D и SF-36. Для статистического анализа использовали Emax модель, позволяющую оценить зависимость ответа от дозы во всей выборке, т.е. у больных, получивших по крайней мере одну дозу тофацитиниба.
Пациенты были рандомизированы на 4 сопоставимые группы и получали тофацитиниб в трех дозах или плацебо в течение 12 недель. По данным моделирования, ожидаемая частота ответа по критериям ASAS 20 при применении плацебо и тофацитиниба в дозе 2 мг два раза в сутки составила 40,1% и 56,0%, соответственно, а при лечении тофацитинибом в дозах 5 и 10 мг два раза в сутки – 63,0% и 67,4%. Фактическая частота ответа по критериям ASAS 20 была самой высокой в группе тофацитиниба 5 мг два раза в сутки и достоверно превышала таковую в группе плацебо. По ряду вторичных показателей эффективности, в том числе частоте ответа по критериям ASAS 40, ASAS 5/6 и BASDAI 50 и частоте достижения клинически значимого улучшения по критериям ASDAS, тофацитиниб в дозах 5 и 10 мг два раза в сутки достоверно превосходил плацебо (табл. 1). Лечение тофацитинибом привело к более выраженному улучшению мобильности (EQ-5D), показателей качества жизни (ASQoL, физический компонент SF-36), усталости (FACIT-F) и работоспособности. Эффективность тофацитиниба была выше у пациентов, у которых содержание С-реактивного белка (СРБ) превышало верхнюю границу нормы. При анализе некоторых показателей достоверного улучшения по сравнению с плацебо или зависимости ответа от дозы выявлено не было, что могло объясняться относительно небольшой выборкой исследования и неожиданно высокой частотой ответа на прием плацебо. Результаты исследования 2 фазы обосновали дальнейшее изучение эффективности и профиля безопасности тофацитиниба в исследованиях 3 фазы.
| Критерии ответа | Плацебо(n=51) | Тофацитиниб | ||
|---|---|---|---|---|
| 2 мг(n=52) | 5 мг(n=52) | 10 мг(n=52) | ||
| Примечание: *p≤0,05, **p≤0,01, ***p≤0,001 по сравнению с плацебо | ||||
| ASAS 20 | 41,2 | 51,9 | 80,8*** | 55,8 |
| ASAS 40 | 19,6 | 42,3* | 46,2** | 38,5* |
| BASDAI 50 | 23,5 | 46,2* | 42,3* | 42,3* |
| ASAS 5/6 | 15,7 | 19,2 | 50,0*** | 38,5** |
| ASAS частичная ремиссия | 11,8 | 17,3 | 19,2* | 15,4 |
| ASDAS | ||||
| Клин. значимое улучшение | 27,5 | 51,9** | 63,5*** | 55,8** |
| Выраженный ответ | 11,8 | 19,2 | 23,1 | 25,0 |
| Ремиссия (<1,3) | 7,8 | 13,5 | 13,5 | 15,4 |
| Низкая активность (<2,1) | 19,6 | 40,4* | 53,9*** | 36,5 |
Исследование 3 фазы
Рандомизированное, двойное слепое, плацебо-контролируемое исследование тофацитиниба в дозе 5 мг два раза в сутки проводилось в 75 центрах в 14 странах [12]. Критерии включения соответствовали таковым в исследовании 2 фазы: возраст ≥18 лет, диагноз АС, подтвержденный при рентгенографии, активность заболевания (счет BASDAI ≥4 и счет боли в спине ≥4) и недостаточная эффективность по крайней мере двух НПВП. Предполагалось, что около 20% пациентов, включенных в исследование, будут иметь опыт применения ингибиторов ФНО-a или других ГИБП. Во время исследования разрешалось продолжить лечение другими препаратами в стабильных дозах, в том числе НПВП, метотрексатом, сульфасалазином и пероральными глюкокортикостероидами. Исследование состояло из 16-недельной двойной слепой фазы и 32-недельной открытой фазы, во время которой пациентов группы плацебо переводили на прием тофацитиниба в дозе 5 мг два раза в сутки, а больные основной группы продолжали ранее начатое лечение ингибитором янус-киназ. Первичным и основным вторичным показателями эффективности была частота ответа по критериям ASAS 20 и ASAS 40 через 16 недель, соответственно. В различные сроки во время исследования анализировали также другие показатели эффективности, отражающие динамику активности заболевания, подвижности, функциональной активности и качества жизни.
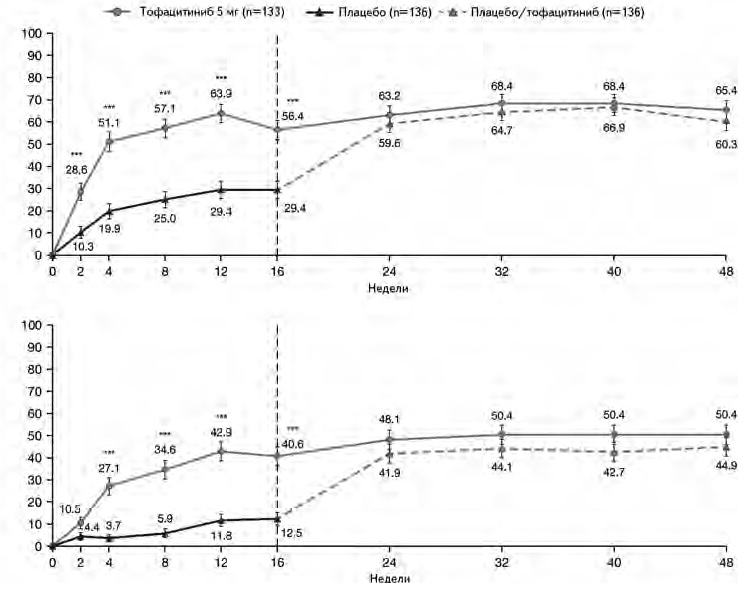
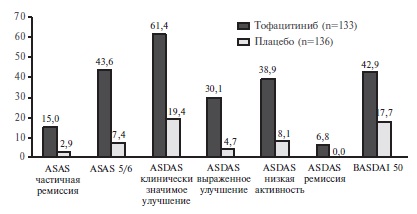
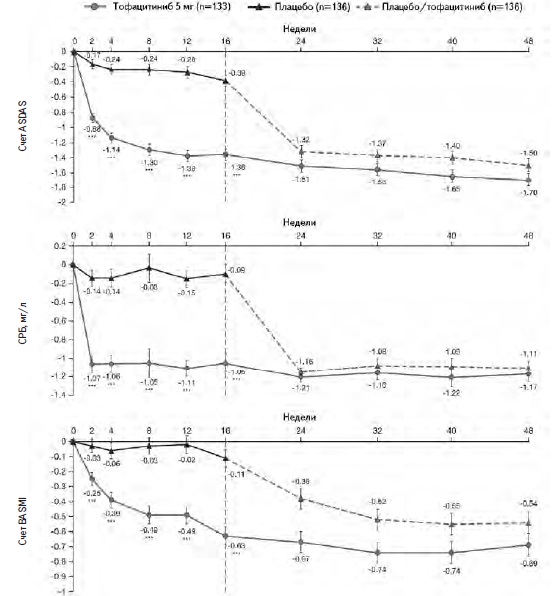
В исследование были включены 270 взрослых пациентов с активным АС, преимущественно мужчины в возрасте в среднем около 40 лет. У большинства из них определялся HLA-B27. У всех больных отмечалась высокая активность АС, в частности средний счет ASDAS составлял около 3,8, а средний счет BASDAI – 6,9. У 23% больных ранее проводилась терапия не только НПВП, но и ГИБП, которая не позволила достичь необходимого ответа. Пациентов рандомизировали на группы тофацитиниба и плацебо, сопоставимые по демографическим и клиническим показателям (табл. 2). Через 16 недель по первичному критерию эффективности – частоте ответа по критериям ASAS 20 – тофацитиниб достоверно превосходил плацебо: 56,4% и 29,4%, соответственно (p<0,0001; рис. 1). Частота более выраженного ответа (ASAS 40) в группе тофацитиниба также была статистически значимо выше, чем в группе плацебо: 40,6% и 12,5%, соответственно (p<0,0001). Сходные результаты были получены в выборках пациентов, получавших или не получавших ГИБП до начала исследования. Действие тофацитиниба начиналось быстро, а значительное увеличение частоты ответа по критериям ASAS 20 в основной группе было отмечено уже через 2 недели после начала лечения (рис. 1). Эффективность тофацитиниба подтверждалась при анализе частоты достижения клинического ответа, низкой активности или ремиссии АС, которую оценивали на основании различных критериев (рис. 2). Кроме того, лечение тофацитинибом привело к снижению счета ASDAS, содержания СРБ, улучшению качества жизни (ASQoL, SF-36), увеличению подвижности позвоночника (BASMI) и уменьшению усталости (FACIT-F) (рис. 3).
| Тофацитиниб (n=133) |
Плацебо (n=136) |
|
|---|---|---|
| Мужчины, n (%) | 116 (87,2) | 108 (79,4) |
| Средний возраст, лет | 42,2±11,9 | 40,0±11,1 |
| Длительность АС, лет | 14,2±9,8 | 12,9±9,5 |
| Системные проявления, n (%) | ||
| Увеит | 22 (16,5) | 20 (14,7) |
| Псориаз | 5 (3,8) | 3 (2,2) |
| Воспалительное заболевание кишечника | 1 (0,8) | 2 (1,5) |
| Периферический артрит | 21 (15,8) | 25 (18,4) |
| HLA-B27, n (%) | 117 (88,0) | 118 (86,8) |
| СРБ >5 мг/л, n (%) | 92 (69,2) | 103 (75,7) |
| ASDAS | 3,8±0,8 | 3,9±0,8 |
| BASDAI | 6,4±1,5 | 6,5±1,4 |
| Счет боли в спине | 6,9±1,5 | 6,9±1,6 |
| ГИБП в анамнезе, n (%) | 31 (23,3) | 31 (22,8) |
| Сопутствующая терапия, n (%) | ||
| НПВП | 106 (79,7) | 108 (79,4) |
| Пероральные кортикостероиды | 13 (9,8) | 7 (5,1) |
| Метотрексат | 5 (3,8) | 13 (9,6) |
| Сульфасалазин | 24 (18,0) | 31 (22,8) |
Во время открытой фазы исследования все пациенты, в том числе группы плацебо, получали тофацитиниб в дозе 5 мг два раза в сутки. У больных основной группы, продолживших прием ингибитора янус-киназ, достигнутый ответ на лечение сохранялся, в то время как у пациентов контрольной группы после перехода с плацебо на тофацитиниб наблюдалось быстрое и значительное снижение показателей активности АС, которые к концу 48-недельного исследования соответствовали таковым в основной группе. Так, частота ответа по критериям ASAS 20 через 48 недель в основной и контрольной группах составила 65,4% и 60,3%, соответственно, а по критериям ASAS 40 – 50,4% и 44,9%.
Безопасность тофацитиниба у больных АС
Переносимость тофацитиниба в исследовании 3 фазы была хорошей. Во время 48-недельного исследования не были зарегистрированы случаи смерти, злокачественных опухолей, сердечно-сосудистых событий, венозных тромбоэмболических осложнений, перфорации желудочно-кишечного тракта или лекарственного повреждения печени. Основными нежелательными явлениями были инфекции верхних дыхательных путей, назофарингит и диарея, однако их частота достоверно не отличалась от таковой в группе плацебо. Количество больных, включенных в клиническое исследование, и длительность лечения были недостаточными для адекватной оценки профиля безопасности тофацитиниба у пациентов с АС. Однако безопасность тофацитиниба хорошо изучена у больных ревматоидным артритом, в том числе в длительных открытых исследованиях, которые проводились в продолжение регистрационных исследований. Профиль безопасности тофацитиниба и других ингибиторов янус-киназ подробно рассмотрен в нашей предыдущей публикации [10].
Место тофацитиниба в лечении АС
За последние годы показания к назначению тофацитиниба постепенно расширяются. Первоначально эффективность этого препарата была продемонстрирована у пациентов с ревматоидным артритом, причем накопление опыта его применения не только в клинических исследованиях, но и в обычной практике, позволило рассматривать тофацитиниб и другие ингибиторы янускиназ как препараты не третьей, а второй линии, т.е. как альтернативу ГИБП при отсутствии необходимого ответа на лечение стандартными БПВП. Позднее применение тофацитиниба было одобрено для лечения псориатического артрита, псориаза и язвенного колита. Тофацитиниб блокирует сигнальную систему, опосредующую действие различных цитокинов, в том числе ИЛ-17, ИЛ-21 и ИЛ-23, которые играют важную роль в патогенезе АС [13,14]. Экспериментальные данные, а также эффективность тофацитиниба при других ревматических заболеваниях послужили основанием для изучения его эффективности и безопасности у пациентов с АС.
В рандомизированном, двойном слепом, плацебоконтролируемом исследовании 3 фазы у взрослых пациентов с активным АС тофацитиниб в дозе 5 мг/сут достоверно превосходил плацебо как по первичному (частоте ответа по критериям ASAS 20 через 16 недель), так и вторичным показателям эффективности, отражающим активность заболевания, степень ограничения подвижности в позвоночнике, функциональную активность и качество жизни. Клинический эффект препарата проявлялся уже через 8 недель после начала лечения (при первом визите после исходного) и сохранялся до конца 48-недельного исследования. В клиническое исследование 3 фазы включали не только пациентов, не ответивших на лечение по крайней мере двумя НПВП, но и больных, имевших опыт применения ингибиторов ФНО-a и других ГИБП. В этих выборках тофацитиниб также имел преимущество перед плацебо, хотя эффективность лечения была ожидаемо несколько ниже у пациентов, которые ранее получали ГИБП. Полу ченные данные согласуются с результатами исследований других ингибиторов янус-киназ, в том числе упадацитиниба (исследование SELECT-AXIS 1) и филготиниба (исследование TORTUGA), у пациентов с АС [15,16].
Когда назначать тофацитиниб больным АС? АС обычно развивается в молодом возрасте, но характеризуется медленным прогрессированием, поэтому пациенты часто на протяжении многих лет сохраняют достаточно высокую функциональную активность на фоне регулярных физических упражнений и приема НПВП. Стандартные БПВП не оказывают влияния на аксиальные проявления АС, однако эти препараты могут быть использованы при наличии системных проявлений заболевания, например, сульфасалазин обычно назначают при наличии периферического артрита. Необходимость в модификации терапии возникает, если пациент с активным АС не отвечает на лечение по крайней мере двумя НПВП в адекватных дозах. В таких случаях могут быть назначены не только ингибиторы ФНО-a или ИЛ-17, но и тофацитиниб. Допол нительным доводом в пользу “усиления" терапии считают повышение содержания СРБ [7]. В исследовании 2 фазы эффективность тофацитиниба была несколько выше у пациентов с высоким уровнем этого маркера воспаления, в то время как в исследовании 3 фазы результаты лечения в зависимости от содержания СРБ специально не анализировали. Необходимо отметить, что в этом исследовании у 28% пациентов содержание СРБ не превышало верхнюю границу нормы. Кроме того, увеличение уровня СРБ не является обязательным признаком при решении вопроса о модификации терапии. Последнее принимается на основании сохранения боли в спине и высокого счета BASDAI и/или ASDAS, которые указывают на активность заболевания.
Заключение
Результаты двойного слепого, плацебо-контролируемого исследования 3 фазы у больных активным АС, у которых лечение НПВП не позволяло достичь необходимого ответа, показали, что тофацитиниб в дозе 5 мг два раза в сутки по эффективности достоверно превосходит плацебо и вызывает быстрое и стойкое уменьшение активности заболевания и улучшение других показателей, отражающих ограничение подвижности в позвоночнике и функциональной активности. Приведенные данные свидетельствуют о том, что тофацитиниб может быть использован в качестве альтернативы ГИБП при недостаточной эффективности НПВП или плохой их переносимости.
Используемые источники
- Эрдес Ш.Ф. Развитие концепции спондилоартритов. Научно-практическая ревматология. 2014;52(5):474–6 [Erdes ShF. Spondyloarthritis: Evolution of a concept. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice 2014;52(5):474–6 (In Russ.)].
- Моисеев С.В., Новиков, П.И., Гуляеев С.В. и др. Анкилозирующий спондилит: подходы к диагностике и клиническая эффективность упадацитиниба. Клин фармакол тер 2021;30(4):62-70 [Moiseev S, Novikov P, Gulyaev S, et al. Ankylosing spondylitis: diagnostic challenges and efficacy of upadacitinib. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):62-70 (In Russ.)].
- van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum1984;27:361–8.
- Poddubnyy D, Brandt H, Vahldiek J, et al. The frequency of non-radiographic axial spondyloarthritis in relation to symptom duration in patients referred because of chronic back pain: results from the Berlin early spondyloarthritis clinic. Ann Rheum Dis 2012;71:1998–2001.
- Rudwaleit M, van der Heijde D, Landewe Ret al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis 2011;70:25–31.
- Общероссийская общественная организация Ассоциация ревматологов России. Федеральные клинические рекомендации по диагностике и лечению анкилозирующего спондилита (болезнь Бехтерева). Москва, 2013 г.
- van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017;76:978–91.
- Ward MM, Deodhar A, Gensler LS, et al. 2019 update of the American College of Rheumatology/Spondylitis association of America/Spondyloarthritis research and treatment network recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis. Arthritis Rheumatol 2019;71:1599–613.
- Regel A, Sepriano A, Baraliakos X, et al. Efficacy and safety of non-pharmacological and non-biological pharmacological treatment: a systematic literature review Informing the 2016 update of the ASAS/EULAR recommendations for the management of axial spondyloarthritis. RMD Open 2017;3:e000397.
- Новиков П.И., Шевцова Т.П., Щеголева Е.М., Моисеев С.В. Ингибиторы янус-киназ: фармакологические свойства и сравнительные клиническая эффективность и безопасность. Клин фармакол тер 2021;30(1):51-60 [Novikov P, Shevtsova T, Shchegoleva E, Moiseev S. JAK-inhibitors: pharmacological properties and comparative clinical efficacy and safety. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(1):51-60 (In Russ.)].
- van der Heijde D, Deodhar A, Wei JC, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16-week, randomised, placebo-controlled, dose-ranging study. Ann Rheum Dis 2017;76:1340–7.
- Deodhar A, Sliwinska-Stanczyk P, Xu H, et al. Tofacitinib for the treatment of ankylosing spondylitis: a phase III, randomised, double-blind, placebo-controlled study. Ann Rheum Dis 2021;80(8):1004–13.
- Sherlock JP, Cua DJ. Interleukin-23: a promising therapeutic target in seronegative spondyloarthropathy. Curr Opin Pharmacol 2013;13:445–8.
- Liu W, Wu YH, Zhang L, et al. Elevated serum levels of IL-6 and IL-17 may associate with the development of ankylosing spondylitis. Int J Clin Exp Med 2015;8:17362–76.
- van der Heijde D, Song I-H, Pangan AL, et al. Efficacy and safety of upadacitinib in patients with active ankylosing spondylitis (SELECT-AXIS 1): a multicentre, randomised, double-blind, placebo-controlled, phase 2/3 trial. Lancet 2019;394:2108–17.
- van der Heijde D, Baraliakos X, Gensler LS, et al. Efficacy and safety of filgotinib, a selective Janus kinase 1 inhibitor, in patients with active ankylosing spondylitis (TORTUGA): results from a randomised, placebo-controlled, phase 2 trial. Lancet 2018;392:2378–87.
- Pavelka K, Kivitz A, Dokoupilova E, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017;19(1):285.
- Wanders A, Heijde D, Landew R, et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial. Arthritis Rheum 2005;52:1756–65.
- Kroon F, Landewo R, Dougados M, et al. Continuous NSAID use reverts the effects of inflammation on radiographic progression in patients with ankylosing spondylitis. Ann Rheum Dis 2012;71:1623–9.
- Sieper J, Listing J, Poddubnyy D, et al. Effect of continuous versus on-demand treatment of ankylosing spondylitis with diclofenac over 2 years on radiographic progression of the spine: results from a randomised multicentre trial (ENRADAS). Ann Rheum Dis 2016;75:1438–43.
- Callhoff J, Sieper J, Weil A, et al. Efficacy of TNFalfa blockers in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis: a meta-analysis. Ann Rheum Dis 2015;74:1241–8.
- Karmacharya P, Duarte-Garcia A, Dubreuil M, et al. Effect of therapy on radiographic progression in axial spondyloarthritis: a systematic review and metaanalysis. Arthritis Rheumatol 2020;72:733–49.
- Ramiro S, van der Heijde D, van Tubergen A, et al. Higher disease activity leads to more structural damage in the spine in ankylosing spondylitis: 12-year longitudinal data from the OASIS cohort. Ann Rheum Dis 2014;73:1455-61.
- Poddubnyy D, Protopopov M, Haibel H, et al. High disease activity according to the Ankylosing Spondylitis Disease Activity Score is associated with accelerated radiographic spinal progression in patients with early axial spondyloarthritis: results from the GErman SPondyloarthritis Inception Cohort. Ann Rheum Dis 2016;75(12):2114-8.
