Эффективность и безопасность упадацитиниба в лечении псориатического артрита
Псориатический артрит (ПсА) – это распространенное заболевание, которое развивается у каждого пятого пациента с псориазом. Помимо асимметричного моно- или олигоартрита или полиартрита характерные проявления ПсА включают в себя спондилоартрит, энтезит и дактилит. Реже ПсА сочетается с увеитом или воспалительными заболеваниями кишечника. Упадацитиниб – это селективный ингибитор янус-киназ, эффективность и безопасность которого в лечении ПсА были установлены в двух плацебо-контролируемых исследованиях 3 фазы SELECT-PsA 1 и 2. В обоих исследованиях упадацитиниб превосходил плацебо по эффективности в лечении не только периферического артрита, но и псориаза кожи, энтезита и дактилита. Кроме того, упадацитиниб применяется для лечения аксиального спондилоартрита, что позволяет назначать его пациентам с любыми проявлениями ПсА. В статье на основании клинических наблюдений обсуждаются различные аспекты применения упадацитиниба у пациентов с ПсА.
С.В. Моисеев. Псориаз – это часто встречающееся хроническое иммуновоспалительное заболевание кожи. По данным недавно опубликованного систематизированного обзора, распространенность псориаза в общей популяции составляла 1,92% в странах западной Европы, 1,83% – в странах центральной Европы и 1,50% – в Северной Америке [1]. В Российской Федерации зарегистрировано более 360 000 пациентов с псориазом, а распространенность этого заболевания увеличилась за последние 10 лет и в 2019 г. достигла 0,24%, однако нельзя исключить, что этот показатель занижен [2,3]. В настоящее время псориаз рассматривают как системное заболевание (псориатическая болезнь), которое ассоциируется с увеличением риска развития сердечно-сосудистых заболеваний, сахарного диабета, метаболического синдрома, хронической болезни почек и др. [4], что, вероятно, связано с наличием системного воспаления, опосредованного различными воспалительными цитокинами [5]. Псориза может сочетаться с воспалительными заболеваниями кишечника, хотя подобная ассоциация встречается редко. По данным мета-анализа, частота псориаза у пациентов с болезнью Крона и язвенным колитом составила 3,6% и 2,8%, соответственно. В свою очередь, воспалительные заболевания кишечника наблюдались у 0,7% и 0,5% пациентов с псориазом [6]. Еще одним нечастым внекожным проявлением псориаза является увеит [7].
К основным внекожным проявления псориаза относится псориатический артрит (ПсА) [8]. По данным мета-анализа 266 исследований, в целом частота ПсА у 976000 пациентов с псориазом составила 19,7%, причем этот показатель был одинаково высоким в различных географических регионах (22,7% в Европе, 21,5% в Южной Америке, 19,5% в Северной Америке, 15,5% в Африке и 14,0% в Азии) [6]. Приведенные данные свидетельствуют о том, что, с одной стороны, у всех пациентов с псориазом необходимо обращать внимание на возможные проявления ПсА, а, с другой стороны, у пациентов с суставным синдромом неясного происхождения следует всегда исключать псориаз. При этом целесообразно учитывать, что далеко не у всех пациентов с ПсА отмечается распространенное поражение кожи, а артрит может предшествовать его развитию. С целью скрининга ПсА среди пациентов с псориазом предложены различные опросники [9]. Например, вопросник Psoriasis Epidemiology Screening Tool (PEST) содержит 5 простых вопросов (была ли у вас припухлость суставов, отмечали ли вы боль в области пятки и т.п.), позволяющих дерматологу оценить возможное наличие проявлений ПсА и направить пациента к ревматологу [10].
Важность своевременной диагностики ПсА определяется не только возможностью прогрессирования заболевания с развитием деформации суставов, но и доступностью эффективного лечения, позволяющего подавить активность артрита и предупредить нарастание деструктивных изменений. Список лекарственных средств, которые могут быть использованы для лечения ПсА, быстро расширяется и включает в себя стандартные базисные противовоспалительные препараты (БПВП), генно-инженерные биологические препараты (ГИБП), в том числе ингибиторы фактора некроза опухоли (ФНО)-a, интерлейкина (ИЛ)-23 (гуселькумаб), ИЛ-12/ИЛ-23 (устекинумаб) и ИЛ-17А (секукинумаб, иксекизумаб, нетакимаб), а также ингибиторы фосфодиэстеразы-4 (ФДЭ4; апремиласт) и янус-киназ. Одним из представителей последней группы является упадацитиниб (Ранвэк), который был недавно одобрен для лечения ПсА. Каковы проявления ПсА и современные критерии его диагностики?
С.В. Гуляев. Клинические проявления ПсА, которые нередко сочетаются друг с другом, включают в себя следующие [11]:
- олиго/моноартрит или полиартрит;
- спондилоартрит;
- дактилит;
- энтезит.
Классическим вариантом ПсА является изолированное поражение дистальных межфаланговых суставов кистей и/или стоп. Эта форма заболевания встречается редко (5%), однако вовлечение дистальных межфаланговых суставов может сочетаться с поражением других суставов. Чаще всего (70%) при ПсА развивается асимметричный моно- или олигоартрит (не более 4 суставов) с поражением коленных, лучезапястных, голеностопных, локтевых суставов и межфаланговых суставов кистей и стоп. Реже (15-20%) встречается полиартрит с поражением 5 и более суставов, который может быть сходным с ревматоидным артритом. К редким вариантам ПсА относится мутилирующий артрит, характеризующийся резорбцией суставных поверхностей с укорочением пальцев кистей и/или стоп. Примерно у половины больных ПсА наблюдается спондилоартрит, который обычно сочетается с поражением периферических суставов, но бывает и изолированным [12]. В отличие от ревматоидного артрита, при ПсА часто развиваются дактилит (40-50% больных) и энтезит (30-50%), которые имеют важное диагностическое значение [13]. Дактилит – это воспаление пальцев, проявляющееся болью, припухлостью и покраснением ("сосискообразные пальцы") и сочетающееся с эрозивным полиартритом [14]. При дактилите в 2/3 случаев отмечается асимметричное поражение пальцев стоп, реже только кистей или стоп и кистей одновременно [15]. Для энтезита характерны боль и припухлость в местах прикрепления сухожилий к костям (энтезисы), в частности в области прикрепления ахиллова сухожилия и подошвенного апоневроза к пяточной кости, латерального надмыщелка плечевой кости, медиального мыщелка бедренной кости.
Е.И. Кузнецова. Классификационные критерии ПсА (CASPAR), предложенные в 2006 году, приведены в табл. 1 [16]. Наличие по крайней мере 3 баллов по указанным критериям у пациента с воспалительным заболеванием опорнодвигательного аппарата (артрит, спондилит или энтезит) позволяет диагностировать ПсА с высокими специфичностью и чувствительностью. При ПсА обычно не определяются ревматоидный фактор и антитела к цитруллинированному циклическому пептиду (АЦЦП), характерные для ревматоидного артрита, хотя в невысоких титрах эти антитела могут быть выявлены у части больных (чаще менее специфичный ревматоидный фактор). ПсА следует также дифференцировать с подагрическим артритом. Ключевым лабораторным признаком подагры является гиперурикемия, однако она нередко наблюдается и при псориазе и ПсА и может оказывать влияние на тяжесть клинических проявлений и выраженность воспаления у пациентов с ПсА [17]. Кроме того, возможно сочетание ПсА и подагрического артрита. L. Widawski и соавт. в ретроспективном исследовании выявили гиперурикемию (≥360 мкмоль/л) у 30,2% из 242 пациентов с ПсА, а у 6,2% больных имелись классификационные критерии подагры [18].
| Признаки | Баллы |
|---|---|
| 1. Псориаз: | |
| псориаз в момент осмотра | 2 |
| псориаз в анамнезе | 1 |
| семейный анамнез псориаза | 1 |
| 2. Псориатическая дистрофия ногтей: точечные вдавления, онихолизис, гиперкератоз | 1 |
| 3. Отрицательный результат теста на ревматоидный фактор (кроме латекс-теста) | 1 |
| 4. Дактилит: | |
| припухлость всего пальца при осмотре | 1 |
| дактилит в анамнезе (зафиксирован ревматологом) | 1 |
| 5. Рентгенологические признаки внесуставной костной пролиферации по типу краевых разрастаний (кроме остеофитов) на рентгенограммах кистей и стоп | 1 |
С.В. Моисеев. Сегодня для лечения ПсА помимо стандартных БПВП (метотрексата, сульфасалазина и лефлуномида) применяют еще более десятка лекарственных средств, которые представляют собой моноклональные антитела, блокирующие действие различных цитокинов, или низкомолекулярные синтетические препараты, предназначенные для приема внутрь. Каковы современные подходы к лечению ПсА?
П.И. Новиков. Рекомендации по лечению ПсА были недавно опубликованы экспертами Европейского альянcа ассоциаций ревматологов (EULAR, 2019 г.) [19], Американской коллегии ревматологов/Национального фонда псориаза (2018 г.) [20], Междисциплинарной группы по изучению псориаза и ПсА (GRAPPA, 2021 г.) [21] и Российского общества дерматовенерологов и косметологов/Ассоциации ревматологов России (2021 г.) [22]. В целом подходы к лечению заболевания, изложенные в разных рекомендациях, сходные, хотя при выборе препарата лучше ориентироваться на более поздние версии, так как список рекомендуемых лекарственных средств постоянно обновляется с учетом результатов не только регистрационных исследований, но и наблюдательных исследований, регистров и опыта клинического применения, которые позволяют оценить отдаленные результаты лечения.
Цель лечения ПсА – достижение ремиссии или минимальной активности заболевания (Treat to Target), которое позволяет замедлить или предупредить прогрессирование рентгенологических признаков артрита [19]. Для оценки активности ПсА и ответа на лечение используют критерии PsARC (число болезненных и припухших суставов, общая оценка активности ПсА врачом и больным), а также счет DAS или DAS28. У пациентов с периферическим артритом, особенно при наличии поражения нескольких суставов, структурных изменений, лабораторных признаков активности (высокие СОЭ и уровень С-реактивного белка), поражения ногтей и/или дактилита, лечение начинают со стандартных БПВП, прежде всего метотрексата (15-25 мг/нед). Назначения системных глюкокортикостероидов лучше избегать, хотя возможно их локальное введение при наличии моноартрита/олигоартрита, дактилита и энтезита. При отсутствии ответа на лечение, при оценке которого необходимо учитывать динамику не только артрита, но и других проявлений ПсА и поражения кожи, назначают препараты второй линии – ГИБП или таргетные БПВП. Апремиласт, ингибирующий активность ФДЭ4, по эффективности уступает другим препаратам, поэтому его следует использовать только при более легких формах ПсА, когда применение ГИБП или ингибиторов янус-киназ по каким-то причинам противопоказано. При наличии спондилоартрита лечение проводят так же, как при анкилозирующем спондилите [23], т.е. основой его являются физические нагрузки и применение нестероидных противовоспалительных препаратов (НПВП). При аксиальном спондилоартрите стандартные БПВП неэффективны, поэтому при отсутствии ответа на терапию НПВП целесообразно применение ГИБП или ингибиторов янус-киназ. Как указано выше, спондилоартрит при псориазе часто сочетается с поражением периферических суставов, поэтому назначению ГИБП или ингибиторов янускиназ обычно предшествует применение стандартных БПВП.
С.В. Моисеев. Как выбрать препарат второй линии, если пациент с ПсА не отвечает на лечение?
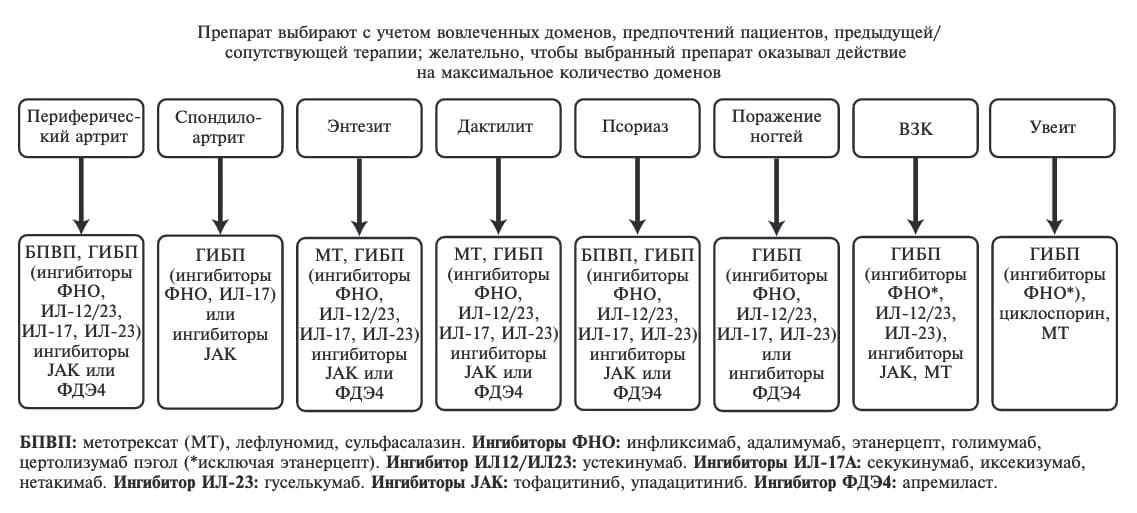
Н.М. Буланов. В регистрационных клинических исследованиях у пациентов с ПсА все новые препараты сравнивали с плацебо, поэтому данные о сравнительной эффективности различных ГИБП и таргетных синтетических БПВП ограничены. Тем не менее, большинство из них (за исключением ингибитора ФДЭ4 апремиласта и ингибитора ИЛ-12/ИЛ-23 устекинумаба), по-видимому, обладают сходной эффективностью в лечении ПсА [21]. Соответственно, при выборе препарата в первую очередь следует учитывать его доказанную или потенциальную активность в отношении внесуставных проявлений ПсА. Так, у пациентов с распространенным псориазом кожи очевидная цель лечения – не только достижение ремиссии или низкой активности ПсА, но и очищение кожи от псориатических бляшек. Наиболее практичными представляются рекомендации экспертов GRAPPA, которые предложили оценивать возможные проявления заболевания по 8 доменам: периферический артрит, спондилоартрит, энтезит, дактилит, псориаз кожи, поражение ногтей, ВЗК и увеит (рис. 1) [21]. В идеале выбранный препарат должен оказывать действие на максимальное количество доменов, которые определяются у пациента. В первую очередь на выбор препарата оказывают влияние псориаз кожи и ногтей, энтезит и дактилит, так как увеит и ВЗК у пациентов с ПсА встречаются редко. По данным мета-анализа клинических исследований, в среднем частота энтезита у пациентов с ПсА составила 30%, дактилита – 25%, поражения ногтей – 60%, увеита – 3,2%, ВЗК – 3,3% [24]. Как видно из рис. 1, ингибиторы янус-киназ могут использоваться при наличии большинства перечисленных проявлений. Исключение составляют псориаз ногтей и увеит, что отражает недостаток данных, подтверждающих эффективность препаратов данной группы по этим показаниям.
Примером успешного применения упадацитиниба у пациентки с ПсА и распространенным псориазом кожи может служить следующее клиническое наблюдение.
Е.И. Кузнецова. Пациентка С., 57 лет, медицинская сестра. В 2012 г. появились папулезные высыпания в области мелких суставов кистей. К врачам не обращалась. Самостоятельно пользовалась мазью, содержащей глюкокортикостероид. В 2016 г. при обследовании отмечались признаки холестаза, небольшое повышение активности аминотрансфераз, антинуклеарный фактор (1:20480) и антитела к митохондриям (AMA-M2). При эластометрии выявлен умеренный фиброз печени (METAVIR F1-2). Диагностирован первичный билиарный холангит. Постоянно принимает урсодезоксихолевую кислоту в дозе 1000 мг/сут. Признаков прогрессирования заболевания печени нет. С 2017 г. наблюдалось распространение папулезных шелушашихся высыпаний, сливающихся в бляшки, с кистей и стоп на предплечья, плечи, голени, бедра, спину, нижнюю часть живота. Диагностирован бляшечный псориаз. Несколько позднее появились боли и опухание в локтевых, лучезапястных, коленных и голеностопных суставах и боль в нижней части спины, которая беспокоила преимущественно по ночам и уменьшалась при физической нагрузке. При магнитно-резонансной томографии признаков спондилита и сакроилиита не выявлено. Ревматоидный фактор и АЦЦП не определялись. Осмотрена ревматологом, который диагностировал ПсА (3 балла по критериям CASPAR) и рекомендовал лечение апремиластом. Учитывая низкую эффективность терапии, в мае 2019 г. начато лечение метотрексатом, доза которого постепенно увеличена до 20 мг/нед. Псориатические высыпания и боли в суставах значительно уменьшились, однако в мае 2021 г. прекратила прием препарата в связи с плохой переносимостью (тошнота) и повторными инфекциями (в декабре 2020 г. и в мае 2021 г. перенесла COVID-19). После отмены метотрексата состояние постепенно ухудшилось: распространились кожные высыпания, вновь усилились боли в крупных и мелких суставах. В сентябре 2021 г. определялись признаки высокой активности ПсА: число болезненных суставов – 8, число припухших суставов – 4, DAS28 – 4,8. Площадь псориатического поражения кожи составляла 65% от площади поверхности тела, индекс PASI – 35. На рентгенограммах кистей выявлены немногочисленные эрозии. Начато лечение упадацитинибом в дозе 15 мг/сут, которое быстро привело к уменьшению боли в суставах. Уже через 3 мес счет DAS28 снизился до 2,8, а через 6 мес – до 2,0, что указывало на достижение ремиссии ПсА. Одновременно было отмечено уменьшение площади псориаза кожи до 8% и 3%, соответственно. В течение 9 мес продолжает терапию упадацитинибом. Нежелательных явлений не было. Сохраняется ремиссия псориатической болезни.
П.И. Новиков. Эффективность и безопасность упадацитиниба при ПсА были установлены в двух рандомизированных контролируемых исследованиях 3 фазы – SELECT-PsA 1 и SELECT-PsA 2 [25,26]. В первое 24недельное исследование были включены 1704 больных активным ПсА, не ответивших на лечение по крайней мере одним стандартным БПВП (в основном метотрексатом). Критериями включения служили счет болезненных или припухших суставов по крайней мере 3, наличие эрозий на рентгенограммах кистей или стоп и/или повышение содержания С-реактивного белка (СРБ) выше нормы. Больные были рандомизированы на 4 равные группы и получали упадацитиниб внутрь в дозе 15 или 30 мг один раз в день, плацебо или адалимумаб подкожно (40 мг каждые 2 недели). Доли мужчин и женщин были сопоставимыми, а средний возраст больных составил около 50 лет. Примерно у половины пациентов площадь псориаза кожи составляла по крайней мере 3%, у двух третей наблюдался энтезит, у одной трети – дактилит. Около 80% больных получали исследуемые препараты в сочетании с одним или реже двумя стандартными БПВП. Первичной конечной точкой исследования была частота ответа по критериям Американской коллегии ревматологов (ACR20) через 12 недель при лечении упадацитинибом по сравнению с плацебо. Выбор указанного срока определялся тем, что через 16 недель при отсутствии адекватного ответа на лечение разрешалось усилить сопутствующую терапию (БПВП, НПВП и др.).
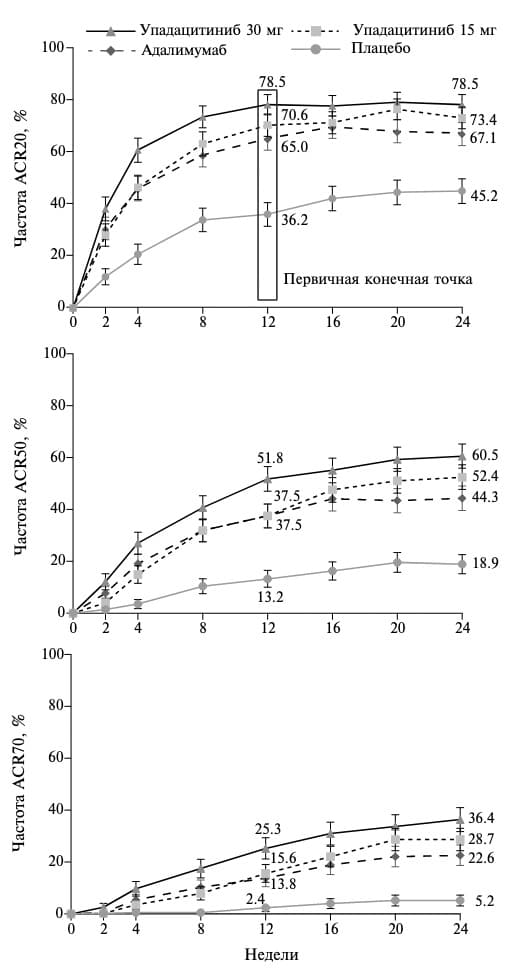
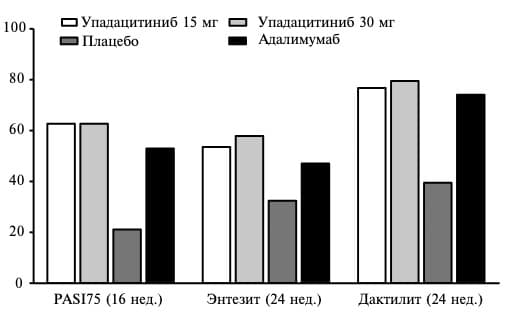
Через 12 недель частота ответа по критериям ACR20 в группе упадацитиниба в дозе 15 мг (70,6%) была сопоставимой с таковой в группах упадацитиниба 30 мг (78,5%) и адалимумаба (65,0%) и достоверно превышала частоту ответа в группе плацебо (36,2%; p<0,001) (рис. 2). В дозе 30 мг упадацитиниб имел также статистически значимое преимущество перед адалимумабом (p<0,001). Сходные результаты были получены при анализе частоты более выраженного ответа на лечение (ACR50 и ACR70). Эффективность упадацитиниба была подтверждена и при анализе вторичных показателей эффективности, которые включали в себя изменения счета HAQ-DI, выраженности боли и усталости (вопросник FACIT), поражения кожи и других проявлений заболевания. Так, доля пациентов, у которых была достигнута минимальная активность ПсА, через 24 недели составила 36,6% в группе упадацитиниба 15 мг и всего 12,3% в группе плацебо. Следует отметить и эффективность упадацитиниба в лечении псориаза, энтезита и дактилита. Ответа по критериям PASI75, т.е. уменьшение этого индекса, отражающего тяжесть псориаза, по крайней мере на 75%, через 16 недель было достигнуто у 62,6% больных, получавших упадацитиниб 15 мг, и 21,3% больных группы плацебо. Доля пациентов, у которых было отмечено разрешение энтезита и дактилита, при лечении упадацинибом также была выше, чем в группе плацебо (рис. 3).
Протокол 24-недельного рандомизированного, плацебо-контролируемого исследования SELECT-PsA 2 был сходным с таковым исследования SELECT-PsA 1. Основное отличие заключалось в том, что во второе исследование отбирали пациентов с активным ПсА, не ответивших на лечение по крайней мере одним ГИБП (более трети имели опыт применения 2-3 ГИБП и более). 642 больных ПсА, включенных в исследование SELECT-PsA 2, были рандомизированы на 4 группы (2:2:1:1) и получали упадацитиниб в дозах 15 или 30 мг один раз в день (первые две группы) или плацебо (последние две группы). Как и в первом исследовании, примерно у 60% больных имелся псориаз кожи с поражением ≥3% площади поверхности тела, у двух третей – энтезит и у трети – дактилит. Следует отметить, что около половины больных получали монотерапию исследуемым препаратом, в то время как в остальных случаях его применяли в комбинации со стандартными БПВП, прежде всего метотрексатом.
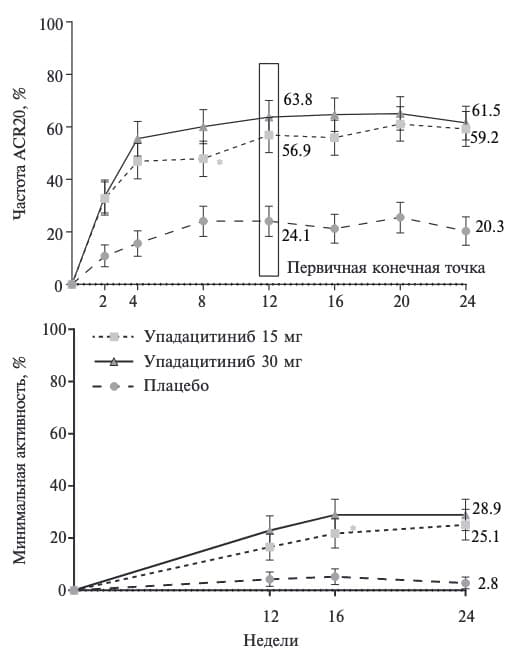
Через 12 недель частота ответа по критериям ACR20, которая была первичной конечной точкой исследования, в группах упадацитиниба 15 и 30 мг/сут (56,9% и 63,8%, соответственно) была достоверно выше, чем в группе плацебо (24,1%; p<0,001; рис. 4). Действие упадацитиниба начиналось быстро, а разница частоты ответа по сравнению с группой плацебо достигла статистической значимости уже через 2 недели после начала терапии. В обеих группах пациентов, получавших ингибитор янус-киназ, частота ответа постепенно увеличивалась. При приеме препарата в дозе 30 мг она достигала плато через 12 недель, в то время как эффективность упадацитиниба в дозе 15 мг продолжала увеличиваться после указанного срока и в конце 24-недельного периода исследовании соответствовала таковой дозы 30 мг. Результаты лечения упадацитинибом у пациентов, не ответивших на терапию несколькими ГИБП, были сходными с таковыми во всей выборке исследования. Через 24 недели минимальная активность ПсА была достигнута примерно у каждого четвертого пациента, получавшего упадацитиниб в дозах 15 или 30 мг, в то время как в группе плацебо такого эффекта удавалось достичь только в единичных случаях (рис. 4). Последний факт был вполне ожидаемым, так как в исследование включали больных, рефрактерных к лечению (около 30% из них не ответили на терапию по крайней мере двумя ГИБП). Преимущество упадацитиниба перед плацебо было подтверждено при анализе вторичных показателей эффективности. Как и в исследовании SELECT-PsA 1, лечение ингибитором янускиназ вызывало уменьшение площади псориатического поражения кожи. Так, частота ответа по критериям PASI75, PASI90 и PASI100 через 24 недели в группах упадацитиниба составляла 53,8-62,6%, 36,2-46,6% и 33,6-22,3%, соответственно, а в группе плацебо – 19,1%, 6,9% и 4,6%. Частота разрешения энтезита и дактилита при лечении упадацитинибом также была достоверно выше, чем в группе плацебо.
С.В. Моисеев. Таким образом, результаты регистрационных клинических исследований 3 фазы подтвердили эффективность упадацитиниба в лечении периферического артрита у пациентов с ПсА, в том числе не ответивших на несколько ГИБП. Важно отметить, что упадацитиниб оказывал положительное влияние и на другие проявления псориатической болезни, в том числе поражение кожи, энтезит и дактилит. Эффективность упадацитиниба в дозе 30 мг/сут была несколько выше, чем в дозе 15 мг/сут. Тем не менее, препарат зарегистрирован только в дозе 15 мг один раз в день. Чем это объясняется?
Н.М. Буланов. Через 12 недель, когда в клинических исследованиях 3 фазы изучали первичный показатель эффективности, частота ответа на упадацитиниб в дозе 30 мг/сут была выше, чем при лечении препаратом в дозе 15 мг/сут, хотя и недостоверно. Однако к концу 24-недельных исследований разница частоты ответа между двумя группами уменьшалась. Таким образом, увеличение дозы упадацитиниба до 30 мг/сут позволяет быстрее достичь максимального эффекта, но, по-видимому, не приводит к существенному улучшению результатов лечения в более отдаленные сроки. При этом увеличение дозы препарата сопровождается более высокой частотой некоторых нежелательных явлений. Например, в исследовании SELECT-PsA 2 частота опоясывающего герпеса мало отличалась в группах пациентов, получавших плацебо или упадацитиниб в дозе 15 мг/сут (0,9% и 1,4%, соответственно), но была выше в группе упадацитиниба 30 мг/сут (3,7%). Сходные результаты были получены и при анализе частоты изменений со стороны печени, которая составила в трех группах 1,4%, 1,9% и 8,3%, соответственно.
С.В. Моисеев. Длительность плацебо-контролируемых исследований была сравнительно небольшой (24 недели). Имеются ли результаты более длительного лечения упадацитинибом у пациентов с ПсА?
Н.М. Буланов. После завершения плацебо-контролируемой части исследования SELECT-PSA 2 пациенты, получавшие упадацитиниб в дозах 15 и 30 мг/сут, продолжили лечение препаратом в тех же дозах, в то время как больных двух групп плацебо перевели на лечение ингибитором янус киназ в дозе 15 или 30 мг/сут [27]. Через 56 недель частота ответа по критериям ACR20/50/70 в группах упадацитиниба оставалась стабильной и составила 59,7/40,8/24,2% при лечении препаратом в дозе 15 мг/сут и 59,2/38,5/26,6% при его применении в дозе 30 мг/сут. У пациентов групп плацебо после начала приема упадацитиниба частота ответа по критериям ACR быстро увеличилась и концу наблюдения соответствовала таковой в двух других группах. Частота ответа псориаза кожи на лечение упадацитинибом также была стабильной на протяжении 56 недель. Следует обратить внимание на сопоставимую эффективность двух доз упадацитиниба в лечении ПсА. При этом, как и в плацебо-контролируемой части исследования, некоторые нежелательные явления, в том числе серьезные инфекции и опоясывающий герпес, чаще развивались при лечении упадацитинибом в дозе 30 мг/сут. Полученные данные служат дополнительным обоснованием зарегистрированной дозы препарата 15 мг один раз в день.
С.В. Моисеев. В обоих исследованиях часть больных ПсА получали монотерапию исследуемыми препаратами. Означает ли это, что упадацитиниб необязательно назначать в комбинации с метотрексатом или другим стандартным ГИБП?
П.И. Новиков. Как указано выше, около половины пациентов, включенных в исследование SELECT-PSA 2, получали монотерапию исследуемым препаратом, причем через 12 недель частота ответа по критериям ACR20 в этой выборке составила 55,8% и 66,7% в группах упадацитиниба 15 и 30 мг/сут, соответственно, т.е. была сходной с таковой во всей выборке. Эти данные свидетельствуют о том, что в части случаев у больных ПсА возможна и монотерапия упадацитинибом. Повидимому, это касается и других препаратов, зарегистрированных для лечения ПсА [21]. Недавно были опубликованы результаты двойного слепого исследования, в котором у 851 пациента с ПсА были сопоставлены резвультаты монотерапии метотрексатом или этанерцептом и комбинированной терапии двумя препаратами [28]. Комбинированная терапия и монотерапия этанерцептом по эффективности превосходили монотерапию метотрексатом, однако присоединение последнего к этанерцепту не приводило к улучшению результатов лечения. В современных руководствах отсутствуют указания на то, в каких случаях обоснована монотерапия ГИБП или ингибиторами янус-киназ. Решать этот вопрос следует индивидуально с учетом предыдущего опыта применения стандартных БПВП, в том числе их переносимости. Например, если пациент с ПсА хотя бы частично отвечает на лечение метотрексатом и хорошо переносит этот препарат, то отменять его в случае назначения упадацитиниба или другого препарата второй линии не следует.
С.В. Моисеев. В исследования SELECT-PSA 1 и 2 включали пациентов с периферическим артритом, хотя у значительной части больных ПсА наблюдается также спондилоартрит, который может быть изолированным или ведущим в клинической картине заболевания. Можно ли применять упадацитиниб в таких случаях?
Т.П. Шевцова. Эффективность упадацитиниба подтверждена в лечении анкилозирующего спондилита в двойном слепом, плацебо-контролируемом исследовании SELECT-AXIS 2, в которое были включены 420 больных, не ответивших на лечение ингибиторами ФНО или ИЛ-17. Им назначали упадацитиниб 15 мг один раз в день или плацебо [29]. По частоте ответа по критериям ASAS40 через 14 недель, которая была первичным показателем эффективности, упадацитиниб достоверно превосходил плацебо (45% и 18%, соответственно; p<0,0001). Статистически значимое преимущество упадацитиниба было выявлено и при анализе всех вторичных показателей эффективности.
Эффективность упадацитиниба при ПсА с поражением позвоночника была установлена при субанализе результатов исследований SELECT-PsA 1 и SELECTPsA 2 [30]. У 539 и 219 пациентов, соответственно, включенных в эти исследования, исходно имелись признаки спондилита. Эффективность упадацитиниба в этой выборке оценивали на основании динамики счета BASDAI, модифицированного счета BASDAI с исключением вопроса 3 (боль/припухлость в периферических суставах) и счета ASDAS-СРБ. У больных ПсА с поражением позвоночника наблюдались более высокая активность заболевания (число болезненных суставов) и более выраженная утренняя скованность и чаще встречались энтезит и дактилит, чем у пациентов без аксиального поражения. Лечение упадацитинибом в дозе 15 мг/сут по сравнению с плацебо привело к достоверному снижению счета BASDAI и ASDAS-СРБ, а также модифицированного счета BASDAI. Улучшение последнего показателя свидетельствовало о том, что ответ по BASDAI не был связан только с уменьшением боли и припухлости в периферических суставах.
Эти данные обосновывают применение упадацитиниба для лечения аксиального спондилоартрита у пациентов с ПсА [21]. Необходимо учитывать, что не все ГИБП, применяющиеся для терапии периферического артрита у пациентов с ПсА, обладают доказанной эффективностью в лечении спондилоартрита. Например, эффективность устекинумаба, блокирующего ИЛ-12/ИЛ-23, не была подтверждена в трех рандомизированных плацебо-контролируемых исследованиях у больных аксиальным спондилоартритом [31], в то время как эффективность ингибитора ИЛ-23 гуселькумаба по этому показанию не изучалась. Соответственно, в рекомендациях GRAPPA пациентам с псориатическим спондилоартритом предлагается назначать только ингибиторы янус-киназ, ингибиторы ФНО или ингибиторы ИЛ-17 (рис. 2) [21].
Е.А. Грунина. Эффективность упадацитиниба в лечении не только периферического артрита и кожного псориаза, но и спондилоартрита и энтезита при псориазе иллюстрирует следующее наблюдение.
Пациент К., 49 лет, менеджер. С 25 лет страдает кожным псориазом. В возрасте 30 лет появились боли и опухание в коленных и голеностопных суставах, боли в пятках и боли в спине, уменьшавшиеся при ходьбе. При обследовании отмечалось повышение СОЭ до 40 мм/ч и содержания СРБ до 30 мг/л. Ревматоидный фактор и АЦЦП не определялись. HLA-B27 не выявлен. Диагностирован ПсА. В течение нескольких лет получал метотрексат в дозе 10 мг в неделю, хотя эффективность препарата была недостаточной, а увеличить дозу не удавалось из-за повышения активности аминотрансфераз. В последующем проводилась терапия сульфасалазином в дозе до 3 г/сут, которая оказалась неэффективной. Предпринималась попытка лечения лефлуномидом в дозе 20 мг/сут, однако препарат пришлось отменить из-за кожной реакции. В связи с недостаточной эффективностью БПВП регулярно получал глюкокортикостероиды парентерально, которые оказывали непродолжительное действие.
В возрасте 43 лет начато лечение адалимумабом в дозе 40 мг каждые две недели, которое привело к разрешению клинических и лабораторных признаков болезни. При попытках снижения дозы или увеличения интервалов между инъекциями адалимумаба наблюдалось ухудшение суставного и кожного синдрома. Через 5 лет непрерывного лечения ингибитором ФНО отмечено постепенное нарастание болей в суставах и спине.
При обследовании в Городской клинической больнице No5 Нижнего Новгорода выявлена высокая активность ПсА: воспалительные боли в спине, ограничение подвижности в позвоночнике, припухлость и болезненность коленных и голеностопных суставов, увеличение содержания СРБ до 32 мг/л. При рентгенографии подтверждено наличие двустороннего сакроилиита 2 стадии. Диагностирован активный ПсА с поражением периферических суставов (олигоартрит коленных и голеностопных суставов) и осевого скелета (спондилит, сакроилиит), энтезитом (ахиллит). В связи со вторичной неэффективностью адалимумаба начато лечение упадацитинибом в дозе 15 мг/сут, которое привело к быстрому улучшению состояния, в том числе уменьшению воспалительной боли в спине и поражения кожи, а также купированию артрита и энтезита и нормализации содержания СРБ. При продолжении терапии в течение 6 мес сохраняется ремиссия ПсА. Переносимость препарата хорошая.
Особенностью данного наблюдения является многолетний анамнез ПсА с поражением периферических суставов, осевого скелета и энтезисов, который был рефрактерным к лечению различными БПВП, что вынуждало прибегать к парентеральному применению глюкокортикостероидов. Лечение ингибитором ФНО позволило поддерживать ремиссию заболевания, однако через 5 лет эффект непрерывной терапии был утрачен. В такой ситуации трудно было ожидать существенного улучшения состояния пациента после замены адалимумаба на другой препарат. Тем не менее, уже через 2 недели после назначения упадацитиниба в дозе 15 мг/сут боли и припухлость в голеностопных и коленных суставах и боли в области пяток значительно уменьшились, а затем полностью исчезли. Одновременно уменьшились боли в спине и увеличился объем движений в позвоночнике. Срок наблюдения после замены ингибитора ФНО на упадацитиниб пока относительно небольшой, но все же ремиссия сохраняется уже в течение 6 мес.
С.В. Моисеев. Безопасность ингибиторов янускиназ, включая упадацитиниб, подробно рассмотрена в нашей предыдущей публикации [32]. В целом они достаточно безопасны, хотя, как и другие иммуносупрессивные препараты, могут вызывать инфекционные осложнения. Частота бактериальных инфекций была сопоставимой при лечении ГИБП и таргетными синтетическими БПВП, однако риск развития опоясывающего герпеса при применении ингибиторов янус-киназ оказался выше, чем при назначении ГИБП. Такие же результаты были получены и при лечении упадацитинибом у пациентов с ПсА [33]. В инструкциях по применению всех ингибиторов янус-киназ указано также на риск развития венозных тромбоэмболических осложнений (ВТЭО). Что известно об этих нежелательных эффектах?
Т.П. Шевцова. Увеличение риска развития ВТЭО при лечении тофацитинибом было отмечено при промежуточном анализе результатов открытого клинического исследования, в котором этот препарат сравнивают с ингибиторами ФНО у 4362 больных в возрасте 50 лет и старше с ревматоидным артритом и по крайней мере одним сердечно-сосудистым фактором риска [34]. Эти данные послужили основанием для внесения соответствующего предостережения в инструкцию по применению тофацитиниба, а затем и других представителей ингибиторов янус-киназ. Вопрос о том, повышается ли риск ВТЭО при лечении этими препаратами, остается спорным. По данным мета-анализа плацебо-контролируемых исследований, у пациентов с иммуновоспалительными заболеваниями частота ВТЭО при применении ингибиторов янус-киназ (6542 пациенто-лет) была даже ниже, чем при приеме плацебо (1578 пациенто-лет) [35]. В исследованиях упадацитиниба также не было выявлено увеличения риска ВТЭО [33]. Тем не менее, эксперты EULAR рекомендовали тщательно взвешивать возможность назначения ингибиторов янус-киназ пациентам с повышенным риском ВТЭО [36].
С.В. Моисеев. Преувеличивать риск ВТЭО при лечении ингибиторами янус-киназ не следует, тем более, что и сами иммуновоспалительные заболевания ассоциируются с повышенным риском их развития. Наличие некоторых факторов риска ВТЭО, таких как ожирение или пожилой возраст, явно не может служить основанием для отказа от применения препаратов этой группы. Да и у пациентов с тромбофилией или ВТЭО в анамнезе угроза развития подобных осложнений нивелируется, если они постоянно принимают антикоагулянты.
Таким образом, результаты регистрационных клинических исследований подтвердили эффективность и безопасность упадацитиниба в дозе 15 мг один раз в день у больных ПсА, не ответивших на лечение стандартными БПВП или ГИБП. Ингибиторы янус-киназ уменьшают различные проявления псориатической болезни, что позволяет назначать их при наличии не только периферического артрита, но и спондилоартрита, энтезита, дактилита, псориаза кожи и ВЗК.
Используемые источники
- Parisi R, Iskandar IYK, Kontopantelis E, et al.; Global Psoriasis Atlas. National, regional, and worldwide epidemiology of psoriasis: systematic analysis and modelling study. BMJ 2020;369:m1590.
- Кубанов А.А., Богданова Е.В. Эпидемиология псориаза среди населения старшего трудоспособного возраста и объемы оказываемой специализированной медицинской помощи больным псориазом в Российской Федерации в 2010–2019 гг. Вестник дерматологии и венерологии 2020;96(5):7-18 [Kubanov АА, Bogdanova EV. Epidemiology of psoriasis among the elderly population and volume of specialized medical care provided to patients with psoriasis in the Russian Federation in 2010–2019. Vestnik Dermatologii i Venerologii 2020;96(5):7-18 (In Russ.)].
- Разнатовский К.И., Древаль Р.О., Жукова О.В. и др. Оценка экономического бремени и текущего состояния организации лекарственного обеспечения пациентов с псориазом в Российской Федерации. Клиническая дерматология и венерология 2021;20(3):8–16 [Raznatovskiy KI, Dreval RO, Zhukova OV, et al. Assessment of the economic burden and the current state of the drug provision organization for patients with psoriasis in the Russian Federation. Russian Journal of Clinical Dermatology and Venereology = Klinicheskaya dermatologiya i venerologiya 2021;20(3):8–16 (In Russ.)].
- Bu J, Ding R, Zhou L, Chen X, Shen E. Epidemiology of psoriasis and comorbid diseases: A narrative review. Front Immunol 2022;13:880201.
- Круглова Л.С., Моисеев С.В. Блокатор ИЛ-17 – новые горизонты эффективности и безопасности в лечении псориаза. Клин фармакол тер 2017; 26(2):5-12.
- Alinaghi F, Calov M, Kristensen LE, et al. Prevalence of psoriatic arthritis in patients with psoriasis: A systematic review and meta-analysis of observational and clinical studies. J Am Acad Dermatol 2019;80(1):251-65.
- Köse B, Uzlu D, Erdöl H. Psoriasis and uveitis. Int Ophthalmol 2022;42(7):2303-2310.
- Schett G, Rahman P, Ritchlin C, et al. Psoriatic arthritis from a mechanistic perspective. Nat Rev Rheumatol 2022;18(6):311-325
- Landini EnrТquez VV, Jurado Santa-Cruz F, Peralta-Pedrero ML, MoralesSЗnchez MA. Content validity of psoriatic arthritis screening questionnaires: systematic review. Int J Dermatol 2020;59(8):902-14.
- Ibrahim G, Buch M, Lawson C, et al. Evaluation of an existing screening tool for psoriatic arthritis in people with psoriasis and the development of a new instrument: the Psoriasis Epidemiology Screening Tool (PEST) questionnaire. Clin Exp Rheumatol 2009;27:469–74.
- Коротаева Т.В. Псориатический артрит: классификация, клиническая картина, диагностика, лечение. Научно-практическая ревматология 2014;52(6):650–9.
- Zeidler HK. Psoriatic spondylitis: A disease manifestation in debate: evidences to know for the clinical rheumatologist. J Clin Rheumatol 2022;28(1):38-43.
- Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med 2009;361(12):496-509.
- Kaeley GS, Eder L, Aydin SZ, et al. Dactylitis: A hallmark of psoriatic arthritis. Semin Arthritis Rheum 2018;48(2):263-73.
- Brockbank JE, Stein M, Schentag CT, Gladman DD. Dactylitis in psoriatic arthritis: a marker for disease severity? Ann Rheum Dis 2005;64:188-90.
- Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54:2665-73.
- Tripolino C, Ciaffi J, Ruscitti P, et al. Hyperuricemia in psoriatic arthritis: epidemiology, pathophysiology, and clinical implications. Front Med (Lausanne) 2021;8:737573.
- Widawski L, Fabacher T, Spielmann L, et al. Psoriatic arthritis with hyperuricemia: more peripheral, destructive, and challenging to treat. Clin Rheumatol 2022;41(5):1421-9.
- Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020;79(6):700-712.
- Singh JA, Guyatt G, Ogdie A, et al. Special Article: 2018 American College of Rheumatology/National Psoriasis Foundation Guideline for the Treatment of Psoriatic Arthritis. Arthritis Rheumatol 2019;71(1):5-32.
- Coates LC, Soriano ER, Corp N, et al.; GRAPPA Treatment Recommendations domain subcommittees. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022 Jun 27:1–15.
- Российское общество дерматовенерологов и косметологов, Ассоциация ревматологов России. Псориатический артрит. Клинические рекомендации, 2021.
- Моисеев С.В., Новиков П.И., Гуляеев С.В. и др. Анкилозирующий спондилит: подходы к диагностике и клиническая эффективность упадацитиниба. Клин фармакол тер 2021;30(4):62-70 [Moiseev S, Novikov P, Gulyaev S, et al. Ankylosing spondylitis: diagnostic challenges and efficacy of upadacitinib. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(4):62-70 (In Russ.)].
- Pittam B, Gupta S, Harrison NL, et al. Prevalence of extra-articular manifestations in psoriatic arthritis: a systematic review and meta-analysis. Rheumatology (Oxford) 2020;59:2199-206.
- McInnes IB, Anderson JK, Magrey M, et al. Trial of upadacitinib and adalimumab for psoriatic arthritis. N Engl J Med 2021;384:1227-39.
- Mease PJ, Lertratanakul A, Anderson JK, et al. Upadacitinib for psoriatic arthritis refractory to biologics: SELECT-PsA 2. Ann Rheum Dis 2021;80:312-20.
- Mease PJ, Lertratanakul A, Papp KA, et al. Upadacitinib in patients with psoriatic arthritis and inadequate response to biologics: 56-week data from the randomized controlled phase 3 SELECT-PsA 2 Study. Rheumatol Ther 2021;8(2):903-919.
- Mease PJ, Gladman DD, Collier DH, et al. Etanercept and methotrexate as monotherapy or in combination for psoriatic arthritis: primary results from a randomized, controlled phase III trial. Arthritis Rheumatol 2019;71(7):1112-24.
- van der Heijde D, Baraliakos X, Sieper J, et al. Efficacy and safety of upadacitinib for active ankylosing spondylitis refractory to biological therapy: a double-blind, randomised, placebo-controlled phase 3 trial. Ann Rheum Dis 2022 Jul 4:annrheumdis-2022-222608.
- Deodhar A, Ranza R, Ganz F, et al.Efficacy and safety of upadacitinib in patients with psoriatic arthritis and axial involvement. Arthritis Rheumatol 2020; 2 (suppl 10). https://acrabstracts.org/abstract/efficacy-and-safety-of-upadacitinib-inpatients-with-psoriatic-arthritis-and-axial-involvement/. Accessed September 13, 2022.
- Deodhar A, Gensler LS, Sieper J, et al. Three multicenter, randomized, doubleblind, placebo-controlled studies evaluating the efficacy and safety of ustekinumab in axial spondyloarthritis. Arthritis Rheumatol 2019;71(2):258-70.
- Новиков П.И., Шевцова Т.П., Щеголева Е.М., Моисеев С.В. Ингибиторы янус-киназ: фармакологические свойства и сравнительные клиническая эффективность и безопасность. Клин фармакол тер 2021;30(1):51-60 [Novikov P, Shevtsova T, Shchegoleva E, Moiseev S. JAK-inhibitors: pharmacological properties and comparative clinical efficacy and safety. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2021;30(1):51-60 (In Russ.)].
- Burmester GR, Winthrop K, Blanco R, et al. Safety profile of upadacitinib up to 3 years in psoriatic arthritis: an integrated analysis of two pivotal phase 3 trials. Rheumatol Ther 2022;9:521-39.
- Direct Healthcare Professional Communication. XELJANZ (tofacitinib): increased risk of venous thromboembolism and increased risk of serious and fatal infections. 7th February 2020.
- Yates M, Mootoo A, Adas M, et al. Venous thromboembolism risk with JAK inhibitors: a meta-analysis. Arthritis Rheumatol 2021;73(5):779-88.
- Nash P, Kerschbaumer A, DЪrner T, et al. Points to consider for the treatment of immune-mediated inflammatory diseases with Janus kinase inhibitors: a consensus statement. Ann Rheum Dis 2021;80(1):71-87.
