Индекс лекарственной устойчивости как критерий эффективности внедрения стратегии контроля антимикробной терапии
Одним из наиболее эффективных способов повышения качества антибактериальной терапии считают внедрение в стационарах программы контроля антимикробной терапии, в нашей стране известной как “Стратегия контроля антимикробной терапии” (СКАТ).
Оценка динамики индекса лекарственной устойчивости (ИЛУ), отражающего уровень резистентности отдельных патогенов и потребление антимикробных препаратов в многопрофильном стационаре, на фоне реализации программы СКАТ, а также во время пандемии COVID-19.
Ретроспективное исследование медицинских карт пациентов, госпитализированных в ГКБ №4 г. Москвы с 4-го квартала 2018 г. по 4-й квартал 2020 г. Анализировали демографические показатели, данные о потреблении антибактериальных препаратов и микробиологические данные и рассчитывали ИЛУ поквартально.
Были проанализированы медицинские карты 593 пациентов в возрасте в среднем 67,3±9,9 лет. Всего было выделено 1425 этиологически значимых патогенов, среди которых преобладали K. pneumoniae и A. baumanii. Значения ИЛУ A. baumanii и P. aeruginosa оставались высокими на протяжении всего исследования. В то же время ИЛУ K. pneumo niae снизился во время функционирования программы СКАТ с 0,81 до 0,66 (p<0,05) и увеличился во время пандемии COVID-19 до 0,90 (p<0,05). ИЛУ E. coli также достоверно увеличился во время пандемии с 0,38 до 0,67 (p<0,05). Для S. aureus и E. faecium зафиксировано снижение ИЛУ к концу функционирования СКАТ с 0,43 до 0,20 и с 0,54 до 0,38, соответственно (p<0,05 в обоих случаях). Во время пандемии COVID-19 отмечено значительное увеличение ИЛУ S. aureus до 0,60 (р<0,05).
Реализация программы СКАТ способствует снижению ИЛУ части ключевых патогенов. Во время пандемии COVID-19 отмечена негативная динамика ИЛУ, что указывает на важность выполнения принципов СКАТ в стационарах, перепрофилированных для лечения пациентов с COVID-19.
О дной из ведущих глобальных проблем мирового здравоохранения в 21 веке является антибиотикорезистентность [1], которая сопровождается увеличением расходов на здравоохранение, длительности госпитализации, заболеваемости и смертности [2]. Данная проблема наиболее актуальна для микроорганизмов, являющихся ведущими возбудителями внутрибольничных инфекций, таких как Enterococcus spp., Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa и Enterobacter spp. (группа ESKAPE). У этих патогенов может быть развиться резистентность ко многим антибиотикам, которая ограничивает возможность лечения больных и увеличивает риск летального исхода. По данным крупного систематического обзора и мета-анализа, инфекции, вызванные патогенами группы ESKAPE, ассоциированы с самым высоким риском смертности (отношение шансов 3,217; 95% доверительный интервал 2,395-4,321; p=0,001) [3].
На прогрессирование антибиотикорезистентности влияют различные факторы, прежде всего ненадлежащее применение антибиотиков [4]. Главным образом это необоснованное назначение антибактериальных препаратов, усиливающее так называемый параллельный ущерб, который способствует селекции полирезистентных штаммов микроорганизмов и тем самым ускоряет распространение антибиотикорезистентности [5]. Например, выявлена статистически значимая корреляция между уровнем резистентности представителей семейства Enterobacteriaceae к цефалоспоринам 3-го поколения, особенно продуцирующих β-лактамазы расширенного спектра действия (БЛРС), и потреблением этих препаратов [6,7]. Более широкое использование фторхинолонов коррелирует с повышением частоты резистентности к ципрофлоксацину у грамотрицательных бактерий [6,8]. Также установлена взаимосвязь между потреблением карбапенемов и резистентностью к ним у грамотрицательных микроорганизмов [9,10]. Таким образом, имеющиеся данные свидетельствуют о том, что любое необоснованное назначение антибактериального препарата негативно влияет на ситуацию с антибиотикорезистентностью как в отдельном стационаре, так и на данную проблему в целом.
Отдельно стоит отметить негативный эффект пандемии COVID-19 на антибиотикорезистентность, так как доля госпитализированных пациентов с SARS-CoV-2 инфекцией, которым назначали антибактериальную терапию, значительно превышала долю пациентов c зарегистрированной бактериальной инфекцией [11,12]. Избыточное назначение антибактериальных препаратов создает благоприятные условия для прогрессирования антибиотикорезистентности, поэтому крайне важно иметь актуальные данные о потреблении антибиотиков и устойчивости к ним с целью оценки динамики и дальнейшего улучшения надлежащего использования антибиотиков.
Одним из наиболее эффективных способов повышения качества проводимой антибактериальной терапии считают реализацию в стационарах так называемых "программ контроля антимикробной терапии" (Antimicrobial stewardship programmes – ASP). Ключевые задачи таких программ – контроль антибиотикорезистентности, потребления антимикробных препаратов и обеспечение качественной медицинской помощи пациентов с инфекцией. Многочисленные систематические обзоры и мета-анализы продемонстрировали, что данные программы оказывают положительное влияние на показатели выживаемости в стационаре [13,14], профиль резистентности ключевых патогенов [14,15] и частоту развития нозокомиальных инфекций [16].
В нашей стране с 2011 г. реализуется программа СКАТ (Стратегия и контроль антимикробной терапии) [17], которая представляет собой комплекс мероприятий, направленных на рациональное применение антимикробных средств, сдерживание антибиотикорезистентности и контроль инфекций, связанных с оказанием медицинской помощи. Ключевым элементом, определяющим успешность реализации программы СКАТ, является наличие в стационаре службы клинической фармакологии, основными задачами которой являются контроль проводимой антибактериальной терапии (в первую очередь, разработка протоколов эмпирической терапии и ограничительные мероприятия по использованию антибиотиков) и мониторинг антибактериальной резистентности ключевых возбудителей. Важное значение для оценки эффективности применения антибактериальных препаратов в стационаре имеет определение индекса лекарственной устойчивости (ИЛУ) в динамике. Этот индикатор объединяет данные об использовании антибиотиков и уровне резистентности конкретного микроорганизма и позволяет получить представление о том, насколько антибиотики, используемые в стационаре, соответствуют профилям резистентности патогенов [18,19]. На основании ИЛУ можно оценить динамику антибиотикорезистентности в конкретном стационаре и выявить потенциальное избыточное или недостаточное потребление того или иного класса противомикробного препарата в исследуемый период времени.
Целью исследования была оценка динамики ИЛУ на фоне внедрения и реализации программы СКАТ в многопрофильном стационаре, а также во время пандемии COVID-19.
Материал и методы
Дизайн исследования. Ретроспективный анализ историй болезней пациентов, госпитализированных в ГКБ No4 Департамента здравоохранения г. Москвы с 4-го квартала 2018 г. по 4-й квартал 2020 г.
В 4-м квартале 2018 г. в стационаре начала функционировать служба клинической фармакологии (0,5 ставки врача-клинического фармаколога на 1040 мест коечного фонда многопрофильного стационара, оказывающего неотложную и плановую медицинскую помощь), а с первого квартала 2019 г. была внедрена программа СКАТ. В связи с недостаточным обеспечением стационара клиническими фармакологами были внедрены рекомендованные СКАТ протоколы эмпирической антибактериальной терапии основных видов инфекций (нижних дыхательных путей, кожи и мягких тканей, мочевыводящих путей, органов брюшной полости, кровотока, сепсиса), основанные на стратификации пациентов в соответствии с риском инфицирования резистентными возбудителями. Программа инфекционного контроля предусматривала улучшение гигиены медперсонала и обследование пациентов, поступавших в реанимационные отделения стационара из других лечебных учреждений, на предмет колонизации антибиотикорезистентными штаммами микроорганизмов. В образовательных целях регулярно проводились обучающие мероприятия для врачей, посвященные вопросам рациональной антибактериальной терапии вышеуказанных инфекций. Еще одним элементом СКАТ стал внутренний аудит с целью своевременного выявления системных ошибок.
В апреле 2020 г. стационар был перепрофилирован и функционировал в режиме оказания медицинской помощи исключительно пациентам с COVID-19. В этой связи было принято административное решение о прекращении функционирования программы СКАТ и упразднении должности клинического фармаколога в связи с экономической нецелесообразностью. Таким образом, нами были проанализированы ретроспективные данные о реализации программы СКАТ от момента начала функционирования службы клинической фармакологии до прекращения ее работы в начале пандемии COVID-19, определены основные изменения в потреблении антибактериальных препаратов и динамике ИЛУ как ключевого индикатора эффективности антибактериальной терапии в допандемийном периоде и на фоне пандемии COVID-19.
Определение ИЛУ. Для расчета ИЛУ были использованы полученные из медицинских карт данные о потреблении антибактериальных препаратов и антибиотикорезистентности основных выявленных патогенов. Потребление антибиотиков рассчитывали с помощью ATC/DDD методологии, рекомендованной ВОЗ [20]. На основании фактического применения антибактериальных препаратов в граммах и средних суточных доз (Defined Daily Dose – DDD) определяли общий объем потребления каждого антибактериального препарата и класса препаратов в целом. Для последующих вычислений полученное значение было рассчитано на 100 койко-дней. Расчеты были выполнены отдельно для каждого из анализируемых патогенов с учетом потенциально эффективных в их отношении препаратов. Информация о количестве койко-дней была получена из данных статистики лечебного учреждения. Расчеты для каждого класса антибактериальных препаратов проводились поквартально по формуле: потребление = (DDD × 100)/общий койко-день. Затем полученные для каждого класса антибактериальных препаратов значения объемов потребления суммировали и определяли частоту потребления по отношению к общему объему для каждого из анализируемых патогенов.
Далее был рассчитан собственно ИЛУ. Среди грамотрицательных микроорганизмов ИЛУ был определен для K. pneumoniae, A. baumanii, P. aeruginosa и E. coli, среди грамположительных – для S. aureus, E. faecalis и E. faecium. Для грамотрицательных патогенов ИЛУ рассчитывали как сумму показателей лекарственной резистентности ко всем используемым в анализируемый период классам антибактериальных препаратов, потенциально эффективных против оцениваемого возбудителя. Расчеты проводились по формуле: лекарственная резистентность = частота резистентных штаммов к определенному классу антибиотика x частота потребления препаратов данного класса. Для грамположительных патогенов ИЛУ рассчитывали как долю выделенных метициллин-резистентных штаммов S. aureus и как долю выделенных ванкомицин-резистентных штаммов E. faecalis и E. faecium. ИЛУ оценивали поквартально. Минимально возможное значение данного индекса – 0, что означает полную чувствительность микроорганизма к потенциально эффективным против него препаратам. Максимально возможное значение – 1, что, наоборот, свидетельствует о том, что микроорганизм устойчив ко всем потенциально эффективным против него препаратам.
Также была определена структура ключевых возбудителей бактериальных инфекций у пациентов и динамика соотношения грамотрицательной и грамположительной флоры за анализируемый период. Анализ проводился для патогенов, выделенных из мокроты, бронхиального аспирата, мочи и крови пациентов. Для мокроты и бронхиального аспирата положительным результатом считали выделение этиологически значимого микроорганизма в концентрации более 104 КОЕ/мл, а для мочи – более 105 КОЕ/мл [21].
Все расчеты проводились в соответствии с методикой, изложенной в программе СКАТ [17].
Статистический анализ. Проводили описательный статистический анализ. Количественные показатели представлены в виде средних значений и среднеквадратических отклонений (M±m) Для определения достоверности различий использовали непарный критерий t (Стьюдента). Сравнение несвязанных групп по качественным признакам было проведено с помощью критерия χ2. При проверке гипотез статистически значимыми результаты считали при уровне значимости p<0,05. Полученные результаты были обработаны с помощью компьютерной программы Excel (Microsoft, США).
Результаты
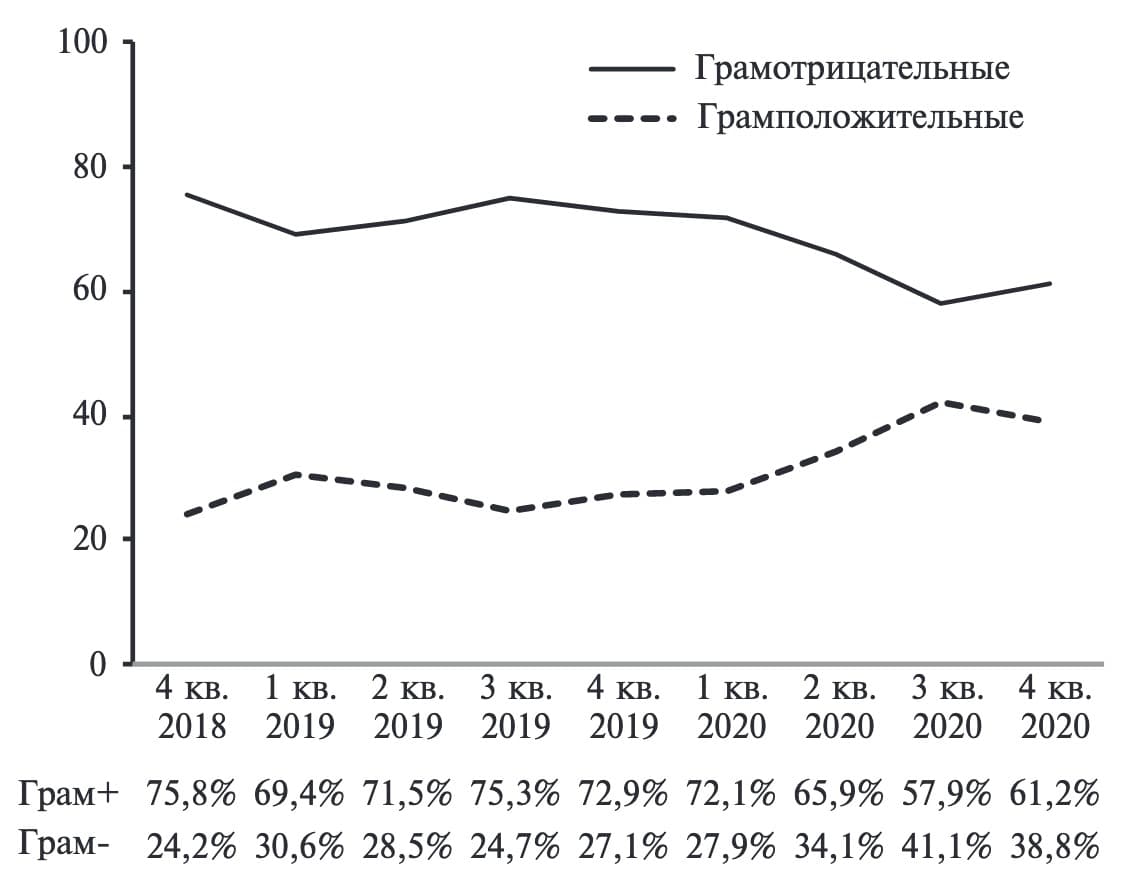
Были проанализированы медицинские карты 593 пациентов, в том числе 269 мужчин и 324 женщин в возрасте в среднем 67,3±9,9 лет. Всего было выделено 1425 этиологически значимых патогенов, среди которых доминировали K. pneumoniae и A. baumanii (табл. 1). В начале исследования отмечено преобладание грамотрицательной флоры, однако во время пандемии зафиксировано снижение разрыва между частотой выделения грамотрицательных и грамположительных возбудителей (рис. 1).
| Патоген | 4 кв. 2018 | 1 кв. 2019 | 2 кв. 2019 | 3 кв. 2019 | 4 кв. 2019 | 1 кв. 2020 | 2 кв. 2020 | 3 кв. 2020 | 4 кв. 2020 |
|---|---|---|---|---|---|---|---|---|---|
| Примечание: *p<0,05 между оцениваемым перидом и 4-й кварталом 2018 г. **S. haemolyticus, S. epidermidis, S. hominis и S. capitis | |||||||||
| A. baumanii | 39 (23,6) | 26 (19,4) | 32 (21,8) | 27 (18,5) | 51 (23,4) | 29 (19,7) | 62 (29,2) | 17 (12,1)* | 13 (11,2)* |
| K. pneumoniae | 67 (40,6) | 35 (26,1)* | 47 (32,0) | 58 (39,7) | 65 (29,8)* | 53 (36,1) | 52 (24,5)* | 34 (24,3)* | 35 (30,2) |
| P. aeruginosa | 10 (6,1) | 15 (11,2) | 12 (8,2) | 18 (12,3) | 24 (11,0) | 19 (12,9)* | 17 (8,0) | 11 (7,9) | 7 (6,0) |
| E. coli | 9 (5,5) | 17 (12,7)* | 14 (9,5) | 7 (4,8) | 19 (8,7) | 5 (3,4) | 9 (4,2) | 19 (13,6)* | 16 (13,8)* |
| S. aureus | 14 (8,5) | 13 (9,7) | 10 (6,8) | 21 (14,4) | 16 (7,3) | 5 (3,4)* | 15 (7,1) | 7 (5,0) | 9 (7,8) |
| E. faecalis | 7 (4,2) | 5 (3,7) | 6 (4,1) | 4 (2,7) | 14 (6,4) | 3 (2,0) | 21 (9,9)* | 13 (9,3)* | 9 (7,8) |
| E. faecium | 8 (4,8) | 15 (11,2)* | 14 (9,5) | 5 (3,4) | 12 (5,5) | 21 (14,3)* | 15 (7,1) | 16 (11,4)* | 13 (11,2)* |
| Другие Грам (+) патогены** | 11 (6,7) | 8 (6,0) | 12 (8,2) | 6 (4,1) | 17 (7,8) | 12 (8,2) | 21 (9.9) | 22 (15,7)* | 14 (12,1) |
| Всего | 165 | 134 | 147 | 146 | 218 | 147 | 212 | 140 | 116 |
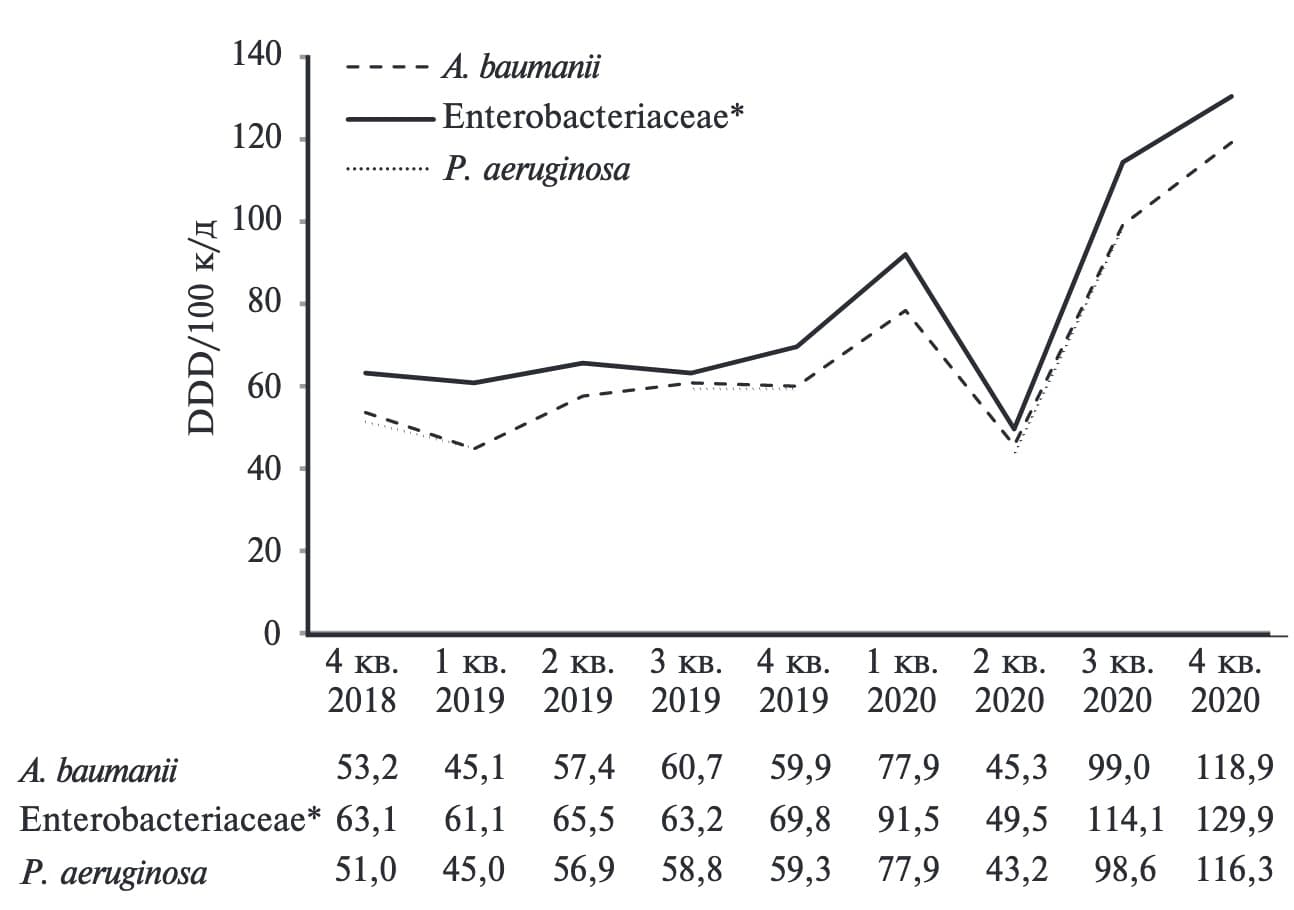
Во время функционирования программы СКАТ объем потребления антибактериальных препаратов, потенциально эффективных в отношении ключевых грамотрицательных патогенов, оставался стабильно низким (рис. 2). Однако он увеличился после перепрофилирования стационара и достиг максимума в 4-м квартале 2020 г. – 129,9 DDD/100 к/д для представителей семейства Enterobacteriacae, 118,9 DDD/100 к/д для A. baumanii и 116,3 DDD/100 к/д для P. aeruginosa. Во 2-м квартале 2020 г. стационар проходил процесс перепрофилирования, поэтому данные о потреблении антибиотиков в этом квартале не учитывали.
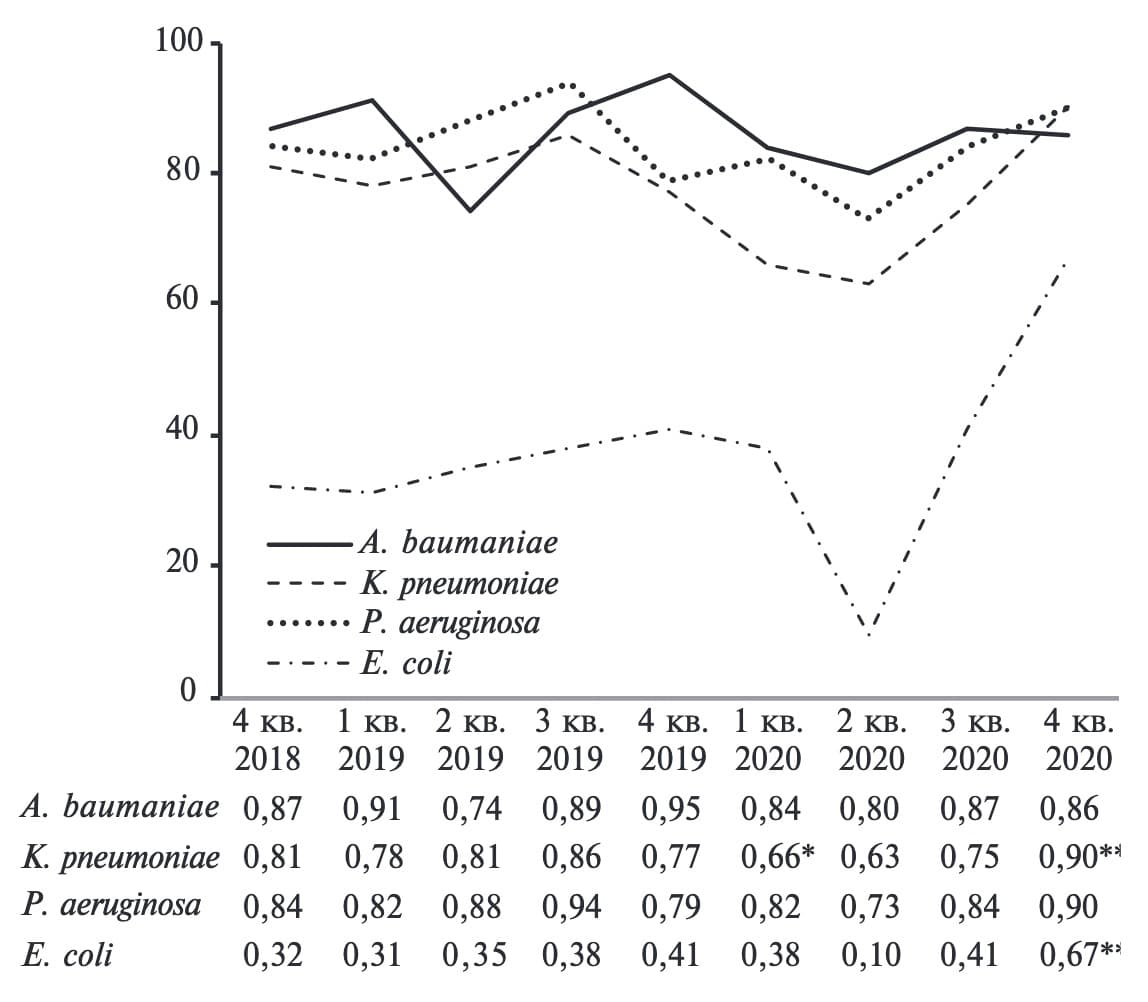
В отношении ИЛУ ключевых грамотрицательных микроорганизмов выявлена неоднородная динамика (рис. 3). Значения ИЛУ A. baumanii и P. aeruginosa существенно не изменились во время исследования (как до, так и во время пандемии). В то же время выявлена тенденция к увеличению ИЛУ представителей семейства Enterobacteriacae во время пандемии. Значения этого показателя для K. pneumoniae и E. coli достигли максимальных значений в 4-м квартале 2020 г. (0,90 и 0,67, соответственно). Были выявлены статистически значимые различия по сравнению с показателями в конце функционирования программы СКАТ (1-й квартал 2020 г.; p<0.05 для обоих патогенов). При этом минимальный ИЛУ для K. pneumoniae был зафиксирован в конце функционирования программы СКАТ (0,66). Различия с исходным периодом (4-й квартал 2018 г.) оказались статистически значимыми (p<0,05).
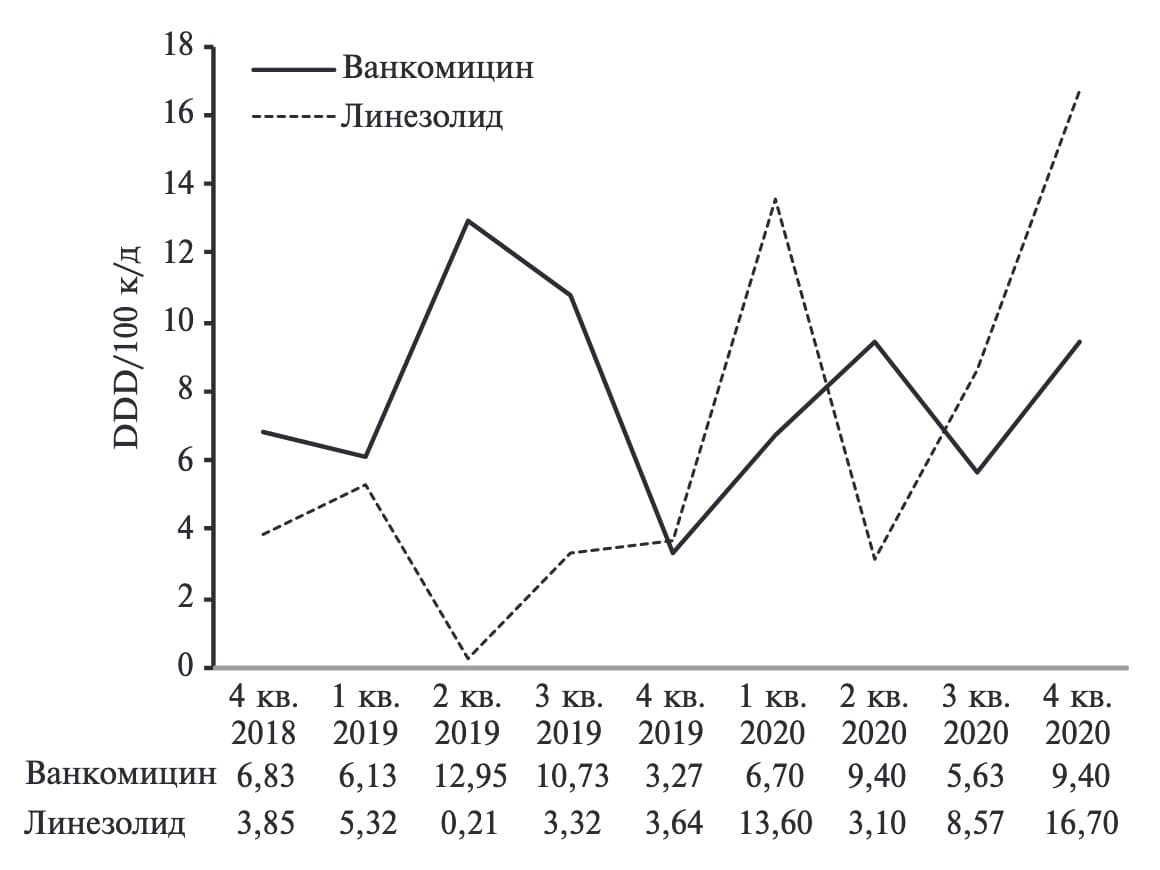
Для лечения инфекций, вызванных грамположительными возбудителями, применяли ванкомицин и линезолид (суммарный объем потребления за весь период исследования 71,0 и 58,4 DDD/100 к/д, соответственно). Значения объема потребления этих антибиотиков в отдельных кварталах были вариабельными, что отражало наличие или отсутствие того или иного препарата в аптеке лечебного учреждения (рис. 4). При наличии обоих препаратов предпочтение отдавали ванкомицину, а линезолид применяли как препарат второй линии, что объяснялось экономическими причинами.
В отношении ИЛУ ключевых грамположительных патогенов зафиксирована разнонаправленная динамика. Для E. faecalis данный показатель на протяжении всего периода исследования оставался низким. Максимальное значение (0,20) было зафиксировано во 2-м квартале 2019 г. (рис. 5). Для S. aureus в период функионирования программы СКАТ отмечалась тенденция к снижению ИЛУ до минимальных значений в 4-м квартале 2019 г. и 1-м квартале 2020 г. (0,17 и 0,20, соответственно) и последующим повышением во время пандемии COVID-19 с достижением максимального значения в 4-м квартале 2020 г. (0,60). Различия между исходным периодом и периодом конца функционирования программы СКАТ, а также между 4-м кварталом 2020 г. и периодом конца функционирования программы СКАТ оказались статистически значимыми (p<0,05).
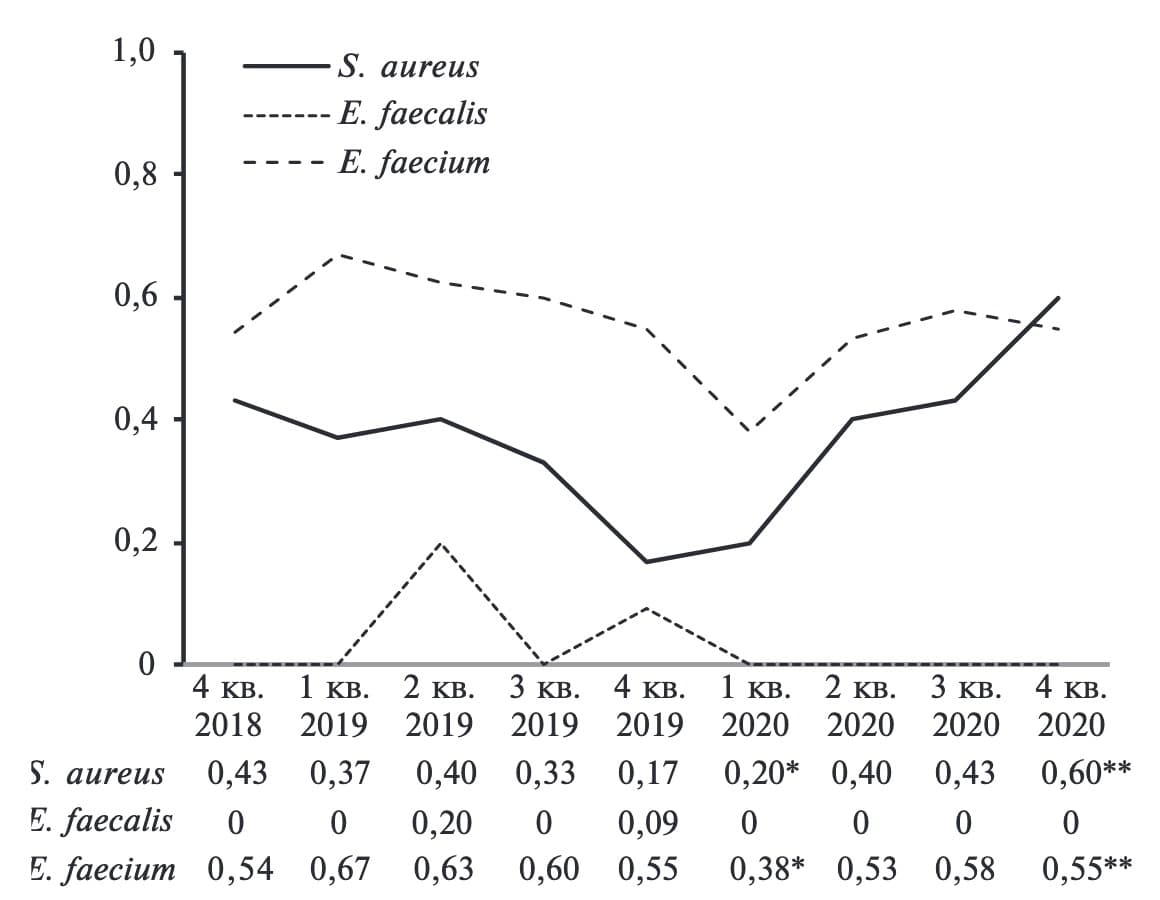
ИЛУ E. faecium существенно не менялся на протяжении всего анализируемого периода. Для этого возбудителя были характерными самые высокие значения ИЛУ среди оцениваемых грамположительных патогенов. При этом, как и для S. aureus, минимальное значение ИЛУ было зафиксировано в конце периода функционирования программы СКАТ (0,38), а на фоне пандемии было выявлено повышение данного показателя до 0,55 в 4-м квартале 2020 г. (p<0.05).
Обсуждение
Внедрение программы СКАТ позволило добиться умеренного эффекта в виде снижения ИЛУ части ключевых патогенов. При этом пандемия COVID-19 отрицательно сказывалась на значениях данного индекса.
Важно упомянуть некоторые нюансы реализации программы СКАТ в ходе данного исследования. Основным документом, регламентирующим деятельность службы клинической фармакологии, является Приказ Минздравсоцразвития России от 22 ноября 2010 г. No 1022н "Об утверждении Порядка оказания медицинской помощи населению по профилю "клиническая фармакология" [22]. В соответствии с Приложением 3, рекомендованным штатным нормативом является 1 ставка клинического фармаколога на 250 коек. Таким образом, для исследуемого стационара расчетный норматив для оказания медицинской помощи по профилю "клиническая фармакология" должен был составлять 4,0 ставки клинического фармаколога при выделенных службе клинической фармакологии 0,5 ставки, что было недостаточным для многопрофильного стационара, оказывающего неотложную помощь. В этой связи программа СКАТ была реализована в ограниченном формате. В частности, не были организованы непрерывный микробиологический мониторинг и создание паспорта локальной антибиотикорезистентности стационара. Реализация программы СКАТ главным образом заключалась в консультациях клинического фармаколога по вопросам применения антибиотиков, оптимизации стандартных протоколов антимикробной терапии с учетом стратификации пациентов и особенностей каждого клинического случая, участии клинического фармаколога в консилиумах и регистрации нежелательных лекарственных реакций при применении антибактериальных препаратов.
Следует обратить внимание на различия в потреблении антибактериальных препаратов между периодом функционирования программы СКАТ и пандемийным периодом. Во время пандемии COVID-19 было выявлено значительное увеличение объема потребления потенциально эффективных препаратов в отношении грамотрицательных микроорганизмов. Этот рост был в основном связан с увеличением потребления фторхинолонов (с 21,38-2,43 DDD/100 к/д в 3-м и 4-м кварталах 2019 г. до 42,49-48,48 DDD/100 к/д в аналогичные периоды 2020 г.). Именно этим можно объяснить тот факт, что максимальные значения ИЛУ для K. pneumoniae и E. coli были выявлены в 3-м и 4-м кварталах 2020 г., когда резистентность данных патогенов к фторхинолонам составила, соответственнно, 0,94 и 0,91 для K. pneumoniae и 0,53 и 0,81 для E. coli при доле потребления фторхинолонов в общей структуре потребления антибактериальных препаратов 0,372 и 0,375, соответственно. Для сравнения, лекарственная резистентность к карбапенемам для K. pneumoniae в 3-м и 4-м квартале 2020 г. составила 0,61 и 0,86, соответственно, при доле потребления этих препаратов 0,292 и 0,188, а лекарственная резистентность к аминогликозидам в те же временные периоды – 0,68 и 0,66 при доле потребления 0,107 в 3-м квартале 2020 г. и при отсутствии аминогликозидов в структуре потребления антибактериальных препаратов в 4-м квартале 2020 г. Наиболее активное применение антибактериальных препаратов, значительно уступающим по эффективности представителям других классов, безусловно, является нерациональным и требует коррекции в виде уменьшения потребления фторхинолонов и увеличения потребления аминогликозидов и карбапенемов. Зависимость между потреблением фторхинолонов и резистентностью микроорганизмов подтверждается результатами многих других исследований [23-26]. Следует отметить, что для K. pneumoniae значение ИЛУ было минимальным в период функционирования СКАТ. Это указывает на успешность реализации программы, так как по данным крупного систематического обзора достичь снижения антибиотикорезистентности хотя бы одного ключевого патогена удается не более чем в 50% случаев [27].
Более оптимистичные данные были получены в ряде отечественных исследований, в которых оценивали результаты реализации программы СКАТ. Так, по данным М.А. Чукиной и соавт., через 2 года после внедрения программы СКАТ было достигнуто снижение ИЛУ всех ключевых грамотрицательных и грамположительных патогенов (K. pneumoniae, A. baumanii, P. aeruginosa, E. coli, S. aureus, E. faecium, E. faecalis) [28]. Однако в данном случае была внедрена более широкая программа, в частности, для отделений был создан паспорт локальной резистентности, что позволило точнее регулировать потребление тех или иных классов антибактериальных препаратов. Также можно выделить исследование О.Э. Карпова и соавт., которые изучали результаты программы СКАТ на основе создания реестра микроорганизмов. С 2012 по 2015 г. ИЛУ ключевых грамотрицательных патогенов (A. baumanii, K. pneumoniae и P. aeruginosa) существенно снизился [29]. Полученные данные подчеркивает важность более активной административной поддержки СКАТ.
Существенной динамики ИЛУ других ключевых грамотрицательных патогенов, а именно A. baumanii и P. aeruginosa, выявлено не было. На протяжении всего исследования значения его оставались стабильно высокими. Во многом это можно объяснить тем, что в структуре потребления антибактериальных препаратов лидирующие позиции занимали фторхинолоны, уровень резистентности к которым был значительно выше, чем к уступающим им по частоте назначения карбапенемам и аминогликозидам. Однако вследствие ограниченной реализации программы СКАТ и отсутствия паспорта локальной резистентности в отделениях данная информация стала доступной только ретроспективно. Снижение частоты потребления фторхинолонов и повышение частоты потребления карбапенемов и аминогликозидов могло бы способствовать снижению значений ИЛУ A. baumanii и P. aeruginosa. Другой вариант – повышение частоты потребления полимиксина B, к которому была зафиксирована наименьшая лекарственная резистентность данных патогенов среди всех используемых антибактериальных препаратов.
Среди грамположительных патогенов следует отметить высокую долю ванкомицин-резистентных штаммов E. faecium и увеличивавшуюся во время пандемии COVID-19 долю метициллин-резистентных штаммов S. aureus. При этом за время функционирования программы СКАТ удалось достичь минимальных значений ИЛУ S. aureus, что можно считать положительным результатом частичного внедрения программы. С учетом того, что в общей структуре патогенов отмечается тенденция к увеличению доли грамположительной флоры на фоне пандемии COVID-19 данные результаты приобретают особую актуальность. При этом доля метициллин-резистентных штаммов S. aureus при увеличении потребления линезолида имеет тенденцию к снижению, поэтому предпочтение следует отдавать этому препарату [30].
Ограничения исследования
Результаты ретроспективного анализа были получены с учетом локального микробиологического "пейзажа", который может отличаться в других лечебных учреждениях.
Заключение
Внедрение программы СКАТ способствует снижению ИЛУ части ключевых патогенов. Во время пандемии COVID-19 отмечена негативная динамика этого показателя, что указывает на важность выполнения принципов СКАТ во всех стационарах, в том числе перепрофилированных для лечения пациентов с COVID-19.
Используемые источники
- Toner E, Adalja A, Gronvall GK, et al. Antimicrobial resistance is a global health emergency. Health Secur 2015;13(3):153-55.
- Gulen TA, Guner R, Celikbilek N, et al. Clinical importance and cost of bacteremia caused by nosocomial multi drug resistant acinetobacter baumannii. Int J Infect Dis 2015;38:32-5.
- Founou RC, Founou LL, Essack SY. Clinical and economic impact of antibiotic resistance in developing countries: A systematic review and meta-analysis. PLoS One. 2017;12(12):e0189621.
- Prestinaci F, Pezzotti P, Pantosti A. Antimicrobial resistance: a global multifaceted phenomenon. Pathog Glob Health 2015;109(7):309-18.
- Van Boeckel TP, Gandra S, Ashok A, et al. Global antibiotic consumption 2000 to 2010: an analysis of national pharmaceutical sales data [published correction appears in Lancet Infect Dis 2017;17(9):897.
- European Centre for Disease Prevention and Control. ECDC/EFSA/EMA first joint report on the integrated analysis of the consumption of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from humans and food-producing animals. EFSA Journal 2015;13(1):4006.
- Chaouch C, Hassairi A, Riba M, Boujaafar N. Relations entre la resistance bacterienne et la consommation des antibiotiques [Association between bacterial resistance and antimicrobial consumption]. Ann Biol Clin (Paris) 2014;72:555-60.
- Zemkova M, Kotlarova J, Merka V, et al. Emergence of fluoroquinolone resistance in Escherichia coli isolates at the department of clinical hematology. New Microbiol 2007;30(4):423-30.
- Voor In't Holt AF, Severin JA, Lesaffre EM, Vos MC. A systematic review and meta-analyses show that carbapenem use and medical devices are the leading risk factors for carbapenem-resistant Pseudomonas aeruginosa. Antimicrob Agents Chemother 2014;58(5):2626-37.
- Plüss-Suard C, Pannatier A, Kronenberg A, et al. Impact of antibiotic use on carbapenem resistance in Pseudomonas aeruginosa: is there a role for antibiotic diversity? Antimicrob Agents Chemother 2013;57(4):1709-13.
- Rawson TM, Moore LSP, Zhu N, et al. Bacterial and fungal coinfection in individuals with Coronavirus: a rapid review to support COVID-19 antimicrobial prescribing. Clin Infect Dis 2020;71(9):2459-68.
- Langford BJ, So M, Raybardhan S, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect 2020;26(12):1622-9.
- Davey P, Marwick CA, Scott CL, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2017;2(2):CD003543.
- Karanika S, Paudel S, Grigoras C, et al. Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother 2016;60(8):4840-52.
- Cai T, Verze P, Brugnolli A, et al. Adherence to European Association of Urology Guidelines on prophylactic antibiotics: an important step in antimicrobial stewardship. Eur Urol 2016;69(2):276-83.
- Baur D, Gladstone BP, Burkert F, et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infect Dis 2017;17(9):990-1001.
- Яковлев С.В., Брико Н.И., Сидоренко С.В., и др. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации. М.: Издательство “Перо”, 2018. 156 с.
- Laxminarayan R, Klugman KP. Communicating trends in resistance using a drug resistance index. BMJ Open 2011;1(2):e000135.
- Klein EY, Tseng KK, Pant S, Laxminarayan R. Tracking global trends in the effectiveness of antibiotic therapy using the Drug Resistance Index. BMJ Glob Health 2019;4(2):e001315.
- WHO Collaborating Centre for Drug Statistics Methodology, Guidelines for ATC classification and DDD assignment, Oslo, 2021. Available at: https://www.whocc.no/atc_ddd_index_and_guidelines/guidelines/
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008;36(5):309-32.
- Министерство здравоохранения и социального развития Российской Федерации. Приказ от 22 ноября 2010 г. N 1022н “Об утверждении Порядка оказания медицинской помощи населению по профилю “клиническая фармакология”. https://legalacts.ru/doc/prikaz-minzdravsotsrazvitija-rf-ot-22112010-n-1022n/.
- Rose L, Coulter MM, Chan S, et al. The quest for the best metric of antibiotic use and its correlation with the emergence of fluoroquinolone resistance in children. Pediatr Infect Dis J 2014;33(6):e158-61.
- Ryu S, Klein EY, Chun BC. Temporal association between antibiotic use and resistance in Klebsiella pneumoniae at a tertiary care hospital. Antimicrob Resist Infect Control 2018;7:83.
- Boni S, Marin GH, CampaЦa L, et al. Association between consumption of fluoroquinolones and carbapenems and their resistance rates in Pseudomonas aeruginosa in Argentina. Interdiscip Perspect Infect Dis 2022;2022:3924212.
- Wu HH, Liu HY, Lin YC, et al. Correlation between levofloxacin consumption and the incidence of nosocomial infections due to fluoroquinolone-resistant Escherichia coli. J Microbiol Immunol Infect 2016;49(3):424-9.
- Nathwani D, Varghese D, Stephens J, et al. Value of hospital antimicrobial stewardship programs [ASPs]: a systematic review. Antimicrob Resist Infect Control 2019;8:35.
- Чукина М.А., Вистовская Н.В., Лукина М.В., Журавлева М.В. Реализация программы Стратегии и контроля антимикробной терапии в Российском научном центре им. академика Б. В. Петровского. Антибиотики и химиотерапия 2020;9-10:44-50 [Chukina MA, Vistovskaya NV, Lukina MV, Zhuravleva MV. Strategy and Сontrol of Antimicrobial Therapy Program шmplementation at the Petrovsky National Research Center of Surgery. Antibiotics and Chemo therapy 2020;65(9-10):44-50 (In Russ.)]
- Карпов О.Э, Гусаров В.Г., Лашенкова Н.Н. и др. Реестр микроорганизмов как инструмент автоматизированного планирования потребления антибиотиков и контроля антибиотикорезистентности в отделениях реаниматологии и профильных отделениях. Общая реаниматология 2016;12(6):39-48 [Karpov OE, Gusarov VG, Lashenkova NN, et al. Register of microorganisms as a tool for automated antibiotics consumption planning and monitoring of antibiotic resistance in intensive care units and specilized hospital departments. General Reanimatology 2016;12(6):39-48 (In Russ.)].
- Lai CC, Chu CC, Cheng A, et al. Correlation between antimicrobial consumption and incidence of health-care-associated infections due to methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococci at a university hospital in Taiwan from 2000 to 2010. J Microbiol Immunol Infect 2015;48(4):431-6.
